土壤与植物之间的相互作用一直是生态学的研究热点,目前的研究主要集中于植物对土壤物理(Xie et al.,2013;章文杰等,2007;任伟等,2009)、化学(丁秋祎等,2009;胡耀升等,2014)、生物学性质(刘振花,2015)的影响方面.但由于传统的土壤微生物研究方法,如微生物平板培养法、Biolog鉴定系统法、生物标记法等往往会过低估计土壤微生物的群落结构组成,无法详细描述出土壤微生物的群落结构组成方面的信息(Schirmer et al.,2015),使得对于土壤真菌多样性的研究仍然匮乏,有关其多样性、分布特征及与环境的关系仍不明了(Zhao et al.,2012),尤其是在盐渍土这种特殊的背景下.真菌作为土壤微生物的重要组成部分,它不仅可以分解有机质为植物提供养分(Eckhard et al.,2008;Timonen et al.,1996),而且还可以改善土壤结构(Wright et al.,1998;Dodd et al.,2000),改良土壤肥力(Yao et al.,2000;O′Donnell et al.,2001).近年来的研究表明,真菌在保障植物健康(Mukerji,1996;Filion et al.,1999;Smith et al.,1999)方面也发挥着重要作用.因此,采用通量高、读长长的焦磷酸测序技术研究土壤真菌的多样性及其与盐生植被的关系具有重要的意义.
黄河三角洲为陆进海退之地,由于其离海距离、成陆时间及土壤盐渍程度不同,以裸地为起点,形成了强度、中度、轻度不同耐盐程度的植被演替系列,是目前地球上为数不多保存完整的自然生态系统之一,也是研究盐渍土壤真菌群落及其与盐生植被演替关系的天然实验室.因此,本研究以黄河三角洲为基地,采用454高通量测序技术研究盐生植被演替过程中土壤真菌群落的变化,以揭示其对地上植被的响应,为黄河三角洲地区生态恢复、盐渍土壤治理提供科学依据,同时也有助于丰富土壤微生物地理学理论.
2 材料与方法(Materials and methods) 2.1 土样采集依据多次考察对黄河三角洲的了解,在研究区内选择大致呈东西向的路线,横跨现代三角洲和近代三角洲,按照黄河三角洲自然演化的顺序,对滨海滩涂(光板地)和每个群落(翅碱蓬、獐茅、白茅、罗布麻)各设置4个样地,每两个样地间的距离不小于1 km.在每个样地内分散设置5个典型区域为采样区,每个采样区划出2 m×2 m的样方,用对角线五点采样法在植株附近10 cm内用土钻钻取土样,充分混匀,然后再将每个样地的5个采样区样品混合,用四分法缩减土样至约2 kg,放入密封袋内,置于冷藏盒,尽快带回实验室.将土壤样品分成两等份:一份放于-80 ℃冰箱中,用于分子生物学研究;另一份风干,采用常规方法测定土壤理化性质.
2.2 土壤理化性质的测定土壤全氮和有机碳测定采用元素分析仪,碱解氮测定采用碱解扩散法,土壤速效磷测定采用Olsen法,土壤活性有机质测定采用低温外加热重铬酸钾氧化-比色法(不乘以氧化校正系数)(鲁如坤,1999),土壤粒径分析参考Kettler等(2001)的方法.在野外采集土样的同时用轻便插入式地温计测定每一采样点土壤10 cm处的地温,用TDR100土壤水分探测器测各采样点0~20 cm的水分含量.
2.3 土壤DNA提取称取0.5 g土壤用Omega DNA试剂盒(D5625-01)提取总DNA,操作依据说明书进行.
2.4 PCR扩增对提取到的基因组DNA进行琼脂糖电泳检测,查看基因组DNA的完整性与浓度.利用Qubit2.0DNA检测试剂盒对基因组DNA精确定量,以确定PCR反应应加入的DNA量.PCR所用的引物已经融合了Roche454FLX测序平台的通用引物(融合真菌18sF引物:CGTATCGCCTCCTCGCGCCATCAG+bar+CAGTAGTCATATGCTTGTCT;融合真菌18sR引物:CTATGCGCCTTGCCAGCCCGCTCAGGCTGCTGGCAC CAGACTTGC).
PCR反应体系的各组分组成:模版DNA 10.0 ng,引物(50 μmol·L-1)各1.0 μL,10×PCR buffer 5.0 μL,dNTP(10 mmol·L-1)0.5 μL,Plantium TaqDNA聚合酶0.5 μL,加H2O补至50.0 μL.PCR热循环参数:94 ℃预变性30 s,94 ℃变性20 s;45 ℃复性20 s,65 ℃延伸1 min,94 ℃变性20 s,循环5次;60 ℃复性20 s,72 ℃延伸20 s,循环20次;72 ℃延伸5 min,10 ℃保存.
2.5 高通量测序及数据分析对PCR产物进行琼脂糖电泳测定后,采用上海生工琼脂糖回收试剂盒(cat:SK8131)对DNA进行回收,使用Qubit2.0荧光剂对回收产物进行定量处理,将所有样品根据测得的DNA浓度按1∶1比例进行混合,并充分振荡均匀,最后,混合产物使用罗氏公司454测序仪(Roch GS FLX sequencer)进行测序.
去除非靶区域序列后,用Mothur软件对序列进行序列错误校正,用Uchime去除序列中的嵌合体(质量控制);通过Blast 比对数据库对处理后的序列进行物种分类;采用Uclust软件将相似性大于97%的序列归为同一种可操作分类单元(OTU),然后进行物种多样性和群落结构多样性分析.
3 结果分析(Results and analysis) 3.1 土壤理化性质黄河三角洲不同植被类型样地的土壤理化性质见表 1.由表 1可以看出,不同植被类型土壤理化性质存在较大差异.由于黄河三角洲土壤可溶性盐分主要为NaCl,其土壤电导率与盐分含量可用线性方程模拟(翁永玲等,2006),因此,本研究采用土壤电导率表征土壤含盐量.5种覆被类型下土壤在1∶5土水比浸提液的电导率范围为1.95~0.04 dS·m-1,光板地、獐茅地、翅碱蓬地为海积潮湿正常盐成土,其中,光板地盐化程度比獐茅地高很多,白茅地和罗布麻地为弱盐淡色潮湿雏形土.轻度耐盐群落(罗布麻群落、白茅群落)土壤含盐量最低,重度耐盐群落(翅碱蓬群落、獐茅群落)土壤含盐量次之,光板地含盐量最高.根据美国农业部土壤质地分类制,光板地、翅碱蓬地和白茅地均属于粉砂壤土,獐茅地和罗布麻地属于粉砂土,这说明采样点土壤粉砂含量占优势.活性有机质(ASOM)、全氮(TN)、碱解氮(AN)在有植被覆被土壤中的含量均高于光板地;光板地的碳氮比最大,重盐土壤(翅碱蓬地和獐茅地)次之,轻盐土壤(白茅地和罗布麻地)最小;白茅地和罗布麻地速效磷(AP)含量高于翅碱蓬地和獐茅地,后两者又高于光板地.从以上分析可以看出,随盐生植被正向演替土壤质量有不断改善的趋势.
| 表 1 不同覆被类型土壤理化性质 Table 1 Soil properties of different vegetation |
利用454高通量测序,5个样品共获得60174条序列,经优化去除长度短于200 bp,模糊碱基数大于0,序列平均质量低于25的序列后,各样地有效序列分别为:光板地10796条,翅碱蓬13019条,獐茅14298条,白茅12277条,罗布麻9784条.
采用 Mothur 对群落结构多样性进行分析(表 2),5种覆被类型下土壤真菌覆盖率均高于94%,表明本次测序深度合理,基本能代表样本的真实情况.轻度耐盐群落(罗布麻群落、白茅群落)土壤中Shannon多样性指数最高,光板地土壤次之,重度耐盐群落(翅碱蓬群落、獐茅群落)土壤最低.由此可判断轻度耐盐群落(罗布麻群落、白茅群落)土壤中真菌丰富度最高,光板地土壤次之,重度耐盐群落(翅碱蓬群落、獐茅群落)土壤最低.此外,OTU数、ACE指数和Shannon指数都与土壤中全氮相关系数最高,分别为0.730、0.634和0.547,说明土壤中全氮含量是影响OTU数、ACE指数和Shannon指数的主要因素.
| 表 2 5种覆被类型下土壤真菌多样性指数 Table 2 Diversity index of fungi in soils from five vegetation types |
热图中对样本间做了聚类,通过聚类树亦可看出样本间的距离关系(图 1).从图 1可以看出,同属重盐土壤的翅碱蓬地与獐茅地间真菌群落相似程度较大(Unifrac Metric值为0.38),同属轻盐土壤的白茅地与罗布麻地间真菌群落相似程度也较大(Unifrac Metric值为0.33),表明当植被处于相同演替阶段时,土壤真菌群落结构具有较大的相似性;而光板地与重盐土壤(翅碱蓬地与獐茅地)之间的Unifrac Metric值分别为0.56、0.67,重盐土壤(翅碱蓬地与獐茅地)和轻盐土壤(白茅地与罗布麻地)的Unifrac Metric值在0.48~0.56之间,光板地与轻盐土壤(白茅地与罗布麻地)的Unifrac Metric分别为0.44、0.38,说明光板地土壤、重盐土壤和轻盐土壤中真菌群落间相似程度较小,在不同演替阶段时,土壤真菌群落结构差别相对较大.
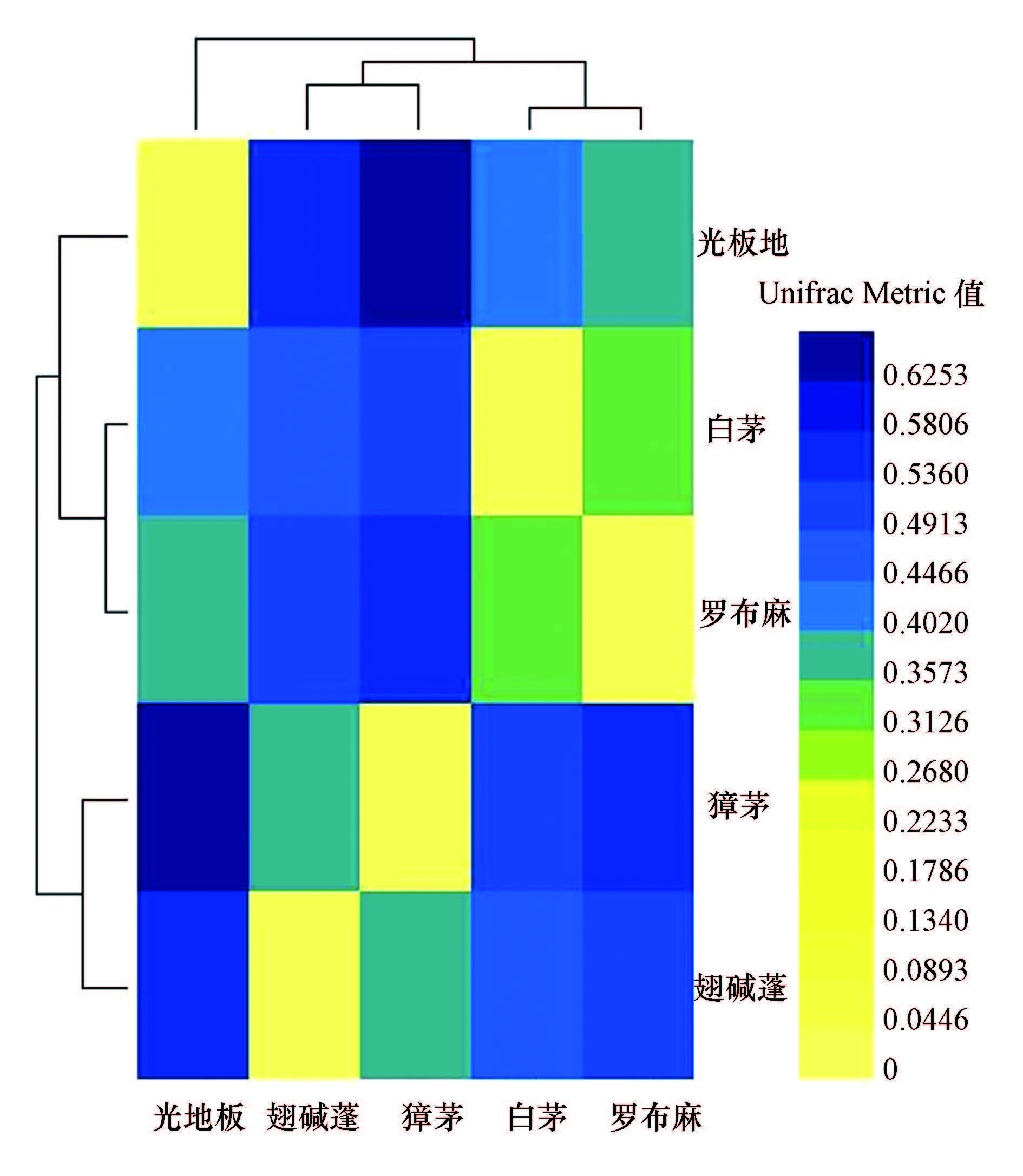 |
| 图 1 真菌样本距离热图 Fig. 1 Heatmap of fungal groups |
本研究采用高通量测序技术对黄河三角洲光板地、翅碱蓬地、獐茅地、白茅地及罗布麻地土壤真菌进行分析,使用RDP Classifier软件对处理后的序列进行物种分类,得到子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)、球囊菌门(Glomeromycota)、毛霉亚门(Mucoromycotina)5个真菌门,包含的有效序列分别为 14851、2638、747、472、283条,各占可分类有效序列的78.2%、13.9%、3.93%、2.49%、1.49%.子囊菌门在5种土样中的相对丰度为2.69%~70.0%,是各覆被类型下最优势的菌群;担子菌门在5种土样中的相对丰度为1.46%~9.43%,是各覆被类型下的次优势菌群.
5种覆被类型下土壤真菌在纲、目、属水平上的分布结果表明(图 2),不同样地中真菌分布存在差异.粪壳菌纲相对丰度最高(1.71%~62.7%),为三角洲土壤中的优势纲.在获得的18个目中,炭角菌目(Xylariales)相对丰度最高(0.290%~58.8%);格孢腔目(Pleosporales)和肉座菌目(Hypocreales)相对丰度次之,分别为0.210%~5.32%、0.180%~5.53%.在属的水平上进行分析,在光板地、獐茅和白茅土壤中焦孢壳属(Diatrype)相对丰度最高,分别为2.91%、58.8%和7.97%;翅碱蓬土壤中Coprinopsis属相对丰度最高为1.18%;罗布麻土壤中Thanatephorus属相对丰度最高为8.50%.
 |
| 图 2 5种覆被类型下土壤真菌在纲(a)、目(b)、属(c)水平上的分布 Fig. 2 Class(a),order(b)and genus(c)distribution of fungi in soils from the five vegetation types |
对黄河三角洲土壤中的20个真菌属及环境因子进行RDA分析,其中,真菌属和环境因子之间夹角的余弦值代表了二者之间的相关性,且环境因子长度表示其对各真菌属所起作用的大小.第1轴可以解释所有信息的47.4%,第2轴可解释36.7%(图 3).由RDA排序图可知,土壤的活性有机质、速效磷、温度、碱解氮、有机碳对这20个真菌属的分布作用较大,含水率和电导率对真菌属的分布作用次之.
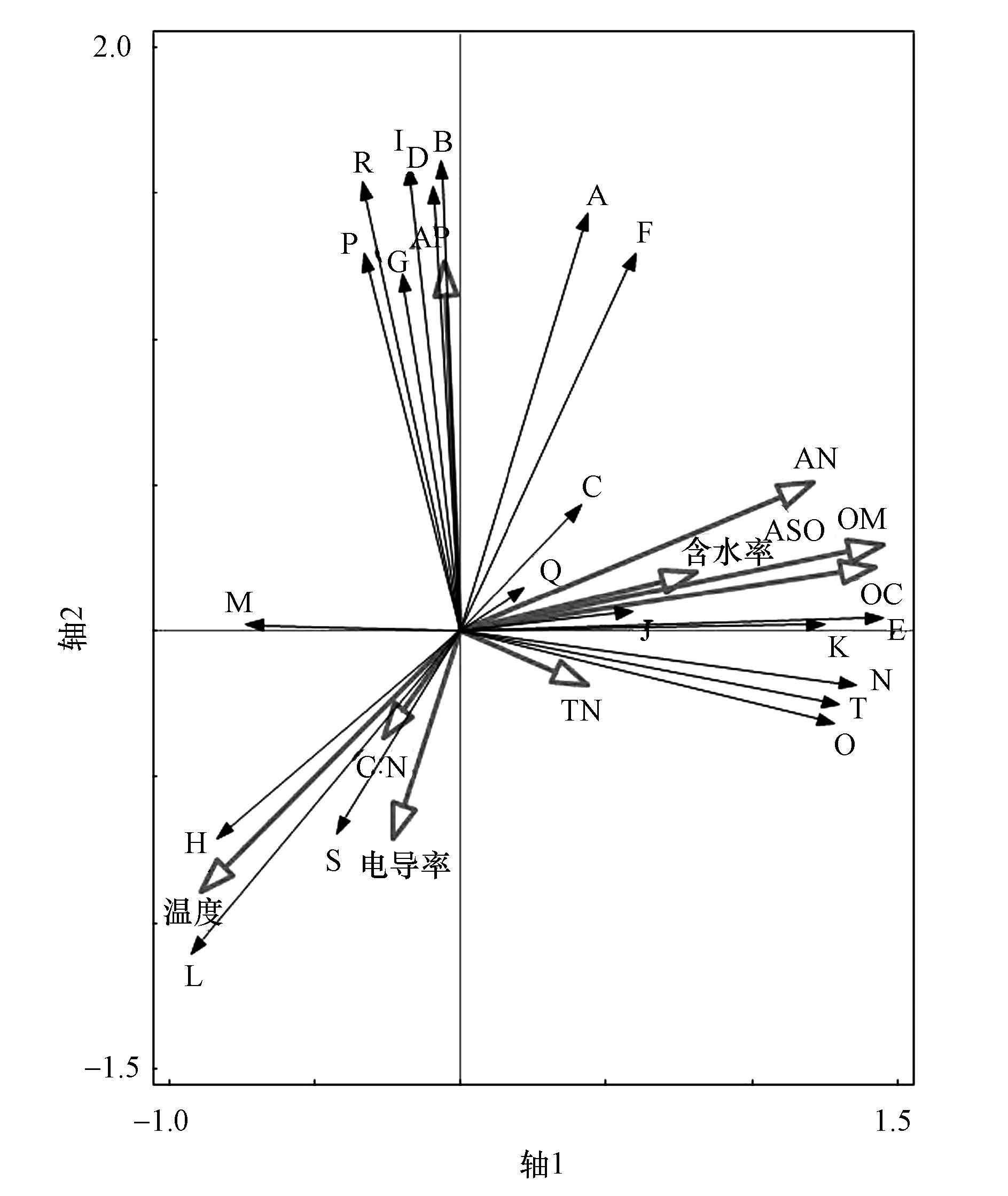 |
| 图 3 土壤真菌属与环境解释变量的 RDA 排序图(A、B、C、D、E、F、G、H、I、J、K、L、M、N、O、P、Q、R、S、T分别代表:真菌、Cochliobolus、丛赤壳属(Nectria)Leptoporus、Saksenaea、焦孢壳属(Diatrype)、Pleospora、Penicillium、Coprinopsis、Thanatephorus、Pluteus、Lulwoana、Hemileia、毛霉属(Mucor)、Phaeosphaeria、Passalora、被孢霉属(Mortierella)、锥毛壳属(coniochaeta)、Geomyces、Malassezia、Metarhizium) Fig. 3 Ordination diagram of RDA with soil fungi communities in genus and explanatory variables |
其中,有机质作用最大,它与Passalora、Metarhizium、Phaeosphaeria、Lulwoana、焦孢壳属、锥毛壳属、Leptoporu、Pleospora、Cochliobolus真菌呈正相关,与Coprinopsis、Hemileia、Malassezia、毛霉属真菌负相关.此外,碱解氮、有机碳和含水率同样与Passalora、Metarhizium、Phaeosphaeria、Lulwoana、焦孢壳属、锥毛壳属、Leptoporu、Pleospora、Cochliobolus真菌呈正相关,与Coprinopsis、Hemileia、Malassezia、真菌负相关,而温度、电导率和碳氮比则与前九者负相关,与后四者正相关.此外,速效磷与Leptoporu、Pleospora、Cochliobolus、丛赤壳属、Saksenaea、Thanatephorus、Penicillium、Geomyces、被孢霉属正相关,与Coprinopsis、Hemileia、Malassezia、Passalora、Metarhizium、Phaeosphaeria、Lulwoana、焦孢壳属负相关.
4 讨论(Discussion)土壤有机碳能直接影响和改变土壤的一系列化学和生物学性质,是土壤固相部分的重要组分(刘鸿雁等,2005).由于土壤有机碳主要来源于植物凋落物(Morrison et al.,2001),因此,翅碱蓬、獐茅、白茅、罗布麻每个群落相对于自然演替初期的光板地,其土壤有机碳含量均有所增加.但各植被下土壤有机碳增加的量却有所不同,尤其是獐茅地土壤有机碳量是翅碱蓬地土壤的3.3倍,可能与凋落物性质、数量及土壤质地等因素(周印东等,2003;孟京辉,2010)有关.由此可以看出,在不同演替阶段,其土壤有机碳的积累速度是不同的,这与龚霞等(2013)及程瑞梅等(2010)的研究结果相似.此外,土壤全氮、碱解氮及速效磷等的含量可以大致反映土壤肥力状况(Gil-Sotres et al.,2005),一般来说,其含量越高,土壤肥力越高.轻度耐盐植被(白茅和罗布麻)土壤中全氮、碱解氮及速效磷含量普遍高于它们在重度耐盐植物群落(翅碱蓬和獐茅)中的相应含量,表明演替后期(轻度耐盐植被群落)土壤质量比演替前期(重度耐盐植物群落)有所改善.
植物群落类型初步决定微生物群落的组成(尚占环等,2007).本研究中子囊菌门在重度耐盐植物群落翅碱蓬和獐茅中相对丰度较高,分别为2.69%、69.97%,且子囊菌门真菌大多数为腐生菌,可降解土壤有机质,进化速率快(王海英等,2010),因此,可推断子囊菌在盐生植物正向演替中主要处于演替的前期,这与前人研究结果一致(何苑皞等,2014).在轻度耐盐植被白茅和罗布麻中担子菌门相对丰度较高,分别为6.64%、9.43%,且担子菌能引起木材腐烂,分解木质纤维素的能力也很强,是土壤有机质主要的分解者,但进化速率相对缓慢(王海英等,2010),因此,可推断担子菌在此群落演替中主要处于演替的后期.
自然界中有很多影响土壤真菌群落组成与数量的因素,如气候变化、植被类型(He et al.,2005;Ranjard et al.,2001)、土壤结构(Blagodatskaya et al.,1998)、化学组成及pH(Noah et al.,2006;Wal et al.,2006)等;同时,土壤真菌在土壤中的分布及活跃程度对土壤肥力增加、土壤物理结构的形成及营养物质的转化都有一定的影响.因此,可推断不同覆被类型土壤真菌类群与土壤理化性质应该存在一定的相关性,本研究中主要属包括Pluteus属、锥毛壳属、Lulwoana属、Hemileia属、丛赤壳属(Nectria)、Thanatephorus属和青霉属 (Penicillium)等,其中,前两个属与土壤全氮显著相关(p<0.05),Lulwoana属、Hemileia属与土壤碱解氮显著相关,丛赤壳属和Thanatephorus属则与土壤速效磷显著相关(p<0.05).而青霉属(Penicillium)是一种对纤维素作用较强的菌株,它可以将由植物残体带入土壤的纤维素分解成简单的物质,增加土壤中微生物数量,提高土壤的肥力和熟化程度.青霉属在重度耐盐植物群落(翅碱蓬和獐茅)中的相对丰度分别为0.0300%、0.0100%,在轻度耐盐植被群落(白茅和罗布麻)的相对丰度分别为0.240%、0.210%.此外,几乎所有主要真菌属在轻度耐盐植被群落(白茅和罗布麻)土壤中的相对丰度都高于其在重度耐盐植物群落(翅碱蓬和獐茅)中的相对丰度,也表明演替后期(轻度耐盐植被群落)土壤质量比演替前期(重度耐盐植物群落)有所改善.土壤肥力、盐生植被及土壤真菌相互依存、互相影响.
5 结论(Conclusions)1) 随盐生植被正向演替土壤质量有不断改善的趋势,土壤全氮、碱解氮及速效磷等的含量随盐生植被正向演替有不断增加的趋势.
2) 轻度耐盐群落(罗布麻群落、白茅群落)土壤中真菌丰富度相对较高,在不同演替阶段时,土壤真菌群落结构差别相对较大.
3) 土壤中全氮含量是影响真菌OTU数、ACE指数和Shannon指数的主要因素.
4) 5种覆被类型土壤共获得60174条有效序列,检测到的真菌归属于子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)、球囊菌门(Glomeromycota)、毛霉亚门(Mucoromycotina)5个真菌门,其中,子囊菌门相对丰度最高.
| [1] | Blagodatskaya E V, Anderson T H. 1998. Interactive effects of pH and substrate quality on the fungal-to-bacterial ratio and qCO2 of microbial communities in forest soils[J]. Soil Biology & Biochemistry , 30 (10/11) : 1269–1274. |
| [2] | 程瑞梅, 肖文发, 王晓荣, 等.2010. 三峡库区植被不同演替阶段的土壤养分特征[J]. 林业科学 , 2010, 46 (9) : 1–6. |
| [3] | 丁秋祎, 白军红, 高海峰, 等.2009. 黄河三角洲湿地不同植被群落下土壤养分含量特征[J]. 农业环境科学学报 , 2009, 28 (10) : 2092–2097. |
| [4] | Dodd J C, Boddington C L, Rodriguez A, et al. 2000. Mycelium of arbuscular mycorrhizal fungi (AMF) from different genera:Form function and detection[J]. Plant & Soil , 226 (2) : 131–151. |
| [5] | Eckhard G, Horst M, Iver J. 2008. Role of arbuscular mycorrhizal fungi in uptake of phosphorus and nitrogen from soil[J]. Critical Reviews in Biotechnology , 15 (3/4) : 257–270. |
| [6] | Filion M, St-Arnaud M, Fortin J A. 1999. Direct interaction between the arbuscular mycorrhizal fungus glomus intraradices and different rhizosphere microorganisms[J]. New Phytologist , 141 (3) : 525–533. DOI:10.1046/j.1469-8137.1999.00366.x |
| [7] | Gil-Sotres F, Trasar-Cepeda C, Leirós M C, et al. 2005. Different approaches to evaluating soil quality using biochemical properties[J]. Soil Biology & Biochemistry , 37 (5) : 877–887. |
| [8] | 龚霞, 牛德奎, 赵晓蕊, 等.2013. 植被恢复对亚热带退化红壤区土壤化学性质与微生物群落的影响[J]. 应用生态学报 , 2013, 24 (4) : 1094–1100. |
| [9] | 何苑皞, 周国英, 王圣洁, 等.2014. 杉木人工林土壤真菌遗传多样性[J]. 生态学报 , 2014, 10 (10) : 2725–2736. |
| [10] | He J, Xu z, Hughes. 2005. Analyses of soil fungal communities in adjacent natural forest and hoop pine plantation ecosystems of subtropical Australia using molecular approaches based on 18S rRNA genes[J]. Fems Microbiology Letters , 247 (1) : 91–100. DOI:10.1016/j.femsle.2005.04.033 |
| [11] | 胡耀升, 么旭阳, 刘艳红.2014. 长白山森林不同演替阶段植物与土壤氮磷的化学计量特征[J]. 应用生态学报 , 2014, 25 (3) : 632–638. |
| [12] | Kettler T A, Doran J W, Gilbert T L. 2001. Simplified method for soil particle-size determination to accompany soil-quality analyses[J]. Soil Science Society of America Journal , 65 (3) : 849–852. DOI:10.2136/sssaj2001.653849x |
| [13] | 刘鸿雁, 黄建国.2005. 缙云山森林群落次生演替中土壤理化性质的动态变化[J]. 应用生态学报 , 2005, 16 (11) : 2041–2046. |
| [14] | 鲁如坤. 1999. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社: 107 -108. |
| [15] | 孟京辉, 陆元昌, 刘刚, 等.2010. 不同演替阶段的热带天然林土壤化学性质对比[J]. 林业科学研究 , 2010, 23 (5) : 791–795. |
| [16] | Morrison I K, Foster N W. 2001. Fifteen-year change in forest floor organic and element content and cycling at the Turkey Lakes watershed[J]. Ecosystems , 4 (6) : 545–554. DOI:10.1007/s10021-001-0028-x |
| [17] | Mukerji K G. 1996. Concepts in mycorrhizal research[J]. Springer Netherlands , 163 (5) : 420–421. |
| [18] | Noah F, Jackson R B. 2006. The diversity and biogeography of soil bacterial communities[J]. Proceedings of the National Academy of Sciences of the United States of America , 103 (3) : 626–631. DOI:10.1073/pnas.0507535103 |
| [19] | O'Donnell A G, Seasman M, Macrae A, et al. 2001. Plants and fertilisers as drivers of change in microbial community structure and function in soils[J]. Plant & Soil , 232 (1/2) : 135–145. |
| [20] | 任伟, 谢世友, 谢德体.2009. 喀斯特山地典型植被恢复过程中的土壤水分生态效应[J]. 水土保持学报 , 2009 (5) : 128–132. |
| [21] | Rousk J, Bååth E, Brookes P C, et al. 2010. Bacterial and fungal communities across a pH gradient in an arable soil[J]. Isme Journal Multidisciplinary Journal of Microbial Ecology , 4 (10) : 1340–1351. |
| [22] | Schirmer M, Ijaz U Z, D'Amore R, et al. 2015. Insight into biases and sequencing errors for amplicon sequencing with the Illumina MiSeq platform[J]. Nucleic Acids Research , 43 (6) : e37–e42. DOI:10.1093/nar/gku1341 |
| [23] | 尚占环, 丁玲玲, 龙瑞军, 等.2007. 江河源区退化高寒草地土壤微生物与地上植被及土壤环境的关系[J]. 草业学报 , 2007, 1 (1) : 34–40. |
| [24] | Smith K P, Goodman R M. 1999. Host variation for interactions with beneficial plant-associated microbes[J]. Ann Rev Phytopathol , 37 (1) : 473–491. DOI:10.1146/annurev.phyto.37.1.473 |
| [25] | Timonen S, Finlay R D, Olsson S, et al. 1996. Dynamics of phosphorus translocation in intact ectomycorrhizal systems:non-destructive monitoring using a β-scanner[J]. Fems Microbiology Ecology , 19 (3) : 171–180. |
| [26] | 王海英, 郭守玉, 黄满荣, 等.2010. 子囊菌较担子菌具有更快的进化速率和更高的物种多样性[J]. 中国科学:生命科学 , 2010, 40 (8) : 731–730. |
| [27] | Wal A V D, Veen J A V, Smant W, et al. 2006. Fungal biomass development in a chronosequence of land abandonment[J]. Soil Biology & Biochemistry , 38 (1) : 51–60. |
| [28] | 翁永玲, 官鹏.2006. 黄河三角洲盐渍土盐分特征研究[J]. 南京大学学报自然科学 , 2006, 42 (6) : 602–610. |
| [29] | Wright S F, Upadhyaya A. 1998. A survey of soils for aggregate stability and glomalin,a glycoprotein produced by hyphae of arbuscular mycorrhizal fungi[J]. Plant & Soil , 198 (1) : 97–107. |
| [30] | Xie S, Ren W. 2013. Soil Moisture characteristics in Karst area with different land use types[J]. Agricultural Science & Technology (12) : 1856–1860. |
| [31] | Yao H, He Z, Wilson M J, et al. 2000. Microbial biomass and community structure in a sequence of soils with increasing fertility and changing land use[J]. Microbial Ecology , 40 (3) : 223–237. |
| [32] | Zhao F, Xu K. 2012. Efficiency of DNA extraction methods on the evaluation of soil microeukaryotic diversity[J]. Acta Ecologica Sinica , 32 (4) : 209–214. DOI:10.1016/j.chnaes.2012.05.003 |
| [33] | 章文杰, 宋洪涛.2007. 滇西北亚高山地区植被演替中的土壤物理性质研究[J]. 山东林业科技 , 2007 (16) : 8–10. |
| [34] | 周印东, 吴金水, 赵世伟, 等.2003. 子午岭植被演替过程中土壤剖面有机质与持水性能变化[J]. 西北植物学报 , 2003, 23 (6) : 895–900. |
 2016, Vol. 36
2016, Vol. 36


