2. 中国科学院大学, 北京 100049;
3. 中国科学院海洋研究所, 青岛 266071;
4. 苏州科技学院环境科学与工程学院, 苏州 215009
2. University of Chinese Academy of Sciences, Beijing 100049;
3. Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071;
4. School of Environmental Science and Engineering, Suzhou University of Science and Technology, Suzhou 215009
随着经济的快速发展,我国多数湖泊富营养化问题日趋严重,导致蓝藻水华频繁暴发(秦伯强等,2006;金相灿,2008).在我国,夏季是蓝藻水华暴发最严重的季节,水华发生期间蓝藻受盛行风的影响易向湖岸带聚积.一些湖湾因蓝藻聚积后不易扩散,导致水体溶解氧迅速消耗,藻体死亡分解,并伴随藻源性污染物释放.若发生在水源地取水口,会严重威胁用水安全.2007年的无锡饮用水危机正是由于取水口大量蓝藻聚积死亡引起水质恶化造成(秦伯强,2007;Zhang et al.,2010).
因此,蓝藻聚积污染倍受关注.Chuai等(2011)研究发现,太湖水华期间梅梁湾较高的溶解性磷主要是由蓝藻降解释放引起的.尚丽霞等(2013)的研究表明,蓝藻聚积会释放大量藻源污染物,且蓝藻密度升高,污染物释放强度增大.还有研究发现,浮游植物降解对水体有色溶解性有机物(CDOM)有很大贡献(Zhang et al.,2009).此外,微生物作用对藻源污染物的转化有很大影响,国外早有研究发现,附着细菌可利用蓝藻释放的氮磷(Fallon et al.,1979).国内也有研究发现,巢湖西半湖北岸蓝藻聚积处细菌的群落结构较复杂,多样性较高,且聚积表层细菌多样性要比底层高(宣淮翔等,2011).
针对蓝藻聚积污染,采取行之有效的控制措施迫在眉睫.打捞是目前广泛使用的蓝藻聚积污染应急控制手段,具有见效快、无二次污染等优点.然而针对不同打捞强度,打捞对水体藻源污染物释放有何影响?目前文献鲜有报道.巢湖是我国第五大淡水湖,近年来夏季水华期间因湖湾带蓝藻聚积造成了严重的水体污染.因此,本文以巢湖为研究对象,通过室内培养模拟夏季湖湾带蓝藻聚积,并设置不同的打捞强度,探讨不同打捞强度下藻源污染物的释放特征,以期为我国浅水湖泊湖湾带蓝藻聚积污染的科学防控提供理论支撑.
2 材料与方法(Materials and methods) 2.1 高密度藻液配制实验所用蓝藻和模拟用水均取自巢湖西半湖.于2015年5月在巢湖西半湖近岸用400目浮游生物网采集聚积蓝藻,迅速带回实验室,经自来水初洗静置数次,除去泥沙及漂浮杂质,再用超纯水冲洗浓缩备用.采集的原位湖水经0.45 μm醋酸纤维滤膜过滤后与备用浓缩藻体混合均匀,配制成近1.3×1011cells·L-1的高密度藻液.经镜检发现,99.9%(藻密度)以上为铜绿微囊藻.
2.2 蓝藻密度控制实验取4 L高密度藻液装于5 L细口培养瓶中,根据夏季蓝藻聚积的环境条件,在光照培养箱(LRH-G-400,珠江)中以温度35 ℃、光照强度6000 lx、光暗比12 h:12 h稳定培养2 d后,通过特制38 μm不锈钢筛网对高密度藻液进行了3种强度的打捞过滤实验,具体步骤为按不同打捞强度取对应体积的藻液进行一次性过滤后滤液再倒回培养瓶中.所设置的3种打捞强度组分别为低、中和高强度打捞组,藻密度分别由(1.38±0.05)×1011、(1.21±0.14)×1011和(1.30±0.29)×1011 cells·L-1降至(5.44±0.22)×1010、(1.39±0.01)×1010和(7.48±1.64)×109 cells·L-1,去除率分别达60.57%±0.09%、88.49%±0.52%和94.23%±0.00%.同时设置未打捞组,每组设置3个平行,并以经0.45 μm醋酸纤维滤膜过滤后湖水组作为对照.所有实验组每天摇动3次且交换培养瓶的位置.按时间序列进行采样,未打捞前采样记为0 d,在打捞后第1、2、3、5、8、11、14和24 d每天定时采样,研究聚积蓝藻不同打捞强度下藻源污染物的释放特征.
2.3 分析方法 2.3.1 物理化学指标的测定pH、电导率分别用实验室pH计(Mettler Toledo)、电导率仪(Mettler Toledo FE30)测定,溶解氧用便携式溶解氧测定仪(YSIDO200)测定.
2.3.2 蓝藻生物量测定藻细胞计数方法为取适当水样稀释至50 mL,用0.75 mL鲁哥试剂固定24 h后用光学倒置式显微镜(Nikon Ts100)进行计数.较大藻团用超声波细胞破碎仪(先欧 X01000D)打散,选择功率10%,工作时间2 s,间隔1 s,变轴杆在液面以下1 cm,一般10 s内即可在不破碎藻细胞的前提下使藻团分散.叶绿素a(chl.a)的测定方法为水样经0.45 μm醋酸纤维滤膜过滤后所得滤膜用丙酮法提取测定(国家环保总局《水和废水监测分析方法》编委会,2002).
2.3.3 营养盐指标的测定总氮(TN)、总磷(TP)分别用碱性-过硫酸钾消解紫外分光光度法、过硫酸钾消解-钼酸盐分光光度法测定,溶解性总氮(DTN)、溶解性总磷(DTP)经过0.45 μm醋酸纤维滤膜过滤后所得滤液按TN、TP方法测定(国家环保总局《水和废水监测分析方法》编委会,2002),溶解性无机氮DIN(NH4+、NO3-、NO2-)、PO43-的测定方法为水样经0.45 μm醋酸纤维滤膜过滤后滤液用连续流动分析仪(SKALAR,荷兰)测定.
2.3.4 藻源有机物的测定水样经450 ℃灼烧的GF/F膜(Whatman)过滤,滤液用总有机碳测定仪(TOC5000A,岛津)测定溶解性有机碳(DOC).用紫外-可见分光光度计(UV2700,岛津)进行光谱扫描,扫描波长范围为200~800 nm.用荧光分光光度计(F-7000,日立)扫描三维荧光光谱(3DEEMs),扣除超纯水背景值,结合紫外-可见光谱数据,用Matlab软件去除瑞利和拉曼散射的影响,所得光谱用Origin绘制成三维荧光等高线图.参考Chen等(2003)提出的区域积分法(FRI)将三维荧光图谱划分为5个区域(图 1),每个区域代表不同有机物类型(表 1),通过计算每个区域的累积积分强度,进行标准化后得到标准积分体积表征不同有机物类型的相对含量,具体计算公式如下:
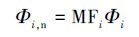
|
(1) |
 |
| 图 1 三维荧光图谱5个积分区域 Fig. 1 Five integral regions of 3DEEMs |
| 表 1 三维荧光图谱5个积分区域的表征意义 Table 1 The characteritics of the five integral regions in 3DEEMs |
其中, Φi,n 为荧光区域i的积分标准体积(au·nm2); Φi 为荧光区域i的积分体积(au·nm2);MFi为倍增因子,等于总积分面积与荧光区域i的积分面积的比值.
3 结果分析(Result analysis) 3.1 不同打捞强度下藻体表观变化特征稳定培养36 h后所有实验组藻液表层开始有白色斑点,并开始伴有恶臭,表明藻细胞已经开始趋于快速衰亡.未打捞组藻体颜色由绿色逐渐向黄色(3 d)、棕色(14 d)、褐紫色(24 d)转变,前5 d内恶臭严重,絮体增加并下沉明显.不同强度打捞使藻体表观存在明显差异,低强度组藻体表观变化趋势与未打捞组一致.而中、高强度打捞后未产生明显恶臭,虽有少部分絮体产生但并无明显下沉.中强度打捞组藻体颜色逐步由绿色向黄色转变,未出现棕色、褐紫色.高强度打捞后虽出现部分发黄现象,但第14 d仍有带绿色并有恢复生长趋势,第24 d高强度组绿色明显.结合chl.a的变化(图 2)可知,低强度打捞并未遏制蓝藻死亡,中、高强度打捞后蓝藻的死亡减缓,甚至高强度组出现恢复生长,这对增强细胞活力,减缓藻源污染物的释放有重要作用.
 |
| 图 2 不同打捞强度下水体chl.a变化特征 Fig. 2 The variation of chl.a under different salvage strength |
高密度蓝藻聚积水体中,氮磷营养盐主要赋存于藻体中,通过打捞削减蓝藻生物量,可以有效控制水体氮磷营养盐负荷.打捞强度越大,对chl.a、氮磷营养盐的控制效果越明显.因此,从污染物总量控制的角度考虑,高强度组打捞具有优越性.3种打捞强度下chl.a的去除效果与对应强度藻密度的去除效果接近(表 2),说明高密度蓝藻聚积期间,chl.a水平可以表征蓝藻生物量的变化.而氮磷营养盐的去除率均低于chl.a的去除率,此结果与徐宪根(2014)在巢湖、星云湖等蓝藻聚积水体所得结果类似.对于本实验而言,这主要是由于蓝藻聚积后死亡分解导致大量的颗粒态氮磷(PP、PN)向水体释放,导致水体中溶解性氮磷(DTN、DTP)的含量增加.但即使在低强度打捞下,TN、TP分别仍有52.93%和39.60%的去除率,这说明蓝藻打捞是控制湖泊营养盐负荷的有效途径之一.
| 表 2 不同打捞强度对蓝藻生物量及氮磷营养盐的控制效果 Table 2 Effects of salvage intensities on the control of cyanobacteria biomass and the concentrations of nitrogen and phosphorus |
不同打捞强度对水体pH及电导率的影响如图 3所示,中、高强度组与未打捞组、低强度组pH均有显著差异(p<0.05).未打捞组与低强度组的pH均在第 3 d达最低值使水体呈酸性,而后出现上升趋势,而中、高强度组及湖水组pH均呈上升趋势.电导率常用于推测水中离子总浓度或含盐量,各富藻实验组的电导率均呈现先上升后下降的趋势,未打捞组与低强度组电导率在前8 d内上升至峰值后开始下降,而中、高强度组分别在第3、2 d达最大后开始下降.未打捞组电导率显著高于打捞组、湖水组(p<0.01),表明蓝藻聚积污染使水体电导率显著增加,打捞可以有效降低水体电导率值.此外,对溶解氧(DO)监测表明,实验周期内未打捞组呈完全厌氧状态.打捞后水体DO略有增加,但未改变水体厌氧状态.高强度组在第24 d由于藻类生长及光合作用,DO增加显著.
 |
| 图 3 不同打捞强度下水体pH(a)、电导率(b)变化特征 Fig. 3 The variation characteristics of pH(a)and conductivity(b)in different salvage intensities |
由图 4、图 5可知,湖水组DTN、DTP明显低于富藻实验组,表明聚积过程中藻细胞的氮磷向水体释放.通过打捞,水中DTN、DTP含量可以得到有效控制(p<0.05),打捞强度越大,DTN、DTP控制效果越明显(图 4a、图 5a).在0~5 d内未打捞组和低强度组的DTN呈快速上升趋势,中、高强度打捞组在打捞后第1 d DTN先短暂下降后上升.所有富藻实验组均在第5 d达到峰值,打捞后DTN的峰值浓度明显降低,未打捞组DTN的峰值浓度分别是对应低、中、高强度组的1.72、2.82和3.02倍.第5 d后所有富藻实验组DTN开始下降.实验期间所有实验组的NH4+占DTN的比值在52.86%~96.94%之间(图 4),NH4+的变化趋势与DTN变化类似,前8 d内未打捞组NH4+呈现快速上升趋势,至第8 d到达峰值后趋于下降.而3种强度打捞组在第5 d就达到峰值.由于厌氧环境,NO3-、NO2-含量均很低,NO3-、NO2-分别在0.10~1.45 mg·L-1、0.01~0.47 mg·L-1之间.
 |
| 图 4 不同打捞强度下水体DTN(a)、NH4+(b)释放特征 Fig. 4 The release characteristics of DTN(a)and NH4+(b)in different salvage strength |
 |
| 图 5 不同打捞强度下水体DTP(a)、PO43-(b)释放特征 Fig. 5 The release characteristics of DTP(a)and PO43-(b)in different salvage intensities |
由于藻体死亡分解,未打捞组8 d内DTP快速释放并达到峰值,随后趋于下降.打捞后峰值浓度明显下降,未打捞组DTP峰值浓度分别是对应低、中、高强度组的1.47、2.39和2.89倍.结合图 5可知,第2 d起PO43-/DTP值大于0.7,表明实验期间蓝藻释放的有机磷很快就转化为PO43-,DTP以PO43-形式为主.与DTP变化趋势类似,未打捞组PO43-浓度在前8 d内快速上升而后趋于下降.各打捞组PO43-浓度在第5 d达到峰值后开始下降.线性拟合表明,打捞强度越大,藻源性N、P的释放速率越小(表 3),表明通过打捞可有效降低藻源性N、P的释放.
| 表 3 不同打捞强度对藻源性氮、磷释放速率(V1)的影响 Table 3 Effects of different salvage strengths on the releasing rates of nitrogen and phosphorus |
蓝藻水华暴发期间,可通过DOC表征藻源性有机物(AOM)的含量.富藻实验组的DOC明显高于湖水组(p<0.01)(图 6),说明蓝藻聚积后水体DOC显著上升.未打捞组在5 d内DOC由初始的46.63 mg·L-1快速上升至峰值384.85 mg·L-1.打捞对DOC的控制效果显著(p<0.05),第5 d未打捞组DOC峰值浓度分别是对应低、中、高强度组的2.85、10.76和10.12倍.通过线性拟合可知,未打捞组DOC释放速率达87.43 mg·L-1·d-1,低强度打捞后第1~5 d DOC的释放速率达23.68 mg·L-1·d-1,第5 d后未打捞组、低强度组DOC 均出现下降趋势.而中、高强度组经打捞后第1 d即出现明显下降而后DOC并未出现快速上升,说明在本实验条件下,当打捞强度达到中强度时就可以控制藻源性DOC的快速释放.
 |
| 图 6 不同打捞强度下水体DOC释放特征 Fig. 6 The release characteristics of DOC in different salvage strength |
未打捞前湖水组与藻液的三维荧光光谱图见图 7,巢湖水体三维荧光图谱主要有4类峰,分别为类富里酸A峰、类腐殖质C峰、微生物代谢产物B峰和类蛋白质D峰.其中,在湖泊水体中,A、C峰一般来自于陆源有机物,D峰主要源于内源藻类降解及其代谢,B峰代表细菌等微生物代谢产物(Maie et al.,2012).未添加蓝藻的湖水组主要以类蛋白质为主,但类富里酸也占有一定的比重.藻液组除以上4类峰外,类腐殖质E峰型(Ziegmann et al.,2010)明显,对比图 7a、7b发现,藻液三维荧光光谱中各峰的峰值强度均明显高于湖水组,说明蓝藻聚积导致水体的荧光有机物含量增加.
 |
| 图 7 第0 d湖水组(a)及藻液(b)三维荧光光谱图 Fig. 7 Spectrograms of the lake water and the solution of algae on 0 d |
FRI法计算所得积分标准体积可以间接表征荧光有机物相对含量.未打捞组前5 d,5类荧光物质均呈现快速释放趋势,至峰值时色氨酸、酪氨酸、类富里酸、微生物代谢产物和类腐殖质的相对含量分别是初始值的19.27、19.75、7.61、17.31和3.25倍,5 d或8 d后各类荧光物质开始趋于下降(图 8).打捞对5类荧光有机物均有显著的控制效果(p<0.05),且打捞强度越大,水体荧光有机物的相对含量越低.通过对释放阶段数据进行线性拟合,发现各强度打捞组5类荧光有机物的释放速率明显低于未打捞组(表 4),且打捞强度越大,荧光有机物的释放速率越低.结合表 4及图 8可知,当打捞强度达到中、高强度时,5类荧光有机物均没有出现明显的释放过程,即表明在本实验条件下,若控制强度达到中强度,可以控制藻源性荧光有机物释放.
 |
| 图 8 不同打捞强度下水体5类荧光物质释放特征(a.色氨酸;b.酪氨酸;c.类富里酸;d.微生物代谢产物;e.类腐殖质) Fig. 8 The release characteristics of five types of fluorescent materials with different salvage strength(a.tryptophan,b.tyrosine,c.fulvic acid,d.soluble microbial products,e.humic-like substance) |
| 表 4 打捞对荧光有机物释放速率(V2)的影响 Table 4 Effects of different salvage intensities on the release rate of fluorescent materials |
夏季是蓝藻水华暴发的主要季节,发生蓝藻聚积后打捞的“窗口期”是指蓝藻聚积发生后至蓝藻已开始明显死亡分解一段时间,该时段藻体死亡分解程度较轻.“窗口期”的长短与蓝藻生长状态有关,在蓝藻聚积水体,藻密度影响蓝藻生长状态,藻密度越高,蓝藻生长受“密度制约”影响越大,“窗口期”则会相应缩短.本实验中在蓝藻聚积36 h后开始出现白色斑点并伴有恶臭,蓝藻表观发生明显改变,蓝藻开始加速衰亡,因此,本实验中蓝藻聚积后36 h内可以作为蓝藻打捞的“窗口期”,在此期间打捞效果最佳.在高温、高光强的环境条件下,水中DO迅速消耗,未打捞组接近完全厌氧状态,致蓝藻藻体大量死亡分解,实验周期内chl.a含量不断下降(图 2).打捞后低强度组与未打捞组的表观变化类似,说明低强度组仍出现了藻细胞死亡破裂,而中、高强度组与低强度组表观变化存在明显差异,并未出现实验后期的褐色,甚至高强度组在后期出现了蓝藻生长的状态.这说明与低强度组相比,中、高强度组解除了蓝藻生长的“密度制约”(Odum et al.,2009).但高强度组的生物量并未出现大幅增加(图 2),表明本实验条件下打捞不会引起蓝藻水华的二次暴发.
pH是蓝藻生长的重要环境因子(Niamien-Ebrottie et al.,2015),许海等(2009)的研究表明,当水体pH为6时,微囊藻会受到严重伤害.本实验中未打捞组、低强度组第3 d时pH均接近6,说明蓝藻聚积给蓝藻生理状况已造成严重破坏.蓝藻死亡分解产生有机酸及CO2均会使水体pH降低(Yan et al.,2011),而后可能由于产甲烷及微生物对有机酸的利用使得pH趋于上升,而中、高强度组并未出现pH下降至酸性(图 3a),表明中、高强度组蓝藻没有出现快速死亡分解,藻细胞仍保持活性,这有利于减缓藻源性污染物的释放.中、高强度组的pH的上升与蓝藻的生理调节有关,黄钰铃等(2008)研究表明,当水体pH不利于藻类生长时,藻类的自适应性使其可通过一系列生理生化反应调节水体 pH 值趋向适宜生长的偏碱性范围.
氮磷营养盐在蓝藻生长及水华形成中起着重要的作用(Paerl et al.,2011),但蓝藻聚积死亡引起的氮磷营养盐的释放也不容忽视.厌氧环境下藻细胞死亡过程中产生的大量有机碎屑矿化分解产生NH4+、PO43-,且温度越高、矿化速度越快(Christensen et al.,1987;刘国锋等,2010;潘攀等,2010).本实验中温度达35 ℃,较高的矿化速度使得未打捞组、低强度组中NH4+、PO43-含量均在窗口期后5 d或8 d内快速上升达到峰值,随后呈下降趋势.打捞后藻源氮磷营养盐释放速度明显降低,打捞强度越大,释放速率及峰值浓度均越小.因此,若错过“窗口期”打捞,应在窗口期后5 d内增加打捞频率及强度尽快打捞,该段时期可作为蓝藻打捞的“有效期”,在此期间打捞仍可保证控污效果.此外,还可根据实验所得峰值浓度在“有效期”内设置打捞频率,优化打捞效果.实验后期NH4+、PO43-的下降可能与附着细菌的吸收利用及颗粒吸附有关(史红星等,2005).研究表明,附着细菌在藻类降解过程中影响着污染物的动力学过程(Grossart et al.,2006),细菌可利用蓝藻释放的氮磷营养盐而生长繁殖(Fallon et al.,1979),因此,在“有效期”内及时打捞可防止氮磷营养盐因微生物的利用进入水体内源循环.实验过程中,各实验组的电导率与NH4+、DTN、PO43-和DTP均呈现显著正相关性(p<0.05),这与水华期间藻体释放的无机盐会增加水体电导率的报道一致(Chuai et al.,2011;Chellappa et al.,2003).因此,在蓝藻聚积水体中可通过电导率的监测推断水体氮磷污染物的变化.
水中DOM会影响水体生物化学过程、颗粒物的稳定与转移、微量金属络合作用和饮用水处理及废水处理过程中产生消毒副产物等(Chen et al.,2003;姚昕等,2014).高密度蓝藻聚积后AOM占DOM很大比重,DOC可表征AOM含量(Leenheer et al.,2003).蓝藻聚积期间,一方面藻细胞破裂致胞内有机物(IOM)释放,另一方面,部分有活性藻细胞因抵御高温、高光强等不利环境因素而分泌多糖、蛋白质等胞外有机物(EOM).这些都是蓝藻聚积水体DOC的主要来源.研究表明,自养型生物(蓝藻)产生的DOM有很高的生物活性,更易被生物降解(Benner et al.,2011;Nguyen et al.,2005;姚昕等,2014).此外还有研究表明,IOM的生物可利用性要比EOM高(Bittar et al.,2015).本实验中对于未打捞组及低强度组,蓝藻死亡过程中大量IOM向水体释放,使得水中的AOM生物可利用性更高.在蓝藻死亡分解过程初期附着细菌开始繁殖,蓝藻释放DOC的同时细菌等微生物也在利用DOC,前期(前5 d或8 d内)可能由于细菌丰度较低、该时段主要以蓝藻死亡释放DOC为主,此过程中附着细菌大量繁殖,至5 d或8 d后微生物利用开始占主导,开始利用可生物转化的DOC,使得DOC快速下降.因此,蓝藻聚积期间,在“有效期”内进行打捞对控制DOC浓度及防止进入内源循环至关重要.经中、高强度打捞后藻细胞虽没有大量死亡,IOM对AOM的贡献低,但高温、高光强对蓝藻生理产生不利影响导致EOM的释放,使得中、高强度组DOC缓慢上升.值得注意的是,当打捞强度达到中强度时(去除藻密度近88.49%),AOM的释放得到基本控制.因此,从控制AOM释放的角度考虑,中强度组可以满足要求,中强度也是控制AOM释放的必要强度.
DOM中可产生荧光的有机物称为荧光溶解性有机物(FDOM),FDOM中不同成份可以示踪DOM诸多性质,如DOM的生物降解与可利用能力、光化学活性(Hambly et al.,2015;Coble et al.,2014).三维荧光技术是目前表征FDOM最先进的方法之一.巢湖西半湖北岸紧靠合肥城市中心,未发生蓝藻聚积时,DOM受到内源贡献的同时,也受陆源影响(图 7a),但一旦发生蓝藻聚积,则以内源贡献为主,类蛋白物质(Ⅰ区+Ⅱ区)浓度上升迅速(图 7b),因此,可通过类蛋白物质峰值状况指示藻源污染物状况.如有研究认为,类蛋白物质可以用来指示水中芳香族氨基酸及水解氨基酸的含量(郭卫东等,2007;Yamashita et al.,2003).还有研究表明,类蛋白物质可以指示水体微囊藻毒素的含量变化(Ziegmann et al.,2010).Baker等(2004)发现,色氨酸类荧光物质与生化需氧量(BOD)存在明显相关性,说明类蛋白物质有很高的生物活性.因此,未打捞组及低强度组在蓝藻聚积过程中酪氨酸、色氨酸在5 d或8 d内达到峰值后开始被细菌利用.一般认为陆源排放的类腐殖质及类富里酸生物利用性不高(Ziegmann et al.,2010;Guillemette et al.,2011),而本研究中藻液内部受光的辐射较小,DOM降解过程中光化学的比重会有所下降,微生物的降解利用在类腐殖质及类富里酸占重要作用(图 8).相关性分析表明,未打捞组、低强度组5类荧光物质均与DOC存在显著的相关性(p<0.01),而中、高强度组荧光类有机物与DOC之间不存在相关性(p>0.05),可能由于在高蓝藻聚积死亡期间,藻细胞破裂过程中IOM的释放产生的各类荧光有机物对DOC有重要的贡献作用,而有活性的藻细胞在生理调节过程中释放的EOM所含荧光物质含量较低.关于荧光有机物与DOC之间的关联性仍需进一步研究.中、高强度打捞后荧光有机物的释放得到有效控制(图 8),因此,中强度打捞为控制荧光有机物的必要强度.
5 结论(Conclusions)1) 在模拟夏季高温、高光强环境下,蓝藻聚积密度达1.3×1011 cells·L-1时,聚积36 h内成为打捞的“窗口期”,在此期间打捞效果最佳.聚积藻体使水体呈厌氧状态,蓝藻大量死亡,chl.a浓度下降.低强度打捞并未遏制蓝藻死亡降解,而蓝藻密度削减88.49%以上的中、高强度打捞使蓝藻解除密度制约,延缓死亡,有利于减缓藻源污染物的释放.
2) 蓝藻聚积过程中,水体NH4+、PO43-分别为DTN、DTP的主要形式.藻源性氮磷、AOM(DOC、FDOM)均在窗口期后5 d或8 d内快速释放,而后进入内源循环,峰值浓度可达初始值的数倍,甚至数十倍,确定窗口期后5 d内为打捞的“有效期”,在此期间增加打捞频率及强度,仍可确保对藻源污染物的控制效果.
3) 打捞可以有效削减藻源污染物,且强度越大,污染物总量控制越大,污染物释放速率越低.当打捞强度达到中强度(去除藻密度88.49%),水体AOM得到基本控制,所以中强度是控制AOM的必要强度.因此,若为控制藻源污染物总量,高强度打捞具有优越性;而从AOM释放的角度考虑,中强度打捞可以满足要求.
| [1] | Baker A, Inverarity R. 2004. Protein-like fluorescence intensity as a possible tool for determining river water quality[J]. Hydrological Processes , 18 (15) : 2927–2945. DOI:10.1002/(ISSN)1099-1085 |
| [2] | Benner R, Kaiser K. 2011. Biological and photochemical transformations of amino acids and lignin phenols in riverine dissolved organic matter[J]. Biogeochemistry , 102 : 209–222. DOI:10.1007/s10533-010-9435-4 |
| [3] | Bittar T B, Vieira A A H, Stubbins A, et al. 2015. Competition between photochemical and biological degradation of dissolved organic matter from the cyanobacteria Microcystis aeruginosa[J]. Limnology and Oceanography , 60 (4) : 1172–1194. DOI:10.1002/lno.10090 |
| [4] | Chellappa N T, Costa M A M. 2003. Dominant and co-existing species of cyanobacteria from a Eutrophicated reservoir of Rio Grande do Norte State,Brazil[J]. Acta Oecologica , 24 : S3–S10. DOI:10.1016/S1146-609X(03)00005-5 |
| [5] | Chen W, Westerhoff P, Leenheer J A, et al. 2003. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science & Technology , 37 (24) : 5701–5710. |
| [6] | Christensen J P, Smethie W M, Devol A H. 1987. Benthic nutrient regeneration and denitrification on the Washington continental shelf[J]. Deep Sea Research Part A.Oceanographic Research Papers , 34 (5) : 1027–1047. |
| [7] | Chuai X, Ding W, Chen X, et al. 2011. Phosphorus release from cyanobacterial blooms in Meiliang Bay of Lake Taihu,China[J]. Ecological Engineering , 37 (6) : 842–849. DOI:10.1016/j.ecoleng.2011.01.001 |
| [8] | Coble P G, Lead J, Baker A, et al. 2014. Aquatic Organic Matter Fluorescence[M]. New York: Cambridge University Press: 279 . |
| [9] | Fallon R D, Brock T D. 1979. Decomposition of blue-green algal (cyanobacterial) blooms in Lake Mendota,Wisconsin[J]. Applied and Environmental Microbiology , 37 (5) : 820–830. |
| [10] | Grossart H P, Czub G, Simon M. 2006. Algae-bacteria interactions and their effects on aggregation and organic matter flux in the sea[J]. Environmental Microbiology , 8 (6) : 1074–1084. DOI:10.1111/emi.2006.8.issue-6 |
| [11] | Guillemette F, Del Giorgio P A. 2011. Reconstructing the various facets of dissolved organic carbon bioavailability in freshwater ecosystems[J]. Limnology and Oceanography , 56 (2) : 734–748. DOI:10.4319/lo.2011.56.2.0734 |
| [12] | 国家环保总局《水和废水监测分析方法》编委会.2002.水和废水监测分析方法[M].北京: 中国环境科学出版社.243-250,254-257,670-671 |
| [13] | 郭卫东, 程远月, 吴芳.2007. 海洋荧光溶解有机物研究进展[J]. 海洋通报 , 2007, 26 (1) : 98–106. |
| [14] | Hambly A, Arvin E, Pedersen L-F, et al. 2015. Characterising organic matter in recirculating aquaculture systems with fluorescence EEM spectroscopy[J]. Water Research , 83 : 112–120. DOI:10.1016/j.watres.2015.06.037 |
| [15] | 黄钰铃, 纪道斌, 陈明曦, 等.2008. 水体pH值对蓝藻水华生消的影响[J]. 人民长江 , 2008, 39 (2) : 63–65. |
| [16] | 金相灿.2008. 湖泊富营养化研究中的主要科学问题[J]. 环境科学学报 , 2008, 28 (1) : 21–23. |
| [17] | Leenheer J A, Croué J-P. 2003. Peer reviewed: characterizing aquatic dissolved organic matter[J]. Environmental Science & Technology , 37 (1) : 18A–26A. |
| [18] | 刘国锋, 申秋实, 张雷, 等.2010. 藻源性黑水团环境效应: 对水-沉积物界面氮磷变化的驱动作用[J]. 环境科学 , 2010, 31 (12) : 2917–2924. |
| [19] | Maie N, Yamashita Y, Cory R M, et al. 2012. Application of excitation emission matrix fluorescence monitoring in the assessment of spatial and seasonal drivers of dissolved organic matter composition: sources and physical disturbance controls[J]. Applied Geochemistry , 27 (4) : 917–929. DOI:10.1016/j.apgeochem.2011.12.021 |
| [20] | Nguyen M-L, Westerhoff P, Baker L, et al. 2005. Characteristics and reactivity of algae-produced dissolved organic carbon[J]. Journal of Environmental Engineering , 131 (11) : 1574–1582. DOI:10.1061/(ASCE)0733-9372(2005)131:11(1574) |
| [21] | Niamien-Ebrottie J, Bhattacharyya S, Deep P, et al. 2015. Cyanobacteria and cyanotoxins in the world: Review[J]. International Journal of Applied Research , 1 (8) : 563–569. |
| [22] | Odum E P,Barrett G W.2009.生态学基础[M].陆健健,王伟,王天慧,等.译.北京:高等教育出版社.229 |
| [23] | Paerl H W, Xu H, Mccarthy M J, et al. 2011. Controlling harmful cyanobacterial blooms in a hyper-eutrophic lake (Lake Taihu,China): the need for a dual nutrient (N & P) management strategy[J]. Water Research , 45 (5) : 1973–1983. DOI:10.1016/j.watres.2010.09.018 |
| [24] | 潘攀, 刘德启, 李海青, 等.2010. 藻类打捞对水体营养循环的影响及其生态效果研究[J]. 环境工程学报 , 2010, 4 (7) : 1509–1512. |
| [25] | 秦伯强, 王小冬, 汤祥明, 等.2007. 太湖富营养化与蓝藻水华引起的饮用水危机-原因与对策[J]. 地球科学进展 , 2007, 22 (9) : 896–906. |
| [26] | 秦伯强, 杨柳燕, 陈非洲, 等.2006. 湖泊富营养化发生机制与控制技术及其应用[J]. 科学通报 , 2006, 51 (16) : 1857–1866. |
| [27] | 尚丽霞, 柯凡, 李文朝, 等.2013. 高密度蓝藻厌氧分解过程与污染物释放实验研究[J]. 湖泊科学 , 2013, 25 (1) : 47–54. |
| [28] | 史红星, 刘会娟, 曲久辉, 等.2005. 富营养化水体中微囊藻细胞碎屑对氨氮的吸附特性[J]. 环境化学 , 2005, 24 (3) : 241–244. |
| [29] | 许海, 刘兆普, 袁兰, 等.2009. pH 对几种淡水藻类生长的影响[J]. 环境科学与技术 , 2009, 32 (1) : 27–30. |
| [30] | 宣淮翔, 安树青, 孙庆业, 等.2011. 巢湖西半湖北岸湖滨带蓝藻堆积处细菌多样性初步研究[J]. 水产学报 , 2011, 35 (12) : 1873–1880. |
| [31] | 徐宪根.2014.巢湖水源区蓝藻水华发生规律及控制响应[D].南京: 中国科学院南京地理湖泊研究所 |
| [32] | Yamashita Y, Tanoue E. 2003. Chemical characterization of protein-like fluorophores in DOM in relation to aromatic amino acids[J]. Marine Chemistry , 82 (3) : 255–271. |
| [33] | Yan Q, Wang A, Yu C, et al. 2011. Enzymatic characterization of acid tolerance response (ATR) during the enhanced biohydrogen production process from Taihu cyanobacteria via anaerobic digestion[J]. International Journal of Hydrogen Energy , 36 (1) : 405–410. DOI:10.1016/j.ijhydene.2010.10.005 |
| [34] | Yang L, Jiang L, Qin B, et al. 2003. Comparison of static uptake of phosphorus between Microcystis aeruginosa and attached Pseudomonas sp[J]. [J].China Environmental Science , 24 (5) : 572–575. |
| [35] | 姚昕, 张运林, 朱广伟, 等.2014. 湖泊草,藻来源溶解性有机质及其微生物降解的差异[J]. 环境科学学报 , 2014, 34 (3) : 688–694. |
| [36] | Zhang X, Chen C, Ding J, et al. 2010. The 2007 water crisis in Wuxi,China: Analysis of the origin[J]. Journal of Hazardous Materials , 182 (1) : 130–135. |
| [37] | Zhang Y, Van Dijk M A, Liu M, et al. 2009. The contribution of phytoplankton degradation to chromophoric dissolved organic matter (CDOM) in eutrophic shallow lakes: field and experimental evidence[J]. Water Research , 43 (18) : 4685–4697. DOI:10.1016/j.watres.2009.07.024 |
| [38] | Ziegmann M, Abert M, Müller M, et al. 2010. Use of fluorescence fingerprints for the estimation of bloom formation and toxin production of Microcystis aeruginosa[J]. Water Research , 44 (1) : 195–204. DOI:10.1016/j.watres.2009.09.035 |
 2016, Vol. 36
2016, Vol. 36


