由于磷(P)过量排放而引起的水体富营养化污染现象已成为当前政府与公众最为关注的环境问题之一.据《2014年中国环境状况公报》所述,国控监测的62座重点湖泊(水库)中,Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、劣Ⅴ类水质断面分别占3.4%、30.4%、29.3%、20.9%、6.8%、9.2%,其主要污染指标为总磷和化学需氧量.由此可见,解决水体富营养化污染的问题已迫在眉睫.我国现有污水处理厂通常使用强化生物除磷系统(Enhanced Biological Phosphorus Removal,EBPR)(Mino et al.,1998)处理污水中所含磷元素,其具有运行费用低、二次污染少、除磷效果好等特点,是现阶段应用最为广泛的污水生物除磷技术.
随着科学进步,纳米材料已经在许多商业领域广泛应用,如半导体、化妆品、纺织品和颜料等工业和消耗类产品(Gottschalk et al.,2009).研究发现,纳米材料一旦释放到环境中,将会对人类健康和环境微生物产生潜在危害(Colvin et al.,2003;Nel et al.,2006; Zheng et al.,2011),其中,以纳米氧化锌颗粒(ZnO NPs)毒性最为突出.毒理学研究表明,10 mg·L-1的ZnO NPs将会显著减少Bacillus subtilis的生长活性(最高90%),但对于Escherichia col 只能减少22%的生长活性(Adams et al.,2006).该研究也表明,ZnO NPs毒性具有一定的菌种选择性.同时,ZnO NPs产生的氧化应激性会引起细胞膜损伤、胞液渗漏及脂质过氧化(Brayner et al.,2006;Xia et al.,2008).研究发现,水体中的ZnO NPs能够促使微生物产生大量胞内氧自由基(ROS),而其对细胞质脂质、蛋白质及细胞中其他中间体有明显抑制作用(Xia et al.,2008).众所周知,生物除磷过程包含了一系列的生化过程,如厌氧释磷作用与好氧或缺氧吸磷作用(Mino et al.,1998; Zeng et al.,2003).因此,ZnO NPs能促使水体微生物产生大量ROS从而对除磷过程中的生化作用产生抑制效果.Zheng等(2011)发现,当水体中ZnO NPs浓度达到1 mg·L-1时,聚磷菌并未受到明显抑制,除磷效率仍为100%,可见低浓度(1 mg·L-1)ZnO NPs无法对聚磷菌起到抑制作用;但当浓度升高至10和50 mg·L-1时,周期末的出水中即可检测到正磷酸盐,且其浓度高于进水中的正磷酸盐浓度.显然,高浓度ZnO NPs已明显抑制聚磷菌的功能效果,对其厌氧释磷、好氧或缺氧吸磷产生显著抑制.
然而,ZnO NPs对EBPR系统的抑制机理机制尚未研究透彻.因此,本文着眼于系统宏观运行效能与微观结构变化,从宏观到微观系统地分析ZnO NPs对于EBPR系统的影响机制.该研究对ZnO NPs抑制EBPR系统高效稳定运行的机理机制探究具有重要理论价值与实践指导意义.
2 材料与方法(Materials and methods) 2.1 试验用水及污泥本试验的反应器接种污泥取自杭州市七格污水处理厂的曝气池污泥,采用乙酸和丙酸交替作为碳源的方法来富集聚磷菌,交替的周期为10 d(Lu et al.,2006),培养条件为C/N/P=200/15/10.试验过程所用进水为人工合成的模拟废水,COD为800 mg·L-1,NH4+-N为60 mg·L-1,PO43--P为40 mg·L-1,进入系统完全混合后浓度变为原来的1/4,即系统初始浓度.以相对应的COD为定量标准,乙酸/丙酸=1/3的比例作为混合碳源,NH4Cl作为氮源,K2HPO4和KH2PO4作为磷源.每升进水组成为:0.256 g无水乙酸钠,0.4 mL丙酸,0.0875 g KH2PO4,0.147 g K2HPO4·3H2O,0.2293 g NH4Cl,0.1845 g MgSO4·7H2O,0.0222 g CaCl2,0.0015 g蛋白胨,0.0015 g酵母浸出粉,0.0012 g ATU,0.5112 g NaClO3,0.6 mL微量元素液.微量元素液成份参考Smolders(1994).其中,ATU是氨氧化过程的抑制剂,而NaClO3能够抑制NO2--N的继续氧化,因此,氨氮主要是作为系统微生物正常生长代谢所需(Liu et al.,2003).另外,通过加入不同体积的ZnO NPs浓缩储备液以满足系统内达到上述ZnO NPs浓度要求,R1作为对照组ZnO NPs浓度为0 mg·L-1,R2为2 mg·L-1,R3为6 mg·L-1,R4为10 mg·L-1.而在恢复阶段,各反应器停止投加ZnO NPs.
2.2 试验装置本试验采用SBR反应器,有效容积10 L.整套试验装置的运行由SBR污水处理智能控制系统负责调节控制,反应周期设置为:每周期按进水(5 min)、厌氧搅拌(2.5 h)、好氧曝气(3 h)、沉淀(5 min)、排水(5 min)、静置(15 min)的顺序连续运行6 h,每天运行4个周期.每周期进水体积为2.5 L,即反应器排水比为1/4,以控制系统水力停留时间(Hydraulic Retention Time,HRT)为24 h,控制系统污泥浓度(Mixed Liquor Suspended Solids,MLSS)为2500 mg·L-1,污泥停留时间(Solids Retention Time,SRT)为7 d.反应器采用机械搅拌,搅拌器的转动速率控制在300 r·min-1.本试验在恒温实验室内进行,运行期间调节控制室温为((20.0±0.5)℃).利用5 mol·L-1 NaOH和5 mol·L-1 HCl调节控制pH值为7.0~7.5.厌氧阶段溶解氧(DO)浓度为0 mg·L-1,利用空气流量计调节曝气量控制好氧阶段DO为6~7 mg·L-1.
2.3 测定方法每天定时采集各系统的污泥样品和其中一个周期的进水(厌氧段初始)、厌氧段结束及好氧段结束的水样进行分析测定.所有水样测定前经孔径为0.22 μm的中速定性滤纸过滤.样品采集完毕后,需测定的指标主要包括化学需氧量(COD)、正磷酸盐(PO43--P)、混合液污泥浓度(MLSS)、污泥沉降比(SV30)、污泥容积指数(SVI)等.具体测定方法参考《水和废水监测分析方法(第四版)》(魏复盛,2002).同时定期测定活性污泥的胞外聚合物(EPS)(曹秀芹等,2010).在抑制实验的前期、后期及恢复末期分别取污泥的DNA,利用高通量测序技术考察细菌群落变化(Li et al.,2013).
3 结果与讨论(Results and discussion) 3.1 ZnO NPs对污泥特性的影响ZnO NPs对活性污泥SV30、SVI的影响如图 1所示.从图 1a可以看出,未添加ZnO NPs之前,反应器内SV30均保持在25~30 mL·g-1范围内,说明本实验所接种的絮状活性污泥具有良好的沉降性能.
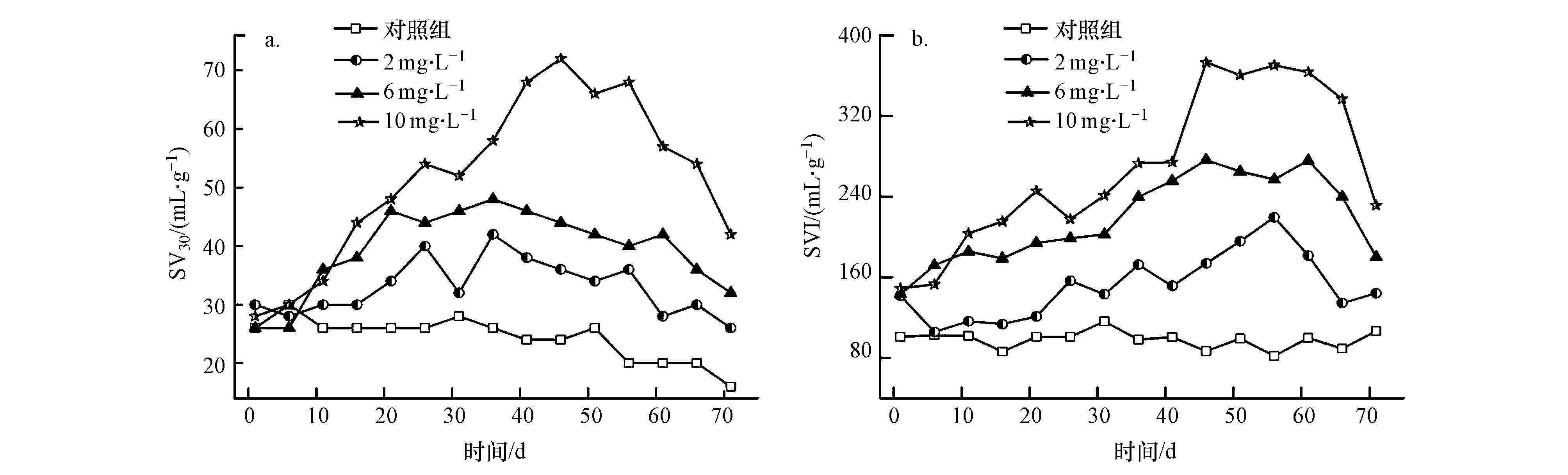 |
| 图 1 ZnO NPs对活性污泥特性的影响 Fig. 1 Influence of ZnO NPs on activated sludge characteristics |
将ZnO NPs添加至试验组,可以发现在不同浓度的ZnO NPs影响下,各反应器均出现不同状态的污泥膨胀,且各浓度ZnO NPs对活性污泥的影响也不同.2 mg·L-1的ZnO NPs抑制下,R2反应器中的SV30逐渐升高,但维持在30~40 mL·g-1范围内;ZnO NPs浓度为6 mg·L-1的R3反应器,其SV30数值相对较高,维持在40~50 mL·g-1;浓度最大的R4反应器,在ZnO NPs抑制条件下,其SV30最高可到70 mL·g-1.对于各反应器的SVI,SVI随ZnO NPs浓度增大而增大.对照组中的SVI保持在90 mL·g-1左右,而在添加ZnO NPs的反应器中均出现了不同程度的恶化,浓度最高的R4反应器最高时可达370 mL·g-1.由此可见,ZnO NPs对活性污泥的沉降性能有较为显著的影响,浓度越大,沉降性能下降越明显.
在恢复阶段,试验组反应器虽然都有不同程度的恢复,但均不能恢复至最佳状态,即其沉降性能并不十分良好,R4中的污泥沉降指数为对照组的3倍.这表明经过ZnO NPs抑制后,虽然活性污泥沉降性能得到一定程度的恢复,但仍受到其后续影响.
3.2 ZnO NPs对系统除磷特性的影响ZnO NPs对絮状体EBPR除磷特性和COD去除率的影响如图 2所示.从图 2a、图 2b发现,初始系统内厌氧释磷速率与好氧吸磷速率都保持较高水平,除磷效率稳定在100%,COD在厌氧段几乎消耗完毕,这些数据均强有力地证明了聚磷菌在系统内具有较好的功能活性.
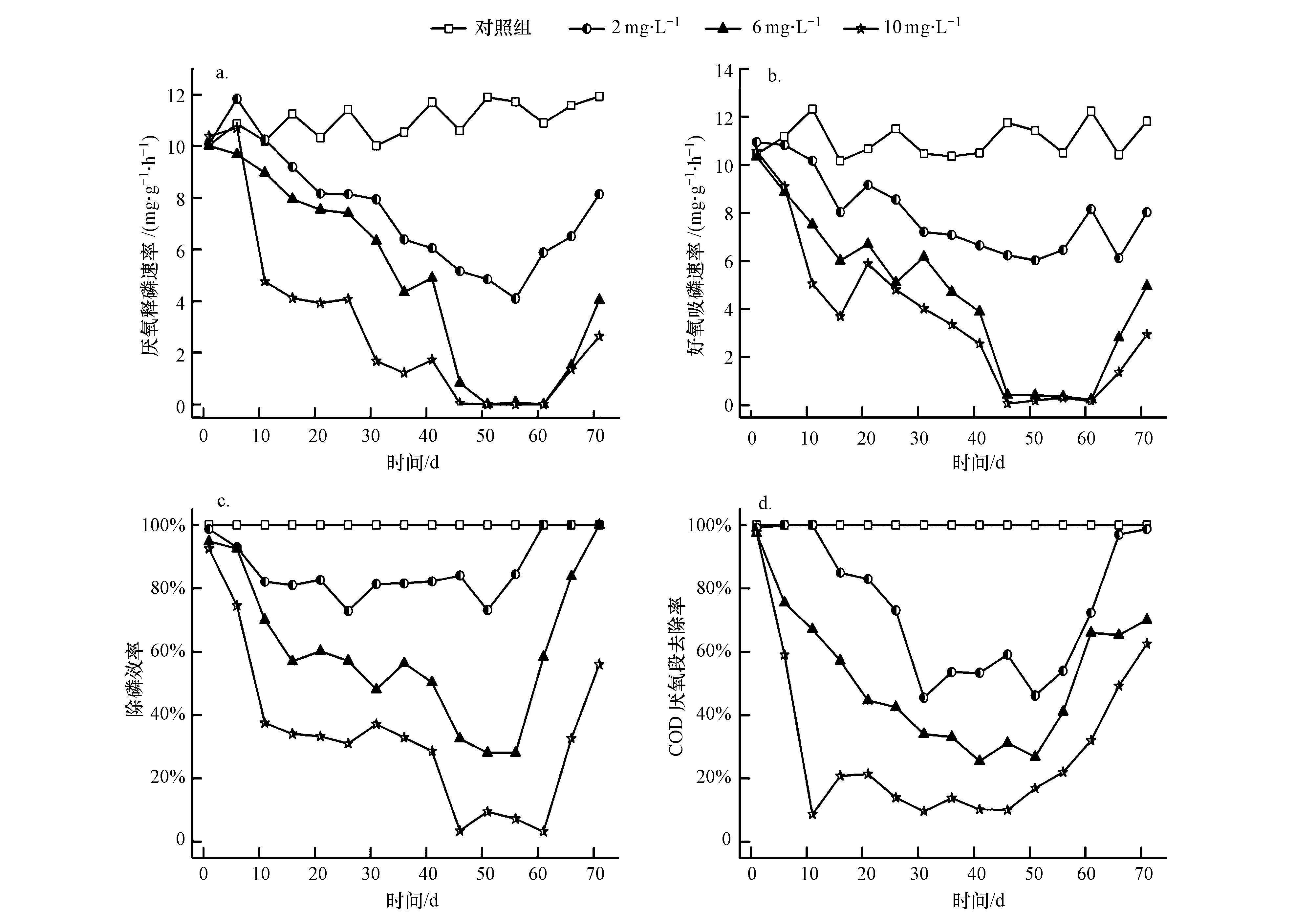 |
| 图 2 释磷速率(a)、吸磷速率(a)和C/P去除效率(c,d)曲线 Fig. 2 Release(a)and uptake(b)rate of P,and variations of P(c)and COD(d)removal efficiencies in the batch tests |
试验发现,ZnO NPs将会严重抑制EBPR中聚磷菌的代谢过程.投加ZnO NPs后,各反应器立即产生抑制效果.从第2 d开始厌氧释磷速率与好氧吸磷速率都急剧下降,且从曲线可以看出,好氧吸磷速率下降程度相对较大.试验进行10 d,R4中厌氧释磷速率与好氧吸磷速率已降至初始水平的1/2;试验进行45 d,R3与R4内厌氧释磷速率与好氧吸磷速率已降至0 mg·g-1·h-1.而除磷效率随着释磷与吸磷的降低而降低,且去除效率也随着ZnO NPs的浓度降低而降低,可见ZnO NPs显著抑制EBPR系统中P的代谢过程.另一方面,随着ZnO NPs浓度的升高,EBPR系统在厌氧段去除COD的效果逐渐降低,但并未降至0,而好氧段去除率却有轻微上升.结合上述结果可知,在系统内聚磷菌被抑制条件下,其他好氧异养菌逐渐增殖.
当停止投加ZnO NPs后,聚磷菌的吸放磷能力开始恢复.R2与R3的除磷效率分别在第61 d与第71 d恢复至100%,表现出良好且稳定的除磷能力,但R4只能恢复至60%.然而,试验组反应器中吸放磷能力却无法恢复至初始水平,R2维持在8 mg·g-1·h-1,R3与R4只能恢复至4 mg·g-1·h-1左右.显而易见,经过ZnO NPs的长期抑制,聚磷菌对P元素的代谢能力与ZnO NPs浓度有很大关联,ZnO NPs浓度越高,受抑制情况也更为严重,在恢复阶段的恢复速度与可恢复性也越低.
3.3 ZnO NPs对EPS分泌的影响EPS作为一种胶质的网状物质,在维护污泥的稳定过程中起着关键作用,它能够将周围零散附着的细菌聚集起来并粘附在一起,形成致密的絮状体.同时,还是活性污泥保护自身进行有效生理代谢的重要组成部分.当外部条件恶劣时,活性污泥通过应激反应可以产生很多的EPS覆盖表面,形成一层保护层.Sheng等(2010)也已证明了此现象.
EPS含量在抑制过程中的变化曲线如图 3所示.试验发现,EPS的组成成分中,蛋白质(PN)与多糖(PS)占据主要比例,而DNA含量相对较低.由图 3a和3b可知,蛋白质和多糖含量(以MLSS计)均呈现出明显的变化趋势,两者均随着ZnO NPs的加入而降低,而且ZnO NPs浓度越高,降幅越明显.试验浓度最高的R4反应器在抑制末期的蛋白质含量仅为初始水平的50%,多糖仅为10%.当进水中去除ZnO NPs后,受低浓度ZnO NPs抑制的反应器可以明显恢复,但对于多糖来说却难以回到初始水平,可见,ZnO NPs对聚磷菌代谢已产生显著抑制;在高浓度的反应器中,其恢复程度却并不显著,这说明高浓度ZnO NPs可以对聚磷菌代谢产生不可逆的抑制作用.多糖作为微生物分泌的重要物质在维持微生物结构完整性方面起着至关重要的作用,它不仅能凝聚细菌细胞还能粘合絮状体(Tay et al.,2011).Tay等(2011)研究发现,当反应器中微生物分泌的胞外多糖含量减少后,好氧污泥开始出现解体现象.此外,Liu等(2002)也发现多糖对细胞的附着有着重大贡献,同时还能使细菌细胞自我固定.因此,本研究得到的多糖含量减少与此前观察到的在高浓度ZnO NPs抑制下污泥开始出现膨胀有着一致性,据此推测,污泥解体松散可能为EPS中多糖含量下降的缘故.此外,本试验还发现对照组聚磷菌具有较低的PN/PS比,而随着ZnO NPs的加入,该比例逐渐增大(图 3c).结合系统性能变化不难发现,低PN/PS比的聚磷菌具有更为良好的性能.
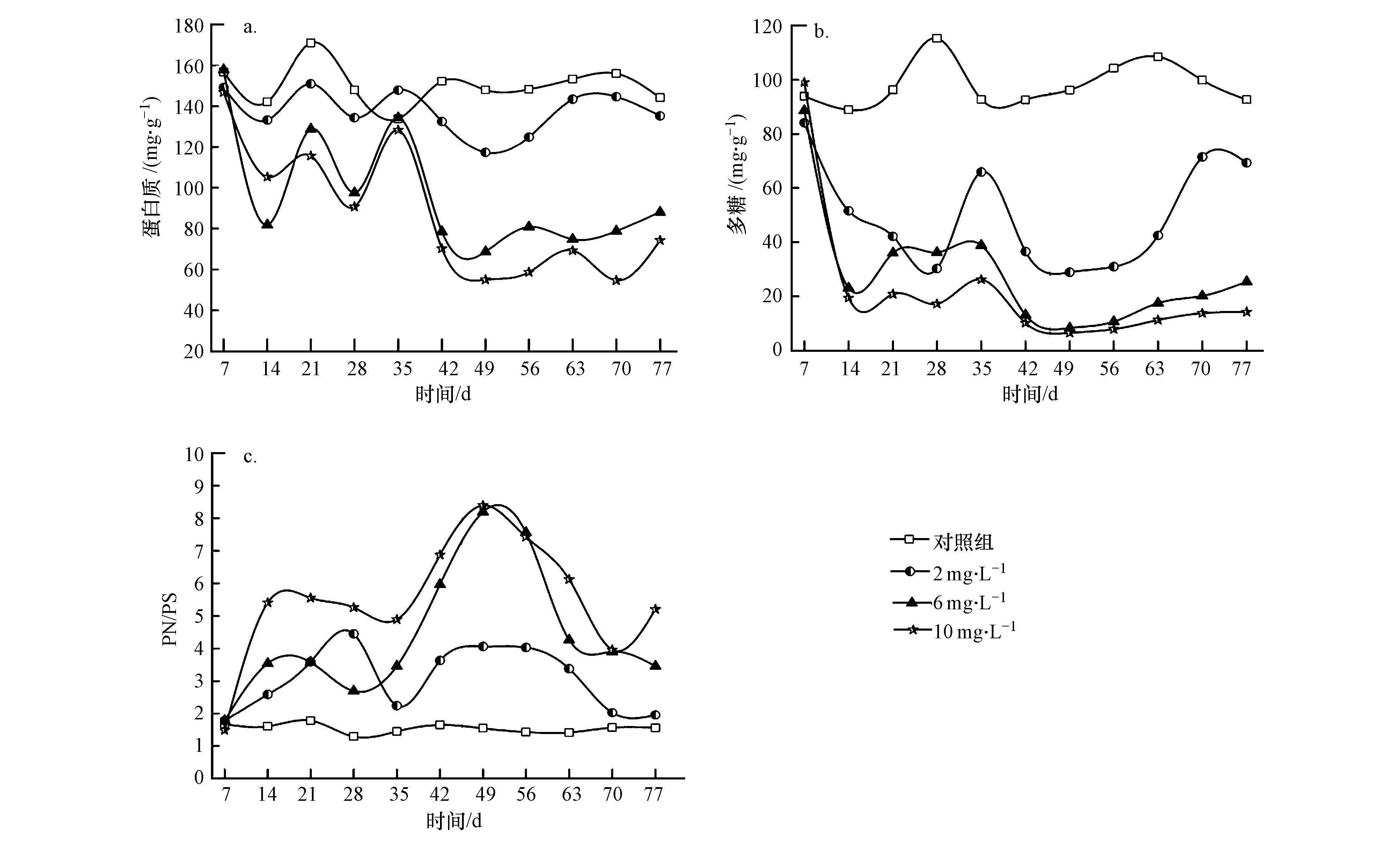 |
| 图 3 试验过程中EPS的变化 Fig. 3 EPS variations during the experiment |
聚磷菌与聚糖菌对能源物质的竞争往往被认为是导致系统性能的重要原因,以往研究通过荧光原位杂交技术来半定量分析这两种功能菌的比例变化.本试验通过454-焦磷酸盐高通量技术全定量分析比较能更为准确直观地分析变化情况.本试验所描述的聚磷菌指Rhodocyclaceae、Candidatus_Accumulibacter、 Uncultured Alpha proteobacterium、PHOS-HE36、PHOS-HE51、Uncultured Chlorobi bacterium等已被现有研究明确的聚磷菌,聚糖菌指Candidatus_Competibacter等已被现有研究明确的聚糖菌.本试验将测得菌属按功能归类,统计其比例,分析结果如表 1所示.可以看出,对照组中聚磷菌相对比例为53.12%,而聚糖菌的相对比例则较低(13.81%),这表明聚磷菌在系统内已高度富集成功.
| 表 1 试验过程中聚磷菌和聚糖菌比例的变化 Table 1 Proportion of PAOs and GAOs during the experiment |
抑制试验中,EBPR系统内聚磷菌、聚糖菌的比例发生了显著的变化.各反应器中的聚磷菌、聚糖菌的比例均随着ZnO NPs的投加均出现大幅下降,R4反应器中聚磷菌、聚糖菌的比例均已接近0,这与前期试验中EBPR系统失去除磷性能和无法在厌氧段去除COD的表现极为符合.由此可见,ZnO NPs通过抑制系统中聚磷菌的生长代谢来间接降低EBPR的运行性能.
恢复阶段,聚磷菌、聚糖菌所占比例均得到明显的恢复.然而不同浓度ZnO NPs抑制的反应器中聚磷菌与聚糖菌的恢复程度不同,且明显发现聚磷菌的恢复程度优于聚糖菌.ZnO NPs浓度最低的R2反应器中聚磷菌的恢复最佳(41.03%),已接近初始水平,而浓度最高的R4反应器恢复程度最差(21.34%),这也与系统除磷效率的恢复符合.由上述结果可知,当EBPR系统长期被ZnO NPs抑制后,聚磷菌与聚糖菌均会产生显著的抑制效果,浓度越高,恢复速度越慢,恢复程度也越低.
3.5 ZnO NPs对系统微生物群落结构的影响 3.5.1 EBPR系统群落多样性分析本试验中,454-焦磷酸盐高通量技术揭示了抑制过程与恢复阶段中微生物群落结构多样性的变化,结果如表 2所示.OTUs是在系统发生学或群体遗传学研究中人为设定的分类单元,可有效显示菌属数目信息.由表 2可知,抑制过程中各反应器OTUs呈明显下降趋势,对照组R1中的OUTs为396,而在R4中仅为252,可见在抑制过程中系统内有效菌属不断减少.同时,本试验分析了系统内的物种多样性与群落多样性.Chao1和Shannon指数作为常用的微生物多样性表征指数,其数值与系统物种多样性成正比.从表 2明显可得,在整个抑制过程中两种指数不断减少,可见ZnO NPs对EBPR系统内微生物有明显抑制作用恢复阶段,OTUs呈明显上升趋势,R2反应器已接近初始水平,而浓度较大的R3与R4反应器虽具有上升趋势,但其恢复程度却不及R2.因此,可得在长期ZnO NPs抑制条件下,系统内有效菌属受其影响发生锐减,而恢复程度也随着ZnO NPs浓度的降低而降低.类似现象也发生在Chao1和Shannon指数上,浓度最高的R4反应器降幅最大,而恢复程度也是最小.由此可知,ZnO NPs对系统微生物影响较大,能减少系统内群落多样性.
| 表 2 EBPR系统群落多样性变化 Table 2 Variations of community diversity in EBPR system |
变形菌门是细菌中最大的一门,包括固氮细菌、脱硫细菌、除磷细菌,因此,研究该门类的细菌可以为探究EBPR系统效能提供可靠的科学依据.拟杆菌门作为系统内数量第二大的门类,包含了黄杆菌纲和鞘脂杆菌纲等,具有降解纤维素的特性.
本试验对抑制过程与恢复阶段的拟杆菌门与变形菌门进行了比较分析,结果如表 3所示.对照组中拟杆菌门与变形菌门分别为17.49%和74.67%.进水中添加ZnO NPs后,拟杆菌门比例急剧上升,接近系统菌群的50%,而变形菌门则发生了锐减现象,浓度最高的R4反应器中变形菌门比例已降至56.59%.上述试验现象表明,ZnO NPs对菌属的抑制毒性并不是广泛的,而是针对特定菌属.拟杆菌门在抑制过程中比例升高,说明ZnO NPs对其反而有一定的促进作用;而对于变形菌门,抑制作用显而易见.由于变形菌门中含有大量脱氮除磷菌,因此,该门细菌的减少也降低了EBPR系统的运行效能.
| 表 3 试验过程中拟杆菌门和变形菌门比例的变化 Table 3 Proportion of Bacteroidetes and Proteobacteria during the experiment |
而在恢复阶段拟杆菌门比例开始下降,变形菌门比例则开始上升,两者的比例变化都趋向于初始水平.由表 3可以看出,进水去除ZnO NPs后,拟杆菌门比例出现下降趋势,抑制阶段浓度越高的反应器,在恢复阶段的下降趋势越明显;变形菌门经过ZnO NPs长期抑制其比例在恢复期仍然得到一定的恢复,但两者均难以恢复至初始水平.可见,ZnO NPs对不同菌属有不同作用,对于拟杆菌门,它起到促进作用;而对于包括脱氮除磷菌在内的变形菌门,其抑制效果极其显著.同时,经过ZnO NPs抑制,拟杆菌门与变形菌门虽然有着向初始水平靠近的趋势,却无法回到初始水平.
3.5.3 纲层次细菌比例变化分析拟杆菌与变形菌门作为系统内数量最多的两种细菌,在ZnO NPs投加后出现截然不同的两种变化.因此,为了深入探究其中的缘由,特在纲层次上进行菌属分析比较,结果如表 4、5所示.
| 表 4 抑制试验中特定菌属在纲层次的比例变化 Table 4 Proportion of specific bacterium at the class level in the inhibition process |
| 表 5 恢复试验中特定菌属在纲层次的比例变化 Table 5 Proportion of specific bacterium at the class level in the recovery process |
由表 4可知,在抑制阶段隶属于拟杆菌门的Bacteroidia、Cytophagia及Flavobacteriia均出现不同程度的上升,而Sphingobacteriia并无明显影响,可知,虽然整个拟杆菌门在ZnO NPs影响下所占比例增加,但其内部并非所有纲都有此趋势.Bacteroidia纲与有机物的降解及有机酸的生产密切相关,这是由于ZnO NPs加入使得污泥代谢过程受阻,无法在好氧过程生长从而促进厌氧产酸.而对于隶属于变形菌门的4类细菌在纲层次变化也不同,Betaproteobacteria纲在添加ZnO NPs后比例有小幅增加,此类细菌为与水华爆发有关的好氧异养菌;其他纲类细菌比例均出现下降,包括含有脱硫菌在内的Deltaproteobacteria.
在恢复阶段,除Bacteroidia纲外其他细菌比例均有一定程度下降,这可能是由于系统在ZnO NPs长期抑制条件下,好氧代谢被大幅抑制,从而促进厌氧产酸.对于变形菌门中的细菌,Alphaproteobacteria、Deltaproteobacteria和Gammaproteobacteria比例进一步下降,由此可知,ZnO NPs对系统中特定纲类细菌的抑制是明显且不可逆的.另一方面,Betaproteobacteria却有上升.对照组中Betaproteobacteria只有11.56%,经过抑制阶段其比例增加至13.33%,而通过恢复阶段已快速增加到53.58%,超过了50%.Betaproteobacteria是一种与水华爆发相关的优势好氧异养菌,具有极强的增殖能力,而ZnO NPs恰好成为诱因,使得其极速增长.
3.5.4 优势菌群变化分析为了研究系统内微生物群落结构变化的规律,对不同试验阶段所提取的DNA进行454-焦磷酸盐高通量测序,并与NCBI基因数据库的序列进行对比,确定菌种与变化比例,结果如表 6所示.
| 表 6 优势菌群演变 Table 6 Diversity of microbial community |
显而易见,Candidatus_Accumulibacte(39.08%)、Candidatus_Competibacter(23.41%)与Alphaproteobacteria_unclassified(18.29%)在系统初始阶段优势明显;亚硝化单胞菌(Nitrosomonas)只含有4.53%.抑制试验后可以明显发现Candidatus_Accumulibacte已经下降到2%,作为具有除磷能力的菌属,该比例已无法支撑反应器运行,这与系统宏观表现相对应;而作为聚糖菌的一种,Candidatus_Competibacter也无法在ZnO NPs的抑制下得到良好的生长,在最高浓度的R4反应器中只含有0.13%;同时,亚硝化单胞菌(Nitrosomonas)在ZnO NPs抑制下几乎接近于0.上述结果表明,ZnO NPs对于EBPR系统原有优势菌群具有非常大的抑制作用,能大幅度抑制其生长,最终失去优势被淘汰出系统.然而并非所有菌属均被抑制,具有脱氯功能的Dechloromonas在ZnO NPs条件下反而逐渐变迁为优势菌群之一;有研究发现,Zoogloea是一种菌胶团,与活性污泥膨胀紧密相关,在ZnO NPs影响下其在系统内所占比例发生极大变化,由初始的0.45%升至13.31%,这一现象表明系统内非丝状菌膨胀,与系统宏观表现十分吻合.恢复阶段中,Candidatus_Accumulibacte迅速恢复,这与系统宏观表现相对应;然而即使不再添加ZnO NPs,Candidatus_Competibacter也无法恢复到初始水平,可见ZnO NPs对Candidatus_Competibacter的影响是不可逆的;而与硝化过程相关的菌属Nitrosomonas和Nitrospira则呈现明显上升趋势,可见系统的硝化过程对ZnO NPs较为敏感.总之,通过研究系统内微生物群落结构变迁的规律可以得出,ZnO NPs对系统内微生物变迁影响明显,可以通过有效抑制功能菌的生长促使EBPR系统崩溃;同时恢复试验得出,即使微生物不再受到ZnO NPs抑制也难以恢复到初始水平.
4 结论(Conclusions)1) 经过不同浓度梯度的ZnO NPs抑制,试验组均出现了不同程度的丝状菌膨胀,导致反应器中污泥沉降性能降低.SV30最高可达70以上,SVI可接近400 mL·g-1.而在恢复阶段,虽然各试验组均可恢复到一定程度,但都无法回到初始水平.
2) 试验发现,ZnO NPs可严重抑制聚磷菌的代谢过程,导致聚磷菌厌氧释磷速率与好氧吸磷速率降低,间接导致失去除磷能力,最终使EBPR系统崩溃.同时,其他好氧异养菌滋生,COD无法在厌氧阶段被除去.
3) ZnO NPs的存在还会使EPS中的蛋白质与多糖含量降低,使污泥出现松散现象,虽然恢复试验可以使其略微恢复,但仍然难以回到初始水平.
4) 通过高通量技术对微观层面进行分析,研究表明,ZnO NPs可严重抑制聚磷菌的正常生长,而高浓度ZnO NPs甚至可以完全抑制.同时发现,ZnO NPs对于系统内不同细菌有截然不同的作用,Proteobacteria门在试验过程中比例不断减小,而Bacteroidetes门却受到了促进作用,该发现有助于后续相关试验对某些特定菌种的筛菌.
| [1] | Adams L K, Lyon D Y, Alvarez P J J. 2006. Comparative ecotoxicity of nanoscale TiO2 NPs,SiO2,and ZnO water suspensions[J]. Water Research , 40 : 3527–3532. DOI:10.1016/j.watres.2006.08.004 |
| [2] | 曹秀芹, 赵自玲.2010. 胞外聚合物(EPS)构成的影响因素分析[J]. 环境科学与技术 , 2010, 33 (12F) : 420–424. |
| [3] | Colvin V L. 2003. The potential environmental impact of engineered nanomaterials[J]. Nature biotechnology , 21 : 1166–1170. DOI:10.1038/nbt875 |
| [4] | Gottschalk F, Sonderer T, Scholz R W, et al. 2009. Modeled environmental concentrations of engineered nanomaterials (TiO2 NPs,ZnO,Ag,CNT,Fullerenes) for different regions[J]. Environmental Science Technology , 43 : 9216–9222. DOI:10.1021/es9015553 |
| [5] | Li B, Zhang X X, Guo F, et al. 2013. Characterization of tetracycline resistant bacterial community in saline activated sludge using batch stress incubation with high-throughput sequencing analysis[J]. Water Research , 47 : 4207–4216. DOI:10.1016/j.watres.2013.04.021 |
| [6] | Liu Q S, Tay J H, Liu Y. 2003. Substrate concentration-independent aerobic granulation in sequential aerobic sludge blanket reactor[J]. Environmental Technology , 24 (10) : 1235–1242. DOI:10.1080/09593330309385665 |
| [7] | Liu Y, Tay J H. 2002. The essential role of hydrodynamic shear force in the formation of biofilm and granular sludge[J]. Water Research , 36 (7) : 1653–1665. DOI:10.1016/S0043-1354(01)00379-7 |
| [8] | Lu H, Oehmen A, Virdis B, et al. 2006. Obtaining highly enriched cultures of Candidatus Accumulibacter phosphates through alternating carbon sources[J]. Water Research , 40 (20) : 3838–3848. DOI:10.1016/j.watres.2006.09.004 |
| [9] | Mino T, Van Loosdrecht M C M, Heijnen J J. 1998. Microbiology and biochemistry of the enhanced biological phosphate removal process[J]. Water Research , 32 (11) : 3193–3207. DOI:10.1016/S0043-1354(98)00129-8 |
| [10] | Nel A, Xia T, Madler L, Li N. 2006. Toxic potential of materials at the nano-level[J]. Science , 311 : 622–627. DOI:10.1126/science.1114397 |
| [11] | Smolders G, Van der Meij J, Van Loosdrecht M, et al. 1994. Model of the anaerobic metabolism of the biological phosphorus removal process: stoichiometry and pH influence[J]. Biotechnology and Bioengineering , 43 : 461–470. DOI:10.1002/(ISSN)1097-0290 |
| [12] | Sheng G, Yu H, Li X. 2010. Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems: A review[J]. Biotechnology Advances , 28 (6) : 882–894. DOI:10.1016/j.biotechadv.2010.08.001 |
| [13] | Tay J H, Liu Q S, Liu Y. 2011. The role of cellular polysaccharides in the formation and stability of aerobic granules[J]. Letters in Applied Microbiology , 33 (3) : 222–226. |
| [14] | 魏复盛. 2002. 水和废水监测分析方法(第四版)[M]. 北京: 中国环境科学出版社 . |
| [15] | Xia T, Kovochich M, Liong M, et al. 2008. Comparisonofthemechanism of toxicity of zinc oxide and cerium oxide nanoparticles based on dissolution and oxidative stress properties[J]. ACS Nano , 2 : 2121–2134. DOI:10.1021/nn800511k |
| [16] | Zeng R, Lemaire R, Yuan Z, et al. 2003. Simultaneous nitrification,denitrification,and phosphorus removal in a lab-scale sequencing batch reactor[J]. Biotechnology and Bioengineering , 84 : 170–178. DOI:10.1002/(ISSN)1097-0290 |
| [17] | Zheng X, Wu R, Chen Y G. 2011. Effects of ZnO nanoparticles on wastewater biological nitrogen and phosphorus removal[J]. Environmental Science Technology , 45 : 2826–2832. DOI:10.1021/es2000744 |
| [18] | 钟晓, 孙培德, 方治国, 等.2010. 强化生物除磷系统除磷特性对水温变化相应的试验研究[J]. 环境科学学报 , 2010, 30 (11) : 2197–2204. |
 2016, Vol. 36
2016, Vol. 36


