2. 河南师范大学生命科学学院, 新乡 453007;
3. 莆田学院环境与生物工程学院, 莆田 351100
2. College of Life Sciences, Henan Normal University, Xinxiang 453007;
3. Department of Environment and Life Science, Putian University, Putian 351100
海洋中的藻类提供了全球一半以上的初级生产力, 对海洋生态系统的稳定及全球能流、物流有重要影响(Amin et al., 2012;Thamatrakoln et al., 2013).近年来, 随着工业化进程的加快, 海洋污染问题日益突出, 海洋环境的富营养化状态造成了藻类的过度生长, 从而形成有害藻华(Harmful Algal Blooms, HABs)(Gobler et al., 2011;郑天凌等, 2011).在我国沿海地区, 常年受到甲藻藻华的危害, 甲藻藻华对我国的沿海环境、水产经济和人类健康造成了极大的威胁(吴玉霖等, 1997;2001).塔玛亚历山大藻(Alexandrium tamarense)是一种有毒的甲藻, 在其生长过程中会分泌麻痹性贝毒(PSP)并在贝类体内累积, 被其他动物摄食后会引起中毒甚至死亡, 且常年引发藻华(林元烧, 1996), 亟待治理.
为了更好地应对藻华的危害, 包括物理法(Lee et al., 2013)、化学法(俞志明等, 1993)及生物法(龚良玉等, 2010)等在内的多种治理手段被应用于藻华的防治中.但是, 物理法成本较高、不易操作, 而化学法会危害生态环境及非藻华生物, 造成二次伤害, 因此, 以安全高效著称的生物法成为防治藻华的主要手段(黄姿等, 2008), 特别是“以菌治藻”已成为国内外生物法治理藻华的研究热点(Li et al., 2014a;2014b).课题组前期从富营养化湖水中筛选到一株高效杀害塔玛亚历山大藻的杀藻菌株Y35, 经过杀藻验证确定该菌株通过分泌红色色素作用于藻细胞, 并将该杀藻化合物进行了分离纯化, 借助于高分辨率质谱和核磁共振确定该化合物为Deinoxanthin(图 1)(Li et al., 2015).为了加强Deinoxanthin的应用效果, 在本研究中进行Deinoxanthin理化性质的探究, 并用壳聚糖-海藻酸钠对该杀藻物质进行包埋固定化, 完成杀藻制剂的制备, 以期为下一步将杀藻化合物应用于藻华的深化理论研究与灾害有效治理奠定基础.
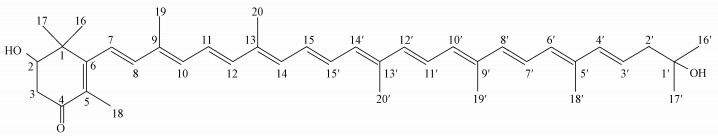 |
| 图 1 杀藻化合物Deinoxanthin的分子结构图 Fig. 1 Molecular structure of deinoxanthin |
杀藻细菌色素Deinoxanthin, 按照Li等(2015)的分离方法从杀藻菌株Deinococcus xianganensis Y35(GenBank No.KJ639011)细胞上进行纯化.供试藻种为塔玛亚历山大藻(Alexandrium tamarense ATGD98-006), 由暨南大学水生生态研究所提供.采用f/2培养基(Guillard, 1975), 于光强50 μE·m-2·s-1、温度(20±1) ℃、昼夜比为12 h:12 h的条件下培养.
2.2 实验方法 2.2.1 全波长扫描取一定量杀藻化合物Deinoxanthin溶于二甲亚砜(DMSO)中制成色素溶液, 以DMSO调零, 采用UNICAM UV300对Deinoxanthin在波长200~800 nm处进行扫描, 确定Deinoxanthin的最大吸收峰.
2.2.2 Deinoxanthin的热稳定性取一定量的Deinoxanthin溶解于DMSO中, 平均分在4个处理组, 每个处理组做3个平行, 分别将4个处理组的样品在20、40、60、80 ℃下水浴1 h, 待样品冷却至常温后, 在475 nm下测定样品的吸光度值.
2.2.3 Deinoxanthin的酸碱稳定性取一定量的Deinoxanthin溶解于DMSO中, 平均分在6个处理组, 每个处理组做3个平行, 分别将6个处理组的样品的pH调为3、5、7、9、10和12, 并保持5 h后, 再将各处理组的pH调回初始pH, 在475 nm下测定样品的吸光度值.
2.2.4 光照对Deinoxanthin的影响取上述色素的DMSO溶液于5 mL试管中, 插放在塑料透明试管架上, 放置于20 ℃光照培养箱中, 其中, 光照强度为1000 lx使各管与光源保持等距并开始计时, 分别放置2、4、6、8、10和12 h后, 在475 nm下测定样品的吸光度值.
2.2.5 紫外线对Deinoxanthin的影响取上述色素的DMSO溶液于敞开的玻璃平皿并置于紫外光下, 分别处理5、10、15和20 min, 每个处理组做3个平行, 紫外处理后在475 nm下测定样品的吸光度值.
2.2.6 杀藻制剂的制备①将6 mg杀藻化合物Deinoxanthin与1 g的壳聚糖混合后, 并添加100 mL蒸馏水制备成混合液A;②称量3.0 g海藻酸钠加入到60 mL蒸馏水中, 用微波炉加热, 每加热20 s用玻璃杯进行搅拌并捶打固体颗粒, 最终形成没有明显颗粒物的乳胶状体系B;③称量0.75 g阿拉伯胶溶解于25 mL蒸馏水中, 乳化5 min, 得到混合液C;④将混合体系A、B和C混合在同一烧杯中, 用玻璃棒搅拌均匀, 并在超声清洗机中清除体系中的气泡, 至完全清除气泡为止;⑤将上述超声除气的混合体系在恒流泵的蠕动作用下逐滴地滴入3.0%的氯化钙水溶液中(李芝等, 2011), 形成含有杀藻化合物的凝胶小球, 将小球置于电热恒温干燥箱中干燥2~4 h后, 置于风口处待小球完全干燥, 期间不断拨动小球, 防止小球之间相互粘连, 干燥后的包含有Deinoxanthin的凝胶小球即为杀藻制剂.
2.2.7 杀藻制剂杀藻效果验证将制备好的杀藻制剂按照1 mL藻液分别添加1、2、3、4、5个凝胶小球的添加量, 添加入对数生长期的藻细胞进行杀藻效果验证.每隔一段时间, 用酶标仪测定各处理组藻细胞在激发波长440 nm和发射波长680 nm处的荧光强度, 以此来表征不同添加量的杀藻制剂的杀藻效果(Zhang et al., 2014).
2.2.8 杀藻制剂的杀藻过程按照1 mL添加3个凝胶小管的添加量将上述制备的杀藻制剂加入到对数生长期的藻培养液中, 每隔12 h取藻液在光学显微镜(Olympus BX41, Chiyoda-ku, Tokyo, Japan)下观察藻细胞的形态变化.
3 结果与讨论(Results and discussion) 3.1 杀藻化合物Deinoxanthin的最大吸收峰杀藻化合物Deinoxanthin呈红色粉末状, 可以溶解于甲醇、乙醇、乙酸乙酯和二甲亚砜(DMSO)等有机溶剂中, 由于DMSO稳定性好且毒性低, 常被用来当作溶剂使用(Ronen et al., 1984).因此, 本研究将Deinoxanthin溶解于DMSO, 制备成Deinoxanthin溶液.用紫外分光光度计对Deinoxanthin进行全波长扫描, 发现该化合物在可见光区域和紫外光区域均有吸收峰出现, 在475 nm处有最大吸收峰(图 2), 因此, 在后续试验中通过测定475 nm波长下的物质含量来检测Deinoxanthin的含量变化.
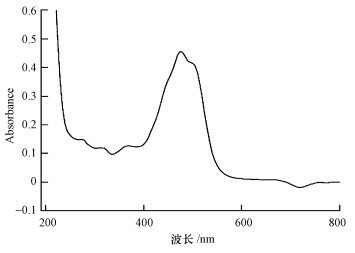 |
| 图 2 杀藻化合物Deinoxanthin的全波长扫描图 Fig. 2 Full wavelength scanning profile of deinoxanthin |
利用紫外分光光度计测定了经过不同温度处理后的Deinoxanthin在475 nm下的吸光度值(图 3), 与常温下(20 ℃)Deinoxanthin的含量相比, 经过40 ℃处理后的化合物没有表现出明显的差异, 而经过60和80 ℃处理后的化合物的含量明显下降(p < 0.01), 但其含量仍保持较高水平, 其OD475值维持在0.6左右, 可以在常温下保存和发挥杀藻作用.
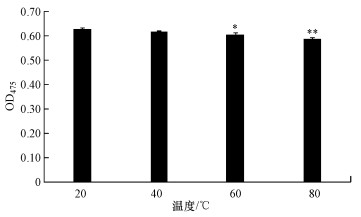 |
| 图 3 不同温度处理对Deinoxanthin的影响(*(**)表示与20 ℃处理组相比差异显著, p < 0.05(p < 0.01)) Fig. 3 The effect of different temperature on deinoxanthin |
为了确定化合物Deinoxanthin的酸碱稳定性, 检测了经过不同pH处理后的Deinoxanthin在475 nm下的吸光度值变化(图 4).结果表明, Deinoxanthin在碱性环境下有较高的稳定性, 但对酸性环境敏感, 化合物的含量在酸性环境下与中性或碱性环境相比显著下降(p < 0.01).当pH降低到5.0时, Deinoxanthin的OD475值下降为0.44, 当pH降低到3.0的时候, 其OD475值降低到0.36.表明Deinoxanthin在中性或者碱性环境下有高稳定性, 在酸性环境下逐渐失去活性, 并且活性随着pH的降低而逐渐减弱.海水环境中的pH一般都维持在8左右, 而藻华爆发时期大量藻类的出现消耗了海水中的CO2, 同时提高了海水环境的pH(李祎等, 2012).因此, 将杀藻物质Deinoxanthin投放于藻华现场, 不会受到海水的pH的影响, 从而保证了Deinoxanthin在藻华现场发挥杀藻作用.
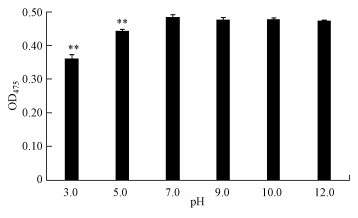 |
| 图 4 不同pH处理对Deinoxanthin的影响(**表示与pH=7处理组相比差异显著, p < 0.01) Fig. 4 The effectof different pH on deinoxanthin |
为了确定Deinoxanthin在光照下的稳定性, 用分光光度计检测了在光照下处理不同时间的Deinoxanthin在475 nm处的吸光度值.结果表明, Deinoxanthin对光照非常敏感, 在短时间的光照作用下, Deinoxanthin含量显著下降(p < 0.01), 并且随着光照时间的延长, 其含量越来越低, 最终失去活性(图 5).Deinoxanthin在光照作用下逐渐分解, 色素颜色逐渐变浅, 不具有光照稳定性.光照对于色素类物质稳定性的影响, 主要是因为光照可以促进类色素分子中CC双键的断裂, 导致色素的降解(Kopas-Lane et al., 1995).Deinoxanthin分子结构中存在大量的CC双键, 在光照的作用下很容易断裂, 加速了Deinoxanthin的降解.孙明奇等(2008)研究了光照对橘皮类胡萝卜素稳定性的影响, 发现光照对类胡萝卜素有明显的降解作用, 光照8 h后类胡萝卜素的保存率仅为49.1%.为了加强Deinoxanthin在藻华现场的杀藻功能, 必须要解决Deinoxanthin在光照下易分解的缺点, 由于Deinoxanthin的杀藻效果非常高效, 短时间就可以将塔玛亚历山大藻细胞杀死(Li et al., 2015), 因此, 可以选择在夜晚进行Deinoxanthin的投放, 以此来避免光照的影响.但这不能从根本上解决Deinoxanthin的光照不稳定性, 而Deinoxanthin的固定化作用则可以提高其稳定性.
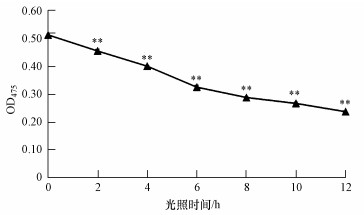 |
| 图 5 不同光照时间对Deinoxanthin稳定性的影响(**表示对照组相比差异显著, p < 0.01) Fig. 5 The influence of different illumination time on the stability of deinoxanthin |
为了确定紫外线对Deinoxanthin稳定性的影响, 测定了在紫外线下处理不同时间后的Deinoxanthin在475 nm下的吸光度值(图 6).结果表明, Deinoxanthin对紫外线辐射非常敏感, 在紫外线作用20 min后, Deinoxanthin的含量急剧下降(p < 0.01), 其OD475值降低到0.024.紫外线辐射对Deinoxanthin活性的影响很大, 这可能跟Deinoxanthin的化学结构有关.紫外线对色素稳定性的影响, 同样是通过对色素分子结构中的CC双键的作用而产生的降解效果(Shunmugam et al., 2014), 相对于光照的影响, 紫外线的影响更为显著.袁保红等(2006)研究了紫外线对海洋细菌Pseudomonas sp.所分泌的灵菌红素的稳定性的影响, 结果表明, 紫外线影响了色素的稳定性, 并且影响的效果随pH的升高而增强.紫外线对色素的稳定性影响很大, 如果要解决紫外线对色素稳定性的影响, 需要对杀藻化合物Deinoxanthin进行包埋固定化, 从而提高Deinoxanthin的稳定性.
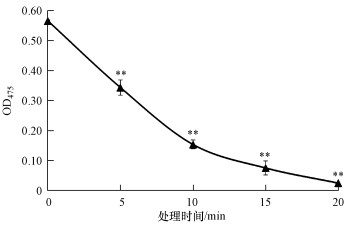 |
| 图 6 紫外线作用对Deinoxanthin稳定性的影响(**表示对照组相比差异显著, p < 0.01) Fig. 6 The influence of ultraviolet rays on the stability of deinoxanthin |
将杀藻化合物Deinoxanthin与壳聚糖混合添加到海藻酸钠-阿拉伯明胶体系中, 在恒流泵的蠕动作用下逐滴滴加至3.0%的氯化钙水溶液中, 形成含有Deinoxanthin的凝胶小球(图 7a).海藻酸钠的分子链上有大量的梭基, 壳聚糖分子链上有大量的伯氨基, 因此, 二者可以通过正、负电荷吸引形成复合凝胶, 增加微球的强度, 抑制海藻酸纳凝胶微球的崩解, 而壳聚糖因在酸性介质中膨胀形成胶体粘稠物质而阻滞包埋物质的扩散及溶出(川島嘉明等, 1985), 从而实现了对包埋物稳定性的提高及缓释作用.将Deinoxanthin与壳聚糖和海藻酸钠构建成“Deinoxanthin-壳聚糖-海藻酸钠”缓释微球有利于提高Deinoxanthin的稳定性和作用时间.所形成的凝胶小球直径为2~3 mm, 呈粉红色.在电热恒温干燥箱中完全干燥使其内部水分完全蒸发, 得到直径为1 mm, 呈深红色的凝胶小球(图 7b, c).其中, 每个小球重约1 mg, 内部含有约1.2 μg Deinoxanthin.
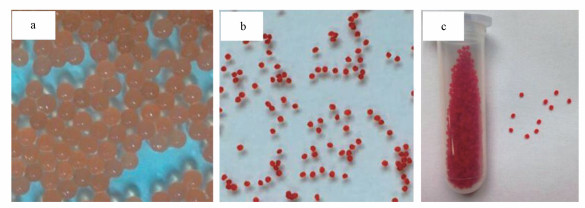 |
| 图 7 含有Deinoxanthin的杀藻制剂在干燥前(a)和干燥后(b, c)的形态特征 Fig. 7 The morphology of algicidal agents before (a) and after drying (b, c) |
为了确定含有Deinoxanthin的杀藻制剂对塔玛亚历山大藻的作用效果, 分别添加了1、2、3、4和5个凝胶小球于1 mL藻培养液中验证杀藻效果, 其中, 每个凝胶小球含有1.2 μg杀藻化合物Deinoxanthin(图 8).Zhang等(2014)研究表明, 藻细胞的叶绿素荧光与藻细胞数成线性关系, 可以通过测量藻细胞生长过程中的叶绿素荧光来衡量藻细胞的生长状况.因此, 在本研究中, 通过对藻细胞的叶绿素荧光值进行测量来确定杀藻制剂的杀藻效果.在整个处理过程中, 对照组藻细胞的荧光值保持在持续升高的水平, 添加了1个(1.2 μg·mL-1)和2个(2.4 μg·mL-1)凝胶小球的藻培养液的荧光值与对照组相比没有明显差别, 说明2个凝胶小球对1 mL藻细胞的生长没有明显的抑制效果.而添加了3个(3.6 μg·mL-1)及以上凝胶小球的藻培养液的荧光值与对照相比显著下降.在处理3 h的时候, 添加4个(4.8 μg·mL-1)和5个(6.0 μg·mL-1)凝胶小球的藻培养液的荧光值已经开始有明显降低, 并且随着处理时间的延长, 其荧光值逐渐降低.在添加了3个凝胶小球的藻培养液的荧光值在处理18 h时显著低于对照组.在处理48 h时, 添加了3、4和5个凝胶小球的藻培养液的荧光值显著低于对照组, 分别为对照组荧光值的10.6%、13.2%和8.1%.这说明每1 mL藻液中添加3个及3个以上的凝胶小球后, 藻细胞生长受到抑制.每个凝胶小球中约含有1.2 μg杀藻化合物Deinoxanthin, 3个凝胶小球中的Deinoxanthin含量大约达到3.6 μg, 这与我们在前期实验中确定的Deinoxanthin杀藻浓度为5 μg·mL-1(Li et al., 2015)一致.结果表明, 含有Deinoxanthin的杀藻制剂有十分高效的杀藻效果, 在凝胶小球加入到藻培养体系后, 小球吸水膨胀, 释放杀藻物质, 同时小球颜色变浅.添加了1个和2个凝胶小球的藻培养液的颜色与对照相比没有明显差别, 均呈现出深棕色, 且可看见大量颗粒状的藻细胞.而添加了3个及其以上凝胶小球的藻培养液颜色变得较为透明, 无法观察到颗粒状的藻细胞, 在杀藻物质作用下, 藻细胞死亡.
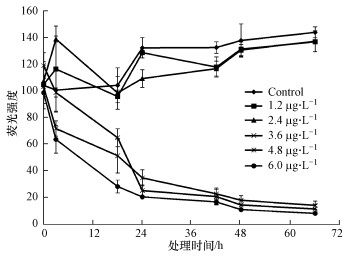 |
| 图 8 含有Deinoxanthin的杀藻制剂对塔玛亚历山大藻的作用效果 Fig. 8 Algicidal activity of algicidal agents on Alexandrium tamarense |
在杀藻制剂的作用下, 藻细胞形态发生明显的改变(图 9).正常生长的藻细胞有完整的细胞结构, 细胞膜和细胞壁紧凑且细胞质致密均一(图 9a);在杀藻制剂作用12 h后, 藻细胞形态发生改变, 细胞壁和细胞膜发生质壁分离, 藻细胞的一段发生明显的突起现象(图 9b);在杀藻制剂作用24 h后, 藻细胞一段的细胞膜和细胞壁破裂, 胞内物质大量外溢, 同时细胞质分布不均匀(图 9c);在杀藻制剂作用36 h后, 无法观察到藻细胞成形的细胞结构, 细胞质颜色变浅, 且细胞结构严整破坏, 最终藻细胞裂解死亡(图 9d).
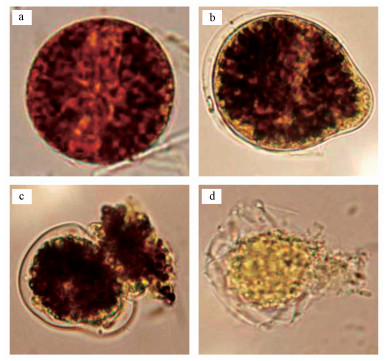 |
| 图 9 在杀藻制剂作用下塔玛亚历山大藻细胞的死亡过程(a.正常藻细胞;b.处理12h藻细胞;c.处理24h藻细胞;d.处理36h藻细胞) Fig. 9 Decay of A. tamarense by algicidal preparations(a.control cells presenting normal morphology; b~d.cells exposed to algicidal preparations for 12, 24, and 36 h) |
1)杀藻化合物Deinoxanthin有较高的热稳定性;在中性和碱性条件下有稳定的活性, 但在酸性条件下活性减弱;对光照和紫外线敏感, 在光照和紫外线辐射下易分解, 失去活性.
2)将Deinoxanthin与海藻酸钠-阿拉伯明胶形成的凝胶小球制备成杀藻制剂, 每个凝胶小球重约1 mg, 内部含有约1.2 μg杀藻化合物, 每毫升藻液中加3个凝胶小球后, 藻细胞死亡.
3)在杀藻制剂作用下, Deinoxanthin在藻培养液中缓慢释放, 能够长时间对藻细胞持续起作用, 并且Deinoxanthin在凝胶小球的包裹下更加稳定, 在长时间光照后也不会分解.因此, 杀藻制剂相对于直接将化合物投加到环境中较为温和, 减小了对局部生态环境的负面影响, 并且增加了杀藻细菌色素的稳定性, 可为杀藻细菌色素的应用提供技术支持.
| [${referVo.labelOrder}] | Amin S A, Parker M S, Armbrust E V. 2012. Interactions between diatoms and bacteria[J]. Microbiology and Molecular Biology Reviews , 76 (3) : 667–684. DOI:10.1128/MMBR.00007-12 |
| [${referVo.labelOrder}] | 川島嘉明, 林山陽, 笠井昭宏, 等.1985. Preparation of a prolonged release tablet of aspirin with chitosan[J]. Chemical and Pharmaceutical Bulletin , 1985, 33 (5) : 2107–2113. |
| [${referVo.labelOrder}] | 龚良玉, 李雁宾, 祝陈坚, 等.2010. 生物法治理赤潮的研究进展[J]. 海洋环境科学 , 2010 (1) : 152–158. |
| [${referVo.labelOrder}] | Gobler C J, Berry DL, Dyhrman S T, et al. 2011. Niche of harmful alga Aureococcus anophagefferens revealed through ecogenomics[J]. Proceedings of the National Academy of Sciences , 108 (11) : 4352–4357. DOI:10.1073/pnas.1016106108 |
| [${referVo.labelOrder}] | Guillard R R. 1975. Culture of Phytoplankton for Feeding Marine Invertebrates Culture of Marine Invertebrate Animals[M]. Berlin: Springer: 29 -60. |
| [${referVo.labelOrder}] | 黄姿, 朱白婢, 孙建波, 等.2008. 赤潮的生物防治及其研究进展[J]. 安徽农学通报 , 2008, 14 (15) : 82–84. |
| [${referVo.labelOrder}] | Kopas-Lane L, Warthesen J. 1995. Carotenoid photostability in raw spinach and carrots during cold storage[J]. Journal of Food Science , 60 (4) : 773–776. DOI:10.1111/jfds.1995.60.issue-4 |
| [${referVo.labelOrder}] | 李祎, 杨彩云, 李东, 等.2012. 厦门海域2011年中肋骨条藻和血红哈卡藻赤潮期间细菌群落结构变化[J]. 微生物学报 , 2012, 52 (10) : 1268–1281. |
| [${referVo.labelOrder}] | 李芝, 葛旭升, 王志.2011. 啶虫脒/羧甲基壳聚糖-阿拉伯胶-海藻酸钠缓释微球的制备及性能研究[J]. 保定学院学报 , 2011, 24 (3) : 58–62. |
| [${referVo.labelOrder}] | 林元烧.1996. 有毒甲藻-塔玛亚历山大藻在厦门地区虾塘引起赤潮[J]. 台湾海峡 , 1996, 15 (1) : 16–18. |
| [${referVo.labelOrder}] | Lee Y C, Jin E, Jung S W, et al. 2013. Utilizing the algicidal activity of aminoclay as a practical treatment for toxic red tides[J]. Scientific Reports , 3 : 1292. |
| [${referVo.labelOrder}] | Li Y, Zhu H, Guan C, et al. 2014. Towards molecular, physiological, and biochemical understanding of photosynthetic inhibition and oxidative stress in the toxic Alexandrium tamarense induced by a marine bacterium[J]. Applied Microbiology and Biotechnology , 98 (10) : 4637–4652. DOI:10.1007/s00253-014-5578-x |
| [${referVo.labelOrder}] | Li Y, Zhu H, Lei X, et al. 2015. The first evidence of deinoxanthin from Deinococcus sp[J]. Y35 with strong algicidal effect on the toxic dinoflagellate Alexandrium tamarense[J]. Journal of Hazardous Materials , 290 : 87–95. |
| [${referVo.labelOrder}] | Li Y, Zhu H, Zhang H, et al. 2014b. Toxicity of algicidal extracts from Mangrovimonas yunxiaonensis strain LY01 on a HAB causing Alexandrium tamarense[J]. Journal of Hazardous Materials , 278 : 372–381. DOI:10.1016/j.jhazmat.2014.06.032 |
| [${referVo.labelOrder}] | Ronen R, Galun M. 1984. Pigment extraction from lichens with dimethyl sulfoxide (DMSO) and estimation of chlorophyll degradation[J]. Environmental and Experimental Botany , 24 (3) : 239–245. DOI:10.1016/0098-8472(84)90004-2 |
| [${referVo.labelOrder}] | 孙明奇, 潘思轶, 胡建中, 等.2008. 环境条件对柑橘果皮类胡萝卜素稳定性影响研究[J]. 食品科学 , 2008, 29 (6) : 127–129. |
| [${referVo.labelOrder}] | Shunmugam S, Jokela J, Wahlsten M, et al. 2014. Secondary metabolite from Nostoc XPORK14A inhibits photosynthesis and growth of Synechocystis PCC 6803[J]. Plant, Cell & Environment , 37 (6) : 1371–1381. |
| [${referVo.labelOrder}] | Thamatrakoln K, Bailleul B, Brown C M, et al. 2013. Death-specific protein in a marine diatom regulates photosynthetic responses to iron and light availability[J]. Proceedings of the National Academy of Sciences , 110 (50) : 20123–20128. DOI:10.1073/pnas.1304727110 |
| [${referVo.labelOrder}] | 吴玉霖, 周成旭.1997. 甲藻赤潮的海洋环境危害及其防治[J]. 海洋环境科学 , 1997, 16 (4) : 58–63. |
| [${referVo.labelOrder}] | 吴玉霖, 周成旭, 张永山, 等.2001. 烟台四十里湾海域红色裸甲藻赤潮发展过程及其成因[J]. 海洋与湖沼 , 2001, 32 (2) : 159–167. |
| [${referVo.labelOrder}] | 俞志明, 邹景忠, 马锡年, 等.1993. 治理赤潮的化学方法[J]. 海洋与湖沼 , 1993, 24 (3) : 314–318. |
| [${referVo.labelOrder}] | 袁保红, 杜青平, 蔡创华, 等.2006. 海洋细菌Pseudomonas sp[J]. 色素的提取及稳定性的研究[J].海洋通报 , 2006, 24 (6) : 92–96. |
| [${referVo.labelOrder}] | 郑天凌, 吕静琳, 周艳艳, 等.2011. 海洋有害赤潮调控功能菌的发现与研究[J]. 厦门大学学报:自然科学版 , 2011, 50 (2) : 445–454. |
| [${referVo.labelOrder}] | Zhang B, Cai G, Wang H, et al. 2014. Streptomyces alboflavus RPS and its novel and high algicidal activity against harmful algal bloom species phaeocystis globosa[J]. PloS One , 9 (3) : e92907. DOI:10.1371/journal.pone.0092907 |
 2016, Vol. 36
2016, Vol. 36


