2. 南京农业大学资源与环境科学学院, 南京 210095
2. College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095
在酸性环境下, 氧化亚铁硫杆菌(A.ferrooxidans)可将Fe2+和还原态S分别氧化为Fe3+和SO42-, 同时获得生命活动中所需要的能量来固定空气中的CO2和维持自身生长, 在环境工程领域有着广阔的应用前景(Torma et al., 1982;Torma, 1983).目前, A.ferrooxidans氧化Fe2+和还原态S的特性已经被成功地应用于生物湿法冶金(Torma et al., 1988)、AMD的治理(Nemati et al., 1998;Skousen et al., 2000;刘成, 2001)、烟气脱硫(Magota et al., 1988;赵跃明, 1998)、煤炭脱硫(唐军等, 1998), 以及污泥、底泥等处理中(Tyagi, 1992;Tyagi et al., 1996;Zhou et al., 2005;Liu et al., 2012).
A.ferrooxidans氧化Fe2+的过程通常发生在低pH、富含Fe3+、SO42-及一价阳离子等(如K+、Na+、NH4+等)极端酸性环境中, 通常伴随有次生羟基硫酸铁矿物如黄铁矾、施氏矿物等的生成.黄铁矾具有不溶解于稀酸, 易于沉淀、洗涤和过滤等优点, 因而被广泛用于金属冶炼工业中除铁.同时, 黄铁矾也是性能优异、稀有昂贵的赭黄色无机颜料(周顺桂等, 2004), 且黄铁矾在作为固定化载体时有助于A.ferrooxidans生物膜的形成(Karamanev, 1991;Elgersma et al., 1993;Dutrizac, 1996;Gómez et al., 2000;周立祥, 2008).然而, 在实际工程应用中, 黄铁矾的出现也会带来负面作用.如烟气脱硫中, 黄铁矾的生成会减少反应器中作为氧化剂的Fe3+的浓度;黄铁矾在管道、阀门等位置的沉积还会影响反应器的正常运转(Jensen et al., 2005;周顺桂等, 2006).而另一种次生矿物—施氏矿物, 具有纳米级粒度和不规则孔道结构, 比表面积多在100~200 m2·g-1, 且富含羟基、硫酸根等基团, 对重(类)金属具有很强的吸附能力和共沉淀作用, 在重金属废水处理领域具有潜在的应用价值(Jönsson et al., 2005;Waychunas et al., 2005;Bang et al., 2005).但若以A.ferrooxidans为主要功能菌的生物酸化来去除污泥或土壤体系固相中的重金属时, 产生的施氏矿物反而会起到副作用(Liao et al., 2009b).
可见, 黄铁矾或施氏矿物都有各自的优缺点, 结合上述实际应用中出现的诸多问题, 本研究主要考察黄铁矾或施氏矿物的形成条件, 根据实际需求来调整最佳的工艺参数, 进而避免负效应的产生.温度和pH是容易调控的两个主要因素, 本试验拟在A.ferrooxidans改良9K液体培养基体系下, 通过调节反应温度和初始pH来考察二者对次生产物的综合影响, 以期为环境治理中有效调控次生矿物的形成提供科学依据.
2 材料与方法(Materials and methods) 2.1 供试材料改良9K液体培养基:(NH4)2SO4 3.5 g, KCl 0.119 g, K2HPO4 0.058 g, Ca(NO3)2·4H2O 0.0168 g, MgSO4·7H2O 0.583 g, 蒸馏水1000 mL, pH=2.5, 121 ℃灭菌30 min.
A.ferrooxidans休止细胞制备:将A.ferrooxidans接种在改良9K培养基中, 置于28 ℃、180 r·min-1摇床中振荡培养, 指数生长阶段后期停止培养(约2~3 d).随后将培养液经定性滤纸过滤以除去生成的铁沉淀物, 将滤液以10000×g的相对离心力(4 ℃、10 min)离心收集菌体, 并用pH=1.5的酸水(H2SO4配制)洗3次, 除去各种杂离子.将这些菌体悬浮于pH=2.5的酸水(H2SO4配制), 所得即为A.ferrooxidans浓缩菌液.
2.2 试验设置在一系列500 mL三角瓶中加入改良9K液体培养基, 按8960 mg·L-1的Fe2+浓度加入FeSO4·7H2O, 用1:1的H2SO4调上述所有体系pH至1.5、2.0、2.5和3.0, 随后接种A.ferrooxidans休止细胞悬浮液, 并补充去离子水, 使体系的有效容积为250 mL, A.ferrooxidans密度为5×107 cells·mL-1.上述三角瓶分别置于8、18、28和38 ℃摇床中振荡培养72 h.培养过程中, 定期取液体样约1 mL过0.22 μm滤膜(取样前使三角瓶预先静置5 min, 使次生矿物完全沉降, 然后取上清液), 测定和计算Fe2+浓度、Fe2+平均氧化速度、总Fe沉淀率的变化情况.培养期间采用称重法定时补加因蒸发减少的水分.培养终点时, 用中速定性滤纸收集合成的次生矿物, 用去离子水清洗2次以去除杂质, 60 ℃烘干后称重并进行矿物相鉴定.不同处理均设置3个重复.Fe2+氧化率(R1)、总Fe沉淀率(R2)和Fe2+平均氧化速度(V, mg·L-1·h-1)计算公式如下:
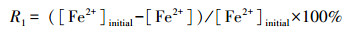
|
(1) |
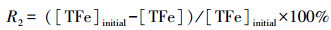
|
(2) |
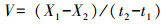
|
(3) |
式中, [TFe]为总Fe浓度(mg·L-1);X1和X2分别为t1和t2时刻的Fe2+浓度(mg·L-1).
2.3 测定方法采用pHS-3C精密pH计测定溶液pH值;Fe2+和总Fe浓度采用邻啡罗啉比色法测定;矿物质量用电子天平称量;矿物颜色用标准比色卡进行比对;矿物相采用X射线衍射仪测定(XRD, Bruker D8), 测试工作条件为:管电压40 kV, 管电流40 mA, 扫描区间10°~80°(2θ), 步长0.01°, 扫描速率6°·min-1, Cu靶.
3 结果与讨论(Results and discussion) 3.1 溶液温度和pH对Fe2+生物氧化的影响在A.ferrooxidans接种密度为5×107 cells·mL-1, Fe2+浓度为8960 mg·L-1的9K培养基中, 通过改变起始pH和培养温度来观察二者对Fe2+氧化、Fe3+水解沉淀及次生矿物形成的综合影响.图 1是反应过程中不同处理体系Fe2+的生物氧化情况.另外, 通过计算Fe2+的平均氧化速度来对各处理中Fe2+的氧化速度进行定量比较, 结果如表 1所示.
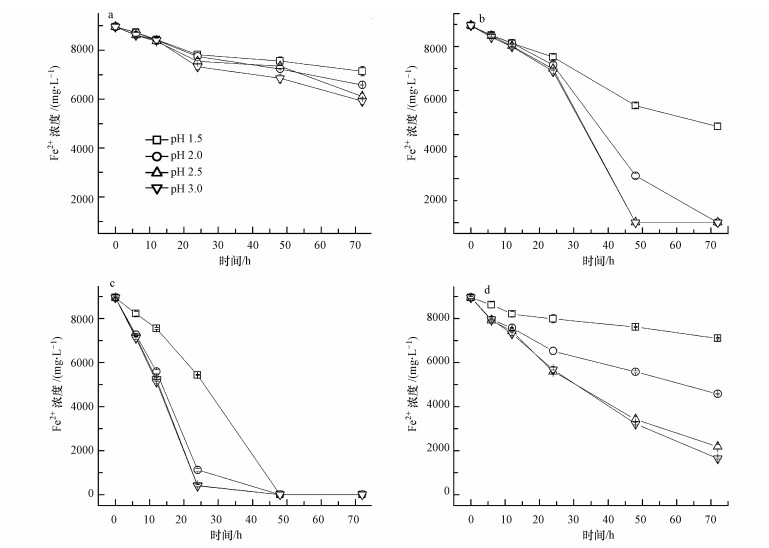 |
| 图 1 溶液起始pH和反应温度对Fe2+氧化的影响(a.8 ℃;b.18 ℃;c.28 ℃;d.38 ℃) Fig. 1 Effects of pH and temperature on Fe2+ oxidation |
| 表 1 溶液起始pH和反应温度对Fe2+平均氧化速度的影响 Table 1 Effects of pH and temperature on the mean Fe2+ oxidation rate |
结合图 1c和表 1可以看出, 28 ℃时A.ferrooxidans氧化Fe2+的速度最快, 这与Daoud 等(2006)的研究结果是接近的.当培养温度为28 ℃时, 起始pH=2.0~3.0处理中的反应最快, Fe2+的最高平均氧化速度高达402 mg·L-1·h-1(pH=2.5, 12~24 h), 反应至24 h时90%以上的Fe2+被氧化;当pH降到1.5时, Fe2+的氧化速度明显下降, Fe2+的最高平均氧化速度为226 mg·L-1·h-1(24~48 h), 反应至24 h时Fe2+氧化率只有39.35%.不过, 所有处理的Fe2+都在48 h内被完全氧化.由于A.ferrooxidans在氧化Fe2+的过程中可以获得自身生命活动所需的能量, 因而在9K培养基中培养时, A.ferrooxidans会不断繁殖, 菌密度会不断增加.而因受低pH的影响, A.ferrooxidans活性或繁殖受到抑制, 表现出较低的Fe2+氧化速度.因此, 在图 1c中可以看到, 在pH 2.0~3.0时, 12~24 h时段Fe2+的平均氧化速度要高于0~12 h时Fe2+的平均氧化速度, 而pH=1.5处理则表现出Fe2+最高氧化速度的延后性.
当温度升高到38 ℃时, Fe2+的氧化速度明显变慢, 最高Fe2+平均氧化速率也只有176 mg·L-1·h-1(0~6 h), 此时起始pH=2.5, 反应72 h时只有75.69%的Fe2+被氧化, pH=3.0处理与其相当.此外, 结合图 1d和表 1可以发现, pH=2.0~3.0时Fe2+的最高平均氧化速度体现在反应初始阶段, 其不仅没有随着反应时间的延长逐渐提高, 反而表现出明显下降的趋势.说明高温不仅使得A.ferrooxidans的氧化活性受到了抑制, 而且其繁殖能力也受到了影响.尤其是pH=1.5的处理, 高温加上低pH的双重影响, A.ferrooxidans一直表现出较低Fe2+氧化速度, 反应72 h时Fe2+累积氧化率只有20.67%.
当温度为18 ℃时, Fe2+的氧化速度要慢于28 ℃, 但要快于38 ℃.pH越低, 完全氧化Fe2+所需的时间越长, 其中, 起始pH=2.5~3.0处理中的Fe2+在48 h内被完全氧化, pH=2.0处理中的Fe2+被完全氧化则需72 h, pH=1.5处理在72 h反应时间内Fe2+氧化率只有51.26%(图 1b).对照28 ℃处理可知, 因受温度的影响, A.ferrooxidans的氧化活性和繁殖能力都迅速下降, 各处理Fe2+的平均氧化速率在0~24 h内都只在52~93 mg·L-1·h-1间起伏, 最高平均氧化速度相对滞后12~24 h.
当温度只有8 ℃时, 所有处理中Fe2+的氧化速度都很慢, 反应72 h时, Fe2+最高氧化率只有34.02%, 不同处理之间差异较小, 说明相对于pH而言, 温度对A.ferrooxidans的影响作用更明显.另外, 表 1中也没有观察到Fe2+加速氧化的现象, 不同时段Fe2+平均氧化速度基本在40~90 mg·L-1·h-1之间, 说明8 ℃下不利于A.ferrooxidans的生长繁殖.
3.2 溶液温度和pH对Fe3+水解成矿的影响图 2描述的是在不同的起始pH和反应温度条件下, 各处理中总Fe沉淀率的变化趋势.其实质是在一定的pH和温度、充分的SO42-和一价阳离子(K+、NH4+)体系中, 溶液中的可溶性Fe3+通过水解形成次生铁矿物的方式从液相转移到固相(Gramp et al., 2008;柏双友等, 2010).
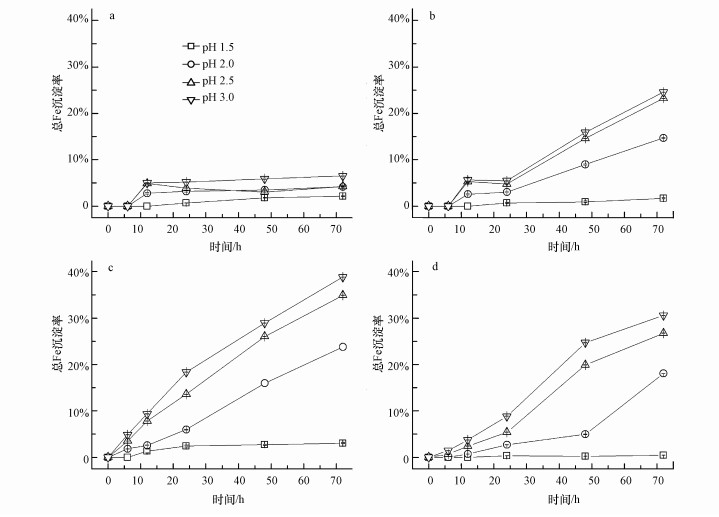 |
| 图 2 溶液起始pH和反应温度对Fe3+水解沉淀的影响(a.8 ℃;b.18 ℃;c.28 ℃;d.38 ℃) Fig. 2 Effects of pH and temperature on Fe3+ precipitation |
当反应温度为8 ℃时(图 2a), 通过观察发现, 只有pH=3.0处理中出现浑浊, 有少量沉淀生成, 计算总Fe沉淀率为6.50%;而其它处理中则液体澄清, 瓶壁干净, 没有明显的固相生成.究其原因有两个:一是低温不利于细菌氧化Fe2+(图 1a和表 1), 从而导致体系中的Fe3+浓度低, 继而不利于次生矿物的形成;另外一个就是次生矿物的形成是一个吸热反应, 所以温度低不利于Fe3+水解反应的进行(邹学功, 1998).当温度提高到18 ℃时(图 2b), 除了起始pH=1.5处理外, 其它反应体系中均有沉淀生成, 且反应24 h后总Fe沉淀率呈直线上升趋势, 结合表 1可以推测, Fe2+氧化速度的加快(24~48 h)促进体系Fe3+浓度的提高有利于次生矿物的生成.总体来说, 起始pH越高, 越有利于除去溶液中的可溶性铁.当温度提高到28 ℃时(图 2c), 除pH=1.5处理外, 所有处理中总Fe沉淀率从反应启动时就开始直线上升, 生成大量次生铁矿物, 反应72 h后, pH=2.0、2.5、3.0时总Fe沉淀率分别达到23.75%、34.92%、38.85%.当温度为38 ℃时(图 2d), 较高pH处理也能保证一定的总Fe沉淀率.通过与18 ℃条件下的结果相比较发现, 虽然温度升高不利于A.ferrooxidans对Fe2+充分氧化, 但却能够显著促进次生铁矿物的生成.说明高温促进了Fe3+的水解, 吸热效应促使次生铁矿物的形成反应平衡向右移动.
3.3 溶液温度和pH对次生铁矿物颜色和重量的影响表 2是不同处理培养72 h后收集的次生铁矿物的颜色和质量.采用土壤标准比色卡对矿物颜色进行比对, 发现矿物的颜色变化具有一定的规律性, 大致如下:在温度相同的情况下, 随着起始pH的升高, 矿物的颜色由浅入深, 由黄色向红色转变.如在18 ℃条件下, 随着溶液的起始pH从2.0升到3.0, 矿物的颜色逐渐由黄色, 经黄橙色过渡到淡红棕色.在起始pH相同的情况下, 随着反应温度的升高, 矿物的颜色由深变浅.
| 表 2 不同pH和温度处理下生成矿物的颜色和质量 Table 2 Effects of pH and temperature on the color and mass of the precipitates |
不同反应条件下, 生物成因次生矿物量具有明显差异.起始pH=1.5时, 不同温度处理均未发现有矿物生成, 起始pH越高, 收集矿物量越多.温度为8 ℃时, 只有pH=3.0处理中有0.03 g矿物生成.当温度升高到18 ℃时, 矿物的形成量明显增多, 相对于8 ℃而言, 18 ℃下在pH=2.0时就发现有矿物形成.当温度为28 ℃时, 矿物生成量明显增多, 如pH=3.0处理矿物量达到2.23 g.当温度为38 ℃时, 不同pH条件下生成矿物量虽然相对28 ℃有所减少, 但仍远多于18 ℃处理, 这与图 2总Fe沉淀率的规律较为一致.
3.4 溶液温度和pH对次生铁矿物相的影响及调控图 3为改良9K培养基中培养72 h时收集得到的次生铁矿物XRD谱.显然, 温度和起始pH对体系次生铁矿物的种类都有一定的影响.在18 ℃环境下, 起始pH=2.5和pH=3.0处理收集的次生铁矿物应为同一物质, 根据其衍射峰位置及相对强度, 分析矿物为一种无定型的施威特曼石.而起始pH=2.0时, 次生矿物开始出现微弱的黄铁矾衍射峰.柏双友等(2011)的研究结果表明, Fe3+供应速度的提高是促进次生矿物相向黄铁矾转变的主要原因, 在相同条件下, 80 mmol·L-1 Fe2+时产物为纯净的施氏矿物, 而80 mmol·L-1 Fe2++10 mmol·L-1 Fe3+时主要产物为黄铁矾.而结合图 1可以发现, pH=2.0时Fe2+氧化速度不及pH=2.5~3.0, 这也间接说明促使黄铁矾生成的因素不仅仅局限于Fe2+氧化速度, 与体系pH也密切相关.当温度上升至28 ℃时, 起始pH=3.0时收集到的矿物为单一施威特曼石, 而在pH=2.0~2.5范围内, pH降低有利于黄铁矾的生成, 且pH越低, 表征的衍射峰越强, 这与Liao等(2009a)研究结果一致.此外发现, 不同pH处理在38 ℃时获得矿物相均为无定型的施威特曼石, 结合图 1可以判断, 较低的Fe3+供应速度是导致此温度下次生矿物相为施威特曼石的主要原因.Kupka等(2007)研究表明, 在5 ℃环境下培养17 d后生成的矿物以施威特曼石为主, 并含有少量的黄钾铁矾, 而在30 ℃时则相反.因本研究培养时间只有3 d, 故在低温时并未收集到任何矿物相的次生产物, 但从温度18~28 ℃、pH=2.0~2.5时的培养结果来看, 与上述学者结论并不矛盾.Wang等(2006)报道, 温度的升高有利于施威特曼石向黄钾铁矾转变, 这在图 3中也有所体现, 但前提是温度不能过于极端, 且要保证培养体系起始pH在一定范围内.
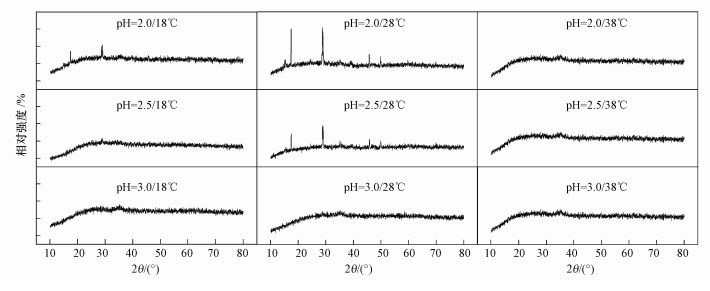 |
| 图 3 不同处理生物成因次生铁矿物的XRD图谱 Fig. 3 XRD patterns of biogenic secondary iron minerals under different treatments |
在适宜环境条件下, A.ferrooxidans氧化Fe2+成Fe3+后, 体系成矿主要反应方程式如下:
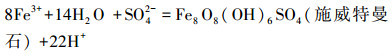
|
(4) |
当体系存在一定浓度一价阳离子时(M+=Na+、K+、NH4+), Fe3+会水解生成黄铁矾(Barham, 1997;Gramp et al., 2008):
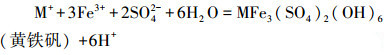
|
(5) |
理论上, 次生矿物完全按反应式(4) 或(5)单独进行时, 单位Fe3+所合成纯黄铁矾质量应为纯施威特曼石的1.5倍以上.在知晓温度和起始pH对次生铁矿物相影响的基础上, 结合表 2和图 3发现, 18~28 ℃温度下获得施威特曼石和黄钾铁矾的混合物质量均小于纯施威特曼石, 与理论结果“相悖”, 这主要受体系起始pH的影响.因为施威特曼石为典型的球形海胆结构, 且具有较高的比表面积, 易于溶质扩散和矿物溶解(Dold, 2003;Loan et al., 2005;李浙英等, 2011).刘奋武等(2013)在酸性环境下考察了施威特曼石的稳定性, 结果表明, 在15 ℃摇床中振荡72 h, pH=3.0体系中施威特曼石溶解率只有3.34%, 而当pH下调至2.0时, 相同时间内溶解率达到61.46%.这也对本研究结果进行了佐证, 且由反应式(4)和(5) 可知, Fe3+水解成矿是产酸过程, 随着反应的不断进行, 体系pH相对起始值会更低, 更易提高施威特曼石溶解程度.依此可以推断, 要使得施威特曼石大量合成和总Fe沉淀率提高, 对反应体系温度和pH的适当调控至关重要.
结合前面的试验结果, 对不同pH和温度条件下Fe2+氧化和Fe3+水解成矿的若干规律及其控制条件进行了总结:以提高溶液Fe3+浓度为目的:在涉及A.ferrooxidans工程应用中, 如烟气脱硫, 次生矿物的生成会减少反应器中作为氧化剂的Fe3+的浓度, 且其在管道、阀门等位置的沉积还会影响反应器的正常运转.所以, 若要确保溶液具有较高的Fe3+浓度且防止次生矿物形成, 则最佳控制反应条件为温度28 ℃和起始pH=1.5, 此时48 h内Fe2+的平均氧化速率为187 mg·L-1·h-1, TFe沉淀率只有2.69%.以提高施氏矿物生物合成率为目的:施氏矿物具有纳米级粒度和不规则孔道结构, 具有较大比表面积且富含羟基、硫酸根等基团, 对重(类)金属具有很强的吸附能力和共沉淀作用, 在重金属废水领域具有潜在的应用价值.研究结果表明, 若要促使Fe2+快速氧化同时大量合成施氏矿物, 最佳控制条件为28 ℃和pH=3.0, 此时24 h内Fe2+的平均氧化速率为357 mg·L-1·h-1, 72 h内TFe沉淀率高达38.85%.以提高黄铁矾生物合成率为目的:黄铁矾具有不溶解于稀酸, 易于沉淀、洗涤和过滤等优点, 是稀有昂贵的赭黄色无机颜料.因此, 若从无机颜料的角度出发, 以促进次生铁矿物向黄铁矾转换为目的, 则控制反应温度28 ℃和pH=2.0~2.5为宜.
4 结论(Conclusions)1) 温度和pH均影响Fe2+生物氧化和Fe3+水解成矿.A.ferrooxidans在28 ℃时生长最为适宜, 18 ℃次之, 而10 ℃和38 ℃则都不利于细菌生长繁殖, 导致Fe2+氧化速度明显变慢.pH=2.0~3.0对A.ferrooxidans的氧化活性没有明显影响, 而pH=1.5对其有显著的抑制作用.
2) 在适宜温度下, 体系初始pH会影响生物成因次生矿物的产量及矿物相.在改良9K培养基中, 以促进次生铁矿物向黄铁矾转换为目的, 则控制反应温度28 ℃、pH=2.0~2.5为宜.若要保证Fe2+快速氧化同时提高总Fe沉淀率和施氏矿物的大量生成, 最佳控制条件为28 ℃、pH=3.0.这对去除酸性矿山废水中可溶性Fe、SO42-及有效调控次生矿物的形成具有潜在意义.
| [${referVo.labelOrder}] | 柏双友, 梁剑茹, 王敏, 等.2011. Fe(Ⅲ)供应速率对无定型施氏矿物形成的影响[J]. 矿物学报 , 2011, 31 (2) : 256–262. |
| [${referVo.labelOrder}] | 柏双友, 梁剑茹, 周立祥.2010. FeSO4-K2SO4-H2O体系中Fe/K摩尔比对生物成因羟基硫酸铁矿物质量的影响及环境意义[J]. 环境科学学报 , 2010, 30 (8) : 1601–1607. |
| [${referVo.labelOrder}] | Bai S Y, Xu Z H, Wang M, et al. 2012. Both initial concentrations of Fe(II) and monovalent cations jointly determine the formation of biogenic iron hydroxysulfate precipitates in acidic sulfate-rich environments[J]. Materials Sciences and Engineering C , 32 (8) : 2323–2329. DOI:10.1016/j.msec.2012.07.003 |
| [${referVo.labelOrder}] | Bang S, Patel M, Lippincott L, et al. 2005. Removal of arsenic from groundwater by granular titanium dioxide adsorbent[J]. Chemosphere , 60 : 389–397. DOI:10.1016/j.chemosphere.2004.12.008 |
| [${referVo.labelOrder}] | Barham R J. 1997. Schwertmannite: A unique mineral, contains a replaceable ligand, transforms to jarosites, hematites, and/or basic iron sulfate[J]. Jorunal of Materials Research , 12 (10) : 2751–2758. DOI:10.1557/JMR.1997.0366 |
| [${referVo.labelOrder}] | Daoud J, Karamanev D. 2006. Formation of jarosite during Fe2+ oxidation by Acidithiobacillus ferrooxidans[J]. Minerals Engineering , 19 (9) : 960–967. DOI:10.1016/j.mineng.2005.10.024 |
| [${referVo.labelOrder}] | Dold B. 2003. Dissolution kinetics of schwertmannite and ferrihydrite in oxidized mine samples and their detection by differential X-ray diffraction (DXRD)[J]. Applied Geochemistry , 18 (10) : 1531–1540. DOI:10.1016/S0883-2927(03)00015-5 |
| [${referVo.labelOrder}] | Dutrizac J E. 1996. The effect of seeding on the rate of precipitation of ammonium jarosite and sodium jarosite[J]. Hydrometallurgy , 42 : 293–312. DOI:10.1016/0304-386X(95)00111-S |
| [${referVo.labelOrder}] | Elgersma F, Witkamp G J, Van Rosmalen G M. 1993. Simultaneous dissolution of zinc ferrite and precipitation of ammonium jarosite[J]. Hydrometallurgy , 34 : 23–47. DOI:10.1016/0304-386X(93)90079-S |
| [${referVo.labelOrder}] | Gómez J M, Cantero D, Webb C. 2000. Immobilisation of Thiobacillus ferrooxidans cells on nickel alloy fibre for ferrous sulphate oxidation[J]. Appl Microbiol Biotechnol , 54 : 335–340. DOI:10.1007/s002530000414 |
| [${referVo.labelOrder}] | Gramp J P, Sandy Jones F, Bigham J M, et al. 2008. Monovalent cation concentrations determine the types of Fe(III) hydroxysulfate precipitates formed in bioleach solutions[J]. Hydrometallurgy , 94 (1/4) : 29–33. |
| [${referVo.labelOrder}] | Jensen A B, Webb C. 1995. Ferrous sulphate oxidation using Thiobacillus ferrooxidans: a review[J]. Process Biochem. , 30 : 225–236. DOI:10.1016/0032-9592(95)85003-1 |
| [${referVo.labelOrder}] | Jönsson J, Persson P, Sjöberg S, et al. 2005. Schwertmannite precipitated from acid mine drainage: phase transformation, sulfate release and surface properties[J]. Applied Geochemistry , 20 : 179–191. DOI:10.1016/j.apgeochem.2004.04.008 |
| [${referVo.labelOrder}] | Karamanev D G. 1991. Model of the biofilm structure of Thiobacillus ferrooxidans[J]. Journal of Biotechnology , 20 (1) : 51–64. DOI:10.1016/0168-1656(91)90034-S |
| [${referVo.labelOrder}] | Kupka D, Karnachuk O V, Tuovinen O H, et al. 2007. Bacerial oxidation of ferrous iron at low temperatures[J]. Biotechnology and Bioengineering , 97 (6) : 1470–1478. DOI:10.1002/(ISSN)1097-0290 |
| [${referVo.labelOrder}] | Liao Y H, Zhou L X, Bai S Y, et al. 2009b. Occurrence of biogenic schwertmannite in sludge bioleaching environments and its adverse effect on solubilization of sludge-borne metals[J]. Appl Geochem , 24 (9) : 1739–1746. DOI:10.1016/j.apgeochem.2009.05.003 |
| [${referVo.labelOrder}] | Liao Y H, Zhou L X, Liang J R, et al. 2009a. Biosynthesis of schwertmannite by Acidithiobacillus ferrooxidans cell suspensions under different pH condition[J]. Mater Sci Eng C , 29 (1) : 211–215. DOI:10.1016/j.msec.2008.06.011 |
| [${referVo.labelOrder}] | 刘成.2001. 生物法处理矿山酸性废水技术的应用[J]. 有色金属(矿山部分) , 2001, 35 (4) : 39–44. |
| [${referVo.labelOrder}] | 刘奋武, 卜玉山, 田国举, 等.2013. 温度与pH对生物合成施氏矿物在酸性环境中溶解行为及对Cu2+吸附效果的影响[J]. 环境科学学报 , 2013, 33 (9) : 460–467. |
| [${referVo.labelOrder}] | Liu F W, Zhou L X, Zhou J. 2012. Improvement of sludge dewaterability by bioleaching at optimum pH with higher sludge-borne metals removal[J]. Journal of Hazardous Materials , 221-222 : 170–177. DOI:10.1016/j.jhazmat.2012.04.028 |
| [${referVo.labelOrder}] | 李浙英, 梁剑茹, 柏双友, 等.2011. 生物成因与化学成因施氏矿物的合成、表征及其对As(Ⅲ)的吸附[J]. 环境科学学报 , 2011, 31 (3) : 460–467. |
| [${referVo.labelOrder}] | Loan M, Richmond W R, Parkinson G M. 2005. On the crystal growth of nanoscale schwertmannite[J]. Journal of Crystal Growth , 275 (1/2) : 1875–1881. |
| [${referVo.labelOrder}] | Magota H, Shiratori Y.1988.Treatment of sour natural gas containing hydrogen sulfide[P].Japan. Patent No.63 205 124 |
| [${referVo.labelOrder}] | Nemati M, Harrison S T L, Ansford G S, et al. 1988. Biological oxidation of ferrous sulphate by Thiobacillus ferrooxidans: a review on the kinetic aspects[J]. Biochemical Engineering Journal , 1 (3) : 171–190. |
| [${referVo.labelOrder}] | Skousen J G, Sexstone A, Ziemkiewicz P F.2000.Acid mine drainage control and treatment//Barnhisel R, et al.(eds).Reclamation of Drastically Disturbed Lands[M].Madison, WI:American Society of Agronomy and American Society for Surface Mining and Reclamation.131-168 |
| [${referVo.labelOrder}] | 唐军, 葛蕙.1998. 矿物生物技术在煤炭脱硫中的应用[J]. 矿业科学技术 , 1998 (1) : 42–45. |
| [${referVo.labelOrder}] | Torma A E. 1983. Biotechnology applied to mining of metals[J]. Biotechnology Advances , 1 (1) : 73–80. DOI:10.1016/0734-9750(83)90302-6 |
| [${referVo.labelOrder}] | Torma A E, Bosecker K. 1982. Bacterial leaching[J]. Progress in Industrial Microbiology , 16 : 77–118. |
| [${referVo.labelOrder}] | Torma A E, Olsen T M. 1988. Kinetics of biodesulfurication of a high-sulfur coal[J]. Applied Biochemistry and Biotechnology , 18 (1) : 341–354. DOI:10.1007/BF02930838 |
| [${referVo.labelOrder}] | Tyagi R D. 1992. Microbial leaching of metals from municipal sludge: Effects of sludge solids concentration[J]. Process Biochemistry , 27 (2) : 89–96. DOI:10.1016/0032-9592(92)80015-U |
| [${referVo.labelOrder}] | Tyagi R D, Meunier N, Blais J F. 1996. Simultaneous sewage sludge digestion and metal leaching-effect of temperature[J]. Applied Microbiology and Biotechnology , 46 (4) : 422–431. |
| [${referVo.labelOrder}] | Wang H, Bigham J M, Tuovinen O H. 2006. Formation of schwertmannite and its transformation to jarosite in the presence of acidophilic iron-oxidizing microorganisms[J]. Master Science Engineering Part C Biomimetics Supramolecular Systems , 26 (4) : 588–595. DOI:10.1016/j.msec.2005.04.009 |
| [${referVo.labelOrder}] | Waychunas G A, Kim C S, Banfield J F. 2005. Nanoparticulate iron oxide minerals in soils and sediments: unique properties and contaminant scanvenging mechanisms[J]. Journa of Nanoparticle Research , 7 : 409–433. DOI:10.1007/s11051-005-6931-x |
| [${referVo.labelOrder}] | Xiong H X, Liao Y H, Zhou L X. 2008. Influence of chloride and sulfate on formation of akaganéte and schwertmannite through ferrous biooxidation by Acidithiobacillus ferrooxidans cells[J]. Environ Sci Technol , 42 (23) : 8681–8686. DOI:10.1021/es801646j |
| [${referVo.labelOrder}] | 赵跃民.1998. 我国选煤技术的现状与发展趋势[J]. 国外金属矿选矿 , 1998 (6) : 46–48. |
| [${referVo.labelOrder}] | 周立祥.2008. 酸性矿山废水中生物成因次生铁矿物的形成及环境工程意义[J]. 地学前缘 , 2008, 15 (6) : 74–82. |
| [${referVo.labelOrder}] | Zhou L X, Fang D, Wang S M, et al. 2005. Bioleaching of Cr from tannery sludge: the effects of initial acid addition and recycling of acidified bioleached sludge[J]. Environmental Technology , 26 (3) : 277–284. DOI:10.1080/09593332608618558 |
| [${referVo.labelOrder}] | 周顺桂, 周立祥.2006. 污泥生物淋滤过程中黄铁矾对重金属离子的吸附与共沉淀作用的模拟研究[J]. 光谱学与光谱分析 , 2006, 26 (5) : 966–970. |
| [${referVo.labelOrder}] | 周顺桂, 周立祥, 黄焕忠.2004. 黄钾铁矾的生物合成与鉴定[J]. 光谱学与光谱分析 , 2004, 24 (9) : 1140–1143. |
| [${referVo.labelOrder}] | 邹学功.1998. 黄钾铁矾除铁理论分析[J]. 冶金丛刊 , 1998 (6) : 15, 18–20. |
 2016, Vol. 36
2016, Vol. 36


