2. 浙江工商大学环境科学与工程学院,杭州 310018
2. School of Environmental Science and Engineering,Zhejiang Gongshang University,Hangzhou 310018
TCP是有机废水中一种最常见的氯酚类物质,主要来源于造纸、印染、纺织等行业废水(Mikesell and Boyd,1986;Nicholsonet al.,1992). 由于TCP的水溶解性较大,且土壤等固体物质对其吸附和固定作用较弱,常以水为载体广泛存在(金相灿,1990;Favaet al.,1995;张兵等,2001). TCP结构较为稳定,难以降解,且具有三致性(刘艳霞等,2012),美国环保总局已将其列为了“优先污染物”. 利用真菌、青霉菌、曲霉菌和酵母菌等生物法处理酚类废水,工艺简单,效果好. Lentinula对橄榄油排放废水中酚类(苯酚等)有毒物质具有较好的去除效果(D'Annibaleet al.,2004). 曲霉菌可以p-甲酚和4-甲基苯酚作为唯一碳源,但对氯酚类效果不大(Joneset al.,1994).Kiyohara等发现酿造酵母、鞘脂菌可降解TCP(Kiyohara et al,1992;Tiirolaet al.,2002;Aranda et al.,2003). Aguayo等发现钩虫贪铜菌、鞘氨醇单胞菌、光合细菌等也能降解TCP(Aranda et al.,2009; 姚斌等,2011;Aranda et al.,2015). 这些研究为酚类物质的生物处理打下了一定基础,但国内外大多数研究主要局限于细菌对TCP降解. 相比细菌,真菌具有较强的抗毒性和环境适应能力,在处理氯酚废水方面较细菌更具优势. 镰刀菌为一种真菌,广泛存在于自然环境中,适应性强. 镰刀菌具有良好的降解苯酚、4-CP的能力(Cai et al,2007;朱凌和李济吾,2009;李济吾和蔡伟建,2011;Liet al.,2011;潘俊雅和李济吾,2013),但对毒性更强TCP的降解情况还未知. 本文研究了镰刀菌降解TCP的降解影响因素及其效果,并探讨了其降解动力学与降解机制.
2 材料与方法(Materials and methods) 2.1 菌种与培养基菌种:从膨润土中分离得到的一种镰刀菌,确定为层出镰刀菌Fusarium proliferatum,属于镰刀菌属(李济吾和李峰,2005). 培养温度30 ℃.
固体培养基:KH2PO4 1.0 g,MgSO4·7H2O 0.5 g,蛋白胨5 g,葡萄糖10 g,琼脂15~20 g,蒸馏水500 mL. 灭菌后加入相应浓度的TCP摇匀,在无菌操作台上倒平板,待平板冷却凝固后进行接种,最后于30 ℃恒温生化培养箱中倒置培养.
液体培养基:CaCl2 0.1 g,KH2PO4 0.5 g,NaCl 0.2 g,H2O 1000 mL,微量元素(FeSO4·7H2O 3.82 g,CoCl2·6H2O 0.25 g,H3BO3 6 mg,CuSO4·5H2O 2.9 mg等)1 mL. 所有培养基均在121 ℃下灭菌30 min.
孢子悬浊液:在驯化好且长有丰富的白色分生孢子的蛋白胨琼脂培养基中刮取部分孢子置于无机盐固体培养基(含100 mg·L-1 TCP)上,30 ℃恒温培养. 7 d后转接于150 mg·L-1 TCP的无机盐固体培养基驯化3次,待菌体大量长出后于无菌条件下刮取孢子至无菌蒸馏水中,振荡分散成乳白色的孢子悬液,光密度约为0.1(OD400),孢子个数为3.1×106 个·mL-1.
2.2 试剂与仪器试剂:氨水,乙醇(纯度>90%),浓盐酸,稀盐酸,三氯酚(TCP)(化学纯),4-氨基安替比林,铁氰化钾,NaCl,缓冲溶液.
主要仪器:Agilent1200系列液相色谱仪(安捷抡),电子天平(METTLER TOLEDO);UV2450PC紫外可见分光光度计(岛津);DHG-9140A电热恒温鼓风干燥箱(上海荣丰);LRH-250Ⅱ微电脑控制生化培养箱(广东医疗);THZ-C恒温振荡器(培英);SW-CJ-1F单人水平垂直两用净化工作台(苏州净化);MLS-3750高压蒸汽灭菌器(三洋);CF-RXⅡ高速冷冻离心机(日立).
2.3 TCP的降解条件取0.05 g过滤出的菌体(湿重)的菌体孢子悬浊液(600 nm处吸光度为0.16~0.165),加入50 mL液体培养基浓度一定的TCP溶液中,在一定温度、pH、150 r·min-1下继续培养,每间隔24 h测定TCP浓度,分别研究温度、pH、外加碳源、氮源、氯离子及TCP初始浓度对其降解效率的影响. 温度影响实验条件为pH 7.0,TCP初始浓度为30 mg·L-1,温度25 ℃、30 ℃和35 ℃. pH影响实验条件为30 ℃,TCP初始浓度为30 mg·L-1,pH为2.0~8.0. 外加碳源影响实验条件为30 ℃、pH 7.0,TCP初始浓度为30 mg·L-1,葡萄糖(1 g·L-1、3 g·L-1、5 g·L-1). 氮源影响实验条件为30 ℃、pH 7.0,TCP初始浓度为30 mg·L-1,氮源物质为NH4Cl、NaNO2、蛋白胨、NH4NO3和NaNO3(浓度均为0.2 g·L-1). 氯离子影响实验条件为30 ℃、pH 7.0,TCP初始浓度为30 mg·L-1,NaCl浓度为0~0.6 g·L-1. TCP浓度影响实验条件为30 ℃、pH 7.0,TCP初始浓度为10~50 mg·L-1. 平行试验3次,取其平均值.
2.4 动力学分析根据微生物对底物降解速率与底物浓度的关系,可将这种反应分为不同的级数方程. 当底物降解速率不受反应物浓度影响时,为零级方程. 在温度不变的情况下,零级方程的降解速率是常数. 本文拟用零级降解动力学方程对实验数据进行拟合.
2.5 降解产物分析取不同的降解时间的5 mL培养液于5000 r·min-1,4 ℃离心10 min后,取上清液作为测定样,以酸化样为空白对照,碱化样做测定样,于190~600 nm范围内进行紫外扫描,以分析上清液溶质组分差异.
取不同的降解时间的10 mL培养液于10000 r·min-1,4 ℃离心10 min,过滤上层清液. 再用等体积的乙酸乙酯萃取其中的有机物质,氮吹浓缩至1 mL,直接进GC-MS分析,氦气流速为0.8 mL·min-1. 柱温为50 ℃,保留5 min,再以20 ℃·min-1程序升温至280 ℃,保留10 min. 进样口和检测器温度分别为250 ℃和300 ℃.
2.6 分析方法采用高效液相色谱法(HPLC)对TCP浓度进行测定. 分析仪器为Agilent1200液相色谱仪,色谱柱为Diamonsil C18(2)150 mm×4.6 mm×5 μm,20 μL进样器,流动相为1%冰乙酸水溶液:1%冰乙酸乙腈溶液=7∶3(体积比),流速为1 mL·min-1,检测波长为280 nm. TCP降解率的计算:
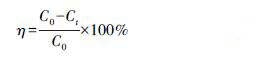
|
(1) |
式中,C0、Ct分别为降解初始、时间t时TCP的浓度(mg·L-1).
3 结果与讨论(Results and discussion) 3.1 温度对TCP降解的影响图 1是不同温度条件下镰刀菌对TCP的降解效果. 由图 1可知,在25~35 ℃条件下,镰刀菌均能以TCP为唯一碳源和能源物质进行生长. 在30 ℃时,TCP完全降解仅需3 d;而25 ℃和35 ℃时,TCP完全降解则需4 d. 这与镰刀菌体内TCP相关降解酶活性有关,可能是30 ℃时TCP降解酶活性最强所致.
 |
| 图 1 温度对TCP 降解的影响 Fig. 1 Effect of temperature on TCP degradation |
图 2为不同pH条件下镰刀菌对TCP的降解影响. 由图 2可知:pH=7时镰刀菌对TCP的降解速率最快,3 d降解完成;而pH=6时镰刀菌对TCP的降解速率稍慢,但TCP完全降解也只需3 d. 当pH=8时镰刀菌对TCP降解受到了一定的抑制,4 d时TCP降解率为97%. 此外,当pH=2或pH=4时,镰刀菌对TCP几乎没有降解能力. 因此,可认为镰刀菌在中性或者弱酸弱碱环境中利用TCP进行生长,最适pH=6~7.
 |
| 图 2 pH 对TCP 降解的影响 Fig. 2 Effect of pH on TCP degradation |
图 3是添加不同浓度的外加碳源葡萄糖镰刀菌对TCP降解影响. 由图 3可知,镰刀菌可利用TCP为唯一碳源和能源物质进行生长繁殖,30 mg·L-1的TCP只需3 d即可完全降解,但观察到镰刀菌的生长受到了严重的抑制. 这是由于葡萄糖与TCP为共基质时,镰刀菌首先利用葡萄糖,在代谢产生了一些酸性中间产物(实测pH由6降到了2.3),使培养液呈强酸环境,抑制了镰刀菌的生长,这与刘艳霞等研究结果一致(刘艳霞等,2012).
 |
| 图 3 外加碳源葡萄糖对TCP 降解的影响 Fig. 3 Effect of glucose on TCP degradation |
图 4为不同氮源对镰刀菌降解TCP的影响. 由图 4可知,氮源为蛋白胨时,TCP降解速率最快,完全降解仅需3 d;氮源为NaNO3时,TCP的降解速率次之,但TCP完全降解也仅需3 d. 当氮源物质为NaNO2时,镰刀菌对TCP的降解受到了明显的抑制,此时镰刀菌菌体不能生长. 因此,考虑到实用经济性,镰刀菌降解TCP最适氮源为NaNO3.
 |
| 图 4 氮源对TCP 降解的影响 Fig. 4 Effect of nitrogen source on TCP degradation |
图 5为氯离子浓度对TCP降解的影响. 由图 5可知,低浓度Cl-(0.2 g·L-1)对镰刀菌降解TCP具有一定的促进作用,但随着Cl-浓度的增加,TCP的降解受到了抑制,且Cl-浓度越高,其抑制作用越强. 这说明Cl-是镰刀菌生长所必须的,但Cl-浓度过高时则会对TCP脱氯过程产生抑制,从而减缓了镰刀菌对TCP的降解速率. 这与Kargi等研究结果相一致,认为多氯酚物质在微生物体内的代谢主要是一个脱氯的过程,氯离子的存在会对镰刀菌降解TCP的脱氯过程产生影响(Kargi and Eker,2004,2005;Jesús et al.,2009).
 |
| 图 5 氯离子浓度对TCP 降解的影响 Fig. 5 Effect of Cl- concentration on TCP degradation |
浓度对镰刀菌降解TCP的影响如图 6所示,当TCP浓度在10~50 mg·L-1范围内时,镰刀菌均可将其完全降解. 镰刀菌对TCP的降解速率则随着TCP浓度的增加而逐渐减缓. 当TCP浓度为10 mg·L-1时,镰刀菌对其完全降解最快只需2 d即可完成;但当TCP浓度提高到50 mg·L-1时,镰刀菌对其完全降解则需4.5 d才能完成.
 |
| 图 6 镰刀菌对TCP 的降解零级动力学拟合曲线 Fig. 6 TCP degradation reaction with zero?order kinetics |
图 6为不同浓度条件下镰刀菌降解TCP的动力学拟合曲线. 由图 6可知,在不同浓度条件下,TCP浓度均随着降解时间的增加而不断降低,浓度与降解时间呈较好的线性关系,R2维持在0.87~0.95范围内(表 1),说明镰刀菌对TCP的降解符合零级降解动力学方程.
| 表 1 镰刀菌对TCP 的降解零级动力学参数 Table 1 TCP degradation with zero-order kinetics parameters |
图 7是镰刀菌以TCP为唯一碳源和能源物质时的降解产物紫外扫描图. 在图 7中,TCP的特征吸收波长为325 nm,随着时间推移,其特征峰逐渐消失. 当降解4 d时,其特征峰则完全消失,没有新的峰产生,这说明TCP已被完全降解.
 |
| 图 7 镰刀菌降解TCP 的产物紫外扫描曲线 Fig. 7 UV scanning of TCP degradation solution |
图 8为镰刀菌对TCP降解2 d的气相色谱图,图 9为TCP降解产物的质量色谱图. 由图 8与图 9知,TCP的保留时间为12.521 min,特征离子m/z为196. 此外,在10.355 min时也出现了一个较为明显的峰(图 8),特征离子m/z为162,经NIST检索为2,6-二氯苯酚,根据相关资料可推断其可能为TCP降解中间产物(Spain et al.,1989;全向春等,2003).
 |
| 图 8 镰刀菌降解TCP 中间产物的GC 图谱 Fig. 8 Gas chromatograms of the TCP and its degradation products |
 |
| 图 9 TCP 降解产物的质量色谱图 Fig. 9 Mass spectrum of the metabolite isolated from TCP cultures |
文献(Li et al.,l1991)认为,Azotobacter sp.等对TCP代谢降解途径主要是偏苯三酚途径,是在2,4,6-TCP-4-单加氧酶(同时存在FADH2和NADH)的作用下依次将对位和邻位上的氯原子脱去并氧化,形成2,6-二氯对苯二酚,再进一步代谢为6-氯偏苯三酚,进一步脱氯后形成偏苯三酚,然后在偏苯三酚1,2-双加氧酶的作用下邻位开环形成马来酰乙酸,最后进入三羧酸循环进行完全矿化. 在厌氧条件下微生物对TCP的降解途径是通过直接邻位/对位脱氯生成2,4-二氯苯酚/2,6-二氯苯酚,再分别通过邻位或对位脱氯生成苯酚,最后被矿化(Kennes et al.,l1996; Nicholson et al.,l1992 ).根据实验结果,可推测得出镰刀菌对TCP的降解途径如图 10所示. 它是通过2,6-二氯苯酚途径进行降解的,这是一个直接脱氯的过程. TCP首先经过对位脱氯形成2,6-二氯苯酚,2,6-二氯苯酚再通过邻位脱氯形成2-氯苯酚,最后2-氯苯酚邻位脱氯形成苯酚,随后进入三羧酸循环,完全矿化.
 |
| 图 10 镰刀菌对TCP 的降解途径 Fig. 10 Degradation pathway of TCP by Fusarium sp |
1) 镰刀菌降解TCP的最适条件为:氮源NaNO3(0.2 g·L-1),30 ℃,pH=6~7. 外加碳源葡萄糖对降解TCP具有明显的抑制作用. 氯离子浓度低于0.2 g·L-1时对镰刀菌降解TCP具有一定的促进作用,但随着氯离子浓度的增加,TCP的降解受到了抑制. 镰刀菌对TCP降解速率随着其浓度的升高而减缓.
2) 镰刀菌能降解10~50 mg·L-1的TCP,对其降解反应符合零级降解动力学方程.
3) 当以TCP为唯一碳源和能源物质时,TCP特征峰均随着降解时间的延长而逐渐消失,且无新峰产生. 镰刀菌降解TCP过程中可检测到2,6-二氯苯酚(RT 12.521 min)的存在,可认为是通过2,6-二氯苯酚途径进行反应降解.
| [1] | Aguayo J, Barra R, Becerra J, et al. 2009. Degradation of 2,4,6-tribromophenol and 2,4,6-trichlorophenol by aerobic heterotrophic bacteria present in psychrophilic lakes[J]. World Journal of Microbiology and Biotechnology , 25 (4) : 553–560. DOI:10.1007/s11274-008-9923-z |
| [2] | Aranda C, Godoy F, Becerra J, et al. 2003. Aerobic secondary utilization of a non-growth and inhibitory substrate 2,4,6-trichlorophenol by Sphingopyxis chilensis S37 and Sphingopyxis-like strain S32[J]. Biodegradation , 14 (4) : 265–274. DOI:10.1023/A:1024752605059 |
| [3] | Cai W J, Li J W, Zhang Z. 2007. The characteristics and mechanisms of phenol biodegradation by Fusarium sp[J]. [J]. Journal of Hazardous Materials , 148 (1/2) : 38–42. |
| [4] | D'Annibale A, Casa R, Pieruccetti F, et al. 2004. Lentinula edodes removes phenols from olive-mill wastewater: impact on durum wheat(Triticum durum Desf[J]. )Chemosphere , 54 (7) : 887–894. DOI:10.1016/j.chemosphere.2003.10.010 |
| [5] | Fava F, Armenante P M, Kafkewitz D. 1995. Aerobic degradation and dechlorination of 2-chlorophenol,3-chlorophenol,and 4-chlorophenol by a Pseudomonas pickettii strain[J]. Letters in Applied Microbiology , 21 (5) : 307–312. DOI:10.1111/j.1472-765X.1995.tb01066.x |
| [6] | Jesús A G D, Romano-Baez F J, Leyva-Amezcua L, et al. 2009. Biodegradation of 2,4,6-trichlorophenol in a packed-bed biofilm reactor equipped with an internal net draft tube riser for aeration and liquid circulation[J]. Journal of Hazardous Materials , 161 (2/3) : 1140–1149. |
| [7] | 金相灿. 1990. 有机化合物污染化学-有毒有机物污染化学[M]. 北京: 清华大学出版社 . |
| [8] | Jones K H, Trudgill P W, Hopper D J. 1994. 4-Ethylphenol metabolism by Aspergillus fumigatus[J]. Applied and Environmental Microbiology , 60 (6) : 1978–1983. |
| [9] | Kargi F, Eker S. 2004. Toxicity and batch biodegradation kinetics of 2,4 dichlorophenol by pure Pseudomonas putida culture[J]. Enzyme and Microbial Technology , 35 (5) : 424–428. DOI:10.1016/j.enzmictec.2004.06.004 |
| [10] | Kargi F, Eker S. 2005. Kinetics of 2,4-dichlorophenol degradation by Pseudomonas putida CP1 in batch culture[J]. International Biodeterioration & Biodegradation , 55 (1) : 25–28. |
| [11] | Kennes C, Wu W M, Bhatnagar L, et al. 1996. Anaerobic dechlorination and mineralization of pentachlorophenol and 2,4,6-trichlorophenol by methanogenic pentachlorophenol degrading granules[J]. Applied Microbiology and Biotechnology , 44 (6) : 801–806. DOI:10.1007/BF00178622 |
| [12] | Kiyohara H, Hatta T, Ogawa Y, et al. 1992. Isolation of Pseudomonas pickettii strains that degrade 2,4,6-trichlorophenol and their dechlorination of chlorophenols[J]. Applied and Environmental Microbiology , 58 (4) : 1276–1283. |
| [13] | Li D Y, Eberspächer J, Wagner B, et al. 1991. Degradation of 2,4,6-Trichlorophenol by Azotobacter sp[J]. Strain GP1[J]. Applied and Environmental Microbiology , 57 (7) : 1920–1928. |
| [14] | 李济吾, 李峰.2005. 降解酸性蓝B的镰刀菌(Fusarium sp[J]. )HJ01的分离和降解特性研究[J]. 环境科学学报 , 2005, 25 (12) : 1641–1646. |
| [15] | 李济吾, 蔡伟建.2011. CMC-膨润土交联固定镰刀菌反应器对对氯苯酚废水的降解特性[J]. 环境科学学报 , 2011, 31 (6) : 1248–1253. |
| [16] | Li J W, Cai W J, Zhu L. 2011. The characteristics and enzyme activities of 4-chlorophenol biodegradation by Fusarium sp[J]. [J]. Bioresource Technology , 102 (3) : 2985–2989. DOI:10.1016/j.biortech.2010.10.006 |
| [17] | Liu H Y, Guo S S, Jiao K, et al. 2015. Bioremediation of soils co-contaminated with heavy metals and 2,4,5-trichlorophenol by fruiting body of Clitocybe maxima[J]. Journal of Hazardous Materials , 294 : 121–127. DOI:10.1016/j.jhazmat.2015.04.004 |
| [18] | 刘艳霞, 魏刚, 陈晓华.2012. 一株降酚菌的分离鉴定及降解性能研究[J]. 北京化工大学学报(自然科学版) , 2012, 39 (2) : 58–62. |
| [19] | Mikesell M D, Boyd S A. 1986. Complete reductive dechlorination and mineralization of pentachlorophenol by anaerobic microorganisms[J]. Applied and Environmental Microbiology , 52 (4) : 861–865. |
| [20] | Nicholson D K, Woods S L, Istok J D, et al. 1992. Reductive dechlorination of chlorophenols by a pentachlorophenol-acclimated methanogenic consortium[J]. Applied and Environmental Microbiology , 58 (7) : 2280–2286. |
| [21] | 潘俊雅, 李济吾.2013. Cd2+共存时镰刀菌(Fusarium sp[J]. HJ01)降解对氯苯酚的特性与机制[J]. 环境科学学报 , 2013, 33 (8) : 2243–2247. |
| [22] | 全向春, 施汉昌, 王建龙, 等.2003. 4-氯酚存在对生物强化系统降解2,4-二氯酚的影响研究[J]. 环境科学学报 , 2003, 23 (1) : 69–73. |
| [23] | Spain J C, Zylstra G J, Blake C K, et al. 1989. Monohydroxylation of phenol and 2,5-dichlorophenol by toluene dioxygenase in Pseudomonas putida Fl[J]. Applied and Environmental Microbiology , 55 (10) : 2648–2652. |
| [24] | Tiirola M A, Männistö M K, Puhakka J A, et al. 2002. Isolation and characterization of Novosphingobium sp[J]. strain MT1,a dominant polychlorophenol-degrading strain in a groundwater bioremediation system[J]. Applied and Environmental Microbiology , 68 (1) : 173–180. |
| [25] | 姚斌, 金赞芳, 胡忠策, 等.2011. 光合细菌对2,4,6-三氯苯酚的降解特性研究[J]. 中国环境科学 , 2011, 31 (10) : 1669–1675. |
| [26] | 张兵, 郑明辉, 刘芃岩, 等.2001. 五氯酚在洞庭湖环境介质中的分布[J]. 中国环境科学 , 2001, 21 (2) : 165–167. |
| [27] | 朱凌, 李济吾.2009. 镰刀菌HJ01对对氯苯酚的降解特性[J]. 化工环保 , 2009, 29 (5) : 402–405. |
 2016, Vol. 36
2016, Vol. 36


