近年来, 药品和个人护理用品(PPCPs)的大量使用以及在污水厂中不完全降解, 使得其在环境中频繁被检出(Boreen et al., 2003).甲芬那酸(MEF)是一种常见的邻氨基苯甲酸类非甾体抗炎药, 其能通过抑制体内前列腺素E1的合成和释放而达到抗炎作用.临床上具有解热镇痛作用(Moll et al., 2011; 吴寅等, 2006).MEF在地表水中常被检测出来, 其环境浓度可达0.44μg·L-1, 而预测的无效应浓度则为0.428μg·L-1(Tauxe-Wuersch et al., 2005).很多学者研究证实, 传统污水处理厂不能有效的去除MEF(Hilton et al., 2003; Soulet et al., 2002), 且长期摄入痕量水平的MEF会使人感到不适, 如胃部疼痛、腹泻、皮疹等毒性效应(Suwalsky et al., 2011).因此, MEF在水体中的残留及环境行为应该给予更多的关注.
硝酸根(NO3-)广泛存在于水环境中, 浓度可达0.01~1.0 mmol·L-1(季跃飞等, 2012), 在自然界氮循环中起到重要的作用.硝酸根具有光化学活性, 受光照射后可光解生成氮氧自由基(·NO2)和羟基自由基(·OH)等活性中间体.·OH具有很高的氧化活性, 可以和大多数有机物快速反应, 对有机污染物的迁移转化产生重要影响(Brezonik et al., 1998).除了硝酸根, 天然水体中还普遍存在着其他可以影响有机污染物光化学行为的物质, 如腐殖酸和碳酸盐等, 这些物质可以对硝酸根的光敏化过程起到促进或抑制作用, 对目标污染物在硝酸根作用下的光降解反应产生影响.
前人对于MEF在水环境中的光化学行为已进行了相应的研究.Werner等(2005)在模拟太阳光照下MEF的光解行为时表明, MEF的量子产率为(1.5±0.3)×10-4, 比大部分PPCPs的光量子产率低, 研究证实MEF在水中很难光降解.Chen等(2015)研究紫外光照下MEF在纯水和亚硝酸根溶液中的降解机制表明, 降解过程中有6个明显的产物, 产物为羟基化、酮化和亚硝化产物, 证明光解过程中有活性自由基的参与.在水环境中, MEF常暴露在硝酸根溶液中, 已有相关文献对MEF在污水处理厂和天然水体中的残留量以及其在环境中的生态风险进行报道, 然而, 对于MEF在硝酸根溶液中可能发生的光化学转化机制还缺乏必要的研究, 特别是分析反应过程中无机氮之间转换以及反应过程中中间产物的毒性变化情况.
因此, 本实验对MEF在硝酸根存在下的光解行为进行了研究, 讨论了不同硝酸根浓度、pH、碳酸盐浓度、氯离子浓度、三价铁离子浓度的影响, 并对硝酸根光敏化MEF降解过程中的无机氮转换机制的研究以及中间产物的毒性变化进行评价.
2 材料与方法(Materials and methods) 2.1 试剂MEF, 纯度>98.0%, TCI试剂公司;腐殖酸(fulvic acid)≥90%, Aladdin;乙腈, 色谱纯, 美国ACS恩科化学;碳酸氢钠、甲酸、氢氧化钠、硫酸、硝酸钠、硫酸铁、氯化钠均为分析纯, 成都科试.
2.2 实验方法 2.1.1 MEF在硝酸根溶液中的光解将0.1 g MEF溶于200 mL乙腈中, 配制浓度为0.5 g·L-1的MEF母液.准确移取1 mL MEF母液于250 mL容量瓶中, 用高纯氮吹干乙腈.添加含不同剂量的硝酸根溶液, 用超纯水定溶(Smart2 Pure超纯水/纯水一体化系统, 德国TKA), 使容量瓶中MEF的浓度为2 mg·L-1, 硝酸根浓度分别为0、0.1、0.5、1.0 mmol·L-1, 并用1%NaOH和H2SO4调将溶液pH至7.0, 摇匀后, 移取25 mL溶液至50 mL石英管中, 置于XPA-7旋转光化学反应器内(图 1, 南京胥江机电厂)进行搅拌, 控制反应器温度为(25±1)℃, 用500W汞灯照射(UV254, 南京胥江机电厂), 每隔10 min取样1次, 每个时间点的样品至少设3个重复, 取平均值.用HPLC(LC-20AT, SHIMADZU)测定MEF浓度, 色谱条件:流动相是乙腈-0.1%甲酸水(50∶50, 体积比);色谱柱(VP-ODS, SHIMADZU);检测器为光电二极管阵列检测器(SPD-M20A), 检测波长为219 nm, 流速为1 mL·min-1, 进样量10μL, 柱温30℃.MEF等的紫外-可见光谱图采用紫外分光光度计(UV-2100, Beijing Rayleigh)进行全图扫描.采用离子色谱仪(Metrohm AG-822)测定实验过程中NO2-的产生量.
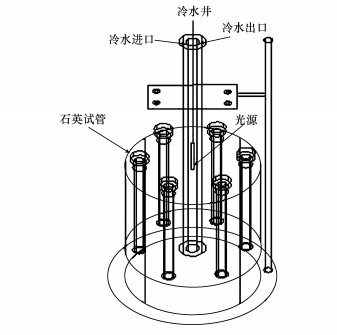 |
| 图 1 旋转光化学反应器 Fig. 1 Scheme for rotating photochemical reactor |
向2 mg·L-1MEF与1 mmol·L-1NO3-的混合溶液中分别加入不同浓度的碳酸氢钠;使用1%NaOH和H2SO4将3份含有2 mg·L-1MEF、1 mmol·L-1NO3-和1 mmol·L-1碳酸氢钠混合溶液的pH调节为7.0, 然后进行光解实验, 一定时间后采样, HPLC测定MEF浓度.
2.1.3 氯离子对硝酸根敏化光降解MEF的影响向2 mg·L-1MEF与1 mmol·L-1NO3-的混合溶液中分别加入不同浓度的氯离子, 使体系中氯离子浓度分别为0、0.01、0.1、1 mmol·L-1, 并用1%NaOH和H2SO4将溶液调节至7.0, 然后进行光解实验, 一定时间后采样, HPLC测定MEF浓度.
2.1.4 三价铁离子对硝酸根敏化光降解MEF的影响向2 mg·L-1MEF与1mmol·L-1NO3-的混合溶液中分别加入不同浓度的三价铁离子, 使体系中三价铁离子浓度分别为0、0.001、0.005、0.01 mmol·L-1, 并用1%NaOH和H2SO4将溶液调节至7.0后进行光解实验, 一定时间后采样, HPLC测定MEF浓度.
2.1.5 MEF光解产物的鉴定将2 mg·L-1MEF和1 mmol·L-1NO3-的混合溶液光解1.5 h, 于旋转蒸发仪(RE-5299, YU HUA INSTRUMENT)中进行浓缩.待溶液浓缩至2ml, 转移至送检样瓶中, 进行UPLC/MS/MS测定.仪器:超高效液相联用飞行时间串联四级杆质谱仪(AQUITY/UPLC/Q-TOFmicro, Waters).色谱柱:AQUITY UPLC BEH C18 1.7μm 2.1×50 mm(Waters);进样量10μL;流动相:乙腈-0.1%甲酸水(55∶45, 体积比)质谱参数:负离子模式(ESI-); 毛细管电压(capillary cone):3500v;锥孔电压(sample cone):30 V, 源温(source Temperature):100℃, 反吹气温度(Desolvation Teperature):350℃.扫描范围:100~800 m/z.质谱校正:Lockmass实时校正, 校正液为脑腓肽溶液(10μg·mL-1), 负离子模式扫描为m/z 554.2615, 多点校正溶液为甲酸钠溶液(10μg·mL-1).
2.1.6 发光菌毒性实验根据国家标准方法GB/T 15441—1995, 采用生物毒性测试仪(DXY-2型, 中国科学院南京土壤研究所)以明亮发光杆菌T3小种冻干粉作为指示生物, 测试MEF水溶液在光解过程中的毒性变化.对于每个时间点上的MEF光解样品, 采用生物毒性测试仪测定其发光度, 通过其对发光菌发光的抑制率来表示其毒性的大小.每个样品都做3次平行测试, 同时, 也设置空白样品进行对照.由下式计算发光菌发光强度的相对抑制率I(%).
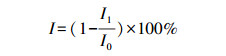
|
式中, I1为样品发光度, I0为对照发光度.
3 结果与讨论(Results and discussion) 3.1 硝酸根对MEF光解的敏化作用在环境浓度范围内, 本节研究了添加不同浓度NO3-时, MEF的降解情况.如图 2所示, 暗反应中MEF没发生水解反应.NO3-的存在会促进MEF的光解, 且光解较好地符合一级反应动力学.NO3-浓度从0.1 mmol·L-1增至1 mmol·L-1, MEF光解速率从0.00806 min-1增至0.0232 min-1(图 2).有研究表明, 硝酸根通常能通过接受光量子, 产生激发态硝酸根, 进而和水反应生成氧化性极强的羟基自由基, 参与氧化有机污染物(式(1)~(3))(Gertraud Mark et al., 1996).

|
(1) |
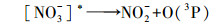
|
(2) |
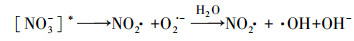
|
(3) |
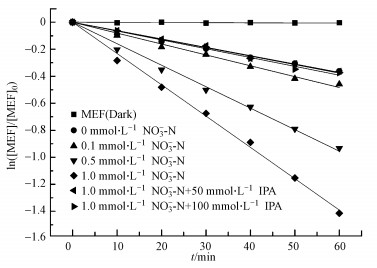 |
| 图 2 不同NO3-浓度对MEF光降解的影响 Fig. 2 Effect of NO3- concentration on the MEF photodegradation under ultraviolet light |
为了证实硝酸根敏化MEF光照下产生羟基自由基, 本研究中通过加入50、100 mmol·L-1异丙醇作为分子探针来检测羟基自由基(Buxton et al., 1988).结果如图 2所示, 异丙醇会抑制甲芬那酸的光降解, 50、100 mmol·L-1异丙醇的加入使得MEF光解速率常数分别从0.0233 min-1降至0.0062 min-1、0.0059 min-1.这主要是由于异丙醇对体系所产生的羟基自由基进行猝灭的结果.
NO3-光解产生羟基自由基来氧化有机污染物还存在一个值得关注之处, 即由NO3-光解产生的NO2-在水中积累的潜在影响(Charles et al., 2001).为了进一步探究NO3-敏化甲芬那酸光降解的机制, 本研究对体系中产生的NO2-进行测定.结果如图 3所示, 体系中亚硝酸根的浓度随着反应的进行而不断增大;其产生量也与硝酸根的初始浓度有关, 随着硝酸根初始浓度的增大, 亚硝酸根浓度也相应的增大.一方面, 硝酸根接受光子后产生激发态硝酸根, 不稳定的激发态硝酸根进而分解产生亚硝酸根和基态原子氧(O3P);另一方面, 体系中的激发态硝酸根能与水反应生成·OH和NO2·, 而NO2·会进一步聚合生成N2O4, 并歧化生成亚硝酸根(Boule et al., 1999).由于羟基自由基能量高于基态原子氧(O3P), 体系以羟基自由基的反应为主, 导致体系中NO2·量增加, 进而迅速二聚产生N2O4.所以溶液中的亚硝酸根主要来源于N2O4的歧化.体系中NO3-、NO2-和MEF三者的关系如图 4所示.
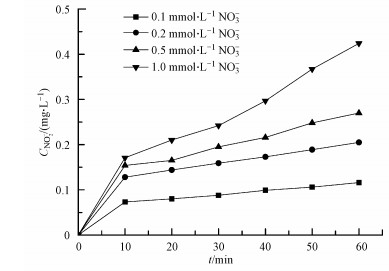 |
| 图 3 光解体系中亚硝酸根浓度变化图 Fig. 3 The variation of NO2- concentration on the MEF photodegradation under ultraviolet light |
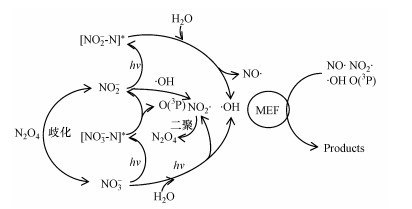 |
| 图 4 光解体系中NO3-、NO2-和MEF三者的关系流程图 Fig. 4 Relationship of NO3-、NO2- and MEF on the photolysis process |
对于大多数有机污染物, pH能够通过改变这些物质在水体中的形态(酸性或碱性), 从而影响其光化学行为(Hapeshi et al., 2010).表 1所示引出了相同NO3-浓度([NO3-]0=1.0 mmol·L-1)、不同pH值条件下, MEF([MEF]0=2 mg·L-1)的光解速率.结果表明, 在pH值为5.0、6.0、8.0、10.0的去离子水体系中, MEF的光解均符合一级动力学规律, 速率常数分别为0.0203、0.0210、0.0233、0.0267 min-1.由此可见, 随着溶液pH值增大, MEF光解速率增大.
| 表 1 不同pH的硝酸根溶液对MEF光降解影响的动力学方程及可决常数 Table 1 Photodegradation rate constants of MEF with different pH of NO3- |
首先, 随着体系pH值的增大, MEF的吸收光谱可因负电荷的去定域化而发生红移, 从而与光源的发射光谱有更多的重叠, 增大了其直接光解.即如图 5所示, 相比酸性环境, MEF在碱性条件下的吸收光谱图明显向右移, 在250~300 nm之间, 酸性和碱性环境下MEF的最大吸收波长分别为269 nm和283 nm; 其次, 随着溶液pH值增大, 羧基上的氢电离使MEF更多地以离子形态存在, 而羧基上氧原子的负电荷增加了苯环上的电子云密度, 有利于具有较强亲电性的羟基进攻而发生光化学转化(Ji et al., 2012);最后, 可能存在碱催化现象使得羟基自由基在碱性条件下的产率增大, 从而提高MEF的降解率(Lam et al., 2005).
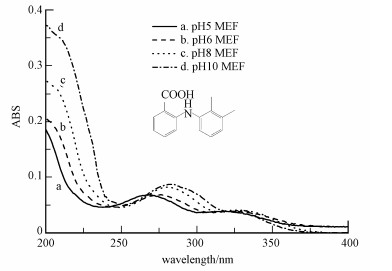 |
| 图 5 不同pH条件下MEF紫外吸收图谱 Fig. 5 Absorption spectrum of MEF in different pH aqueous solution |
碳酸盐是水体中常见的无机盐, 环境浓度可达0.4~4.4 mmol·L-1(Huang et al., 2000), 本文考察了在硝酸根浓度为1.0 mmol·L-1的体系中加入不同浓度的碳酸盐浓度对MEF光降解的影响.
由表 2可见, 当碳酸盐浓度分别为0、1、5和10 mmol·L-1时, MEF的光解均符合一级动力学规律, 速率常数分别为0.0232、0.0217、0.0179、0.0160 min-1.由此可见, 加入碳酸盐对硝酸根敏化MEF的光降解产生抑制作用, 随着碳酸盐浓度的增大, 其抑制效果越明显.有研究表明, 碳酸盐是羟基自由基的清除剂(Espinoza et al., 2007), 其可与体系中羟基自由基反应生成氧化电位更低的碳酸盐自由基(E=1.7 V)(式(4)~(5)), 从而抑制MEF在硝酸根中的光解.
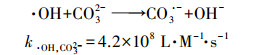
|
(4) |

|
(5) |
| 表 2 不同碳酸盐浓度溶液对硝酸根敏化MEF光降解影响的动力学方程及可决常数 Table 2 Effect of bicarbonate on nitrate sensitized photolysis of MEF |
氯离子是自然水体中常见的无机离子, 其在天然水体中浓度为0.5~5.1 mmol·L-1(Guangshu et al., 2007)本实验考察了不同浓度氯离子对MEF([MEF]0=2 mg·L-1)在1 mmol·L-1硝酸根离子溶液中光降解的影响, 结果如表 3所示.
| 表 3 不同Cl-浓度溶液对硝酸根敏化MEF光降解影响的动力学方程及可决常数 Table 3 Effect of Cl- concentration on photolysis of MEF induced by nitrate |
由表 3可知, 当氯离子浓度分别为0、0.01、0.1和1 mmol·L-1时, MEF的光解均符合一级动力学规律, 速率常数分别为0.0232、0.0159、0.0146、0.0137 min-1.随着体系氯离子浓度的上升, MEF在硝酸根溶液中的反应速率逐渐降低.一方面, 氯离子是羟基自由基的猝灭剂(Rincon et al., 2004), 其可与体系中的羟基自由基反应生成氧化性更低的氯自由基(式(6)~(7)), 从而抑制MEF在硝酸根溶液中的降解.另一方面, 氯离子可与甲芬那酸的激发的三重态反应, 进而与氧气反应生成基态物质(式(8)~(9))(Chiron et al., 2006), 从而抑制MEF的直接光解.

|
(6) |
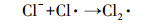
|
(7) |

|
(8) |

|
(9) |
三价铁离子普遍存在于自然水体中, 其在环境中浓度为0.0001~0.1 mmol·L-1(Zepp et al., 1992).本实验考察了不同浓度三价铁离子对MEF([MEF]0=2 mg·L-1)在1 mmol·L-1硝酸根离子溶液中光降解的影响, 结果如表 4所示.
| 表 4 不同Fe3+浓度浓度溶液对硝酸根敏化MEF光降解影响的动力学方程及可决常数 Table 4 Effect of Fe3+ concentration on photolysis of MEF induced by nitrate |
由表 4可知, 当三价铁离子浓度分别为0、0.001、0.005和0.01 mmol·L-1时, MEF的光解均符合一级动力学规律, 速率常数分别为0.0232、0.0165、0.0142、0.0135 min-1.随着体系三价铁离子浓度的上升, 反应速率逐渐降低.一方面, 由紫外吸收图谱(图 6)可知, 三价铁离子在200~400 nm波长有很强的光吸收, 而MEF的吸收光谱集中在200~300 nm之间, 所以体系中的三价铁离子会对光子产生竞争效应, 从而影响MEF对光的吸收;另一方面, 三价铁离子可与水分子结合产生Fe(OH)2+、Fe(OH)2+等络合物(式(10)~式(11)), 降低反应体系的透明度, 对MEF光解产生光屏蔽作用(张楠等, 2012), 从而影响MEF的降解.综上, 三价铁离子的加入会抑制MEF在硝酸根溶液中的降解.
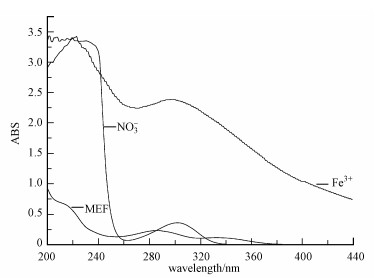 |
| 图 6 紫外吸收图谱 Fig. 6 Absorption spectrum in aqueous solution |

|
(10) |
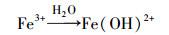
|
(11) |
硝酸根敏化MEF光降解产物总离子流图(TIC)如图 7所示.由图可见, 其在4.86、5.32、5.55、5.73和6.55 min对应有5个明显的主峰(其中6.55 min对应为MEF主峰).根据光降解产物总离子流图(TIC)和二级质谱图(图 8)信息, 可以推测出硝酸根敏化MEF光降解的4个产物.其主要碎片以及推测的可能结构如表 5所示.
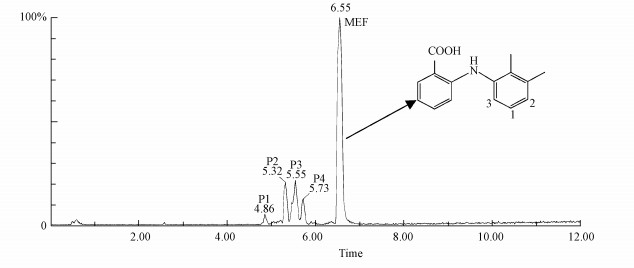 |
| 图 7 光降解产物总离子流图([MEF]0=2 mg·L-1, [NO3-] 0=1.0 mmol·L-1, pH=7.0) Fig. 7 Total ion chromatogram of photoproducts ([MEF]0=2 mg·L-1, [nitrate] 0=1.0 mmol·L-1, pH=7.0) |
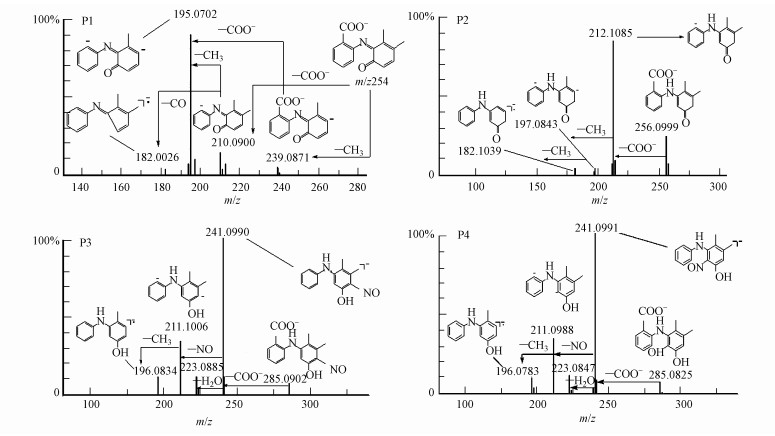 |
| 图 8 光降解产物P1~P4的二级质谱图 Fig. 8 Fragment chart analyses of MS/MS spectrometry of the P1~P4 photolysis products (negative ion mode) |
| 表 5 硝酸根敏化MEF光降解产物推测 Table 5 Proposed photodegradation products of MEF induced by nitrate in aqueous solution |
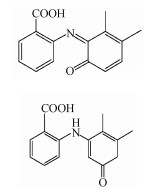
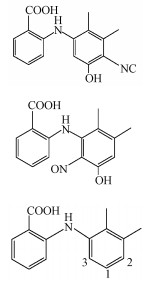
MEF的光解产物二级裂解中主要发生了侧链羧基, 亚硝基, 羟基的丢失, 其光解产物可能为MEF结构中的苯基酮化的氧化产物, 或苯基氧化发生了亚硝基取代.由此推测硝酸根敏化甲芬那酸光降解主要有3个途径, 如图 9所示.硝酸根在光照下产生O2·-, O2·-快速与水产生共轭酸·OH, 进而分别攻击MEF的1、2、3位.途径1是·OH攻击3位生成N-6-羟基-2, 3-二甲苯基邻氨基苯甲酸, 3位是MEF氧化的弱势位, 生成的中间产物不稳定, N-2, 3-二甲基-6-苯酚基邻氨基苯甲酸趋于生成稳定的结构状态, 进一步通过脱氢生成了稳定的共轭结构P1(N-2, 3-二甲基-6-氧代苯基邻氨基苯甲酸);路径2是·OH攻击MEF的2位, 氧化取代生成N-4-羟基-2, 3-二甲苯基邻氨基苯甲酸, 再进一步通过苯基酮化生成稳定结构的产物P2(N-2, 3-二甲基-4-氧代苯基邻氨基苯甲酸)(Myint et al.2008);路径3是·OH攻击MEF的1位, 氧化取代生成N-5-羟基-2, 3-二甲苯基邻氨基苯甲酸, 一方面其会进一步通过苯基酮化生成稳定结构的产物P2(N-2, 3-二甲基-4-氧代苯基邻氨基苯甲酸), 另一方面1和3位与体系中的NO·发生氧化取代生成同分异构体P3(N-5-羟基-2, 3-二甲基-4-亚硝苯基邻氨基苯甲酸)和P4(N-3-羟基-5, 6-二甲基-2-亚硝苯基邻氨基苯甲酸).P1和P2是通过6-羟基-MEF来形成的.产物中测到的MEF-1, 6-亚氨基醌(P2)可以解释为氨基自由基和ROS反应的结果.这是因为给电子基团—CH3的存在, 使得形成的氨基自由基在这个芳香环的邻位上更受ROS攻击.即2位—H的转移形成的苯酚自由基迅速被O2氧化取代而形成P2, 详细的氧化机制参考了(von Sonntag et al.2006).相似的, 羟基自由基在富电子芳香环上的亲电取代导致了P1的形成.
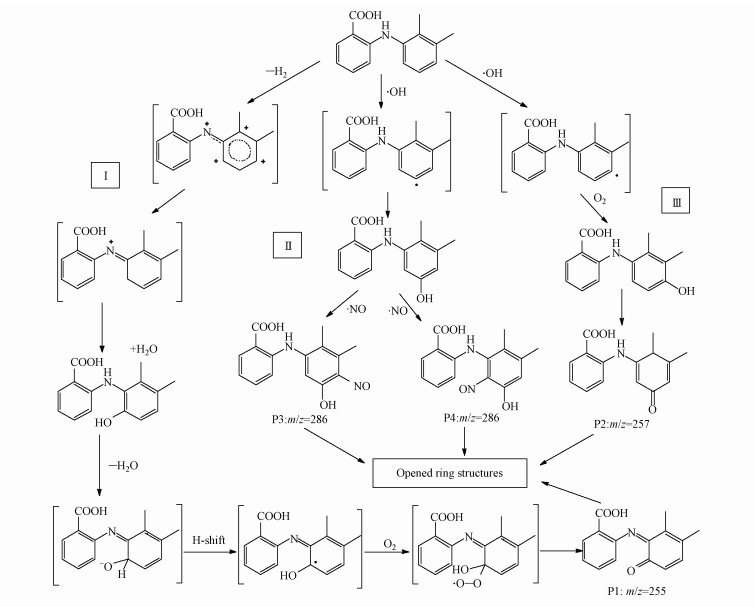 |
| 图 9 硝酸根敏化MEF光降解的可能途径 Fig. 9 Possible photodegradation pathways of MEF in a nitrate aqueous solution |
毒性是评价有机污染物生态风险的一个重要指标.由于硝酸根敏化光降解有机污染物会生成硝化产物和羟基化产物, 这些中间态产物的毒性会比原来物质的毒性强(Shankar et al., 2007), 所以有必要对本研究进行毒性评价.
如图 8所示, 光照前MEF对明亮发光菌T3小种发光的相对抑制率(I)为17.22%, 随着光解过程的进行, 当MEF降解率为25%时, 其对发光菌抑制率达到最低为12.73%.当光照进行至40 min时, MEF降解率达到59%, 此时光解样品对明亮发光杆菌的发光抑制率达到最大.当光照时间为60 min时, 其抑制率为28.97%, 而此时TOC降解率只有16%, 这表明MEF在硝酸根敏化光降解下没有得到彻底的矿化, 生成一些毒性较高的中间产物.值得注意的是, 从UPLC/MS/MS推测出的亚硝基代芳香化合物(P3、P4)可能是体系毒性增大的原因, 这与Suzuki et al.(1990)等对硝基苯酚光降解研究结果一致.综上可知, 在硝酸根敏化光降解MEF过程中, 生成了具有较MEF而言更高风险的中间产物, 其亚硝化产物是致使明亮发光杆菌的发光抑制变高的主要因素;硝酸根广泛存在于水环境中, 在研究有机物由自由基引起的间接光解机理时, 应该着重考虑由亚硝化反应所产生的亚硝化产物毒性.MEF在水处理过程和天然水体中的生态风险值得关注, 在使用UV对其进行深度处理时候应该注意控制水体中硝酸根的含量.
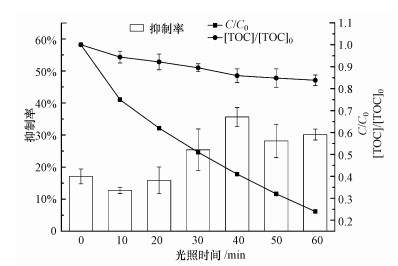 |
| 图 10 MEF在硝酸根溶液中的光解对发光菌的发光抑制率及TOC降解情况 Fig. 10 The inhibition rate of V. fischeri and degradation of TOC on photolysis of MEF in the presence of nitrate ions |
1) 甲芬那酸在不同浓度硝酸根溶液中的光解反应符合准一级动力学规律, 其降解速率常数随硝酸根离子浓度增大而增大.
2) 在硝酸根敏化光降解甲芬那酸过程中有亚硝酸根的产生.
3) 碱性溶液有利于甲芬那酸在硝酸根溶液中的光解.
4) 碳酸盐、氯离子、三价铁均对硝酸根敏化甲芬那酸的光降解表现为抑制作用.
5) 硝酸根敏化MEF的光解分为三个路径, 分别是脱氢反应、羟基化反应和酮化反应.反应产生毒性较MEF高的产物.
| [${referVo.labelOrder}] | Boule P, Bolte M, Richard C. 1999. Phototransformations Induced in Aquatic Media by NO- 3/NO2-, FeⅢand Humic Substances[M]. Environmental Photochemistry. Springer Berlin Heidelberg: : 181 -215. |
| [${referVo.labelOrder}] | Boreen A L, Arnold W A, Mc Neill K. 2003. Photodegradation of pharmaceuticals in the aquatic environment:a review[J]. Aquat Sci , 65 : 320–341. DOI:10.1007/s00027-003-0672-7 |
| [${referVo.labelOrder}] | Brezonik P L, Fulkerson-Brekken J. 1998. Nitrate-induced photolysis in natural wat ers:Controls on concentrat ions of hydroxyl radical photo-intermediat es by natural scavenging agents[J]. Environ Sci Technol , 32 (19) : 3004–3010. DOI:10.1021/es9802908 |
| [${referVo.labelOrder}] | Buxton G V, Greenstock C L, Helman W P, et al. 1988. Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (·OH/·O- in aqueous solution[J]. Journal of Physical & Chemical Reference Data , 17 (2) : 513–886. |
| [${referVo.labelOrder}] | Chen P, Lv W, Chen Z, et al. 2015. Phototransformation of mefenamic acid induced by nitrite ions in water:mechanism, toxicity, and degradation pathways[J]. Environmental Science and Pollution Research , 22 (16) : 12585–12596. DOI:10.1007/s11356-015-4537-0 |
| [${referVo.labelOrder}] | Chen P, Wang F L, Yao K, et al. 2015. Photodegradation of Mefenamic Acid in Aqueous Media:Kinetics, Toxicity and Photolysis Products[J]. Bulletin of Environmental Contamination and Toxicology , 96 : 203–209. |
| [${referVo.labelOrder}] | Chiron S, Minero C, Vione D. 2006. Photodegradation processes of the antiepileptic drug carbamazepine, relevant to estuarine waters[J]. Environmental Science & Technology , 40 (19) : 5977–5983. |
| [${referVo.labelOrder}] | Espinoza L A T, Neamţu M, Frimmel F H. 2007. The effect of nitrate, Fe (Ⅲ) and bicarbonate on the degradation of bisphenol A by simulated solar UV-irradiation[J]. Water Research , 41 (19) : 4479–4487. DOI:10.1016/j.watres.2007.06.060 |
| [${referVo.labelOrder}] | Guangshu Z, Jingfu L, Bin H, et al. 2008. Ultraviolet degradation of methyltins:elucidating the mechanism by identification of a detected new intermediary product and investigating the kinetics at various environmental conditions[J]. Chemosphere , 72 (3) : 389–399. DOI:10.1016/j.chemosphere.2008.02.048 |
| [${referVo.labelOrder}] | Hapeshi E, Achilleos A, Vasquez M I, et al. 2010. Drugs degrading photocatalytically:kinetics and mechanisms of ofloxacin and atenolol removal on titania suspensions[J]. Water Research , 44 (6) : 1737–1746. DOI:10.1016/j.watres.2009.11.044 |
| [${referVo.labelOrder}] | Hilton M J, Thomas K V. 2003. Determination of selected human pharmaceutical compounds in effluent and surface water samples by high-performance liquid chromatography-electrospray tandem mass spectrometry[J]. Chromatogr , 1015 (1) : 129–141. |
| [${referVo.labelOrder}] | Huang J, Mabury S A. 2000. Steady-state concentrations of carbonate radicals in field waters[J]. Environmental Toxicology and Chemistry , 19 (9) : 2181–2188. DOI:10.1002/etc.v19:9 |
| [${referVo.labelOrder}] | Ji Y, Zeng C, Ferronato C, et al. 2012. Nitrate-induced photodegradation of atenolol in aqueous solution:Kinetics, toxicity and degradation pathways[J]. Chemosphere , 88 (5) : 644–649. DOI:10.1016/j.chemosphere.2012.03.050 |
| [${referVo.labelOrder}] | 季跃飞, 曾超, 孟翠, 等.2012. 阿替洛尔在硝酸根溶液中的光降解研究[J]. 环境科学 , 2012 (2) : 481–487. |
| [${referVo.labelOrder}] | Lam M W, Young C J, Mabury S A. 2005. Aqueous photochemical reaction kinetics and transformations of fluoxetine[J]. Environmental Science & Technology , 39 (2) : 513–522. |
| [${referVo.labelOrder}] | Mark G, Korth H G, Schuchmann H P, et al. 1996. The photochemistry of aqueous nitrate ion revisited[J]. Photochem Photobiol , 101 (2/3) : 89–103. |
| [${referVo.labelOrder}] | Moore R A, Derry S, Mcquay H J. 2011. Single dose oral mefenamic acid for acute postoperative pain in adults[J]. Cochrane Database of Systematic Reviews , 66 (3) : 365–365. |
| [${referVo.labelOrder}] | Rincon A G, Pulgarin C. 2004. Effect of pH, inorganic ions, organic matter and H2O2 on E[J]. coli K12 photocatalytic inactivation by TiO2:implications in solar water disinfection[J]. Applied Catalysis B:Environmental , 51 (4) : 283–302. |
| [${referVo.labelOrder}] | Sein M M, Zedda M, Tuerk J, et al. 2008. Oxidation of diclofenac with ozone in aqueous solution[J]. Environmental Science & Technology , 42 (17) : 6656–6662. |
| [${referVo.labelOrder}] | Shankar MV, Nélieu S, Kerhoas L, et al. 2007. Photo-induced degradation of diuron in aqueous solution by nitrites and nitrates:kinetics and pathways[J]. Chemosphere , 66 : 767–774. DOI:10.1016/j.chemosphere.2006.07.044 |
| [${referVo.labelOrder}] | Sharpless C M, Linden K G. 2001. UV photolysis of nitrate:Effect of natural organic matter and dissolved inorganic carbon and implication for UV water disinfection[J]. Environ Sci Technol , 35 (14) : 2949–2955. DOI:10.1021/es002043l |
| [${referVo.labelOrder}] | Soulet B, Tauxe A, Tarradellas J. 2002. Analysis of acidic drugs in Swiss wastewaters[J]. Environ Anal Chem , 82 : 659–667. DOI:10.1080/0306731021000075384 |
| [${referVo.labelOrder}] | Suwalsky M, Manrique-Moreno M, Howe J. 2011. Molecular interactions of mefenamic acid with lipid bilayers and red blood cells[J]. Journal of the Brazilian Chemical Society , 22 (12) : 2243–2249. DOI:10.1590/S0103-50532011001200002 |
| [${referVo.labelOrder}] | Suzuki J, Sato T, Ito A, et al. 1990. Mutagen formation and nitration by exposure of phenylphenols to sunlight in water containing nitrate or nitrite ion[J]. Bulletin of Environmental Contamination & Toxicology , 45 (4) : 516–522. |
| [${referVo.labelOrder}] | Tauxe-Wuersch L F, De Alencastro D, Grandjean J, et al. 2005. Occurrence of several acidic drugs in sewage treatment plants in Switzerland and risk assessment[J]. Water Research , 39 : 1761–1772. DOI:10.1016/j.watres.2005.03.003 |
| [${referVo.labelOrder}] | Von Sonntag C. 2006. Free-radical-induced DNA damage and its repair[M]. Berlin: Springer: 146 . |
| [${referVo.labelOrder}] | Werner J J, Mc Neill K, Arnold W A. 2004. Environmental photodegradation of mefenamic acid[J]. Chemosphere , 58 : 1339–1346. |
| [${referVo.labelOrder}] | 吴寅, 文爱东, 罗晓星, 等.2006. 甲芬那酸分散片在健康人体的生物等效性评价[J]. 中国医院药学杂志 , 2006, 25 (11) : 1013–1016. |
| [${referVo.labelOrder}] | 张楠. 2012.双氯芬酸在水环境中光解行为的研究[D].河南师范大学 |
| [${referVo.labelOrder}] | Zepp R G, Faust, B C, Holgné J. 1992. Hydroxyl radical formation in aqueous reactions (ph 3-8) of iron(ii) with hydrogen peroxide:the photo-fenton reaction[J]. Environmental Science & Technology , 26 : 313–319. |
 2016, Vol. 36
2016, Vol. 36