2. 华中科技大学 化学与化工学院, 武汉 430074
2. School of Chemistry and Chemical Engineering, Huazhong University of Science & Technology, Wuhan 430074
氨苄西林(Ampicillin,AMP)属于β-内酰胺类抗生素(BLAs),自20世纪70年代以来,β-内酰胺类抗生素(BLAs)已经成为最广泛使用的一类抗菌药物(Hou et al.,1971),被应用于人类、动物疾病的预防和治疗,并作为动物生长促进剂添加到动物饲料中;在生物代谢过程中绝大部分抗生素以药物原形随粪便和尿液直接排出体外,最终进入到水环境(Sarmah et al.,2006),成为环境中潜在的新型污染物.目前,国内外已有关于在土壤、水体等环境样品以及食品样品中检测到不同浓度抗生素的诸多报道(Li et al.,2012;Kumar et al.,2012;Derksen et al.,2012;鲍晓磊等,2013).残留在环境和食品样品中的抗生素虽然可能只是痕量水平,但由于其本身具有较强的生物反应活性、持久性及难生物降解性等特点,对人类、水生和陆生生物产生长期潜在危害(Oliver et al.,2005);甘秀梅等,2014).另外,由于环境和食品样品中基质复杂,待测物含量低,因此,如何从环境样品的复杂基体中选择性识别和分离痕量抗生素是一个亟待解决的问题.
分子印迹技术是制备具有专一性识别能力的聚合物的强有力的方法之一(Balamurugan and Spivak,2011;Chen et al.,2011).表面分子印迹技术是把模板分子识别位点建立在基质材料的表面(Gao et al.,2008).表面分子印迹聚合物是通过分子印迹技术合成的对目标分子具有特异性识别、较高选择性和亲和性的聚合物.近年来,表面分子印迹聚合物在环境监测、废水处理领域的应用较多,被大量用于环境中抗生素(Hu et al.,2008)、雌激素(Yuan et al.,2012)等污染物的选择性识别和分离、富集.Zhang等(2010)将磁性分子印迹聚合物用于牛奶中β-内酰胺类抗生素选择性识别和分离.Pan等(2013)以酵母菌为载体制备了温敏型表面印迹聚合物,并将其用于头孢氨苄抗生素的选择性识别.
核桃壳是一种产量丰富、价格低廉、富含纤维素和木质素等有机物质的农林废弃物.农林废弃物生物质炭因其具有较高的孔隙度和巨大的比表面积,已经广泛用于环境中各类极性或非极性有机污染物的吸附去除(何丽芝等,2015; Gaunt et al.,2008;).目前,以农林废弃物生物炭为基质材料制备分子印迹聚合物,将其应用于环境中抗生素的选择性识别与分离研究还较少.与其它基质材料如二氧化硅(Dvorakova et al.,2010)、石墨(Chang et al.,2011)等相比,农林废弃物生物炭作为基质材料制备分子印迹聚合物具有成本低、价廉易得、活性基团丰富、与有机物高分子兼容性高且可与无机材料键联更牢固,而不需要进一步修饰等优势.
本研究利用溶剂热合成法将核桃壳制备磁性炭微球,以磁性炭微球为基质材料,氨苄西林(Ampicillin,AMP)为模板,甲基丙烯酸(MAA)为功能单体,乙二醇双甲基丙烯酸酯(EGDMA)和N,N-亚甲基双丙烯酰胺(BIS)为交联剂,2,2′偶氮二异丁基脒二盐酸盐(AIBA)作为引发剂,在甲醇/水的混合体系中制备出对氨苄西林具有良好特异性识别能力的表面印迹材料,并将其用于环境样品中氨苄西林的选择性识别与分离.
2 材料与方法(Materials and methods) 2.1 主要材料六水氯化铁FeCl3.6H2O、醋酸钠、乙二醇、聚乙二醇购于国药集团化学试剂有限公司.氨苄西林(AMP)、头孢氨苄(CFX)、四环素(TC)、磺胺嘧啶(SD)、甲基丙烯酸(MAA)、乙二醇双甲基丙烯酸酯(EGDMA)、N,N-亚甲基双丙烯酰胺(BIS)、聚乙烯吡咯烷酮(PVP)、 2,2′偶氮二异丁基脒二盐酸盐(AIBA)购于阿拉丁试剂有限公司购买.盐酸、甲醇、醋酸购于河南省金硕化学试剂有限公司.其它化学试剂均为分析纯.实验用水为二次蒸馏水.
2.2 主要仪器设备傅立叶变换红外装置(FT-IR,NEXUS-470);透射电子显微镜(Transmission Electron Microscopy,TEM)),日本,JEOL IEM-200CX;热重分析仪(Thermogavimetric analyzer,TGA),德国,Netzsch STA 449C型,温度范围为25~800 ℃,升温速率为5.0 ℃·min-1;样品振动磁强计(VSM,7300,Lakeshore);比表面与空隙度分析仪,美国,NDVA-2000e;粒度粒型测试仪,荷兰,CIS-100;高效液相色谱仪(1200 LC,Agilent,Germany);原子吸收分光光度计(Atomic Absorption Spectrophotometer,AAS),中国,TBS-990型;紫外可见分光光度计(UV-2450,Shimadzu,Japan);高效液相色谱仪(1200 LC,Agilent,Germany),20 μL注射器,流动相为甲醇和去离子水(25∶75,V/V),流动相速度1.0 mL·min-1,温度25 ℃.
2.3 材料的制备 2.3.1 磁性炭微球(MCMs)的制备将烘干的核桃壳粉碎至粒径为2.0~4.0 mm,用3.0 mol·L-1的盐酸,在70 ℃下回流12 h,蒸馏水洗涤多次至中性,烘干至恒重,得到酸活化核桃壳颗粒.将5 g酸活化核桃壳颗粒与2.0 g FeCl3.6H2O、5 g醋酸钠溶于500 mL乙二醇中,超声搅拌60 min,混合均匀,随后加入2.0 g聚乙二醇,室温下机械搅拌10 h,随后此混合物放在氮气气氛下的管式炉中以3.0~5.0 ℃·min-1升温至500 ℃,维持该温度煅烧3.0 h,煅烧产物用乙醇多次洗涤后,干燥至恒重,得到磁性炭微球(MCMs).
2.3.2 磁性炭微球表面分子印迹吸附材料(MMIPs)的制备0.5 g模板分子氨苄西林(Ampicillin,AMP)、3.0 mL甲基丙烯酸(MAA)加入到150 mL体积比为4∶1的甲醇与水的混合液中,混合体系在氮气保护下超声60 min;随后向上述混合液中加入10.0 g乙二醇双甲基丙烯酸酯(EGDMA)和3.0 g N,N-亚甲基双丙烯酰胺(BIS),搅拌至完全溶解后继续加入5.0 g磁性炭微球、0.2 g聚乙烯吡咯烷酮(PVP),氮气保护下室温超声60 min;随后向上述溶液中加入0.2 g 2, 2′偶氮二异丁基脒二盐酸盐(AIBA)为引发剂,上述混合反应在氮气保护下室温反应16 h.所得产物用Nd-Fe-B永久磁铁收集,用无水乙醇和蒸馏水多次洗涤,最后用甲醇和乙酸为9∶1(V/V)的混合液索氏提取24 h,至洗脱液中检测不到模板分子,60 ℃真空干燥,得到磁性炭微球表面印迹吸附材料(MMIPs).磁性炭微球表面非印迹吸附材料(MNIPs)的制备方法同上,只是过程中不加模板分子.
2.4 吸附实验10 mL 不同初始浓度(10~200 mg·L-1)的AMP溶液与 10 mg MMIPs(或MNIPs)混合,在25 ℃恒温振荡60 min,考察吸附材料的吸附等温线;10 mL初始浓度为100 mg·L-1的AMP水溶液与10 mg MMIPs(或MNIPs)反应,在25 ℃恒温振荡至所需时间(5.0~180 min),考察吸附材料的吸附动力学;用1.0 moL·L-1 HCl和1.0 moL·L-1NaOH调节溶液pH为2.0~11.0,考察 pH 值对吸附过程的影响.上述溶液经振荡后磁吸分离,水相中残留的AMP量用紫外可见分光光度计在波长325 nm处测量.吸附率(E)与吸附容量(q,mg·g-1)根据式(1)计算.
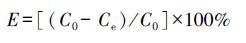
|
(1) |

|
(2) |
式中,C0和Ce分别为AMP的初始浓度和平衡浓度(mg·L-1),V(L)和W(g)分别为溶液体积和吸附剂的剂量.
吸附平衡数据采用Langmuir、Freundlich等温模型进行拟合(Liu et al.,2015; Liu et al.,2015; Anbia and Haqshenas,2015).
Langmuir吸附等温方程式为:
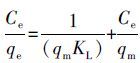
|
(3) |
Freundlich 吸附等温方程式为:
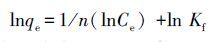
|
(4) |
式中,qe为平衡吸附容量(mg·g-1), qm为饱和吸附容量(mg·g-1),Ce为被吸附物质的平衡浓度(mg·L-1),KL为与吸附能有关的常数(L·mg-1).Kf为与吸附能力有关的常数(g·L-1),n为与温度有关的常数,当n在2~10之间时易于吸附(Zhou et al.,2015).
实验中获得的动力学数据采用准一级和准二级吸附动力学方程进行拟合(Dai et al.,2014;Serrano-Gómez et al.,2015).准一级吸附动力学方程的线性形式为:
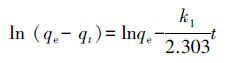
|
(5) |
准二级吸附动力学方程的线性形式为:
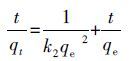
|
(6) |
式中,qe和qt分别是吸附平衡时吸附容量(mg·g-1)和时间t时的吸附容量(mg·g-1).k1(L·min-1)和k2(g.mg-1·min-1)分别为一级和二级速率常数,其相应值可由ln (qe - qt )对t及t/qt对t作图所得直线的截距和斜率获得.
2.5 选择性识别实验为了研究MMIPs对AMP的选择识别性能,将AMP与一系列结构类似的抗生素化合物(如CFX、TC和SD)配制成混合溶液,并将其作为竞争吸附实验的测试溶液,其中每种抗生素的浓度均为100 mg·L-1.在竞争吸附实验中,于10 mL配制的抗生素化合物混合溶液中加入10 mg MMIPs或MNIPs,调节溶液pH值为6.0.吸附体系在25 ℃恒温静置2.0 h后,MMIPs或MNIPs用永磁铁分离,吸附后溶液中残留的每种抗生素浓度用HPLC法测定,并用于计算分配系数Kd(L·g-1)、选择性系数k和相对选择性系数k′.
Kd、k 、k′的计算公式分别为:
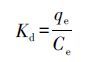
|
(7) |
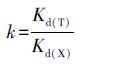
|
(8) |
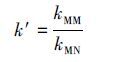
|
(9) |
其中,qe和Ce分别为抗生素平衡吸附容量和平衡浓度(mg·g-1);Kd(T)和Kd(X)分别为模板分子和竞争性抗生素的分配系数;kMM和kMN分别为MMIPs和MNIPs的选择性系数.
2.6 漏磁实验为了考查所制备MMIPs的漏磁情况,将50 mg MMIPs分别加入到pH值为2.0~10的10 mL蒸馏水中,室温振荡24 h后,用永磁铁将MMIPs从溶液中分离,用FAAS法测定溶液中铁离子的含量.
2.7 实际样品应用取5.0 g市售的牛奶样品分散到1.0 mL 15%三氯乙酸(w/V)溶液中,高速搅拌混合均匀,离心,过滤,滤液用AMP溶液定标至50 μg·L-1.50 mL上述溶液分别与MMIPs和MNIPs混合,搅拌混合物12 h,用永磁铁分离,去除上清液.将捕获AMP的MMIPs(或MNIPs)用3.0 mL乙腈去除非特异性吸附,随后用10 mL 20%甲醇和醋酸的混合液洗涤,并在298 K氮气条件下干燥.随后残留物用1.0 mL甲醇和醋酸溶液溶解,0.45 μm滤膜过滤,滤液用于HPLC检测.
3 结果与讨论(Results and discussion) 3.1 3.1 材料的理化性能表征 3.1.1 红外分析图 1是核桃壳、磁性炭微球、磁性炭微球表面印迹吸附材料、表面印迹材料(未经洗脱AMP)和(e)表面印迹材料(已经洗脱AMP)的红外光谱.从图 1a中可知,在3420 cm-1和1632 cm-1处的吸收峰为核桃壳羟基(—OH)峰和CH、CH2中C—H键伸缩振动峰,1430 cm-1和1057 cm-1处的强吸收峰为核桃壳CO和O—H伸缩振动峰(Doshi et al.,2008);从图 1b中可知,磁性炭微球在529 cm-1和573 cm-1处都出现了Fe3O4纳米粒子的Fe—O键特征吸收峰(Liu et al.,2008; Zhu et al.,2010).从图 1c中可知,在1725 cm-1和1255 cm-1处的强吸收峰是羧基中CO的伸缩振动、EGDMA酯基中C—O的对称振动(Zou et al.,2011; Yoshimatsu et al.,2007)以上结果表明,在引发剂AIBA存在下,MAA和EGDMA在磁性炭微球表面成功发生了聚合.图 1d中在1770 cm-1处出现了AMP分子结构的β-内酰胺环的羰基CO振动峰,并且在1583 cm-1、1519 cm-1和1464 cm-1处出现了新的峰位,此峰是AMP分子结构中苯环的特征峰(朱淮武,2005),说明印迹材料中存在AMP.图 1e中未见此峰,这是印迹材料经过洗脱后,只留下结构与模板分子类似的空穴,并没有模板分子AMP.
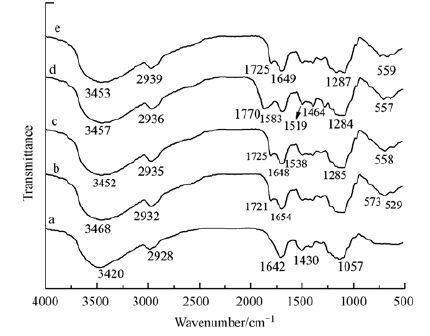 |
| 图 1 核桃壳(a)、磁性炭微球(b)、表面印迹材料(c)、 表面印迹材料(未经洗脱AMP)(d)和表面印迹材料(已经洗脱AMP)(e)的红外光谱 Fig. 1 FT-IR spectra of(a)walnut husks 、(b)MCMs、(c)MMIPs、(d)un-eluted MMIPs and eluted MMIPs |
通过透射电镜从图 2a可以看出,所制备的磁性炭微球(MCMs)颗粒没有发生明显的团聚,分散性良好,呈均匀的球形结构,尺寸在100~200 nm之间.随后MCMs作为基质材料,2, 2′偶氮二异丁基脒二盐酸盐(AIBA)为引发剂,在其表面发生MAA 、BIS和EGDMA的共聚合.图 2b为表面印迹聚合物的透射电镜图.从图中可以看出表面聚合物层的厚度大约为50~80 nm.因此,可以推断MAA、BIS和EGDMA能够在AIBA引发下发生聚合反应且能够获得比较均一的聚合物层.
 |
| 图 2 MCMs(a)和MMIPs(b)的透射电镜图 Fig. 2 Micrographs from a transmission electron microscope of MCMs(a)and MMIPs(b) |
表 1为MMIPs和MNIPs的比表面积、孔容和平均孔尺寸.从表 1可以看出,MMIPs比MNIPs拥有更大的比表面积、孔容和平均孔尺寸.结果表明,MMIPs和MNIPs的不同吸附性能不能完全归因于形貌上的差异,还与产生专一性识别位点的印迹过程有关(Li et al.,2009).
| 表 1 MMIPs和MNIPs的氮气吸附-脱附分析比较 Table 1 Comparison of MMIPs and MNIPs from nitrogen adsorption-desorption analysis |
图 3分别为MCMs(a)、MMIPs(b)和MNIPs(c)的热重分析图.在初始的300 ℃内,MCMs、MMIPs和MNIPs热稳定性较好,不易产生分解,对应的失重率分别为3.25%、6.32%和12.56%,主要是由于少量游离水的失重(Feng et al.,2008).当温度升至800 ℃时,由于表面印迹聚合层的分解,MMIPs和MNIPs出现了较大的失重,失重率分别为75.08%和77.50%.MMIPs和MNIPs 的质量损失趋势较相似,MMIPs的总损失比MNIPs少了1.42%,可能是MMIPs 表面有印迹部分的原因,这与文献(Ren et al.,2012; 王雪等,2014)结论是一致的.800 ℃时MMIPs和MNIPs残留的物质主要是热阻性的Fe3O4磁性纳米粒子和少量的碳或石墨.
 |
| 图 3 MCMs、MMIPs和MNIPs的热重分析图 Fig. 3 Thermogravimetric analysis of MCMs,MMIPs and MNIPs |
图 4a是MCMs和MMIPs在室温时的磁滞回线.比较图中的两条磁滞回线,可以看出两条曲线的形状和变化趋势类似,且都是关于原点对称,表明MCMs和MMIPs都具有超顺磁性(Wang et al.,2009).室温下MCMs和MMIPs的饱和磁化强度(Ms)分别为8.252 emu·g-1和3.125 emu·g-1.由此可知,MMIPs仍拥有足够的磁性响应能力,其磁性分离效果明显.MMIPs 在水中的分散性和磁分离效能结果如图 4b所示,MMIPs可均匀分散于水中,在外加磁场的作用下20 s内能够将其从水中快速分离,表明MMIPs有较好的回收再生性能.图 4c为pH值对MMIPs磁稳定性的影响,在pH值为4.0~8.0的范围内,几乎没有铁离子从MMIPs中泄漏出来,随着pH值的减小,铁离子的泄漏量稍有增加.在pH=2.0时,MMIPs的漏磁量最大,每50 mg MMIPs中约有9.375 μg铁离子泄漏.结果表明,在实验选定pH=6.0的条件下,MMIPs能有效的避免磁漏.这一研究结果对于MMIPs应用于饮用水(实际pH值接近7.0)中AMP分子的识别和分离具有重要意义.
 |
| 图 4 MCMs和MMIPs在室温时的磁滞回线(a),悬浮在水中(左边)和在外加磁场作用下(右边)MMIPs的照片(b),pH值对MMIPs磁稳定性的影响(c) Fig. 4 Magnetization curves at room temperature of MCMs and MMIPs(a),A photograph of MMIPs suspended in water(left)and separated by an external magnet(right)(b),effect of pH value on the magnetic stability of MMIPs(c) |
图 5为pH值对MMIPs和MNIPs吸附氨苄西林(AMP)的影响(a)和初始pH对平衡pH值的影响(b).当初始pH值在2.0~6.0范围内,MMIPs和MNIPs对AMP的吸附容量随着pH值的增加而增加,从图中还可以看出,MMIPs对AMP的吸附容量在pH =6.0时达到了最大值,即39.63 mg·g-1.表明在低pH值时,选择性结合位点与目标分子之间的亲和力是吸附的主要驱动力.在初始pH值为2.0~6.0的范围内,溶液平衡pH值与其初始pH值变化缓慢,但是在初始pH值为6.0~11.0范围内,溶液平衡pH值明显低于其初始pH值,MMIPs和MNIPs的吸附容量也随pH的增大显著下降.综上,本研究选用pH=6.0为测试溶液的pH值.
 |
| 图 5 pH值对吸附AMP的影响(a)和初始pH对平衡pH值的影响(b) Fig. 5 Effect of pH on adsorption of AMP(a)and effect of initial pH on equilibrium pH(b) |
MMIPs和MNIPs对AMP的吸附等温线见图 6.由图 6中可以看出,随着AMP平衡浓度的增加,MMIPs和MNIPs对AMP的平衡吸附容量先是迅速增加,然后缓慢增加,最终达到最大值.同时MMIPs对AMP的吸附容量明显大于MNIPs,表明MMIPs的结合位点对AMP有优先的“响应”,主要是由于印迹聚合物对印迹分子具有吸附特异性(>Li et al.,2012a).
 |
| 图 6 MMIPs和MNIPs的吸附等温线 Fig. 6 The adsorption isotherms of MMIPs and MNIPs |
根据图 6中数据,分别用方程式(3)和(4)拟合所得参数见表 2.从表 2可以看出,Langmuir等温模型能更好的拟合MMIPs和MNIPs对AMP的吸附平衡数据,表明MMIPs和MNIPs对AMP的吸附是单分子层吸附,最大单分子层吸附容量40.96 mg·g-1.由Freundlich线性方程拟合得到的n值大于2,表明在研究范围内均为优惠吸附过程(Manu et al.,2015).
| 表 2 印迹吸附材料和非印迹吸附材料吸附AMP的等温吸附常数 Table 2 Adsorption isotherm constants for AMP adsorption onto MMIPs和MNIPs |
图 7为MMIPs和MNIPs对AMP的吸附动力学情况(7a)及二级动力学线性拟合曲线(图 7b).从图中可以看出,在初始30 min内,MMIPs和MNIPs对AMP的吸附容量迅速增加,60 min后,吸附容量逐渐趋于动态平衡,在相同时间下,MMIPs对AMP的吸附率高于MNIPs,说明印迹过程使MMIPs具有特殊的结合位点,从而提高其吸附性能.将吸附动力学数据用准一级动力学方程(方程5)和准二级动力学方程(方程6)进行拟合,表 3列出了MMIPs和MNIPs的吸附动力学常数.从中可以发现,MMIPs和MNIPs吸附AMP动力学数据符合准二级动力学方程,(R2均大于0.999).说明用准二级动力学方程描述MMIPs对AMP的吸附动力学行为的适用性较好,AMP分子有可能通过与吸附剂MMIPs共用或交换电子形成的化学键牢牢占据了MMIPs的结合位点,同时说明MMIPs吸附AMP的机理可能为化学吸附控制.
 |
| 图 7 MMIPs和MNIPs 吸附动力学数据(a);准二级动力学模型线性回归拟合(b) Fig. 7 The adsorption kinetic curves of MMIPs and MNIPs(a); Pseudo-second-order rate equation for AMP adsorption onto MMIPs and MNIPs using linear regression(b) |
| 表 3 MMIPs和MNIPs的吸附动力学常数 Table 3 Kinetic constants for MMIPs和MNIPs |
表 4中列出了MMIPs和MNIPs的Kd、k和k′值.从表 4中的结果可以看出,与MNIPs相比,MMIPs的Kd、k值显著增加,这可能是因为印迹材料表面有具有识别能力的专一性结合位点,使MMIPs对AMP具有选择识别能力.k′值是识别位点对模板分子识别亲和力的重要指标,表 4的k′值可以看出MMIPs对AMP的选择识别能力是MNIPs的8.276~10.832倍.虽然AMP与CFX的结构类似,但AMP的平衡浓度仍比CFX低的多,表明模板分子官能团对印迹孔穴的记忆作用与MMIPs的识别性能有很大关系(Li et al.,2012b).以上结果表明,分子印迹过程有效实现了印迹聚合物对模板分子的选择性识别.
| 表 4 分配系数、选择性系数和相对选择性系数数据 Table 4 Distribution coefficients and selectivity coefficients,relative selectivity coefficients |
MMIPs吸附AMP达到平衡后,用Nd-Fe-B永磁铁将MMIPs从溶液中分离,弃去上清液,将甲醇和醋酸的混合溶液(9∶1,V/V)作为洗脱剂,用5.0 mL洗脱剂,超声30 min对MMIPs进行洗脱.按照上述方法5次吸附/解吸附循环.图 8为MMIPs对AMP 5次再生的吸附容量.可以看出,经5次再生后的MMIPs在单一AMP溶液以及结构相似抗生素分子的混合溶液中对AMP的吸附容量分别降低了11.11%和14.76%,表明MMIPs具有优良的再生性能.
 |
| 图 8 5次循环后MMIPs的稳定性和再生性能 Fig. 8 Stability and potential regeneration of MMIPs after five cycles |
为了验证MMIPs在实际样品中的应用,将捕获AMP的MMIPs(或MNIPs)用甲醇和醋酸的混合液洗涤,洗涤液的富集溶液在325 nm波长下用HPLC检测
残留的AMP.图 9给出了加标牛奶样品、MNIPs和MMIPs提取样品后溶液的高效液相色谱图.如图 9a所示,加标的牛奶样品中,由于目标分子AMP浓度较低,没有被检测出.但经过MNIPs和MMIPs提取后,如图 9b和9c所示,7.5 min处均有AMP色谱峰,MMIPs检测出的AMP峰值明显高于MNIPs,这要归因于MMIPs对模板分子的特殊识别性.牛奶样品中的AMP可以通过MMIPs富集和回收,本实验中AMP的回收率为92.78%.结果表明,本实验所制备的印迹材料适用于牛奶样品中的AMP微量分析.
 |
| 图 9 定标牛奶样品溶液(a)、用MNIPs提取后的样品溶液(b)、用MMIPs提取后的样品溶液的高效液相色谱图(c) Fig. 9 HPLC-UV chromatograms of AMP obtained from(a)spiked milk samples,(b)extraction with MNIPs and(c)extraction with MMIPs |
以磁性炭微球(MCMs)为基质材料,结合表面印迹技术成功制备了磁性炭微球表面印迹材料(MMIPs).采用吸附实验研究了MMIPs对AMP的识别与选择性吸附性能,结果表明,与其它结构相似抗生素相比,MMIPs对AMP具有较好地亲和力和选择识别性,其吸附性能优于MNIPs,表明MMIPs上有AMP的印迹结合位点.吸附性能研究表明,MMIPs对AMP的吸附行为符合Langmuir 吸附等温模型,在pH=6.0时,最大单分子层吸附容量为40.96 mg·g-1.动力学分析结果表明,MMIPs对AMP吸附过程符合准二级动力学方程,且在60 min可达到吸附平衡,通过外加磁场可以将MMIPs 从溶液中快速分离出来.所制备的MMIPs已成功应用于牛奶样品中痕量AMP的分离、富集和检测.
| [1] | Anbia M, Haqshenas M. 2015.Adsorption studies of Pb(II) and Cu(II) ions on mesoporous carbon nitride functionalized with melamine-based dendrimer amine[J]. Int J Environ Sci Technol, 12 : 2649–2664. |
| [2] | 鲍晓磊, 强志民, 贲伟伟, 等.2013.磁性纳米复合材料 CoFeM48 对水中磺胺类抗生素的吸附去除研究[J].环境科学学报, 33 (2):401–407. |
| [3] | Balamurugan S, Spivak D A. 2011.Molecular imprinting in monolayer surfaces[J]. J Mol Recognit, 24 (6): 915–929. |
| [4] | Chen L X, Xu S F, Li J H. 2011.Recent advances in molecular imprinting technology: current status, challenges and highlighted applications[J]. Chem Soc Rev, 40 (5): 2922–2942. |
| [5] | Chang L M, Wu S, Chen S N, et al. 2011.Preparation of graphene oxide-molecularly imprinted polymer composites via atom transfer radical polymerization[J]. J Mater Sci, 46 (7): 2024–2029. |
| [6] | Dvorakova G, Haschick R, Chiad K, et al. 2010.Molecularly Imprinted Nanospheres by Nonaqueous Emulsion Polymerization[J]. Macromol Rapid Commun, 31 (23): 2035–2040. |
| [7] | Doshi H, Seth C, Ray A, et al. 2008.Bioaccumulation of heavy meals by green algae[J]. Biomedical and Life Sciences, 56 (3): 246–255. |
| [8] | Dai J D, Zhou Z P, Zhao C Y, et al. 2014.Versatile Method To Obtain Homogeneous Imprinted Polymer Thin Film at Surface of Superparamagnetic Nanoparticles for Tetracycline Binding[J]. Ind Eng Chem Res, 53 : 7157–7166. |
| [9] | Feng B, Hong R Y, Wang L S, et al. 2008.Synthesis of Fe3O4/APTES/PEG diacid functionalized magnetic nanoparticles for MR imaging[J]. Colloids Surf A, 328 (1/3): 52–59. |
| [10] | Gaunt J L, Lehmann J. 2008.Enery balance and emissions associated with biochar sequestrations and pyrolysis bioenergy production[J]. Environmental Science and Technology, 42 (11): 4152–4158. |
| [11] | 甘秀梅, 严清, 高旭, 等.2015.典型抗生素在中国西南地区某污水处理厂中的行为和归趋[J].环境科学, 35 (5):1817–1823. |
| [12] | Hou J P, Poole J W. 1971.β-lactam antibiotics: their physicochemical properties and biological activities in relation to structure[J]. Journal of Pharmaceutical Sciences, 60 (4): 503–532. |
| [13] | Hu X G, Pan J L, Hu Y L, et al. 2008.Preparation and evaluation of solid-phase microextraction fiber based on molecularly imprinted polymers for trace analysis of tetracyclines in complicated samples[J]. J Chromatogr A, 1188 (2): 97–107. |
| [14] | 何丽芝, 张小凯, 吴慧明, 等.2015.生物质炭及老化过程对土壤吸附吡虫啉的影响[J].环境科学学报, 35 (2):535–540. |
| [15] | Jones O A, Lester J N, Voulvoulis N. 2005.Pharmaceuticals: a threat to drinking water[J]. Trends in Biotechnology, 23 (4): 163–167. |
| [16] | Kumar R R, Lee J T, Cho J Y. 2012.Fate,occurrence,and toxicity of veterinary antibiotics in environment[J]. Journal of the Korean Society for Applied Biological Chemistry, 55 (6): 701–709. |
| [17] | Li W H, Shi Y L, Gao L H, et al. 2012.Occurrence of antibiotics in water,sediments,aquatic plants,and animals from Baiyangdian Lake in North China[J]. Chemosphere, 89 (11): 1307–1315. |
| [18] | 刘斌, 顾洁, 邱盼, 等.2014.稻壳活性炭对水中染料的吸附特性及其回收利用[J].环境科学学报, 34 (9):2256–2264. |
| [19] | Liu Y S, Liu P, Su Z X, et al. 2008.Attapulgite-Fe3O4 magnetic nanoparticles via co-precipitation technique[J]. Appl Surf Sci, 255 (5): 2020–2025. |
| [20] | Liu Y, Chen R, Yuan D D, et al. 2015.Thermal-responsive ion-imprinted polymer based on magnetic mesoporous silica SBA-15 for selective removal of Sr(II) from aqueous solution[J]. Colloid Polym Sci, 293 : 109–123. |
| [21] | Liu Y, Liu Y F, Zhang J H, et al. 2015.Adsorption behaviors for oleuropein from olive leaves extracts by porous materials with carbon nanotubes[J]. Colloid Polym Sci, 293 : 2395–2404. |
| [22] | Li X X, Pan J M, Dai J D, et al. 2012a.Surface molecular imprinting onto magnetic yeast composites via atom transfer radical polymerization for selective recognition of cefalexin[J]. Chemical Engineering Journal, 198 : . |
| [23] | Li X X, Pan J M, Dai J D, et al. 2012b.Removal of cefalexin using yeast surface-imprinted polymer prepared by atom transfer radical polymerization[J]. Journal of Separation Science, 35 (20): 2787–2795. |
| [24] | Li Y, Li X, Li Y Q, et al. 2009.Selective removal of 2,4-dichlorophenol from contaminated water using non-covalent imprinted microspheres[J]. Environ Pollut, 157 (6): 1879–1885. |
| [25] | Manu J, Mahitha K, Remya K, et al. 2015.Methylene blue adsorption from aqueous solutions using undoped and silver-doped nanotubes of anatase-titania synthesized via modified hydrothermal method[J]. J Sol-Gel Sci Technol, 75 : 541–550. |
| [26] | Pan J M, Hang H, Li X, et al. 2013.Fabrication and evaluation of temperature responsive molecularly imprinted sorbents based on surface of yeast via surface-initiated AGET ATRP[J]. Appl Surf Sci, 287 (15): 211–217. |
| [27] | Ren Y M, Ma W Q, Ma J, et al. 2012.Synthesis and properties of bisphenol A molecular imprinted particle for selective recognition of BPA from water[J]. J Colloid Interf Sci, 367 (1): 355–361. |
| [28] | Sarmah A K, Meyer M T, Boxall A B A. 2006.A global perspective on the use, sales exposure pathways, occurrence,fate and effects of veterinary antibiotics(Vas) in the environment[J]. Chemosphere, 65 (5): 725–759. |
| [29] | Serrano-Gómez J, Olguín M T. 2015.Separation of Cr(VI) from aqueous solutions by adsorption on the microfungus Ustilago maydis[J]. Int J Environ Sci Technol, 12 : 2559–2566. |
| [30] | 王雪, 张頔, 代莹, 等.2014.磁性分子印迹材料对双酚 A 的识别与选择性吸附[J].环境科学学报, 34 (3):658–663. |
| [31] | Wang X, Wang L Y, He X W, et al. 2009.A molecularly imprinted polymer-coated nanocomposite of magnetic nanoparticles for estrone recognition[J]. Talanta, 78 (2): 327–332. |
| [32] | Yuan L H, Ma J, Ding M J, et al. 2012.Preparation of estriol-molecularly imprinted silica nanoparticles for determining oestrogens in milk tablets[J]. Food Chem, 131 (3): 1063–1068. |
| [33] | Yoshimatsu K, Reimhult K, Krozer A, et al. 2007.Uniform molecularly imprinted microspheres and nanoparticles prepared by precipitation polymerization: The control of particle size suitable for different analytical applications[J]. Anal Chim Acta, 584 (1): 112–121. |
| [34] | Zhang X P, Chen L G, Xu Y, et al. 2010.Determination of β-lactam antibiotics in milk based on magnetic molecularly imprinted polymer extraction coupled with liquid chromatography-tandem mass spectrometry[J]. J Chromatogr B, 878 (32): 3421–3426. |
| [35] | Zhu H Y, Jiang R, Xiao L, et al. 2010.A novel magnetically separable γ-Fe2O3/crosslinked chitosan adsorbent: preparation, characterization and adsorption application for removal of hazardous azo dye[J]. J Hazard Mater, 179 (1/3): 251–257. |
| [36] | Zou X H, Pan J M, Ou H X, et al. 2011.Adsorptive removal of Cr(III) and Fe(III) from aqueous solution by chitosan/attapulgite composites: Equilibrium, thermodynamics and kinetics[J]. Chem Eng J, 167 (1): 112–121. |
| [37] | Zhou Q, Duan Y F, Zhu C, et al. 2015.Adsorption equilibrium, kinetics and mechanism studies of mercury on coal-fired fly ash[J]. Korean J Chem Eng, 32 (7): 1405–1413. |
| [38] | 朱淮武. 2005. 有机分子结构波谱解析[M]. 北京: 化学工业出版社: 29 -75. |
 2016, Vol. 36
2016, Vol. 36


