微生物燃料电池(Microbial Fuel Cell,MFC)是一种利用微生物作为催化剂,将有机物质中的化学能转换为电能的装置(Rabaey et al.,2005).MFC作为一种新型的污水处理及污水生物修复技术,具有同时去除有机污染物并获得能源输出的优点(Cheng et al.,2014;Zhao et al.,2009;尤世界,2008),这种具有成本效益的水处理技术成为废水处理及新能源开发领域的研究热点(Aelterman et al.,2006;Yamashita et al.,2015).
在微生物燃料电池中,电化学活性细菌在阳极室内消耗有机质,获得维持微生物生长所需能量并产生电子传递至阳极电极,电子从阳极电极经由外电路到达阴极,在阴极室内,电子受体消耗电子完成整个电能输出过程(Logan et al.,2006a).双室MFC包括阳极室与阴极室,影响阳极室内微生物产电的因素包括电极材料、pH、基质浓度、电极间距、溶液内不同离子等(Lee et al.,2009;詹亚力等,2008;叶晔捷等,2009).近年来,由于化肥流失和工业排放等原因,水体中的硝酸盐污染成为较严重的环境问题(华迪等,2014),许多研究者尝试采用MFC处理含硝酸盐废水,并取得了较好的污染物去除及产电效果(Shen et al.,2009),但关于硝酸盐浓度对MFC阳极性能影响的系统研究较少.相关研究发现,当阳极室内存在硝酸盐,电池的输出功率会受到一定影响(Yi et al.,2009;张吉强等,2014),但关于硝酸盐浓度对于阳极生物膜产电性能的影响机理尚不明确.
因此,本文以双室MFC阳极室为研究对象,探究不同硝酸盐浓度对MFC产电性能及污染物去除的影响机理,并探讨不同硝酸盐浓度对系统内阻的影响,为将MFC应用于处理含硝酸盐废水的工艺设计和优化提供理论依据.
2 材料与方法(Materials and methods) 2.1 双室MFC的搭建本实验共平行启动7个双室MFC反应器,两极室由立方体形有机玻璃容器构成,每个极室的有效容积为0.41 L,阳极室为密封厌氧,阴阳极室由Nafion 117型质子交换膜分隔开.两极室的电极材料均为碳毡(甘肃郝氏),有效面积均为40 cm2.碳毡使用前经马弗炉(320 ℃)加热30 min以增加其亲水性.阳极与阴极之间采用钛导线连接构成回路,外接电阻为1000 Ω,阳极室中放置饱和甘汞电极(SCE)用以测定电极电势,实验启动及运行阶段均采用间歇流方式,反应温度保持在(20±3)℃.
2.2 反应器的接种及培养液成分实验采用的接种液取自实验室长期稳定运行的微生物燃料电池,经驯化培养达到稳定后进行实验.阳极室进水为模拟废水,其组成为:CH3COONa 1.64 g·L-1、K2HPO4·3H2O 18.3 g·L-1、KH2PO4 2.69 g·L-1、NH4Cl 0.1 g·L-1、NaCl 0.5 g·L-1、MgSO4·7H2O 0.1 g·L-1、CaCl2·2H2O 0.015 g·L-1、微量元素液1 ml·L-1(Virdis et al.,2012).微量元素液根据文献(Lu et al.,2006)配制,硝酸盐质量浓度根据实验要求配加.阴极溶液为50 mmol·L-1铁氰化钾溶液,其组成为:K3[Fe(CN)6] 16.46 g·L-1、K2HPO4·3H2O 18.3 g·L-1、KH2PO4 2.69 g·L-1.两极室反应环境维持pH=7.4.
2.3 分析与测试COD、硝态氮、亚硝态氮均参照国家环境保护局发布的标准方法(国家环境保护总局,2002)进行测定,数据结果测量3次取平均值.
采用数据采集系统(Keithley 2700)监测输出电压,采用库仑效率(Coulombic Efficiency,CE)衡量阳极的电子回收效率(Logan et al.,2006b),按照公式(1)进行计算.
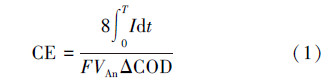
式中,T为一个周期的时间(s),I为电流大小(A),F为法拉第常数(96485 C·mol-1),VAn为阳极室液体体积(L),ΔCOD为周期T内COD的变化值(g·L-1).
采用电化学工作站(CHI660E)进行电化学交流阻抗(Electrochemical Impedance Spectroscopy,EIS)的测试,来表征MFC内阻,并利用Zview软件进行等效电路的拟合.MFC的内阻分为欧姆内阻、传荷内阻和扩散内阻(He et al.,2009),欧姆内阻由质子交换膜、电极材料和溶液等造成,扩散内阻由物质向电极表面迁移引起的传质损失造成(Borole et al.,2010).传荷内阻则主要表示电极反应中氧化还原反应的发生及电子传递造成的活化损失.
阳极生物DNA的提取使用Norcross公司的Omega Bio-tek试剂盒,并参照说明书进行操作,微生物群落组成分析采用基于Illumina公司MiSeq平台的高通量测序技术进行(委托上海美吉生物医药科技有限公司完成),测序流程及数据分析参考文献(Amato et al.,2013).
3 结果与讨论(Results and discussion) 3.1 反应器的启动接种液进入阳极室后,微生物燃料电池的启动期主要经历了3个阶段:延滞期、上升期和稳定期(尤世界,2008).图 1为R1反应器启动期输出电压及阳极电位变化情况,7个平行反应器启动时间及稳定电压情况如表 1所示.由图 1可知,在阴极电位基本保持不变的情况下,电池的输出电压由阳极电位变化决定,即MFC系统的输出电压主要由阳极电势控制,阳极电势的变化表征了微生物的活性变化,同时影响电能输出,可见阳极反应是MFC产电的关键因素之一(Aelterman et al.,2008).由表 1可知,当启动稳定后,7个反应器运行状况基本平行,同时将阳极溶液替换为不同硝酸盐浓度的营养液进行相关实验.
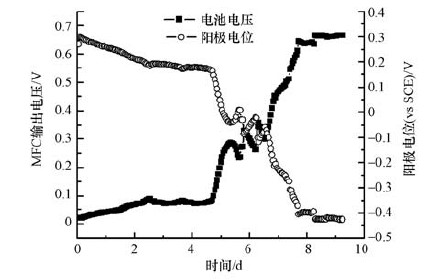 |
| 图 1 微生物燃料电池R1启动期输出电压及阳极电位情况 Fig. 1 Output voltage and anode potential of MFC R1 during start-up period |
| 表 1 微生物燃料电池R1~R7反应器启动期电化学性能 Table 1 Electrochemical properties of MFC R1~R7 during start-up period |
当7个平行反应器运行稳定后,将阳极营养液的初始硝酸盐浓度控制为0、50、100、250、300、500及1000 mg·L-1,图 2为阳极室内加入不同浓度硝酸盐后电压的变化情况.由图 2可知,加入硝酸盐后,输出电压具有明显的下降趋势,这是由于有机物降解产生的电子还未传至阳极电极表面,便被反硝化过程所消耗,使得电流密度降低.由图 2还可知,当初始硝酸盐浓度为0~250 mg·L-1时,系统输出电压经下降后均迅速回升至初始电压水平,呈现“降低-升高-平稳-再降低”的四阶段特性,表明随着反硝化过程的进行,硝酸盐浓度降低,阳极生物产生的电子大部分又再次传递至阴极,系统恢复正常产电,而后随着阳极溶液的有机物消耗殆尽,电池输出电压下降,周期内最大输出功率均可达到120 mW·m-2左右.而张吉强等(2014)构建的反硝化微生物燃料电池在甲醇与硝酸盐共基质作用下呈现“电压初降-电压上升-电压再降”三阶段特性,其电压回升后未经平稳段就逐步降低,其推测“再降”段电压是由于反硝化细菌内碳源分解及微生物细胞水解所致.
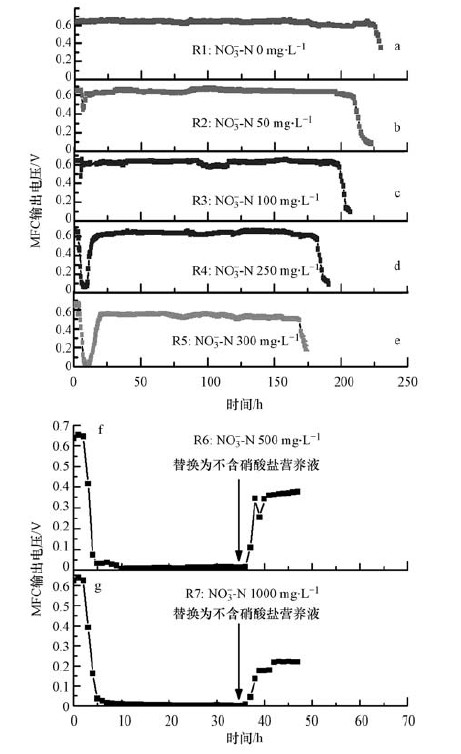 |
| 图 2 不同阳极初始硝酸盐浓度下的MFC输出电压 Fig. 2 Output voltage of MFC with different initial nitrate concentrations |
当硝酸盐浓度升至300 mg·L-1时,如图 2e所示,其经历电压下降段后,电压升高后的平稳电压在500 mV左右波动,无法达到初始电压输出水平,说明产电生物活性下降;而当初始硝酸盐浓度升至500 mg·L-1(图 2f)及1000 mg·L-1(图 2g)时,MFC输出电压均立即出现大幅下降,直至失去电压输出能力,且超过30 h未见电压回升,说明在高浓度的硝酸盐溶液中,产电生物活性受到了极大的抑制.Gorby等(2006)也研究发现,电子受体的存在会抑制纳米导线的产生,从而影响电子传递.此外,为了确定高浓度硝酸盐对产电生物的抑制影响是否可逆,在阳极溶液投加高浓度硝酸盐35 h后,将阳极溶液更换为不含硝酸盐的营养液,由图 2f、图 2g可知,当更换营养液后,初始硝酸盐浓度为500和1000 mg·L-1的MFC输出电压仅可回升至0.4 V和0.2 V附近,且连续运行3个周期后,最大输出电压仍然维持在0.4 V及0.2V左右.说明当阳极初始硝酸盐浓度过高时,即使后续运行中解除了抑制条件,产电微生物仍然无法完全恢复产电能力,推测是由于高浓度的硝酸盐对阳极微生物的产电活性造成抑制,破坏了电子产生和传递过程,且该抑制对产电活性的影响不可逆.
3.3 不同阳极初始硝酸盐浓度下MFC的污染物去除及库仑效率分析表 2为不同阳极初始硝酸盐浓度下MFC的污染物降解情况及库仑效率.当进水COD在1000 mg·L-1左右时,各初始硝酸盐浓度下系统均具有较好的COD去除效果,COD去除率基本都能达到95%左右,最大去除负荷可达到1.392 kg·m-3·d-1,与相关文献(Jang et al.,2004;Liu et al.,2004)的去除负荷(0.02~0.97 kg·m-3·d-1)相比,本MFC系统的阳极室具有较好的COD去除效果.
| 表 2 不同阳极初始硝酸盐浓度下MFC的库仑效率及污染物去除情况 Table 2 Coulombic efficiency and pollutants removal with different initial nitrate concentrations |
随着进水中硝酸盐浓度的升高,传质强度增大,硝酸盐的降解速率也随之增大,但当硝酸盐浓度高于250 mg·L-1时,硝酸盐降解速率产生下降趋势.推测是由于该浓度超过阳极生物承受能力,且本实验采用COD为1000 mg·L-1的配水,当硝酸盐浓度过高时,不足以为反硝化过程提供充足的碳源,菌体的生长就受到抑制.当阳极初始硝酸盐浓度为0~250 mg·L-1时,MFC系统的稳定输出电压未受到较大的影响,且系统的硝酸盐去除率能达到99%以上;当初始硝酸盐浓度达到300 mg·L-1时,虽然系统的稳定产电能力下降,但仍具有较好的脱氮性能,硝酸盐去除率也在99%以上,推测是由于此时作为优势菌种的Pseudomonas sp.C27产电能力受到抑制,其主要表现出反硝化性能.
传统反硝化反应器的容积负荷为0.1~0.5 kg·m-3·d-1(李金涛等,2012),阴极脱氮MFC的硝酸盐去除负荷为0.07~0.18 kg·m-3·d-1(温青等,2008;杨金萍,2012),而本实验系统最大硝酸盐去除负荷可达到0.155 kg·m-3·d-1(以N计),说明本系统具有较好的脱氮性能.
由表 2可得,不同初始硝酸盐浓度下电压下降段的库仑效率远低于全周期库仑效率,库仑效率下降90%以上,这是由于反硝化作用消耗电子,导致进入外电路循环的电子减少,造成系统库仑效率的下降,且随着进水中硝酸盐初始浓度的升高,总库仑效率具有下降趋势.
3.4 阳极生物膜电化学阻抗分析为探究不同硝酸盐浓度下MFC系统内阻的组成及变化,在阳极室添加硝酸盐后输出电压下降达到最低点时,对其进行电化学阻抗谱(EIS)测试.在复阻抗平面上,将测得阻抗的实部(Z′)作为横坐标,虚部绝对值(-Z″)作为纵坐标,绘制Nyquist图.在不同硝酸盐浓度下MFC的EIS测试结果如图 3所示.
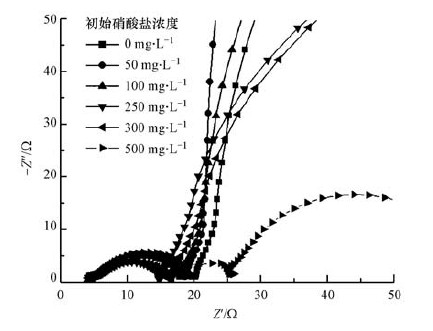 |
| 图 3 不同阳极初始硝酸盐浓度下微生物燃料电池的Nyquist图 Fig. 3 Nyquist plot of MFC with different initial nitrate concentrations |
将交流阻抗图用Zview软件进行模拟,等效电路如图 4所示.电极和溶液之间的双电层一般用等效电容来表示,实际中由于碳毡本身材料具有不平整性且附着有生物膜,会产生“弥散效应”,所以用恒相位角元件CPE来表示双电层阻抗;Rs为欧姆内阻;Rct为传荷内阻,反映了活化过程的特征;W为扩散阻抗(Warbug阻抗),反映了传质过程的特征(史海凤,2012).以阳极初始硝酸盐浓度为300 mg·L-1时的EIS数据进行等效电路模拟举例(图 5),可发现拟合值与实测值具有较好的重合性,其余各浓度下均具有较好的拟合效果.
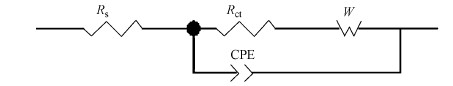 |
| 图 4 不同阳极初始硝酸盐浓度MFC等效电路 Fig. 4 Equivalent circuit of MFC with different initial nitrate concentrations |
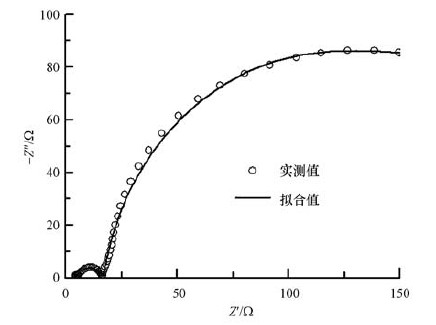 |
| 图 5 阳极初始硝酸盐浓度为300 mg·L-1时的等效电路拟合 Fig. 5 The fitting result of MFC Nyquist plot when the nitrate concentration is 300 mg·L-1 |
表 3为不同硝酸盐浓度下通过拟合等效电路所得的MFC阻抗值.由表 3可得,当硝酸盐浓度为0、50、100、250 mg·L-1时,传荷阻抗占该等效电路总电阻值的绝对份额分别为78.7%、76.8%、77.3%、72.8%,表明阳极生物膜发生的电化学反应是传荷控制过程.进一步分析系统各阻抗值的变化趋势可知,硝酸盐浓度为50、100、250 mg·L-1时的传荷内阻比不加硝酸盐时MFC的传荷内阻分别降低了6.7%、11.0%、31.3%,表明当硝酸盐的浓度低于250 mg·L-1时,随着硝酸盐浓度的升高,系统传荷内阻减小,微生物发生催化反应需要克服的活化能垒降低.这可能是因为阳极室内优势菌为Pseudomonas sp.C27,其具有反硝化及产电功能,硝酸盐的加入促进了该细菌的生长,更多的有机物质被该类细菌利用,细菌活性增强,从而提升了其电子传递效率.Dunaj等(2012)的研究也表明,MFC的产电菌种在长期的驯化刺激下,适应该环境的微生物会大量富集,进而影响系统产电及污染物降解性能.同时,本文也对不同硝酸盐浓度下的阳极液进行了电导率测定,测定结果如表 4所示,结果显示,硝酸盐的加入会提高阳极液的电导率,这在一定程度上也会对系统的产电具有促进作用.而当硝酸盐浓度大于250 mg·L-1时,系统传荷内阻具有增大趋势,此时阳极液的电导率值与250 mg·L-1硝酸盐浓度下的电导率值相差不大,造成系统传荷内阻增大的原因很可能是此时大部分电子被反硝化作用消耗,产电菌活动受到抑制;且由表 2可知,此时硝酸盐降解速率产生下降趋势,说明过高的硝酸盐浓度抑制微生物活性.而当硝酸盐浓度上升至500 mg·L-1时,Nyquist图低频段紊乱,表明电池内部受到破坏,且该浓度下输出电压大幅下降,后续运行中电压均未回升,表明微生物生长受到极大的抑制,已经无法构成有效的电路,造成EIS测试结果异常.
| 表 3 不同阳极初始硝酸盐浓度下MFC阻抗拟合数据 Table 3 Simulated impedance datas in MFCs with different initial nitrate concentrations |
| 表 4 不同硝酸盐浓度下阳极液的电导率 Table 4 Anolyte conductivity with different nitrate concentrations |
由此可见,当阳极初始硝酸盐浓度小于250 mg·L-1时,硝酸盐的加入有助于降低MFC的传荷内阻,提升电子的传递效率;而当硝酸盐浓度大于250 mg·L-1时,硝酸盐浓度的上升会造成传荷内阻的不断增加.因此,在MFC的实际应用中,需注意控制硝酸盐浓度的影响,可考虑结合其它的水处理工艺控制进水的硝酸盐浓度,以达到较高的污染物去除效率及能源回收效率.
3.5 阳极微生物群落结构分析阳极微生物在电子向电极的传递及污染物降解转化的过程中起着至关重要的作用,对不加硝酸盐的阳极生物膜和加入硝酸盐浓度为250 mg·L-1的阳极生物膜取样,对样品进行Illumina MiSeq测序分析,相关结果如图 6所示,其中,不加硝酸盐表示进水中无硝酸盐,加硝酸盐表示进水硝酸盐浓度为250 mg·L-1.
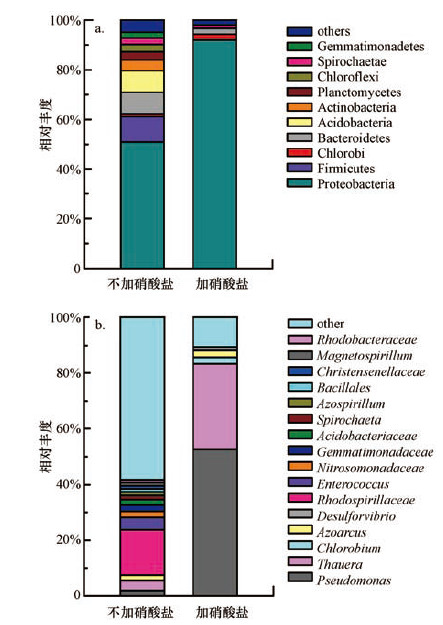 |
| 图 6 进水有无硝酸盐对阳极生物膜群落结构组成的影响(a.门水平 b.属水平) Fig. 6 Influence of nitrate in anolyte on community structure of anodic biofilm(a.phylum level;b.genus level) |
在系统中,变形菌门(Proteobacteria)为绝对的优势菌种,在不加硝酸盐时(50.6%)和加入硝酸盐后(91.9%)所占比例均非常高.而在属的水平上进行分析,在不加硝酸盐时,MFC阳极菌种虽然菌种丰富,但丰度普遍不高,而加入硝酸盐并运行一段时间后,假单胞菌(Pseudomonas)和陶厄氏菌(Thauera)富集成为MFC阳极的优势菌种,所占比例分别为52.48%和30.9%.假单胞菌属γ-变形菌纲下的异养菌,以有机物为氮源和能源,进行无氧呼吸.本体系具体检测到的菌种为Pseudomonas sp. C27(相似度99%);Lee等(2009)曾用该纯菌种成功启动MFC,并证明该菌种具备产电及反硝化性能.陶厄氏菌属是β-变形菌纲下的一类革兰氏阴性细菌,大都为杆状且具有反硝化能力.Morgan等(2008)报道了陶厄氏菌在活性污泥反硝化过程中起着非常重要的作用,其具有较高的反硝化活性.
由加入硝酸盐前后阳极菌群结构变化可知,在加入硝酸盐并运行一段时间后,系统阳极微生物多样性降低,产电及反硝化菌群所占比例优势非常明显,可见MFC在长期含硝酸盐条件运行下对微生物种类起了显著的选择作用.Rabaey等(2004)研究也发现,当系统产电性能等发生变化时,适应该环境的菌种会成为优势菌种并得到富集,造成系统生物多样性降低.
4 结论(Conclusions)1)采用双室MFC阳极室处理含硝酸盐废水,初始COD在1000 mg·L-1左右,当初始硝酸盐浓度在0~250 mg·L-1时,对系统稳定阶段输出电压影响较小,系统最大输出功率密度可达到120 mW·m-2左右.
2)由于含硝酸盐废水中有机物降解产生的部分电子用于反硝化,造成了MFC库仑效率的降低,当初始硝酸盐浓度由250 mg·L-1增加到300 mg·L-1时,微生物燃料电池库仑效率由9.3%下降至4.5%.
3)当阳极初始硝酸盐浓度为0~250 mg·L-1时,系统传荷内阻随着硝酸盐浓度的上升而降低,MFC系统的产电性能均可恢复;但当初始硝酸盐浓度大于300 mg·L-1时,会对MFC阳极产电生物造成不可逆的抑制,系统产电能力会大幅度下降且无法恢复至未受抑制阶段.
| [1] | Aelterman P, Freguia S, Keller J, et al.2008.The anode potential regulates bacterial activity in microbial fuel cells[J].Applied Microbiology and Biotechnology, 78(3):409-418 |
| [2] | Aelterman P, Rabaey K, Clauwaert P, et al.2006.Microbial fuel cells for wastewater treatment[J].Water Science & Technology, 54(8):9-15 |
| [3] | Amato K R, Yeoman C J, Kent A, et al.2013.Habitat degradation impacts black howler monkey (Alouatta pigra) gastrointestinal microbiomes[J].ISME J, 7(7):1344-1353 |
| [4] | Borole A P, Aaron D, Hamilton C Y, et al.2010.Understanding long-term changes in microbial fuel cell performance using electrochemical impedance spectroscopy[J].Environ Sci Technol, 44(7):2740-2745 |
| [5] | Cheng S, Liu W, Guo J, et al.2014.Effects of hydraulic pressure on the performance of single chamber air-cathode microbial fuel cells[J].Biosensors and Bioelectronics, 56:264-270 |
| [6] | Dunaj S J, Vallino J J, Hines M E, et al.2012.Relationships between soil organic matter, nutrients, bacterial community structure, and the performance of microbial fuel cells[J].Environ Sci Technol, 46(3):1914-1922 |
| [7] | Gorby Y A, Yanina S, Mclean J S, et al.2006.Electrically conductive bacterial nanowires produced by Shewanella oneidensis strain MR-1 and other microorganisms[J].Proc Natl Acad Sci USA, 103(30):11358-11363 |
| [8] | 国家环境保护总局.2002.水和废水监测分析方法(第4版)[M].北京:中国环境科学出版社.63-64 |
| [9] | He Z, Mansfeld F.2009.Exploring the use of electrochemical impedance spectroscopy (EIS) in microbial fuel cell studies[J].Energy & Environmental Science, 2(2):215-219 |
| [10] | 华迪, 崔康平, 赵莉丽.2014.微生物燃料电池原位修复地下水硝酸盐污染[J].广东化工, 41(1):93-94 |
| [11] | Jang J K, Pham T H, Chang I S, et al.2004.Construction and operation of a novel mediator-and membrane-less microbial fuel cell[J].Process Biochemistry, 39(8):1007-1012 |
| [12] | Lee C, Ho K, Lee D, et al.2012.Electricity harvest from nitrate/sulfide-containing wastewaters using microbial fuel cell with autotrophic denitrifier, Pseudomonassp.C27[J].International Journal of Hydrogen Energy, 37(20):15827-15832 |
| [13] | Lee H, Torres C I, Rittmann B E.2009.Effects of substrate diffusion and anode potential on kinetic parameters for anode-respiring bacteria[J].Environmental Science & Technology, 43(19):7571-7577 |
| [14] | 李金涛, 张少辉.2012.反硝化微生物燃料电池的基础研究[J].中国环境科学, 32(4):617-622 |
| [15] | Liu H, Ramnarayanan R, Logan B E.2004.Production of electricity during wastewater treatment using a single chamber microbial fuel cell[J].Environmental Science & Technology, 38(7):2281-2285 |
| [16] | Logan B E, Hamelers B, Rozendal R, et al.2006a.Microbial fuel cells:methodology and technology[J].Environmental Science & Technology, 40(17):5181-5192 |
| [17] | Logan B E, Hamelers B, Rozendal R, et al.2006b.Microbial fuel cells:methodology and technology[J].Environmental Science & Technology, 40(17):5181-5192 |
| [18] | Lu H, Oehmen A, Virdis B, et al.2006.Obtaining highly enriched cultures of Candidatus Accumulibacter phosphates through alternating carbon sources[J].Water Res, 40(20):3838-3848 |
| [19] | Morgan-Sagastume F, Nielsen J L, Nielsen P H.2008.Substrate-dependent denitrification of abundant probe-defined denitrifying bacteria in activated sludge[J].FEMS Microbiology Ecology, 66(2):447-461 |
| [20] | Rabaey K, Boon N, Siciliano S D, et al.2004.Biofuel cells select for microbial consortia that self-mediate electron transfer[J].Applied and Environmental Microbiology, 70(9):5373-5382. |
| [21] | Rabaey K, Verstraete W.2005.Microbial fuel cells:novel biotechnology for energy generation[J].Trends in Biotechnology, 23(6):291-298 |
| [22] | Shen J, He R, Han W, et al.2009.Biological denitrification of high-nitrate wastewater in a modified anoxic/oxic-membrane bioreactor (A/O-MBR)[J].Journal of Hazardous Materials, 172(2/3):595-600 |
| [23] | 史海凤.2012.微生物燃料电池的阻抗特性以及在生物阴极实现硝化的研究[D].上海:华东理工大学.58 |
| [24] | Virdis B, Harnisch F, Batstone D J, et al.2012.Non-invasive characterization of electrochemically active microbial biofilms using confocal Raman microscopy[J].Energy & Environmental Science, 5(5):7017 |
| [25] | 温青, 刘智敏, 陈野, 等.2008.空气阴极生物燃料电池电化学性能[J].物理化学学报, 24(6):1063-1067 |
| [26] | Yamashita T, Ishida M, Ogino A, et al.2015.Evaluation of organic matter removal and electricity generation by using integrated microbial fuel cells for wastewater treatment[J].Environmental Technology, 37(2):1-9 |
| [27] | 杨金萍.2012.微生物燃料电池去除硝酸盐及电子传递机理研究[D].合肥:合肥工业大学.61 |
| [28] | 叶晔捷, 宋天顺, 徐源, 等.2009.微生物燃料电池产电的影响因素[J].过程工程学报, 9(3):526-530 |
| [29] | Yi T, Harper W F.2009.The effect of nitrate and sulfate on mediator-less microbial fuel cells with high internal resistance[J].Water Environment Research, 81(11):2320-2328 |
| [30] | 尤世界.2008.微生物燃料电池处理有机废水过程中的产电特性研究[D].哈尔滨:哈尔滨工业大学.154 |
| [31] | 詹亚力, 王琴, 张佩佩, 等.2008.微生物燃料电池影响因素及作用机理探讨[J].高等学校化学学报, 29(1):144-148 |
| [32] | 张吉强, 郑平, 何崭飞, 等.2014.废水中硝氮和COD浓度对AD-MFC脱氮产电性能的影响[J].环境工程学报, 8(10):4508-4514 |
| [33] | Zhao F, Slade R C T, Varcoe J R.2009.Techniques for the study and development of microbial fuel cells:an electrochemical perspective[J].Chemical Society Reviews, 38(7):1926 |
 2016, Vol. 36
2016, Vol. 36


