2. 中国海洋大学环境科学与工程学院, 青岛 266100;
3. 烟台市环境监测中心站, 烟台 264000
2. College of Environment Science and Engineering, Ocean University of China, Qingdao 266100;
3. Environmental Monitoring Center of Yantai, Yantai 264000
食品加工、皮革制造及石油等行业的快速发展造成含盐有机废水排放量日益增加,这类废水除具有高盐度外,通常还含有较高浓度的有机物,因此,采用厌氧生物处理技术处理此类含盐有机废水更具实用性.升流式厌氧污泥流化床(UASB)(Li et al., 2013)、厌氧序批式生物膜反应器(ASBBR)(He et al., 2012)和膨胀颗粒污泥床(EGSB)(Liao et al., 2015)等厌氧生物处理技术已经被证明可以有效地处理含盐有机废水.
胞外聚合物(EPS)是微生物通过新陈代谢作用和细胞自溶形成的附着于细胞壁外的大分子粘性有机多聚物,其在细胞壁表面呈流变性双层结构,内层为紧密结合型EPS(TB-EPS),与细胞壁结合较紧密,具有一定外形,相对稳定地附着于细胞壁外;外层为松散结合型EPS(LB-EPS),可向周围环境扩散,为无明显边缘的粘液层.EPS主要由蛋白(PN)和多糖(PS)组成,并含有少量的腐殖酸、核酸等(Sheng et al., 2006).EPS的这种组成有利于微生物细胞间的粘附和聚集,并影响污泥絮体的理化性质,如沉降性(Basuvaraj et al., 2015)、絮凝性(Wang et al., 2014)、脱水性(Wong et al., 2015)、表面带电性(Zhu et al., 2015)等.因此,研究胞外聚合物在废水生物处理系统中的作用对于维持工艺的稳定运行十分必要.
EPS含量和组成的变化与废水中营养物质浓度(Ye et al., 2011)、基质种类(李冬等,2015)、溶解氧含量(曹秀芹等,2010)、重金属离子等有毒有害物质浓度(Wang et al., 2014)及盐度(Wang et al., 2015)等有关.近年来,废水中盐度的变化对污泥EPS含量和组成的影响已经引起学者广泛关注.Abbasi等(2008) 发现,进水盐度的增加能刺激微生物分泌更多的胞外多糖以降低渗透压的升高对细胞的破坏.Ismail等(2010) 发现,厌氧污泥EPS中PN含量在进水Na+浓度为10 g · L-1和20 g · L-1时没有显著不同,而Na+浓度为10 g · L-1时,EPS中PS含量更高.Wang等(2014) 研究了盐度变化对好氧颗粒污泥EPS的影响,发现进水盐度由0逐渐增加至8%会导致好氧污泥LB-EPS和TB-EPS中PN和PS含量增加,PN/PS比降低,LB-EPS和TB-EPS含量与颗粒污泥容积指数(SVI)正相关.人们对进水中盐度的变化对厌氧和好氧污泥EPS含量和组成的影响已经做了大量研究,然而,关于盐度的增加对厌氧污泥LB-EPS和TB-EPS含量与组成的影响报道较少,并且不同盐度下厌氧污泥的理化性质与胞外聚合物间关系的研究未见报道.
针对上述问题,本文拟研究UASB厌氧污泥LB-EPS和TB-EPS中PN和PS含量随着进水盐度增加的变化规律,并利用三维荧光(3D-EEM)和傅里叶变换红外(FTIR)技术分析不同盐度下LB-EPS和TB-EPS的组成和结构,讨论LB-EPS和TB-EPS中PN和PS组成和含量的变化与污泥沉降性间的关系,以期为含盐有机废水厌氧处理的研究提供有益借鉴.
2 材料与方法(Materials and methods) 2.1 试验装置UASB反应器如图 1所示,反应器由有机玻璃柱制成,反应器主体分为上、下两部分,上部为沉淀区,下部为反应区,反应区内径8 cm,高80 cm,有效容积4 L,沉淀区内径15 cm,有效高度15 cm,有效容积2 L,反应器总高100 cm,总有效容积6 L.采用蠕动泵向UASB反应器进水,流量为0.42 L · h-1,水力停留时间为24 h,反应器外设有循环泵以使废水和污泥充分接触.UASB反应器在常温下运行.
 |
| 图 1 UASB反应器示意图 Fig. 1 Schematic diagram of UASB |
模拟含盐有机废水主要成分如下(mg · L-1):葡萄糖1536,NaNO3 364,KH2PO4 79,盐度和微量元素由海水晶提供.盐度为 3%(每升含30 g 海水晶)条件下,海水晶成分如下(mg · L-1):Na+ 9880,Mg2+ 950,Cl- 18025,SO42- 2500,K+ 360,Ca2+ 300,Zn2+ 0.015,Mn2+ 0.013,Fe2+ 0.13,Co2+ 3×10-4,Mo6+ 3×10-3,Sr+ 7.5×10-3,I- 0.07,Se6+ 3.5×10-4,Cu2+ 0.05,活性磷酸盐 0.045,亚硝酸盐 0.01,硝酸盐 0.3.进水 pH 控制在 7.5 左右.青岛市李村河污水处理厂消化污泥作为UASB反应器接种污泥,污泥浓度(MLSS)为4.23 g · L-1.
2.3 分析方法 2.3.1 胞外聚合物提取和测定依据Li等(2007) 的方法适当修改后提取LB-EPS和TB-EPS.取反应器中污泥样品40 mL,在6000 r · min-1下离心5 min,弃去上清夜,得到浓缩的污泥;用预热到70 ℃的NaCl溶液(与污泥样品具有相同盐度)稀释至40 mL,盖紧盖子并快速振荡1 min;将提取后的混合液于6000 r · min-1离心10 min,收集上清液,即为LB-EPS.用NaCl溶液(与污泥样品具有相同盐度)稀释至40 mL,60 ℃水浴30 min后再在6000 r · min-1下离心15 min,收集上清液,即为TB-EPS.
上清液经过0.45 μm醋酸纤维素膜过滤后分析LB-EPS和TB-EPS中PN和PS含量.PN含量采用Folin酚法测定(Lowry et al., 1951),PS含量采用蒽酮比色法测定(Dubois et al., 1956).以LB-EPS(或TB-EPS)中PN和PS含量之和表示LB-EPS(或TB-EPS)总量.
2.3.2 三维荧光光谱分析采用荧光分光光度计(F-4600,Hitachi,日本)测定LB-EPS和TB-EPS三维荧光光谱.激发波长(λEx)范围为200~400 nm,扫描间隔5 nm;发射波长(λEm)范围为200~500 nm,扫描间隔5 nm;激发光和发射光的狭缝均为10 nm,扫描速度为1200 nm · min-1.采用Origin 8.1软件绘制光谱图.
2.3.3 傅里叶变换红外光谱分析采用傅里叶变换红外光谱仪(Tensor 27,Bruker Optics,德国)测定LB-EPS和TB-EPS红外光谱.LB-EPS和TB-EPS提取液经过冷冻干燥处理后与光谱纯KBr按照1 ∶ 100质量比研磨混合,并于一定压力下保持若干分钟制成半透明薄片,在400~4000 cm-1波数范围内扫描,检测器分辨率为4 cm-1.
2.3.4 常规分析测定方法COD、NO3--N、NO2--N、MLSS、MLVSS及SVI均采用国家规定的标准方法测定(国家环保总局水和废水监测分析方法编委会编委会,2002),pH采用便携式pH仪测定.
3 结果与分析(Results and discussion) 3.1 盐度变化对UASB反应器反硝化性能的影响不同盐度下进出水中COD、NO3--N和NO2--N的变化如图 2所示.废水中盐度的增加会使细胞外渗透压升高,这可能会引起细胞的质壁分离、脱水和活性的降低,甚至是解体死亡.每次增加进水中盐度的初期,由于反硝化菌受到渗透压升高的冲击作用,细胞的代谢活性受到抑制,导致出水中COD和NO3--N浓度较高,随着反硝化菌对高渗透压的承受能力不断提高,出水中COD和NO3--N的浓度也逐渐降低.进水盐度由0逐渐增加至8%,COD平均去除率由90%降至44%,NO3--N平均去除率由95%降至45%.盐度的增加会引起反硝化菌生长缓慢、代谢活性降低(Panswad et al., 1999),进而导致COD和NO3--N去除率随着进水盐度的增加而下降.此外,盐度的增加也会刺激微生物分泌更多的胞外聚合物(Wang et al., 2015),而多余的胞外聚合物会堵塞底物传输的通道,从而降低底物的传质速率(王新华,2008),这也可能导致COD和NO3--N去除率随着进水盐度的增加而降低.不同盐度下出水中没有显著的NO2--N累积.
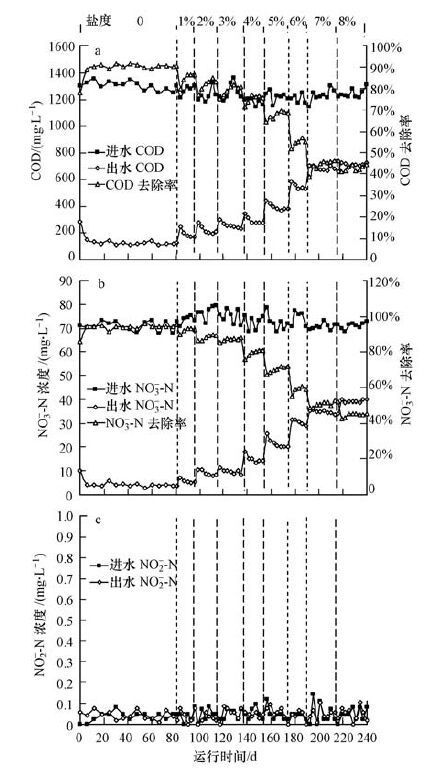 |
| 图 2 不同盐度下进出水中COD、NO3--N和NO2--N的变化(a. COD,b. NO3--N,c.NO2--N) Fig. 2 Variations of COD,NO3--N and NO2--N in the influent and effluent at different salinities(a. COD,b. NO3--N,c.NO2--N) |
不同盐度下,UASB反应器出水水质稳定后取厌氧污泥用于LB-EPS和TB-EPS中PN和PS含量变化的分析,结果如图 3所示.进水盐度由0逐渐增加至8%,LB-EPS中PN和PS的含量分别由3.75和1.19 mg · g-1(以VSS计)增加至26.82和14.65 mg · g-1(以VSS计),TB-EPS中PN和PS含量分别由9.70和2.55 mg · g-1(以VSS计)增加至30.11和12.92 mg · g-1(以VSS计).不同盐度下,LB-EPS和TB-EPS中PN含量总是高于PS含量,这与EPS中存在大量的胞外酶有关(Li et al., 2007).进水中盐度的增加导致细胞内外离子浓度的差异增大,为调节这种差异,细胞在渗透压升高的胁迫下通过分泌大量的酶和其他辅助物质增强主动运输和扩散等运输活动以适应环境的变化(信欣,2007),从而维持正常的新陈代谢,这可能是导致EPS中PN和PS含量随着进水盐度增加而增多的原因.另外,不能适应环境中盐度增加的细胞的解体也会使胞内蛋白和多糖等大分子物质释放,这也会导致EPS中PN和PS含量增加.Li等(2013) 报道了相似的结果,进水盐度由0.4%逐渐增加至2%会导致厌氧污泥EPS中PN和PS含量增加.然而Ismail等(2010) 发现,厌氧污泥EPS中PN含量在进水Na+浓度为10 g · L-1和20 g · L-1时没有显著不同,而Na+浓度为10 g · L-1时,EPS中PS含量更高.学者关于进水盐度的变化对厌氧污泥EPS中PN和PS含量影响的报道结果并不一致,这可能与实验条件的不同有关.进水盐度由0逐渐增加至8%,LB-EPS和TB-EPS中PN/PS比分别由3.2和3.8降低至1.8和2.3,表明盐度的增加更容易引起EPS中PS含量的变化.PS分子中含有大量的极性基团,其与水分子结合能力较强,所以PS可以限制水分的流动,在高渗透压下,EPS中PS含量的增加可以降低细胞的水分流失,这可以被视为细胞抵御环境中渗透压增加的一种方式.Abbasi等(2008) 发现,细胞外盐度的增加会刺激细菌分泌更多的胞外PS以降低渗透压增加对细胞的破坏.Zou等(2006) 也报道了相似的结果,盐度增加导致胞外PS含量的增加.进水盐度低于4%时,LB-EPS中PS含量低于TB-EPS中的PS含量,而进水盐度高于4%时,LB-EPS中PS含量更高.
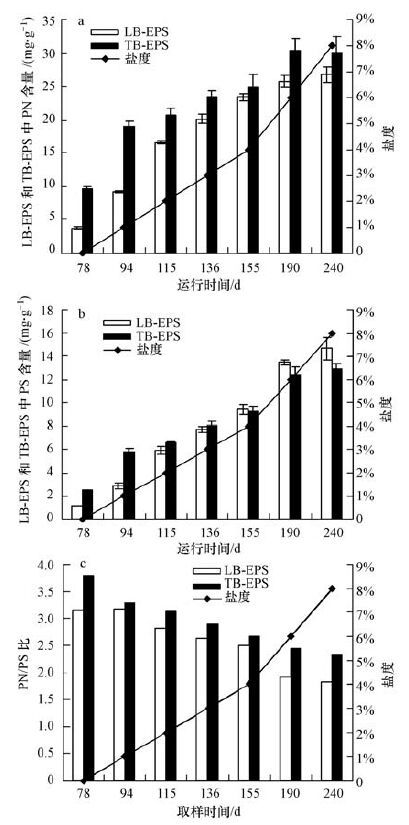 |
| 图 3 不同盐度下LB-EPS和TB-EPS中PN和PS的变化(a.LB-EPS,b.TB-EPS,c.PN/PS比) Fig. 3 Effect of salinity on PN and PS in LB-EPS and TB-EPS(a. LB-EPS,b.TB-EPS,c. PN/PS ratio) |
不同盐度下厌氧污泥LB-EPS和TB-EPS的三维荧光光谱如图 4所示.X轴和Y轴分别代表发射光谱(λEx)和激发光谱(λEm),等高线代表荧光强度.荧光峰A(275~280 nm /335~345 nm)和B(220~225 nm /335~350 nm)为类蛋白荧光,分别与色氨酸蛋白类物质和芳环蛋白类物质有关;荧光峰C(325~340 nm /435~440 nm)为类胡敏酸荧光,与胡敏酸类物质有关(Chen et al., 2003; Yamashita et al., 2003; Sheng et al., 2006).不同盐度下,荧光峰A和荧光峰B在LB-EPS和TB-EPS中均被检测到,表明厌氧污泥胞外聚合物中的蛋白由色氨酸蛋白类物质和芳环蛋白类物质组成.在盐度为4%和8%条件下,荧光峰C在TB-EPS中被检测到,表明胡敏酸类物质的存在,这与死细胞和大分子物质(如蛋白质和多糖)的分解有关(Qu et al., 2012),反映了盐度的增加对细胞的毒害作用.LB-EPS的3D-EEM光谱中没有检测到类胡敏酸荧光,这可能与胡敏酸类物质含量较低有关.不同进水盐度下,荧光峰位和峰强度如表 1所示.与进水盐度为0时LB-EPS和TB-EPS荧光峰位相比,进水盐度为8%时,LB-EPS中荧光峰A沿发谢光谱和激发光谱方向红移5 nm,TB-EPS中荧光峰A沿激发光谱方向红移5 nm.荧光峰的红移表明荧光基团中羰基、羧基、羟基和胺基增加(Chen et al., 2003).进水盐度为8%时,LB-EPS中荧光峰B沿发射光谱方向红移5 nm,盐度为4%和8%时,沿激发光谱方向分别蓝移5 nm和10 nm,荧光峰的蓝移表明荧光基团中芳香环减少(Swietlik et al., 2004).荧光峰的移动反映了盐度的增加导致厌氧污泥胞外聚合物中色氨酸蛋白类物质和芳环蛋白类物质中各组分的含量存在变化,引起这种变化的机理和变化的规律需要被进一步的研究.
 |
| 图 4 不同盐度下LB-EPS和TB-EPS三维荧光光谱(a. LB-EPS(0) ,b.TB-EPS(0) ,c.LB-EPS(4%),d. TB-EPS(4%),e.LB-EPS(8%),f. LB-EPS(8%)) Fig. 4 EEM fluorescence spectra of LB-EPS and TB-EPS fractions under different salinities(a. LB-EPS(0) ,b. TB-EPS(0) ,c. LB-EPS(4%),d. TB-EPS(4%),e. LB-EPS(8%),f. LB-EPS(8%)) |
| 表 1 不同盐度下厌氧污泥LB-EPS和TB-EPS中荧光峰特征 Table 1 Fluorescence spectral parameters of LB-EPS and TB-EPS from anaerobic sludge under different salinities |
不同盐度下LB-EPS和TB-EPS的红外光谱如图 5所示.3440~3454 cm-1处的宽吸收峰是羟基(来自于多糖化合物)和氨基(来自于蛋白质)的伸缩振动导致(Liang et al., 2010),由于EPS组成的复杂性,因此很难准确确定3450 cm-1附近的宽吸收峰由何种基团的伸缩振动导致;1630 cm-1附近吸收峰是蛋白质二级结构中β-sheets的C O伸缩振动导致(Wang et al., 2008);1400 cm-1附近吸收峰是甲基中C—H键振动产生的;1100 cm-1附近吸收峰是多糖类化合物C—O键的伸缩振动导致(Zhu et al., 2013) ;小于1000 cm-1为指纹区;600~900 cm-1的吸收峰说明样品中存在不饱和键(Zhu et al., 2012).LB-EPS和TB-EPS在3450、1600和1100 cm-1处均有明显的吸收峰存在,表明LB-EPS和TB-EPS样品中蛋白质类和多糖类化合物的存在.不同进水盐度下,厌氧污泥LB-EPS和TB-EPS红外光谱峰位是相似的,但峰的相对强度随进水盐度的增加而表现出不同的变化.LB-EPS和TB-EPS中1100 cm-1附近吸收峰相对强度随着盐度增加而显著增强,表明进水盐度增加导致厌氧污泥LB-EPS和TB-EPS中多糖的C—O组分相对含量增加.
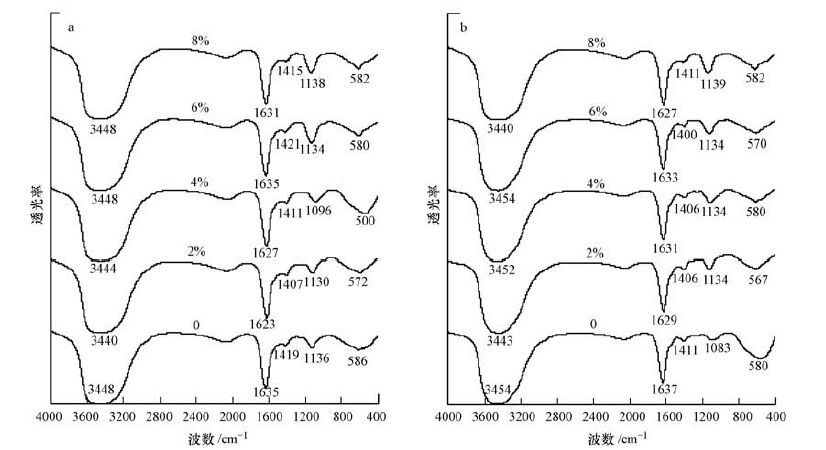 |
| 图 5 不同盐度下LB-EPS和TB-EPS红外光谱(a.LB-EPS,b.TB-EPS) Fig. 5 FTIR spectra variation of LB-EPS and TB-EPS under different salinities(a.LB-EPS,b. TB-EPS) |
进水盐度为0、1%、2%、3%、4%、6%和8%条件下,UASB反应器出水水质稳定后,分别在第78、94、115、136、155、190和240 d取厌氧污泥用于LB-EPS、TB-EPS和SVI分析,结果如图 6所示.进水盐度由0逐渐增加至8%,厌氧污泥LB-EPS和TB-EPS含量分别由4.94和12.25 mg · g-1(以VSS计)增加至41.47和43.04 mg · g-1(以VSS计).LB-EPS和TB-EPS的变化与盐度的增加呈明显的线性关系,R2分别为0.9003(LB-EPS)和0.8851(TB-EPS),由此可知,LB-EPS的变化与进水盐度的增加关系较TB-EPS更紧密.TB-EPS与细胞壁结合较紧密,具有稳定的外形,而LB-EPS为无明显边缘的粘液层,可向周围环境扩散,这可能导致LB-EPS的含量更容易受环境因素变化的影响.随着进水盐度由0逐渐增加至8%,厌氧污泥SVI由88 mL · g-1增加至140 mL · g-1,SVI与盐度呈现出较好的线性关系,R2为0.9391.SVI的增加表明进水盐度的增加导致厌氧污泥沉降性恶化.有学者发现,盐度增加会导致微生物分泌出更多的胞外聚合物以抵御渗透压升高对细胞的破坏,胞外聚合物与大量水分子结合,结构疏松,因此,其含量的增加导致污泥絮体压缩性能变差,进而造成污泥沉降性能的恶化(Zhang et al., 2011;Zhu et al., 2012).为了更深入地理解进水盐度的增加对厌氧污泥SVI的影响,不同盐度下LB-EPS和TB-EPS与SVI间的关系被分别分析(图 7).SVI与LB-EPS和TB-EPS均正相关,且相关系数r分别为0.915和0.911(p <0.01,n=7) .Li等(2007) 发现,LB-EPS与SVI正相关,TB-EPS含量的变化对SVI没有影响.然而,Ye等(2012) 的研究结果显示,LB-EPS和SVI负相关,TB-EPS与SVI正相关.学者关于LB-EPS与TB-EPS对SVI影响的报道是不一致的,这可能与LB-EPS和TB-EPS含量与组成的不同有关.进水盐度的增加可以刺激微生物分泌更多的PS,这导致LB-EPS和TB-EPS中PN/PS比随着盐度的增加而降低.PS是EPS的亲水成分,PN是EPS的疏水成分,较低的PN/PS比导致污泥絮体的疏水性降低,不利于污泥絮凝,进而降低污泥的沉降性.Chen等(2010) 报道了相似的结果,SVI随着EPS中PN/PS比的降低而增加.
 |
| 图 6 不同盐度下LB-EPS、TB-EPS和SVI的变化及相互关系 Fig. 6 Effect of salinity on the content of LB-EPS,TB-EPS and SVI |
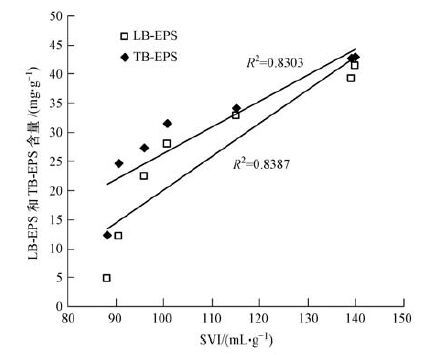 |
| 图 7 不同盐度下LB-EPS、TB-EPS和SVI间的关系 Fig. 7 Relation between LB-EPS,TB-EPS and SVI under different salinities |
1) 进水盐度的增加导致厌氧污泥LB-EPS和TB-EPS中蛋白和多糖含量增加,蛋白和多糖含量比值降低,多糖的C—O组分相对含量增加,表明盐度的增加更容易引起胞外聚合物中多糖的变化.
2) 不同盐度下,厌氧污泥LB-EPS和TB-EPS中的蛋白均由色氨酸类蛋白和芳环类蛋白组成.
3) 厌氧污泥中LB-EPS和TB-EPS含量的增加降低了污泥的沉降性.
| [1] | Abbasi A, Amiri S. 2008. Emulsifying behavior of an exopolysaccharide produced by Enterobacter cloacae[J]. African Journal of Biotechnology , 7 (10) : 1574–1576. |
| [2] | Basuvaraj M, Fein J, Liss S N. 2015. Protein and polysaccharide content of tightly and loosely bound extracellular polymeric substances and the development of a granular activated sludge floc[J]. Water Research , 82 : 104–117. DOI:10.1016/j.watres.2015.05.014 |
| [3] | Chen H, Zhou S G, Li T H. 2010. Impact of extracellular polymeric substances on the settlement ability of aerobic granular sludge[J]. Environmental Technology , 31 (14) : 1601–1612. DOI:10.1080/09593330.2010.482146 |
| [4] | Chen W, Westerhoff P, Leenheer J, et al. 2003. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science & Technology , 37 (24) : 5701–5710. |
| [5] | 曹秀芹, 赵自玲.2010. 胞外聚合物(EPS)构成的影响因素分析[J]. 环境科学与技术 , 2010, 33 (12) : 420–424. |
| [6] | Dubois M, Gilles K A, Hamilton J K, et al. 1956. Colorimetric method for determination of sugars and related substance[J]. Analytical Chemistry , 28 (3) : 350–356. DOI:10.1021/ac60111a017 |
| [7] | 国家环境保护总局水和废水监测分析方法编委会.2002.水和废水监测分析方法(第四版)[M].北京:中国环境科学出版社 |
| [8] | He Q, Kong X J, Chai H X, et al. 2012. Efficiency influence of exogenous betaine on anaerobic sequencing batch biofilm reactor treating high salinity mustard tuber wastewater[J]. Environmental Technology , 33 (15) : 1695–1699. DOI:10.1080/09593330.2011.643317 |
| [9] | Ismail S B, de La Parra C J, Temmink H, et al. 2010. Extracellular polymeric substances (EPS) in upflow anaerobic sludge blanket (UASB) reactors operated under high salinity conditions[J]. Water Research , 44 (6) : 1909–1917. DOI:10.1016/j.watres.2009.11.039 |
| [10] | Li J, Yu L, Yu D S, et al. 2013. Performance and granulation in an upflow anaerobic sludge blanket (UASB) reactor treating saline sulfate wastewater[J]. Biodegradation , 25 (1) : 127–136. |
| [11] | Li X Y, Yang S F. 2007. Influence of loosely bound extracellular polymeric substances (EPS) on the flocculation,sedimentation and dewaterability of activated sludge[J]. Water Research , 41 (5) : 1022–1030. DOI:10.1016/j.watres.2006.06.037 |
| [12] | Liang Z W, Li W H, Yang S Y, et al. 2010. Extraction and structural characteristics of extracellular polymeric substances (EPS),pellets in autotrophic nitrifying biofilm and activated sludge[J]. Chemosphere , 81 (5) : 626–632. DOI:10.1016/j.chemosphere.2010.03.043 |
| [13] | 李冬, 吴青, 梁瑜海, 等.2015. 不同基质条件对亚硝化污泥胞外聚合物的影响[J]. 哈尔滨工业大学学报 , 2015, 47 (4) : 81–86. |
| [14] | Liao R H, Li Y, Du J, et al. 2015. Analysis of high-nitrate,high-salinity wastewater in an expanded granular sludge bed reactor and microbial community[J]. Desalination and Water Treatment , 57 (10) : 4357–4364. |
| [15] | Lowry O H, Rosebrough N J, Farr A L, et al. 1951. Protein measurement with the Folin phenol reagent[J]. The Journal of Biological Chemistry , 193 (1) : 265–275. |
| [16] | Panswad T, Anan C. 1999. Impact of high chloride wastewater on an anaerobic/anoxic/aerobic process with and without inoculation of chloride acclimated seeds[J]. Water Research , 33 (5) : 1165–1172. DOI:10.1016/S0043-1354(98)00314-5 |
| [17] | Qu F, Liang H, He J, et al. 2012. Characterization of dissolved extracellular organic matter (dEOM) and bound extracellular organic matter (bEOM) of Microcystis aeruginosa and their impacts on UF membrane fouling[J]. Water Research , 46 (9) : 2881–2890. DOI:10.1016/j.watres.2012.02.045 |
| [18] | Sheng G P, Yu H Q. 2006. Characterization of extracellular polymeric substances of aerobic and anaerobic sludge using three-dimensional excitation and emission matrix fluorescence spectroscopy[J]. Water Research , 40 (6) : 1233–1239. DOI:10.1016/j.watres.2006.01.023 |
| [19] | Swietlik J, Dabrowska A, Raczyk-Stanislawiak U, et al. 2004. Reactivity of natural organic matter fractions with chloride dioxide and ozone[J]. Water Research , 38 (3) : 547–558. DOI:10.1016/j.watres.2003.10.034 |
| [20] | Wang Z C, Gao M C, She Z L, et al. 2015. Effects of salinity on performance,extracellular polymeric substances and microbial community of an aerobic granular sequencing batch reactor[J]. Separation and Purification Technology , 144 : 223–231. DOI:10.1016/j.seppur.2015.02.042 |
| [21] | Wang Z C, Gao M C, Wang S, et al. 2014. Effect of hexavalent chromium on extracellular polymeric substances of granular sludge from an aerobic granular sequencing batch reactor[J]. Chemical Engineering Journal , 251 : 165–174. DOI:10.1016/j.cej.2014.04.078 |
| [22] | Wang Z W, Wu Z C, Ying X, et al. 2008. Membrane fouling in a submerged membrane bioreactor (MBR) under sub-critical flux operation:membrane foulant and gel layer characterization[J]. Journal of Membrane Science , 325 (1) : 238–244. DOI:10.1016/j.memsci.2008.07.035 |
| [23] | Wong J W C, Zhou J, Kurade M B, et al. 2015. Influence of ferrous ions on extracellular polymeric substances content and sludge dewaterability during bioleaching[J]. Bioresource Technology , 179 : 78–83. DOI:10.1016/j.biortech.2014.10.099 |
| [24] | 王新华.2008.好氧颗粒污泥的性能及储存与解体后的自修复行为研究[D].大连:大连理工大学.86-94 |
| [25] | 信欣.2007.耐盐菌株特性及其在高盐有机废水生物处理中的应用[D].武汉:中国地质大学.10-61 http://cdmd.cnki.com.cn/article/cdmd-10491-2007142824.htm |
| [26] | Yamashita Y, Tanoue E. 2003. Chemical characterization of protein-like fluorophores in DOM in relation to aromatic amino acids[J]. Marine Chemistry , 82 (3) : 255–271. |
| [27] | Ye F X, Liu X W, Li Y. 2012. Effects of potassium ferrate on extracellular polymeric substances (EPS) and physicochemical properties of excess activated sludge[J]. Journal of Hazardous Materials , 199-220 : 158–163. |
| [28] | Ye F X, Ye Y F, Li Y. 2011. Effect of C/N ratio on extracellular polymeric substances (EPS) and physicochemical properties of activated sludge flocs[J]. Journal of Hazardous Materials , 188 (1) : 37–43. |
| [29] | Zhang Z J, Chen S H, Wang S M, et al. 2011. Characterization of extracellular polymeric substances from biofilm in the process of starting-up a partial nitrification process under salt stress[J]. Applied Microbiology and Biotechnology , 89 (5) : 1563–1571. DOI:10.1007/s00253-010-2947-y |
| [30] | Zhu L, Lv M L, Dai X, et al. 2013. The stability of aerobic granular sludge under 4-chloroaniline shock in a sequential air-lift bioreactor (SABR)[J]. Bioresource Technology , 140 : 126–130. DOI:10.1016/j.biortech.2013.04.017 |
| [31] | Zhu L, Qi H Y, Lv M L, et al. 2012. Component analysis of extracellular polymeric substances (EPS) during aerobic sludge granulation using FTIR and 3D-EEM technologies[J]. Bioresource Technology , 124 : 455–459. DOI:10.1016/j.biortech.2012.08.059 |
| [32] | Zhu N, Liu L, Xu Q, et al. 2015. Resources availability mediated EPS production regulate microbial cluster formation in activated sludge system[J]. Chemical Engineering Journal , 279 : 129–135. DOI:10.1016/j.cej.2015.05.017 |
| [33] | Zou X, Sun M, Guo X. 2006. Quantitative response of cell growth and polysaccharide biosynthesis by the medicinal mushroom Phellinus linteus to NaCl in the medium[J]. World Journal of Microbiology & Biotechnology , 22 (11) : 1129–1133. |
 2016, Vol. 36
2016, Vol. 36


