2. 吉林师范大学化学学院, 四平 136000
2. School of Chemistry, Jilin Normal University, Siping 136000
电催化氧化技术是目前最为有效的降解水中难生物降解有毒有机污染物的方法之一,具有氧化能力强、操作简单、无二次污染等优点(Liu et al.,2012; Lin et al.,2012).阳极材料是该技术的核心,直接影响有机污染物的降解效率和矿化程度(Xu et al.,2015; Mukimin et al.,2015).PbO2电极具有成本低、耐腐蚀性强、电催化氧化活性高等优点(Zhao et al.,2004; Li et al.,2014),在电催化氧化领域越来越受到重视,研究人员不断对PbO2电极进行改性,以进一步提高电极催化氧化有机污染物的能力.有研究表明,Bi(Iniesta et al.,2001)、Ce(Ai et al.,2005)、Er(Wang et al.,2010)、Zr(Yao et al.,2013)、F(Cao et al.,2009)等的掺杂能提高PbO2电极降解有机污染物的能力和电极在腐蚀性溶液中的稳定性.然而,这些研究都是对电极β-PbO2活性层进行改性以提高电极的催化氧化活性和稳定性,利用电极基底的改性提高电极性能的研究却较为少见.
钛是一种耐腐蚀、重量轻、强度大的金属,因此,钛片被广泛用作PbO2电极的基体(Zhao et al.,2015).但平板钛片与沉积在钛基体上的氧化物膜层之间的结合力较低,电极的使用寿命有待提高.Zhao等(2015)以多孔钛为基体制备的PbO2电极的使用寿命是平板钛基体PbO2电极3.69倍,降解亚甲基蓝的速率常数也明显提高.可见,基体的变化对电极的使用寿命有明显影响.二氧化钛纳米管(TiO2-NT)阵列因其纳米结构高度有序、比表面积大及定向电子传输能力强越来越引起人们注意,其特殊的结构使得TiO2-NT 具有光电催化氧化降解有机污染物的能力(谭敬等,2012; Ferreira et al.,2015).然而,TiO2是一种半导体材料,在没有光激发的情况下,导电性和电催化能力非常差(Zhao et al.,2009),并不适合作为电催化氧化阳极材料直接使用.但TiO2-NT可为电沉积β-PbO2活性层提供良好的纳米管状结构模板,在以TiO2-NT为基体电沉积β-PbO2活性层的过程中,β-PbO2将首先在TiO2-NT的管内形成,当管内充满β-PbO2后,TiO2-NT表面则会形成平整的β-PbO2膜层.Ti基体、TiO2-NT、管内β-PbO2柱与管顶β-PbO2膜层相互作用,会极大地提高PbO2电极的稳定性.另外,TiO2-NT的纳米微管结构有利于微小尺寸β-PbO2晶粒形成,必将提高电极的比表面积和催化氧化活性.
TiO2-NT的制备方法有模板法、水热合成法和阳极氧化法等.其中,阳极氧化法方法简单、成本低廉、纳米管排列紧密、不易脱落(苏雅玲等,2009).因此,本文拟采用阳极氧化法在Ti基体上制备TiO2-NT层,以TiO2-NT为底层电沉积β-PbO2膜层,并将制备的PbO2/TiO2-NT/Ti电极与传统PbO2/SnO2-Sb2O3/Ti电极的形貌、结构、电化学性能、有机污染物降解能力、电极使用寿命进行对比研究.
2 材料与方法(Materials and methods) 2.1 试剂与仪器试剂:Ti片(3 cm×5 cm×1 mm)购自宝鸡宝冶钛镍制造公司,其它试剂均为分析纯,未经进一步提纯.
仪器:DH-101S集热式恒温加热磁力搅拌器,DH1722A-3型直流稳压稳电源,UV759紫外-可见分光光度计,202-1电热恒温干燥箱,TG328-A型分析天平,RJM-28-10型马弗炉,PASTAT302型电化学工作站.
2.2 电极的制备 2.2.1 PbO2/TiO2-NT/Ti电极的制备预处理:用砂纸打磨钛片,除去表面氧化层,将打磨后的Ti片依次放入丙酮、去离子水中超声清洗.
TiO2-NT底层的制备:以预处理后的Ti片为阳极,等面积的不锈钢板为阴极,在含有5% HF的乙酸水溶液中进行电解45~180 min.乙酸水溶液的组成为乙酸与去离子水的体积比为1∶8,电解槽电压20 V、温度30 ℃、电解时间1.5 h;然后将电解后的钛片洗净,置于马弗炉中500 ℃下焙烧2 h,升温速率2 ℃·min-1.
PbO2表层的制备:以带有TiO2-NT底层的钛片为阳极,等面积的不锈钢板为阴极,电沉积β-PbO2活性层.镀液成分为:1 mol·L-1 HNO3、0.5 mol·L-1 Pb(NO3)2和0.5 mol·L-1 NaF,电流密度为15 mA·cm-2,温度为65 ℃,时间为1 h.
2.2.2 PbO2/SnO2-Sb2O3/Ti电极的制备PbO2/SnO2-Sb2O3/Ti电极按文献(Duan et al.,2013)中PbO2电极的制备方法制备.
2.3 电极的表征采用TT260覆层测厚仪测试沉积层厚度;采用XL30ESEM-FEG型扫描电镜观测电极的表面形貌,系统电压25 kV;采用D-max/3C型X射线衍射仪(XRD,日本理学)测定电极的晶体结构,测试条件为:Cu Kα为射线源,电压45 kV,电流30 mA,扫描速度0.02°·min-1;采用PGSTAT302型电化学工作站测定循环伏安(CV)和线性伏安(LSV),测试过程中采用三电极体系,测试电极为工作电极,电极面积为1 cm2,铂片为辅助电极,饱和甘汞电极为参比电极,线性伏安的电解液为0.05 mol·L-1的Na2SO4溶液,扫描速率为50 mV·s-1,电压范围为0.5~2.5 V,循环伏安电解液为有和无500 mg·L-1 p-NP的0.5 mol·L-1的Na2SO4溶液,扫描速率为50 mV·s-1,扫描电压范围是0~1.5 V.
2.4 p-硝基苯酚(p-NP)的降解PbO2/TiO2-NT/Ti或PbO2/SnO2-Sb2O3/Ti为阳极,等面积的不锈钢片为阴极,阳极与阴极面对面平行放置,电极之间的距离为1 cm.在电流密度为30 mA·cm-2,温度为30 ℃下,对p-NP进行电解.电解液体积为200 mL,p-NP浓度为50 mg·L-1,支持电解质为0.05 mol·L-1的Na2SO4,每隔10 min取样,利用紫外-可见分光光度计于273 nm 波长下测试p-NP浓度.根据朗伯-比尔定律,利用公式(1)计算p-NP的降解率(η).
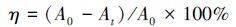
|
(1) |
式中,A0为p-NP初始吸光度,At为t时刻p-NP的吸光度.
2.5 电极稳定性测试采用加速寿命试验测试电极的稳定性,以PbO2/TiO2-NT/Ti或PbO2/SnO2-Sb2O3/Ti为阳极,等面积的不锈钢板为阴极,电解液为2 mol·L-1的H2SO4,电流密度为1 A·cm-2,温度为60 ℃.
3 结果(Results) 3.1 阳极氧化时间对TiO2-NT底层的影响图 1是在含5% HF的乙酸水溶液中阳极氧化45、90、180 min后TiO2-NT底层的XRD谱图.由图 1可知,电解不同时间所获得的TiO2-NT底层均与钛片衬底的衍射峰不同,说明在不同的时间下,电沉积的TiO2-NT均可晶化,且可以将Ti基底完全覆盖.当氧化时间为45 min时,在37.7°、39.3°、52.9°和70.3°位置出现衍射峰,分别对应锐钛矿结构的(004)、(112)、(105)和(220)面(PDF#21-1272).当氧化时间进一步延长到90和180 min时,(004)面的衍射峰消失,在24.9°位置出现了一较强峰,该峰为锐钛矿结构的(101)面(PDF#21-1272).根据Debye-Sherrer公式,计算TiO2-NT的平均粒径,数据列于表 1中.由表中数据可知,电解时间的延长可使TiO2-NT晶粒细化.
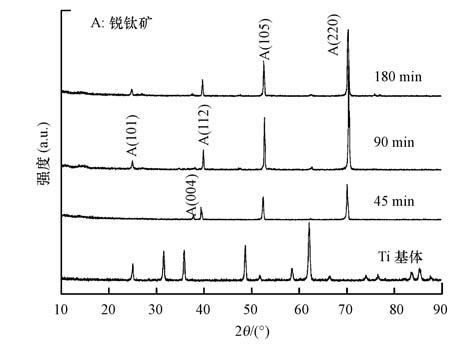 |
| 图 1 TiO2-NT底层的XRD谱图 Fig. 1 XRD patterns of TiO2-NT layers |
| 表 1 TiO2-NT的晶粒尺寸 Table 1 Crystal grain size of TiO2-NT |
图 2为阳极氧化45、90、180 min的TiO2-NT底层的表面形貌.由图 2可知,阳极氧化45~180 min都可制备出管状结构的TiO2-NT,当氧化时间较短时(45 min),制备的纳米管管口形状不规则,管径平均尺寸约为170 nm,壁厚约为30 nm(图 2a);当氧化时间达到90 min后,纳米管的管口形状变得清晰,管径平均尺寸变小,约为135 nm,管壁厚度没有明显变化(图 2b);将氧化时间继续延长至180 min后,纳米管的排列很紧密,管口形状接近圆形,管状结构更规则,管径明显变小(图 2c),平均为93 nm,管壁也明显变小,约为45 min和90 min时的1/2左右.该结果说明随着阳极氧化时间的增加,TiO2-NT的管状结构越来越规则致密,有效地提高了TiO2-NT的比表面积,也将加强TiO2-NT与镀层之间的结合力,使镀层更加稳定,从而提高电极的使用寿命和催化活性.
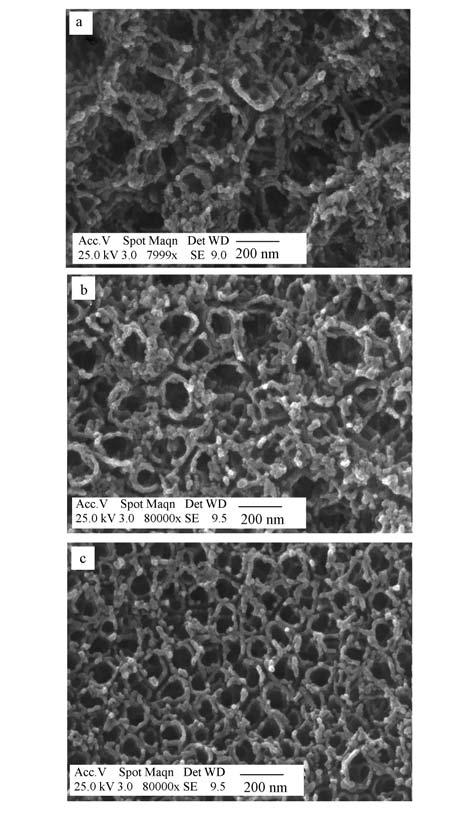 |
| 图 2 TiO2-NT底层的表面形貌(a.45 min;b.90 min;c.180 min) Fig. 2 Surface topography of TiO2-NT layers |
由以上实验结果可知,阳极氧化180 min后可获得排列紧密、结构规则的二氧化钛纳米管,因此,实验在阳极氧化180 min的TiO2-NT底层上电沉积β-PbO2膜层,并将该电极(PbO2/TiO2-NT/Ti)与传统的PbO2/SnO2-Sb2O3/Ti电极进行全面对比.首先利用覆层测厚仪测得PbO2/TiO2-NT/Ti电极与PbO2/SnO2-Sb2O3/Ti电极表面β-PbO2膜层的厚度,分别为23.65 μm和28.32 μm.可见在同样条件下,β-PbO2在TiO2-NT表面的生长速度要略低于在SnO2-Sb2O3表面的生长速度,这可能与TiO2-NT的导电性较低有关.
图 3为PbO2/TiO2-NT/Ti电极与PbO2/SnO2-Sb2O3/Ti电极的XRD谱图.由图 3可知,两谱图中衍射峰位置基本一致,与β-PbO2晶体在2θ=15.40°、31.77°、36.14°、49.04°、51.98°、58.80°和62.32°处的衍射峰基本吻合(PDF#76-0564).因此,两电极表面PbO2膜层的晶体结构均是β-PbO2晶体.但与PbO2/SnO2-Sb2O3/Ti电极相比,PbO2/TiO2-NT/Ti电极的峰强度更大,说明晶体结晶状态更好.根据Debye-Sherrer公式利用主峰计算PbO2/TiO2-NT/Ti与PbO2/SnO2-Sb2O3/Ti电极表面β-PbO2的晶粒尺寸,分别为48.24 nm和50.88 nm.可见,在TiO2-NT表面获得的β-PbO2晶粒比在SnO2-Sb2O3表面获得的β-PbO2晶粒更小.该结果与我们的推测一致,TiO2-NT的纳米管状结构抑制了晶体的生长,更利于微小β-PbO2晶粒的形成.
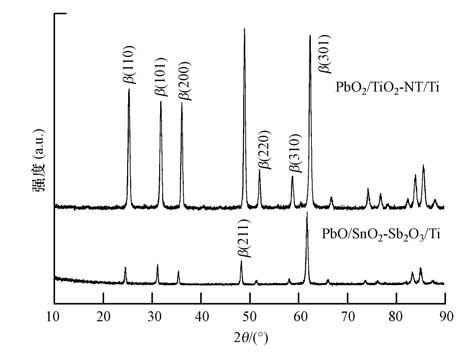 |
| 图 3 PbO/TiO2-NT/Ti与PbO2/SnO2-Sb2O3/Ti电极的XRD谱图 Fig. 3 XRD patterns of PbO2/TiO2-NT/Ti and PbO2/SnO2-Sb2O3/Ti electrodes |
图 4为PbO2/TiO2-NT/Ti与PbO2/SnO2-Sb2O3/Ti电极的SEM照片.由图 4可知,两种电极的晶粒均呈金字塔形.与XRD结果一致,PbO2/TiO2-NT/Ti电极具有比PbO2/SnO2-Sb2O3/Ti电极更小的晶粒度,晶粒更加均匀、规则、致密,晶粒间无明显裂缝,这样的结构既增加其比表面积,也可以有效地阻止氧向基体扩散,使钛基底不易被氧化,从而提高电极的催化活性和耐腐蚀性,延长电极的使用寿命.
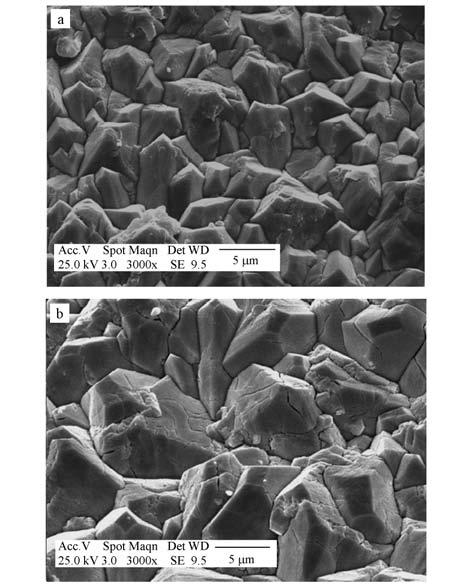 |
| 图 4 PbO2/TiO2-NT/Ti(a)与PbO2/SnO2-Sb2O3/Ti(b)电极的SEM照片 Fig. 4 SEM images of PbO2/TiO2-NT/Ti(a)and PbO2 /SnO2-Sb2O3/Ti(b) electrodes |
图 5是PbO2/TiO2-NT/Ti和PbO2/SnO2-Sb2O3/Ti电极在0.5 mol·L-1 Na2SO4溶液中的极化曲线,扫速为50 mV·s-1,扫描电压范围为0.5~2.5 V.由图 5可知,PbO2/SnO2-Sb2O3/Ti 电极的析氧过电位为1.52 V(vs. SCE)左右,而PbO2/TiO2-NT/Ti电极的析氧过电位为1.78 V(vs. SCE)左右,PbO2/TiO2-NT/Ti电极的析氧过电位明显高于PbO2/SnO2-Sb2O3/Ti 电极,PbO2/TiO2-NT/Ti电极的高析氧过电位可有效抑制电催化氧化有机污染物过程中的析氧副反应.
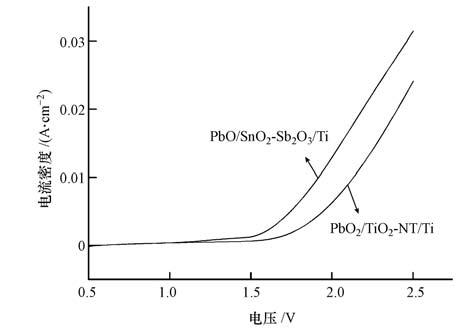 |
| 图 5 不同的电极在0.5 mol·L-1 Na2SO4溶液中的LSV曲线 Fig. 5 LSV curves of different electrodes measured in 0.5 mol·L-1 Na2SO4 solutions |
图 6为PbO2/TiO2-NT/Ti和PbO2/SnO2-Sb2O3/Ti电极在有和无500 mg·L-1 p-NP的0.5 mol·L-1 Na2SO4溶液中的CV曲线,扫描范围为0~1.5 V(vs. SCE),扫速为 50 mV·s-1.由图 6可知,与无p-NP体系的CV曲线相比,在含有p-NP体系中,两电极的CV曲线都在0.9~1.2 V(vs. SCE)左右出现氧化峰,可见p-NP可在两电极表面发生直接氧化反应.对比两电极的氧化峰电位和电流可知,PbO2/TiO2-NT/Ti电极上的氧化峰电位比PbO2/SnO2-Sb2O3/Ti电极上的氧化峰电位小,但电流明显大.可见,p-NP更容易在PbO2/TiO2-NT/Ti电极上发生氧化反应.
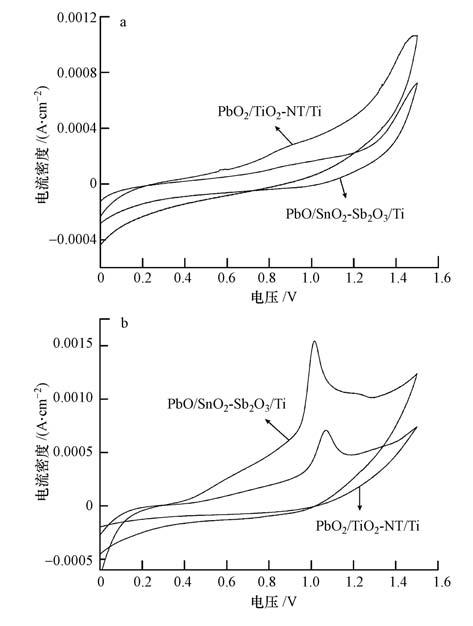 |
| 图 6 电极在无(a)和有(b)500 mg·L-1 p-NP的0.5 mol·L-1 Na2SO4溶液中的CV曲线 Fig. 6 CV curves of electrodes in 0.5 mol·L-1 Na2SO4 solutions without(a)and with(b)500 mg·L-1 p-NP |
为了对比PbO2/TiO2-NT/Ti与PbO2/SnO2-Sb2O3/Ti电极降解有机污染物的能力,以p-NP为目标污染物,进行电催化氧化实验,结果如图 7所示.由图 7可知,电解120 min后,PbO2/TiO2-NT/Ti电极对p-NP的降解率为97.8%,而PbO2/SnO2-Sb2O3/Ti电极对p-NP的降解率仅为87.6%.可见,PbO2/TiO2-NT/Ti电极具有比普通PbO2/SnO2-Sb2O3/Ti电极更高的电催化氧化能力,这可能是因为PbO2/TiO2-NT/Ti电极表面细小的晶粒使其具有更高的活性表面积,为羟基自由基的产生提供更多的活性点.另外,PbO2/TiO2-NT/Ti电极更大的表面积也提高了p-NP在电极表面的吸附量,有利于p-NP在电极表面进一步降解.
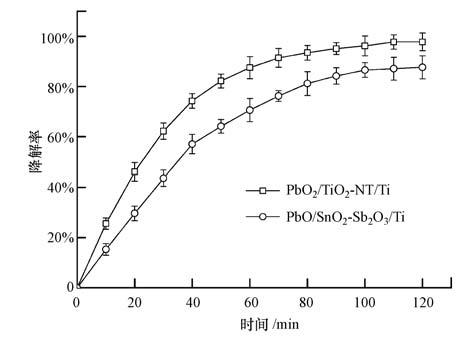 |
| 图 7 p-NP降解率随电解时间的变化曲线 Fig. 7 Variation of p-NP degradation ratio with electrolysis time during electrochemical oxidation |
为了缩短测试时间,采用加速寿命实验测试电极的稳定性,电解液为1 mol·L-1 H2SO4溶液,施加的电流密度为1 A·cm-2,温度为60 ℃.图 8为加速寿命实验中阳极电位随电解时间的变化曲线,当阳极电位比初始值高5 V时,认为电极失活.由图 8可知,PbO2/SnO2-Sb2O3/Ti和PbO2/TiO2-NT/Ti电极在加速寿命试验中的失活时间分别为58和197 h.因此,相同条件下,PbO2/TiO2-NT/Ti电极比PbO2/SnO2-Sb2O3/Ti电极稳定性高,使用寿命更长久,大约是PbO2/SnO2-Sb2O3/Ti电极的3.4倍.电极使用寿命明显提高可能有两方面原因:一方面,PbO2/TiO2-NT/Ti电极的Ti基体、TiO2-NT、管内β-PbO2柱与管顶β-PbO2膜层相互作用,β-PbO2膜层与基体的结合力比PbO2/SnO2-Sb2O3/Ti电极的SnO2-Sb2O3层与Ti基体的结合力强;另一方面,可能是因为PbO2/TiO2-NT/Ti电极致密的表面结构有效地阻止了强酸的腐蚀.
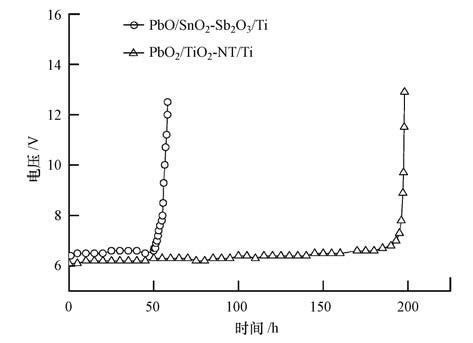 |
| 图 8 不同PbO2电极的加速寿命曲线 Fig. 8 Accelerated life test comparison between PbO2/TiO2-NT/Ti and PbO2/SnO2-Sb2O3/Ti electrodes |
采用阳极氧化法制备TiO2-NT,阳极氧化180 min后,形成的TiO2-NT排列紧密,管口形状接近圆形,管径为93 nm左右.以阳极氧化180 min的TiO2-NT为基体制备PbO2/TiO2-NT/Ti电极,电极的β-PbO2晶粒尺寸明显小于传统PbO2/SnO2-Sb2O3/Ti电极.TiO2-NT改善了PbO2电极的催化活性,p-NP在PbO2/TiO2-NT/Ti电极表面比在PbO2/SnO2-Sb2O3/Ti电极表面更易发生氧化反应,电催化氧化降解120 min后,p-NP降解率达到97.8%,明显高于PbO2/SnO2-Sb2O3/Ti电极的87.6%.另外,TiO2-NT还明显提高了电极的使用寿命,加速寿命实验表明,PbO2/TiO2-NT/Ti电极的使用寿命是PbO2/SnO2-Sb2O3/Ti电极的3.4倍.
| [1] | Ai S Y, Li J Q, Li L P, et al. 2005. Electrochemical deposition and properties of nanometer-structure Ce-doped lead dioxide film electrode[J]. Chinese Journal of Chemistry , 23 : 71–75. DOI:10.1002/(ISSN)1614-7065 |
| [2] | Cao J L, Zhao H Y, Cao F H, et al. 2009. Electrocatalytic degradation of 4-chlorophenol on F-doped PbO2 anodes[J]. Electrochimica Acta , 54 : 2595–2602. DOI:10.1016/j.electacta.2008.10.049 |
| [3] | Duan X Y, Ma F, Yuan Z X, et al. 2013. Electrochemical degradation of phenol in aqueous solution using PbO2 anode[J]. Journal of the Taiwan Institute of Chemical Engineers , 44 : 95–102. DOI:10.1016/j.jtice.2012.08.009 |
| [4] | Ferreira M, Pinto M F, Neves I C, et al. 2015. Electrochemical oxidation of aniline at mono and bimetallic electrocatalysts supported on carbon nanotubes[J]. Chemical Engineering Journal , 260 : 309–315. DOI:10.1016/j.cej.2014.08.005 |
| [5] | Iniesta J, González-garcía J, Expósito E, et al. 2001. Influence of chloride on electrochemical degradation of phenol in alkaline medium using bismuth doped and pure PbO2 anodes[J]. Water Research , 35 (4) : 3291–3300. |
| [6] | Li X L, Li X M, Yang W J, et al. 2014. Preparation of 3D PbO2 nanopheres@SnO2 nanowires/Ti electrode and its application in methyl orange degradation[J]. Electrochimica Acta , 146 : 15–22. DOI:10.1016/j.electacta.2014.08.150 |
| [7] | Lin H, Niu J F, Ding S Y, et al. 2012. Electrochemical degradation of perfluorooctanoic acid (PFOA) by Ti/SnO2-Sb,Ti/SnO2-Sb/PbO2 and Ti/SnO2-Sb/MnO2 anodes[J]. Water Research , 46 : 2281–2289. DOI:10.1016/j.watres.2012.01.053 |
| [8] | Liu Y, Liu H, Ma J, et al. 2012. Preparation and electrochemical properties of Ce-Ru-SnO2 ternary oxide anode and electrochemical oxidation of nitrophenols[J]. Journal of Hazardous Materials : 213-214–222-229. |
| [9] | Mukimin A, Vistanty H, Zen N. 2015. Oxidation of textile wastewater using cylinder Ti/β-PbO2 electrode in electrocatalytic tube reactor[J]. Chemical Engineering Journal , 259 : 430–437. DOI:10.1016/j.cej.2014.08.020 |
| [10] | 苏雅玲, 张飞白, 杜瑛珣, 等.2009. 阳极氧化法制备TiO2纳米管及其光催化性能[J]. 无机化学学报 , 2009, 25 (11) : 1994–2002. |
| [11] | 谭敬, 李新勇, MosesT, 等.2012. Fe-Ni/TiO2纳米管阵列电极的制备、表征及光电催化还原五氯酚活性[J]. 高等学校化学学报 , 2012, 33 (12) : 2703–2707. |
| [12] | Wang Y, Shen Z Y, Chen X C. 2010. Effects of experimentals parameters on 2,4-dichlorphenol degradation over Er-chitosan-PbO2 electrode[J]. Journal of Hazardous Materails , 178 : 867–874. DOI:10.1016/j.jhazmat.2010.02.018 |
| [13] | Xu H, Yuan Q S, Shao D, et al. 2015. Fanrication and characterization of PbO2 electrode modified with[J]. Journal of Hazardous Materails , 286 : 509–516. DOI:10.1016/j.jhazmat.2014.12.065 |
| [14] | Yao Y W, Zhao C M, Zhao M M, et al. 2013. Electrocatalytic degradation of methylene blue on PbO2-ZrO2 nanocomposite electrodes prepared by pulse electrodeposition[J]. Journal of Hazardous Materials , 263 : 726–734. DOI:10.1016/j.jhazmat.2013.10.038 |
| [15] | Zhao G, Cui X, Liu M, et al. 2009. Electrochemical degradation of refractory pollutant using a novel microstructured TiO2 nanotubes/Sb-doped SnO2 electrode[J]. Environment Science Technology , 43 : 1480–1486. DOI:10.1021/es802155p |
| [16] | Zhao J, Zhu C Z, Lu J, et al. 2004. Electro-catalytic degradation of bisphenol A with modified Co3O4/β-PbO2/Ti electrode[J]. Electrochimica Acta , 118 : 169–175. |
| [17] | Zhao W, Xing J, Chen D, et al. 2015. Study on the performance of an improved Ti/SnO2-Sb2O3/PbO2 based on porous titanium substrate compared with planar titamium substrate[J]. RSC Advance , 5 : 26530–26539. DOI:10.1039/C4RA13492C |
 2016, Vol. 36
2016, Vol. 36


