2. 南京信息工程大学江苏省大气环境与装备技术协同创新中心, 南京 210044
2. Jiangsu Collaborative Innovation Center of Atmospheric Environment and Equipment Technology(AEET), Nanjing University of Information &Technology, Nanjing 210044
近年来,由于人类活动所导致的水体富营养化成为世界范围内普遍存在的环境问题.根据已有的理论和实践,沉水植物的恢复与重建被认为是水体富营养化治理最有效的措施.但近年开展的相关恢复与重建工作并没有取得满意的效果(秦伯强等,2005;黄娟等,2009;Brix,1997),这是由于沉水植物的生存和发展受环境中多种生物因子和非生物因子制约(Roberts et al.,2003;王华等,2008;Reid et al.,2007;吴明丽等,2012).已有研究表明,随着水体富营养化,附着藻类会迅速增加(卡尔夫,2011;Havens et al.,1999;Russell et al.,2005),而附着藻类大量繁殖会对沉水植物生长产生不利的影响(Kim et al.,1999).因此,研究富营养化水体氮磷浓度升高对不同宿主植物上附着藻类的影响具有重要的意义.目前,有关水体氮磷浓度对附着藻类的影响较多(陈韬,2012;李冰等,2013;李晓山等,2011;张晶等,2014;丰茂武等,2008),但定量研究富营养化水体氮磷浓度升高对不同类型沉水植物上附着藻类生物量及群落组成的影响相对较少,且不同的学者观点不一致.有些学者认为,在富营养化水体中,由于水体氮磷浓度较高,沉水植物仅用来充当基质,氮磷浓度的升高会促进附着藻类的生物量显著增加,对附着藻类的群落结构影响不大(念宇等,2009).也有学者认为,附着藻类的群落结构与宿主植物具有高度的专一性,即使是富营养化水体中,不同植物基质上,附着藻类群落组成存在差别(宋玉芝等,2014;由文辉,1999). 因此,本文选择广泛分布的、对水体营养盐具有较广耐受性的苦草(Vallisneria natans(Lour.)Hara)和狐尾藻(Myriophyllum spicatum L.)作为载体,通过室内控制试验,研究不同沉水植物上附着藻类的生物量及其群落变化,以期能丰富湖泊附着藻类生态学理论,也为富营养化湖泊生态修复过程中沉水植物群落的构建提供依据.
2 材料与方法(Material and methods) 2.1 实验材料从东太湖湖区采集苦草(Vallisneria natans)块茎种植于室内铺有粗砂的塑料整理箱(30 cm×40 cm×50 cm)内,培养备用.试验时,从苦草备用箱中选取生长状况良好、植株长势一致的苦草,清洗干净后去除枯黄和衰败的叶片,移栽到底部具有小孔的小塑料杯中(直径8 cm,深10 cm),塑料杯中装有8 cm厚已洗净的沙子,每杯种植5株.狐尾藻(Myriophyllum spicatum)取自溱湖国家湿地公园,选取生长状况良好并且长势基本一致的植株,洗净后去除枯黄和衰败的叶片,按照同样方式移栽至底部具有小孔装有8 cm厚沙子的塑料杯中.将栽有苦草和狐尾藻的塑料杯分别放入大棚的塑料整理箱(30 cm×40 cm×50 cm)中,每箱15杯,并向箱中注入40 L的自来水.在阳光充足、通风良好的塑料大棚中进行适应性培养,2周后开始实验.
2.2 实验设计实验开始时更换培养液.培养液用自来水,根据目前太湖不同湖区的营养状况,在水体中添加总氮(NH+4∶NO-3=1∶1)和总磷(NaH2PO4)的浓缩液,使水体的总氮和总磷浓度如表 1所示.每个处理3个重复.为了增加附着藻类种源,从太湖康山湾(太湖站围隔区)采取少量的苦草、狐尾藻等太湖常见的沉水植物,先用去离子水轻轻地冲洗一下,再用软毛刷刷洗植株叶片表面,收集刷洗液定容备用.在每个塑料整理箱的水体中均匀加入等体积含有附着藻类溶液.在培养期间,为了保证各处理水体的氮磷浓度相对稳定,每3 d测水体的TN、TP浓度并补充营养盐浓缩液.为了控制浮游藻类的暴发,试验期间还定期将培养液以虹吸的方式更换.处理后第7 d开始采样,随机采取一杯苦草和一杯狐尾藻,用软毛刷刷洗植株叶片表面,收集刷洗液定容,用于附着藻类生物量的测定及种类的鉴定.刷洗过的植物叶片用吸水纸吸干,在70 ℃条件下烘至恒重.此后每7天采样一次,直至植株上附着藻类群落组成及相对丰度与前一次基本一致时结束试验.实验进行了28 d,实验期间日最高温度为33 ℃,最低为14 ℃;中午11:00左右水面光照强度范围为11680~12800 lx.
| 表 1 营养盐的处理方案 Table 1 Treatment scheme with different nutrient |
由于所有藻类都含有叶绿素a(Chl.a),通常用Chl.a的含量来快速估计藻类的生物量.本文用Chl.a的含量来表示藻类生物量,取一定体积附着藻类备用液,通过混合纤维滤膜抽滤,抽滤后将滤膜装入带塞的试管中,加入4 mL热乙醇,萃取后过滤、定容、测吸光度(陈宇炜等,2006).
2.3.2 附着藻类的鉴定与计数用软毛刷刷下待测植物叶片上的附植藻类,加入鲁哥试剂(胡鸿钧等,2006),静置48 h后,用偏光显微镜进行藻类的鉴定(胡鸿钧等,2006).藻类群落中相对丰度为10%以上的藻种被认为是群落优势种(何剑锋等,2005).
2.4 数据处理利用Excel2003和SPSS19.0软件对数据进行统计分析,利用Origin9.0对数据进行图形处理.
3 结果与分析(Results and analysis) 3.1 不同沉水植物附着藻类生物量图 1为实验结束时,不同处理组苦草和狐尾藻上附着藻类生物量.由图 1可知,苦草与狐尾藻的附着藻类生物量均随氮、磷浓度的增加呈现显著增加的趋势.苦草上,T3处理组的藻类生物量分别是T1、T2处理组的1.94、1.65倍;狐尾藻上,T3处理组的藻类生物量分别是T1、T2处理组的3.19、1.64倍.在相同氮、磷浓度下,狐尾藻上的藻类生物量均高于苦草,且随氮、磷浓度增加差距越来越大.
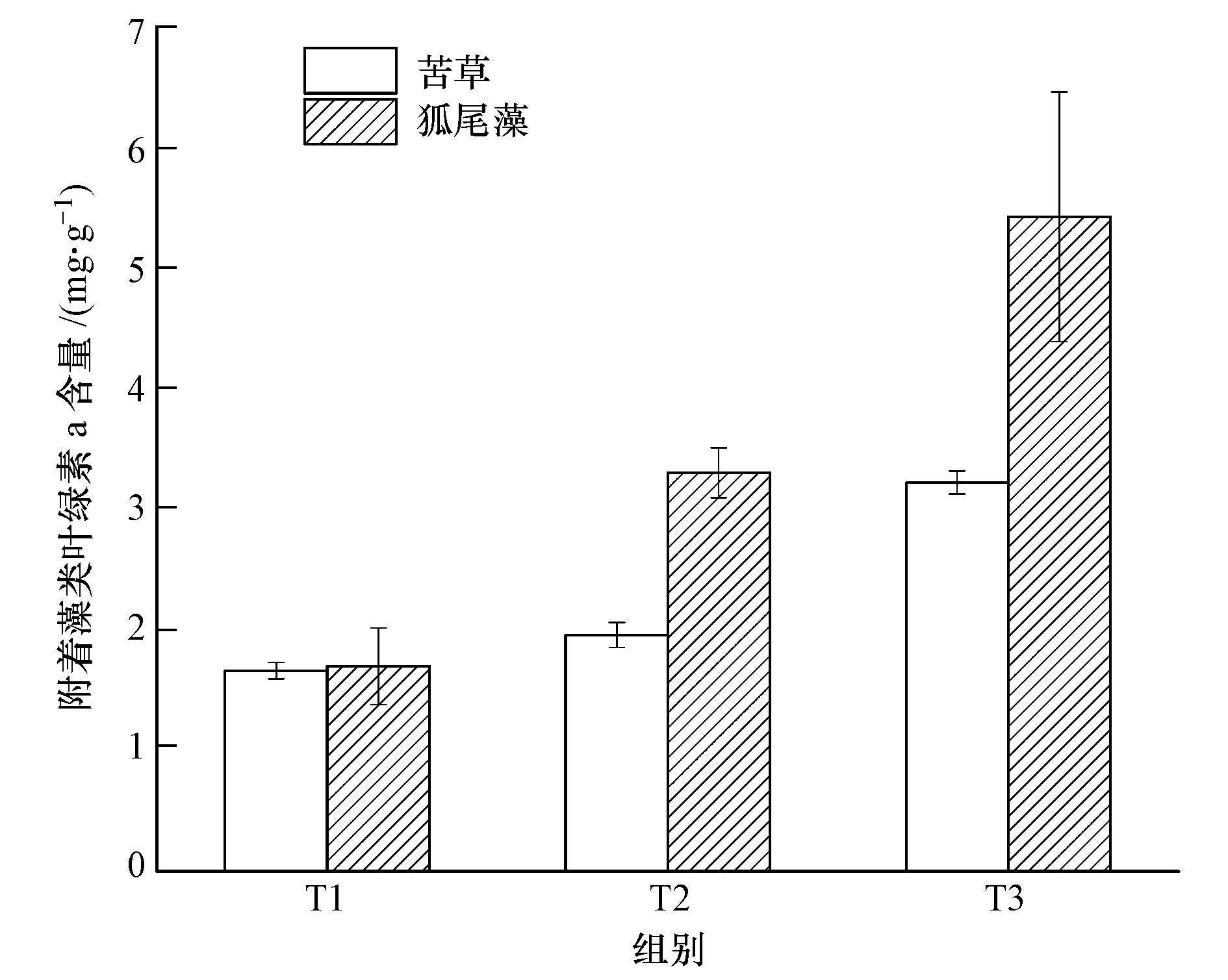 |
| 图 1 不同植物附着藻类的生物量 Fig. 1 Biomass of epiphytic algae living on different submerged plants |
表 2为附着藻类生物量对宿主植物(苦草和狐尾藻)和氮、磷浓度的双因素方差分析.由表 2可以看出,宿主植物和氮、磷浓度对附着藻类生物量有极显著的影响,且这两个因素对附着藻类生长的影响具有显著的交互作用.
| 表 2 附着藻类生物量的双因素方差分析 Table 2 Double factor variance analysis of epiphyte biomass |
图 2是不同氮、磷处理组中苦草和狐尾藻上硅藻、蓝藻和绿藻的相对丰度.从图 2中可知,随水体氮、磷浓度的增加,狐尾藻上的硅藻丰度随之降低,而蓝藻、绿藻的丰度在升高;而对于苦草来说,硅藻丰度随水体氮、磷浓度的增加先降低后升高,蓝藻的丰度先升高后降低,绿藻的丰度在T3处理组中较低.进一步分析各处理组中两种沉水植物上的藻类发现,苦草上附着藻类群落中硅藻、蓝藻占绝对优势,绿藻丰度较小.而狐尾藻上的附着藻类群落的优势藻类与苦草上的有所不同,其群落中硅藻、绿藻占绝对优势,蓝藻丰度相对较少.
 |
| 图 2 附着藻类群落组成 Fig. 2 Community composition of epiphytic algae |
图 3是在不同氮、磷浓度下两种沉水植物上附着藻类群落中的优势种属.从图 3可以看出,不同处理组,两种沉水植物上的优势种数及其相对丰度存在差异.在T1处理组中,苦草上附着藻类以硅藻门的小环藻(Cyclotella)占绝对优势,其相对丰度为36.2%;其次是硅藻门的直链藻(Melosira)、蓝藻门的隐杆藻(Aphanothece)和鱼腥藻(Anabeana)及绿藻门的小球藻(Chlorella)占优势,其相对丰度分别为14.4%、15.9%、10.0%和15.4%.狐尾藻上的附着藻类也以硅藻门的小环藻(Cyclotella)占绝对优势,其相对丰度为41.5%;其次是绿藻门的小球藻(Chlorella)和硅藻门的直链藻(Melosira),其相对丰度分别为30.2%和12.5%.在T2处理组中,小环藻(Cyclotella)在苦草及狐尾藻上仍占绝对优势,其相对丰度分别为30.3%和32.6%;其次,苦草上的隐杆藻(Aphanothece)、微囊藻(Microcystis)、色球藻(Chroococcus)及小球藻(Chlorella)也是优势藻,其相对丰度分别为14.9%、11.0%、14.1%和14.9%;而狐尾藻上的小球藻是优势藻,其相对丰度为29.9%.T3处理组中,苦草上以硅藻门的直链藻(Melosira)、小环藻(Cyclotella)、舟形藻(Navicula)和蓝藻门的微囊藻(Microcystis)为优势藻,其相对丰度分别为18.6%、23.2%、10.2%和24.4%;狐尾藻上绿藻门的小球藻(Chlorella)与针丝藻(Raphidonema)及硅藻门的小环藻(Cyclotella)占优势,其相对丰度分别为18.0%、18.6%及20.4%.不同的处理组中,小环藻(Cyclotella)在两种沉水植物上均为优势藻,而微囊藻(Microcystis)在中、高处理组(T2、T3)中的苦草上为优势藻,在狐尾藻上不是优势藻.
 |
| 图 3 附着藻类种群组成 Fig. 3 Specific community composition of epiphytic algae |
附着藻类与其宿主植物苦草和狐尾藻一样,是水体的初级生产者.氮、磷作为其生源要素,对沉水植物生长及附着藻类群落发展产生影响.随着水体氮、磷等营养盐的增加,附着藻类生物量迅速增加(卡尔夫,2011;Havens et al.,1999;Russell et al.,2005).而繁茂的沉水植物为附着藻类提供附着表面和可利用的营养物质等,有利于附着藻类的生存和发展(姚洁等,2010;卡尔夫,2011).但由于不同沉水植物的形态特征及代谢不同,其上附着藻类的发展存在着差异.本实验中两种沉水植物中的狐尾藻,叶片丝状全裂,而苦草叶片呈带形,相对而言,狐尾藻叶片具有较高的比表面积,能够为附着藻类提供有利的附着和生长环境(由文辉,1999).这可能是在相同的氮、磷浓度下,狐尾藻上藻类生物量大于苦草上藻类生物量的原因之一.本试验中两种沉水植物上的藻类均以硅藻门、蓝藻门及绿藻门占优势,苦草上附着藻类群落中硅藻门、蓝藻门占绝对优势,而狐尾藻上附着藻类群落中硅藻门、绿藻门占绝对优势,但二者上附着的藻类大多数时期硅藻门最多,占40%~65%.通常情况下,由于硅藻具有胶质粘性的结构,由胶质孔分泌的胶质或由胶质柄较易固着在小突起和障碍物上,具有很强的附生能力(胡鸿钧等,2006),这也可能是硅藻在附着藻类中占优势的原因.国内外的一些研究结果也与本实验结果相似(Jaskowiak et al.,2004;Pizarro et al.,2002),如白羽军等(2004)研究的1991—1999年松花江黑龙江段,以及王丽卿等(2012)研究的淀山湖等,都是硅藻、蓝藻、绿藻在附着藻类群落结构组成中占优势且硅藻门最多.念宇等(2009)在研究不同基质上附着藻类时发现,硅藻门始终都是优势种.事实上,沉水植物的叶片形态、叶片释放物及叶片更新速率等自身的生理特征对附着生物群落的组成结构有着显著的影响(James et al.,2006;Robets et al.,2003).沉水植物通过与附着藻类竞争光、热和营养物质及分泌抑藻物质,破坏藻类的生理代谢功能,影响藻类的生长(边归国等,2012).由于不同藻类对化感物质的敏感程度不同,并且不同沉水植物的抑藻能力也存在差异(胡建立等,2012),因此,不同沉水植物上附着藻类的群落组成和优势藻不同.
附着藻类的存在,无疑会对沉水植物生长产生影响.近年来一些研究表明,附着藻类对沉水植物光合作用产生影响,进而影响沉水植物的生长(曹永旭等,2009;魏宏农,2013;李佩等,2012;Harwell et al.,2003).但在寡营养湖中,水体氮、磷等营养物质的浓度较低,附着藻类主要通过宿主植物从沉积物中获得营养,附着藻类的发展受到宿主植物的制约(Robets et al.,2003;卡尔夫,2011).随着水体中氮、磷等营养物质增加,附植藻类可直接从水体中获得氮、磷等营养元素满足自身生长需要,生物量急剧增加(Havens et al.,1999;Russell et al.,2005),不利沉水植物生长,导致水草过早凋落(由文辉,1999;Kim et al.,1999).而本试验的结果表明,不同的沉水植物在相同浓度氮、磷的水体中,其生物量及种群组成存在差异,这也为富营养化水体生态修复过程中沉水植物群落的构建提供了一定的依据.
5 结论(Conclusions)1) 苦草与狐尾藻的附着藻类生物量随氮、磷浓度上升呈现显著增加的趋势;在相同的氮、磷浓度下,狐尾藻上附着藻类生物量均高于苦草,且随氮、磷浓度升高差异变大.
2) 不同沉水植物上藻类均以硅藻门、蓝藻门及绿藻门占优势,但苦草上附着藻类群落中硅藻门、蓝藻门占绝对优势,而狐尾藻上附着藻类群落中硅藻门、绿藻门占绝对优势.两种沉水植物上优势藻组成和优势藻数量存在差异.
| [1] | 白羽军, 杨翠英, 李中宇.2004. 松花江哈尔滨江段着生藻类群落的研究[J]. 黑龙江环境通报 , 2004, 27 (2) : 73–74. |
| [2] | 边归国, 赵卫东, 来达.2012. 沉水植物化感作用抑制藻类生长的研究与应用[J]. 北方环境 , 2012, 24 (1) : 59–64. |
| [3] | Brix H. 1997. Do macrophytes play a role in constructed treatment wetlands?[J]. Water Science and Technology , 35 (5) : 11–17. DOI:10.1016/S0273-1223(97)00047-4 |
| [4] | 曹永旭, 曹诗林.2009. 不同浓度富营养化水体中附着藻类对苦草生长影响的初步研究[J]. 人民珠江 , 2009, 30 (3) : 17–19. |
| [5] | 陈韬.2012. 筼筜湖藻类与氮磷营养盐相关性研究[J]. 海峡科学 , 2012 (6) : 17–18. |
| [6] | 陈宇炜, 陈开宁, 胡耀辉.2006. 浮游植物叶绿素a测定的"热乙醇法"及其测定误差的探讨[J]. 湖泊科学 , 2006, 18 (5) : 550–552. |
| [7] | 丰茂武, 吴云海, 冯仕训, 等.2008. 不同氮磷比对藻类生长的影响[J]. 生态环境 , 2008, 17 (5) : 1759–1763. |
| [8] | Harwell M C, Havens K E. 2003. Experimental studies on the recovery potential of submerged aquatic vegetation after flooding and desiccation in a large subtropical lake[J]. Aquatic Botany , 77 (2) : 135–151. DOI:10.1016/S0304-3770(03)00101-3 |
| [9] | Havens K E, East T L, Rodusky A J, et al. 1999. Littoral periphyton responses to nitrogen and phosphorus:an experimental study in a subtropical lake[J]. Aquatic Botany , 63 (3) : 267–290. |
| [10] | 何剑锋, 王桂忠, 李少菁, 等.2005. 北极拉普捷夫海春季冰藻和浮游植物群落结构及生物量分析[J]. 极地研究 , 2005, 17 (1) : 1–10. |
| [11] | 黄娟, 王世和, 钟秋爽, 等.2009. 植物生理生态特性对人工湿地脱氮效果的影响[J]. 生态环境学报 , 2009, 18 (2) : 471–475. |
| [12] | 胡鸿钧, 魏印心. 2006. 中国淡水藻类-系统、分类及生态[M]. 北京: 科学出版社 . |
| [13] | 胡建立, 周迟骏, 祈小丹, 等.2012. 淡水水生植物化感控藻的研究进展[J]. 安徽农业科学 , 2012, 40 (2) : 956–957. |
| [14] | James C S, Eaton J W, Hardwick K. 2006. Responses of three invasive aquatic macrophytes to nutrient enrichment do not explain their observed field displacements[J]. Aquatic Botany , 84 (4) : 347–353. DOI:10.1016/j.aquabot.2006.01.002 |
| [15] | Jaskowiak M A, Fawley K P, Fawley M W. 2004. 72 An examination of the periphytic algae in the sheyenne river,north dakota,usa,and the factors influence the community structure[J]. Journal of Phycology , 39 (s1) : 25–25. |
| [16] | 卡尔夫. 2011. 湖沼学:内陆水生态系统[M]. 北京: 高等教育出版社: 443 -445. |
| [17] | Kim M A, Richardson J S. 1999. Effects of light and nutrients on grazer-periphyton interactions[J]. Proc Biology and Management of Species and Habitats at Risk,Kamloops,BC , 2 : 15–19. |
| [18] | 李冰.2013.氮磷营养盐与藻类生长相关性研究[D].济南:山东建筑大学 http://cdmd.cnki.com.cn/Article/CDMD-10430-1013205911.htm |
| [19] | 李佩, 谢从新, 何绪刚, 等.2012. 水体营养水平及附着藻类对苦草生长的影响[J]. 渔业现代化 , 2012, 39 (1) : 11–17. |
| [20] | 李晓山, 杨敏, 刘富舜, 等.2011. 氮磷比对藻类竞争生长的影响[J]. 安徽农业科学 , 2011, 39 (16) : 9815–9817. |
| [21] | 念宇, 韩耀宗, 杨再福.2009. 不同基质上着生生物群落生态学特性比较研究[J]. 环境科技 , 2009, 22 (5) : 14–17. |
| [22] | Pizarro H, Vinocur A, Tell G. 2002. Periphyton on artificial substrata from three lakes of different trophic status at Hope Bay (Antarctica)[J]. Polar Biology , 25 (3) : 169–179. |
| [23] | 秦伯强, 高光, 胡维平, 等.2005. 浅水湖泊生态系统恢复的理论与实践思考[J]. 湖泊科学 , 2005, 17 (1) : 9–16. |
| [24] | Reid R, Greenberg M, Lorincz A, et al. 2007. Macrophyte-phytoplankton interactions:the relative importance of allelopathy versus other factors[J]. Ecological Modelling , 204 (1/2) : 85–92. |
| [25] | Roberts E, Kroker J, Körner S, et al. 2003. The role of periphyton during the re-colonization of a shallow lake with submerged macrophytes[J]. Hydrobiologia , 506 (1/3) : 525–530. |
| [26] | Russell B D, Elsdon T S, Gillanders B M, et al. 2005. Nutrients increase epiphyte loads:broad-scale observations and an experimental assessment[J]. Marine Biology , 147 (2) : 551–558. DOI:10.1007/s00227-005-1571-3 |
| [27] | 宋玉芝, 赵淑颖, 杨美玖.2014. 氨氮浓度及基质对附着藻类群落组成的影响[J]. 环境科学学报 , 2014, 34 (5) : 1173–1177. |
| [28] | 王华, 逄勇, 刘申宝, 等.2008. 沉水植物生长影响因子研究进展[J]. 生态学报 , 2008, 28 (8) : 3958–3968. |
| [29] | 王丽卿, 张玮, 范志锋, 等.2012. 淀山湖生态示范区附着藻类季节动态变化研究[J]. 农业环境科学学报 , 2012, 31 (8) : 1596–1602. |
| [30] | 魏宏农.2013.附着藻类与水体营养盐及沉水植物衰亡的关系[D].南京:南京师范大学 http://cdmd.cnki.com.cn/article/cdmd-10319-1013339523.htm |
| [31] | 吴明丽, 李叙勇.2012. 光衰减及其相关环境因子对沉水植物生长影响研究进展[J]. 生态学报 , 2012, 32 (22) : 7202–7212. |
| [32] | 姚洁, 刘正文.2010. 罗非鱼对附着藻类和浮游植物影响的初步研究[J]. 生态科学 , 2010, 29 (2) : 147–151. |
| [33] | 由文辉.1999. 淀山湖着生藻类群落结构与数量特征[J]. 环境科学 , 1999, 20 (5) : 59–62. |
| [34] | 张晶, 刘存歧, 张亚娟, 等.2014. 穗花狐尾藻附着藻类对不同氮·磷浓度的响应[J]. 安徽农业科学 , 2014, 42 (28) : 9887–9890. |
 2016, Vol. 36
2016, Vol. 36


