2. 武汉大学土木建筑工程学院, 武汉 430072
2. School of Civil Engineering, Wuhan University, Wuhan 430072
WU Feng, fengwu@whu.edu.cn
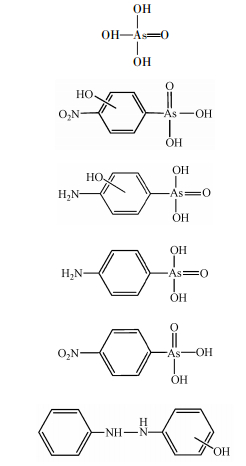
自20世纪50年代起, 有机砷化合物就因其具有提高饲料效率、促进动物生长(杨凤, 1999)、有效抑制肠道中部分有害菌生长(邱亦秀, 2006)、使动物皮红毛亮、不会残留于禽畜产品中、不产生耐药性及交叉耐药性等优点, 被作为饲料添加剂进行了深入研究并广泛应用于动物养殖业.目前主要应用的有机砷饲料添加剂是阿散酸(对氨基苯胂酸, p-ASA, 图 1)和洛克沙胂.有关洛克沙胂的环境行为与归趋已有一些研究与报道(Bednar et al., 2003;Brown et al., 2005;Garbarino et al., 2003;Rutherford et al., 2003), 而关于p-ASA的研究则比较缺乏.且p-ASA在中国养殖业中使用广泛、剂量大(Yao et al., 2013), Liu等(Liu et al., 2015)研究报道在珠江三角洲地区的密集型养猪场附近环境基质中砷的主要形式是p-ASA和无机的As(Ⅴ)、As(Ⅲ).
 |
| 图 1 p-ASA结构式 Fig. 1 The molecular structure of p-ASA |
已知p-ASA在动物体内吸收转化效率较低, 大部分以原型排出体外(Morrison, 1969), 直接进入到养殖场土壤和水体中(Liu et al., 2015).p-ASA在环境中受各种因素作用而发生多途径转化, 除微生物转化(郭瑞子, 2015)外, 化学转化包括直接光降解(Arroyo-Abad et al., 2012; Zhu et al., 2014)、受HO·(Xu et al., 2007)、1O2等基团作用而氧化, 会产生毒性更高的无机砷形态As(Ⅲ)、As(Ⅴ)(Mitchell et al., 2011), 造成环境砷污染.但前人对1O2与p-ASA反应的过程研究尚未见报道.
本文选取亚甲基蓝(MB)作为光敏剂(Ronzani et al., 2013), 采用LED灯(λ=660 nm)作为激发光源, 在体系中生成1O2, 以研究其对水中p-ASA的氧化降解.考察溶液初始pH、光照强度、光敏剂浓度等因素对于反应的影响, 还考察以太阳光为光源时, p-ASA在体系中的氧化降解情况.选取糠醇(FFA)作为探针, 测试并计算了1O2与p-ASA的反应速率常数.
2 实验部分(Experiments) 2.1 实验试剂及仪器阿散酸(C6H8AsNO3, 98%)、KOH(GR)、苯酚, 购自阿拉丁工业公司;亚甲基蓝(AR), 购自天津市远航化学品有限公司;糠醇(C5H6O2, 98%), 购自上海金山亭新化工试剂厂;盐酸(HCl, GR)、NaOH(AR)、KBH4(AR)、抗坏血酸(AR)、硫脲(AR)、甲酸(HCOOH, 88%), 均购自国药集团化学试剂有限公司;甲醇为色谱级;实验用水均为超纯水(电阻率≥18 MΩ·cm, 25℃).
高效液相色谱仪(HPLC, 日本岛津LC-10A);AFS-8230氢化物发生-原子荧光度计(北京吉天);pHS-3C精密pH计(上海雷磁仪器厂);78-1型磁力加热搅拌器(江苏省金坛市荣华仪器制造有限公司);DLSB-5/25型低温冷却液循环泵(巩义市予华仪器有限责任公司);自制LED灯板(λ=660 nm, 单灯板光强约(115±10)W·m-2).
2.2 实验装置及方法实验装置如图 2所示, 反应器为内径66 mm、外径101 mm、高160 mm的圆柱体玻璃容器(容积约为550 mL), 外接循环冷凝水控温, 四周等距离外置4块LED灯板, 底置一磁力搅拌器.实验利用光敏剂(sens)参与下产生的1O2来降解底物, 其光敏氧化法机理已被广泛研究(王自军, 2004;熊楚才, 1987):

|
 |
| 图 2 实验装置图(Xu et al., 2013) Fig. 2 The image of experimental device(Xu et al., 2013) |
MB是常用的光敏剂之一, 具有廉价、低毒、能在体系中高效产生1O2、不干扰p-ASA和无机As的测定等优点, 且对于用MB作为光敏剂、利用光敏氧化法降解特定物质的研究比较充分, 故而在此选用MB作为光敏剂.用光纤光谱仪扫描实验光源, 可知灯板光源波长在660 nm左右, 属于可见红光, 接近MB的最大吸收波长.在该波长照射下, MB成为激发态, 并将能量传递给基态氧, 在体系中产生1O2;且该波长光能较低, 其对反应液的照射不会在体系中产生其他具有氧化性的自由基.
且已有研究(毕刚, 2000)论证了亚甲基蓝是通过1O2历程来完成对底物的光降解, 但不排除体系中出现其他自由基, 如汪守建等(2004)提到1O2与糖或多元醇类底物反应会有其他自由基产生, 因此认为体系中1O2的产生为一级反应, 如果有产生其他自由基也为次级反应, 故不做讨论.
2.3 分析方法p-ASA浓度用HPLC分析, 色谱柱为C18柱(5μm, 4.6 mm×150 mm), 流动相为甲醇/水=5/95(V/V, 加2.5‰甲酸), 流速1.00 mL·min-1, 检测波长为254 nm, 进样量50μL, 柱温25℃, 保留时间约为4.8 min.测定FFA浓度时, 流动相为甲醇/水=20/80(V/V), 检测波长为220 nm.HPLC方法测定p-ASA的检测限为2.17μg·L-1(按p-ASA中As计算), 相对标准偏差为0.48%.采用氢化物发生-原子荧光度法(HG-AFS)分别测定As(Ⅲ)和总As(Total)的浓度, 通过差减法得到As(Ⅴ)的浓度(Ren et al., 2011;Wang et al., 2013).HG-AFS测定As的检测限为0.03μg·L-1, 相对标准偏差为0.49%.
3 结果与讨论(Results and discussion) 3.1 对照实验中p-ASA的降解实验证明, 暗反应条件下, 在25℃、pH=10、含5 mg·L-1 MB的体系中初始浓度为500μg·L-1的p-ASA没有随反应时间的增加而减少;光反应条件下, 在25℃、pH=10、不含MB的体系中初始浓度为500μg·L-1的p-ASA也不随光照时间的增加而有所变化;由此可知光敏剂和光照都是反应进行的必要条件.为确定分子氧在反应体系中的作用, 分别在敞口和密封通N2条件下进行实验.为确保体系中无分子氧存在, 预先向反应体系中通N2 30 min, 反应开始后仍持续通N2至反应结束.结果如图 3所示, 持续通N2能很好地抑制p-ASA的氧化降解, 分子氧也是体系中p-ASA氧化反应进行的必要条件.综上所述, 体系中p-ASA的降解实际上是一个光敏化产生1O2氧化的过程.
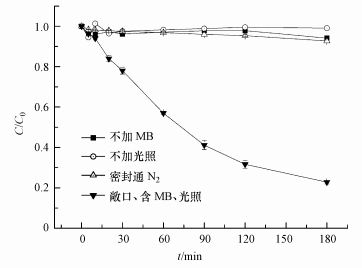 |
| 图 3 p-ASA在不同体系中的浓度变化 Fig. 3 Changes of p-ASA concentrations in different systems |
实验研究了在光照条件下, 体系控制温度为25℃、pH=9.0、含5 mg·L-1 MB时, 初始浓度为500μg·L-1(按p-ASA中As计算, 下同)的p-ASA的氧化降解, 如图 4所示.结果表明, 光照180 min后有56.8%的p-ASA被氧化降解, 反应过程中产生无机砷主要以As(Ⅴ)的形式存在(占95%以上), 且总砷含量有所减少.暗反应条件下, MB分别与p-ASA、As(Ⅲ)、As(Ⅴ)共存时, 并不会出现总砷含量减少的现象, 可知在暗反应条件下MB不会与p-ASA、As(Ⅲ)、As(Ⅴ)发生反应或影响测试.由此可知, 在光反应时, 造成总砷含量减少的原因可能是体系中存在未被监测到的其他有机砷的形态, 如硝苯胂酸(Czaplicka et al., 2015)等.
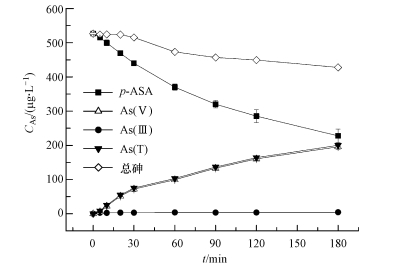 |
| 图 4 体系中有机砷、无机砷、总砷测定(As(T)=As(III)+As(V);总砷=p-ASA+ As(T)) Fig. 4 The determination of organoarsenic, inorganic arsenic and total arsenic(As(T)=As(III)+As(V); Total arsenic=p-ASA+As(T)) |
在控制温度为25℃、含5 mg·L-1 MB的体系中, pH变化对初始浓度为500μg·L-1的p-ASA的氧化效果的影响见图 5.实验结果表明, pH值显著影响p-ASA的初始降解速率及降解效率.从图 5可知, pH=8.0时初始速率r0=1.683μg·L-1·min-1(按p-ASA中As计算, 下同), pH=11.0时r0=5.156μg·L-1·min-1, 当pH从8提高到11时, p-ASA的降解效率不断增加.在pH=11的体系中光反应180 min后, p-ASA的降解效率可以达到85.3%;但在pH=8的反应体系中光照相同时间, p-ASA的氧化率只能达到45.2%;而当pH从8.0降到6.0时, p-ASA的降解效率变化不大, 初始反应速率略有回升.
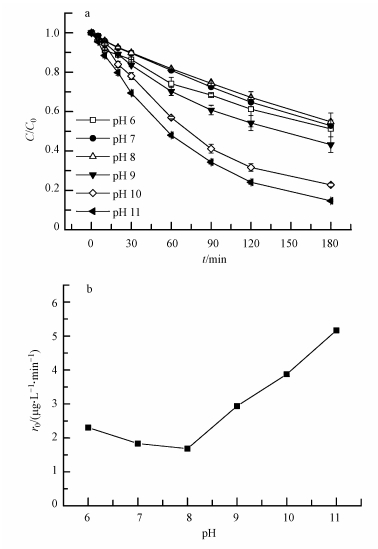 |
| 图 5 不同pH条件下p-ASA的降解效果(a)和初始降解速率(0~30 min)(b) Fig. 5 Effect of pH on the oxidation of p-ASA (a) and the initial reaction rate of p-ASA (b) under different pH(0~30 min) |
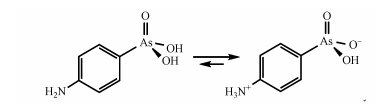
由于光敏剂MB是一种碱性染料, 在水溶液中会形成其弱碱的水解平衡:RCl+H2O→ROH+H++Cl-, 在MB的水溶液中, 实际上起光敏剂作用的可能是其ROH形式(李湘中, 1984).因而在偏碱性条件下, 有利于体系中1O2的产生, 进而促进了p-ASA的氧化降解.因此在碱性条件下p-ASA有更显著的氧化降解效果.p-ASA随体系的pH变化会以不同的形态存在, 已知其pKa=2、4.02、8.92(Jaafar, 2012).p-ASA表现为负电荷离子, 有利于其进行转化;在pH=6~8时, p-ASA的存在形式改变, 可能有利于其自身光敏产1O2促进自身降解, 同时还可能改变了其与单线态氧的反应效率进而影响降解效率.同时还可能因为1O2与p-ASA的反应速率常数在不同pH值条件下有所不同, 故而不同pH条件下p-ASA降解效果有差异.
3.4 光照强度的影响在控制温度为25℃、pH=10、MB浓度为5 mg·L-1、p-ASA初始浓度为500μg·L-1的条件下, 考察了不同光源光强对p-ASA的氧化效果的影响.分别开启1、2、3、4块灯板, 实验结果如图 6所示.结果表明, 随着光照强度的增加, p-ASA转化率不断增加.光照180 min后, 灯板数量为1时, p-ASA降解效率仅为33.3%, 而当灯板数量提高到2和3时, p-ASA降解效率分别提高了19.2%和34.8%, 而当开启4块灯板时, p-ASA降解效率可达到76.9%.根据图 6可知p-ASA降解反应的初始速率与光强呈线性相关.这是因为光照强度越大, 单位时间内产生的光子数量越多, 相应的被激发的光敏剂浓度越高, 加快了体系中分子氧到1O2的过程, 从而提高了p-ASA的降解效率.
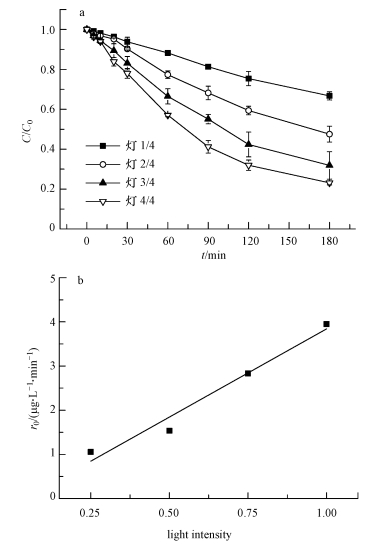 |
| 图 6 不同光强条件下p-ASA的降解效果(a)和初始降解速率(0~30 min)(b) Fig. 6 Effect of light intensity on the oxidation of p-ASA (a) and the initial reaction rate of p-ASA (b) under different light intensities(0~30 min) |
在控制温度为25℃、pH=10、p-ASA初始浓度为500μg·L-1的条件下, 实验设置了5个MB浓度水平(0.5、1、2、3、5 mg·L-1)用以研究其对p-ASA氧化效果的影响, 结果如图 7所示.实验结果将根据C/C0~t进行处理, 发现当MB浓度从0.5 mg·L-1增加到3 mg·L-1时, p-ASA降解率显著增加, 当MB浓度从3 mg·L-1增加到5 mg·L-1时, 增加效果不明显.由r0~t进行处理, 发现随MB浓度增加, 体系中p-ASA氧化降解的初始反应速率略有增加, 后趋于稳定.
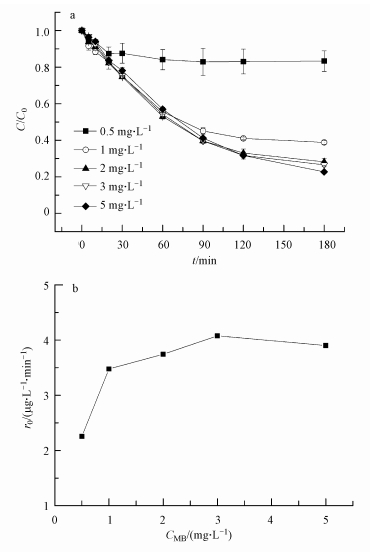 |
| 图 7 不同光敏剂浓度时p-ASA的降解效果(a)和初始降解速率(0~30 min)(b) Fig. 7 Effect of initial concentrations of MB on the oxidation of p-ASA (a) and the initial reaction rate of p-ASA (b) under different initial concentrations of MB(0~30 min) |
上述结果表明, MB浓度对p-ASA氧化降解有一定的影响.由于光敏剂浓度的增加, 反应系统所吸收的光能增多, 则活化光敏剂分子和基态氧分子的碰撞频率增高, 使得1O2的浓度提高, 从而利于反应进行;但当MB达到某一浓度、足以充分激发体系中基态氧分子为1O2时, p-ASA降解的初始反应速率及最终转化效率相差不多.
3.6 阿散酸与单线态氧反应速率常数计算选取FFA作为参考物, 利用竞争反应可测试得出1O2与p-ASA的反应速率常数.体系中FFA和p-ASA的降解情况见图 8a, 其初始反应速率见图 8b.
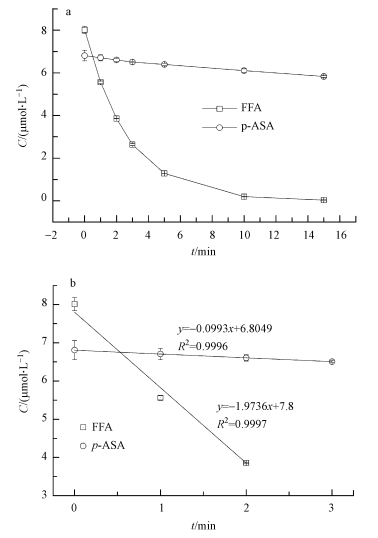 |
| 图 8 竞争反应中FFA与p-ASA在体系中的降解情况(a)和初始降解速率斜率为初始降解速率(b) Fig. 8 The oxidation of FFA and p-ASA in the competitive kinetics experiment (a) and the initial reaction rate of FFA and p-ASA (b) in the system |
根据竞争动力学方法(Yu et al., 2015), 体系中FFA和p-ASA的降解速率符合如下公式:
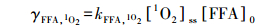
|
(1) |
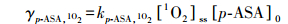
|
(2) |
方程(1)、(2)中, γFFA, 1O2、γp-ASA, 1O2分别为体系中FFA与 p-ASA的初始降解速率, 已知体系控温25℃、pH=10、含MB 5 mg·L-1, 体系中FFA的初始浓度为8.3301μmol·L-1、p-ASA的初始浓度为6.6756μmol·L-1, 且可知kFFA, 1O2=1.4×108 L·mol-1·s-1(pH=9), 计算可得1O2与p-ASA的反应速率常数, 即kp-ASA, 1O2=7.44×106 L·mol-1·s-1.
3.7 产物分析对p-ASA被光敏法产生的1O2氧化降解的产物进行分析, 并结合MB标样分析可排除杂质及MB碎片对分析的影响, 鉴定出的可能产物见表 1.结果可知, 在3.7 min和4.0 min左右出现的产物多为苯上的羟基取代产物, 随着保留时间的延长, 还可以检测到硝基苯胂酸、羟基偶氮苯等特征产物.由此可知, p-ASA受1O2作用会使As—C键断裂, 释放出无机砷, 且多为As(Ⅴ);同时体系中还存在氨基氧化反应、苯环上羟基取代等, 还可能产生偶氮苯类物质.
| 表 1 p-ASA的1O2氧化产物 Table 1 Oxidation products of p-ASA by 1O2 |
以太阳光为光源, 在控制温度为25℃、pH=10、含5 mg·L-1 MB条件下, 研究初始浓度为500μg·L-1的p-ASA光照180 min内的降解效果, 结果如图 9所示.在各个取样点测实时光照强度, 平均光强(W·m-2)=SUM(各取样点实时光强×到下一个取样点的时间间隔)/180 min.结果表明, p-ASA的氧化降解效果与太阳光光强成正相关.
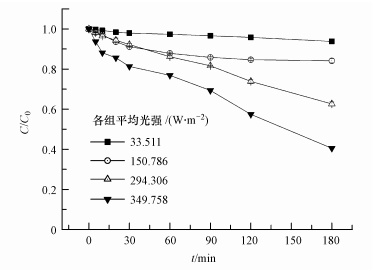 |
| 图 9 以太阳光为光源研究p-ASA降解效果 Fig. 9 The oxidation of p-ASA under sunlight |
1) 1O2能有效氧化降解p-ASA, 反应过程中p-ASA随时间减少, 同时产生无机砷且无机砷主要以As(Ⅴ)的形式存在;反应过程中总砷有所减少, 可能还存在未被监测到的其他有机砷的形态, 如硝基苯胂酸等.
2) 在偏碱性条件下p-ASA的降解速度比在近中性条件下要快得多;p-ASA氧化效果与光照强度呈线性相关;p-ASA氧化效果先随MB浓度增大而提高, 后趋于稳定(MB浓度大于3 mg·L-1).
3) 本文选取糠醇作为参考物, 测试并计算得出1O2与p-ASA的反应速率常数为7.44×106 L·mol-1·s-1.
| [${referVo.labelOrder}] | Arroyo-Abad U, Mattusch J, Möder M, et al. 2012. Identification of degradation products of phenylarsonic acid and o-arsanilic acid in contact with suspensions of soils of volcanic origin.[J]. Talanta , 99 (18) : 310–315. |
| [${referVo.labelOrder}] | Bednar A J, Garbarino J R, Ferrer I, et al. 2003. Photodegradation of roxarsone in poultry litter leachates[J]. The Science of the total environment , 302 (1/3) : 237–245. |
| [${referVo.labelOrder}] | 毕刚, 田世忠, 冯子刚, 等.2000. 氯氰菊酯光敏降解中单线态氧机理研究[J]. 分析科学学报 , 2000, 16 (6) : 450–455. |
| [${referVo.labelOrder}] | Brown B L, Slaughter A D, Schreiber M E. 2005. Controls on roxarsone transport in agricultural watersheds[J]. Applied Geochemistry , 20 (1) : 123–133. DOI:10.1016/j.apgeochem.2004.06.001 |
| [${referVo.labelOrder}] | Czaplicka M, Jaworek K, Bąk M. 2015. Study of photodegradation and photooxidation of p-arsanilic acid in water solutions at pH=7:kinetics and by-products[J]. Environmental Science & Pollution Research , 22 (21) : 16927–16935. |
| [${referVo.labelOrder}] | Garbarino J R, Bednar A J, Rutherford D W, et al. 2003. Environmental Fate of Roxarsone in Poultry Litter. I. Degradation of Roxarsone during Composting[J]. Environmental Science & Technology , 37 (8) : 1509–1514. |
| [${referVo.labelOrder}] | 郭瑞子, 罗雪莲, 张草, 等.2015. 阿散酸在模拟池塘水体中的降解消除规律及对水生态的影响[J]. 华南农业大学学报 , 2015, 36 (1) : 9–13. |
| [${referVo.labelOrder}] | Jaafar J. 2012. Separation of Phenylarsonic Compounds by Ion Pairing-Reversed Phase-High Performance Liquid Chromatography[J]. Jurnal Teknologi , 35 (1) : 71–80. |
| [${referVo.labelOrder}] | 李湘中.1984. 光敏氧化法处理苯酚废水的试验研究[J]. 水处理技术 , 1984 (01) : 11–18. |
| [${referVo.labelOrder}] | Liu X, Zhang W, Hu Y, et al. 2015. Arsenic pollution of agricultural soils by concentrated animal feeding operations (CAFOs)[J]. Chemosphere , 119 : 273–281. DOI:10.1016/j.chemosphere.2014.06.067 |
| [${referVo.labelOrder}] | Mitchell W, Goldberg S, Al-Abadleh H A. 2011. In situ ATR-FTIR and surface complexation modeling studies on the adsorption of dimethylarsinic acid and p-arsanilic acid on iron-(oxyhydr)oxides[J]. Journal of Colloid & Interface Science , 358 (2) : 534–540. |
| [${referVo.labelOrder}] | Morrison J L. 1969. Distribution of arsenic from poultry litter in broiler chickens, soil, and crops[J]. J agric food Chem , 17 (6) : 1288–1290. DOI:10.1021/jf60166a018 |
| [${referVo.labelOrder}] | 邱亦秀.2006. 有机砷制剂在饲料工业中的应用[J]. 江西饲料 , 2006 (5) : 3–4. |
| [${referVo.labelOrder}] | Ren C, Peng H, Huang W, et al. 2011. Speciation of inorganic As(V)/As(Ⅲ) in water and soil by hydride generation-atomic fluorescence spectrometry[J]. Fresenius Environ Bull , 20 : 1069–1074. |
| [${referVo.labelOrder}] | Ronzani F, Trivella A, Arzoumanian E, et al. 2013. Comparison of the photophysical properties of three phenothiazine derivatives:transient detection and singlet oxygen production[J]. Photochemical & Photobiological Sciences Official Journal of the European Photochemistry Association & the European Society for Photobiology , 12 (12) : 2160–2169. |
| [${referVo.labelOrder}] | Rutherford D W, Bednar A J, Garbarino J R, et al. 2003. Environmental fate of roxarsone in poultry litter[J]. PartⅡ. Mobility of arsenic in soils amended with poultry litter[J]. Environmental Science & Technology , 37 (8) : 1515–1520. |
| [${referVo.labelOrder}] | Wang Y, Jing X, Li J, et al. 2013. Natural montmorillonite induced photooxidation of As(Ⅲ) in aqueous suspensions:Roles and sources of hydroxyl and hydroperoxyl/superoxide radicals[J]. Journal of Hazardous Materials , 260 (18) : 255–262. |
| [${referVo.labelOrder}] | 王自军, 薛梅.2004. 单线态氧的光敏作用及其生物学意义[J]. 石河子大学学报:自然科学版 , 2004, 22 (5) : 450–454. |
| [${referVo.labelOrder}] | 汪守建, 王寿武, 刘德启, 等.2004. 亚甲基蓝光敏氧化处理造纸废水研究[J]. 工业安全与环保 , 2004, 30 (5) : 15–17. |
| [${referVo.labelOrder}] | 熊楚才, 栾和林.1987. 非均相光敏化氧化治理含酚废水的研究[J]. 环境化学 , 1987, 6 (3) : 37–44. |
| [${referVo.labelOrder}] | Xu J, Li J, Wu F, et al. 2013. Rapid Photooxidation of As(Ⅲ) through Surface Complexation with Nascent Colloidal Ferric Hydroxide[J]. Environmental Science & Technology , 48 (1) : 272–278. |
| [${referVo.labelOrder}] | Xu T L, Kamat P V, Joshi S, et al. 2007. Hydroxyl radical mediated degradation of phenylarsonic acid[J]. The Journal of Physical Chemistry A , 111 (32) : 7819–7824. DOI:10.1021/jp072135y |
| [${referVo.labelOrder}] | 杨凤. 1999. 动物营养学[M]. 北京: 中国农业出版社 . |
| [${referVo.labelOrder}] | Yao L X, Huang L X, He Z H, et al. 2012. Occurrence of Arsenic Impurities in Organoarsenics and Animal Feeds[J]. Journal of Agricultural & Food Chemistry , 61 (2) : 320–324. |
| [${referVo.labelOrder}] | Yu Y T, Zhou D N, Wu F. 2015. Mechanism and products of the photolysis of hexabromocyclododecane in acetonitrile-water solutions under a UV-C lamp[J]. Chemical Engineering Journal , 281 : 892–899. DOI:10.1016/j.cej.2015.07.031 |
| [${referVo.labelOrder}] | Zhu X D, Wang Y J, Liu C, et al. 2014. Kinetics, intermediates and acute toxicity of arsanilic acid photolysis[J]. Chemosphere , 107 : 274–281. DOI:10.1016/j.chemosphere.2013.12.060 |
 2016, Vol. 36
2016, Vol. 36