饮用水消毒过程产生消毒副产物是一类非常突出的水环境污染问题(Bull,1982; 李金燕等,2005).自三卤甲烷被发现以来,到目前为止,已经有超过80种的消毒副产物被鉴定出,主要有卤代甲烷类、卤代乙酸类、卤代乙晴类等(Roccaro et al.,2006).此外,还有大量新型消毒副产物,包括卤代胺、卤代酰胺、卤代硝基甲烷、亚硝胺、碘代酸和碘代呋喃酮等(Krasner et al.,2006).消毒副产物根据取代卤素的不同,主要有氯代消毒副产物、溴代消毒副产物和碘代消毒副产物这三大类,不同卤素取代消毒副产物的产生过程与消毒用氧化剂的种类有关(Fabbricino and Kroshin,2009).碘代消毒副产物的产生过程研究表明,氧化性更强的氯胺消毒工艺比传统的氯消毒技术更容易导致碘代消毒副产物的形成(Bichsel and Gunten,2000).因此,随着氯胺消毒等新型饮用水消毒技术的推广(赵玉丽和李杏放,2011),其导致的碘代消毒副产物容易产生问题,更值得引起重视.
已有的研究表明,消毒副产物对水生生物可以产生明显的毒效应.Fisher et al.(2014)研究发现消毒副产物能导致大型蚤(Daphnia magna)和鳉鱼(Cyprinodon variegatus)等多种水生生物急性或者慢性中毒;氯乙酰胺能够诱导斑马鱼代谢障碍并且引起抗氧化系统紊乱(Yu et al.,2015);氯代乙酸和溴代乙酸类物质在低剂量暴露条件下,就可以诱导鲫鱼淋巴细胞产生凋亡(Colman et al.,2011).研究表明,不同卤素取代的卤乙酸类消毒副产物毒性差异较大.碘代乙酸的遗传毒性是溴代乙酸的2倍(Woo et al.,2002),它是目前已知消毒副产物中遗传毒性最强的种类(Richardson et al.,2008).此外,碘代乙酸还被证实比氯代乙酸具有更强的细胞毒性(Plewa et al.,2004).
碘代乙酸亲水性强,比氯代和溴代乙酸具有更高的溶解度(赵玉丽和李杏放,2011),饮用水消毒过程产生的碘代乙酸能够通过各种途径进入到天然水体中.根据文献报道,饮用水厂出水中碘代消毒副产物的含量一般为μg·L-1量级(Hua et al.,2006).因此,碘代消毒副产物极有可能对水生生物产生毒效应,相关研究有待开展.因此,本研究以模式生物斑马鱼为研究对象,采用体内暴露实验,研究实际环境浓度碘代乙酸急性暴露对斑马鱼肝脏的氧化损伤效应,从抗氧化物标志物、抗氧化酶和解毒基因表达变化3个角度揭示其致毒机理.
2 材料与方法(Materials and methods) 2.1 试剂和材料碘代乙酸(CAS No. 64-69-7,分子式为C2H3IO2,分子量为185.96)购自百灵威公司(货号211794).活性氧(ROS)检测用2′,7′-二氢二氯荧光素二乙酸酯(DCFH-DA)购自美国Sigma公司.丙二醛(MDA)、蛋白含量、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽硫转移酶(GST)活性检测试剂盒均购自南京建成生物工程研究所.总RNA提取试剂盒购自杭州浩基生物科技有限公司.
成年斑马鱼(Danio rerio),每条体重约0.4 g,购自浙江杭州市花鸟市场斑马鱼繁殖专柜,雌雄各半.采用曝气除氯后自来水驯养3周后进行实验,水温25℃.
2.2 体内暴露实验实验用斑马鱼共分为4组,Ⅰ:对照组;Ⅱ:碘代乙酸浓度为1μg·L-1的暴露组;Ⅲ:碘代乙酸浓度为10μg·L-1的暴露组;Ⅳ:碘代乙酸浓度为100μg·L-1的暴露组.暴露实验在5 L的鱼缸中开展,采用半静止实验法,每组共30条斑马鱼,雌雄各半.光照周期为12 h: 12 h(光暗比),暴露96 h后,将斑马鱼取出冰晕,取出肝脏,称重后过液氮,保存在-80℃冰箱中待用.暴露实验过程中,未发现死亡的斑马鱼.
2.3 活性氧的测定称取0.1 g肝脏组织,按1∶20比例加入预冷的磷酸盐缓冲液(100 mmol·L-1),用玻璃匀浆器匀浆,转入离心管中于4℃离心10 min,取上清液.取96孔板,每孔加入190μL上清液和10μL浓度为1 mmol·L-1的DCFH-DA,混合均匀后在37℃孵育30 min.酶标仪检测激发波长488 nm,发射波长525 nm.检测结果以荧光强度·mg-1表示.
2.4 丙二醛含量和抗氧化酶活性的测定取匀浆好的组织,应用南京建成生物工程研究所试剂盒检测丙二醛含量、蛋白含量以及超氧化物歧化酶、过氧化氢酶、谷胱甘肽S转移酶活性.丙二醛含量以nmol·mg-1表示,酶活性以U·mg-1表示.
2.5 氧化应激标志性基因在mRNA水平相对表达量的测定肝脏组织中总RNA提取根据杭州浩基生物科技有限公司动物组织总RNA提取试剂盒说明书进行.应用分光光度计测定RNA含量,采用Bio-Rad基因扩增仪进行逆转录实验.基因表达水平使用SYBR Green I染料和美国iQTM5实时荧光定量PCR仪进行相对荧光定量检测.根据参考文献(Kim et al.,2013; Bresolin et al.,2005; Mukhopadhyay et al.,2015),CYP1A、CYP3A和GST这3种基因表达检测所用引物设计如表 1所示.PCR反应体系为20μL,反应条件为:95℃预变性5 min,95℃变性30 s,55℃退火40 s,72℃延伸30 s,45次循环.所有测量重复3次,基因相对表达水平以2(Ct内参基因-Ct目的基因)进行分析,结果以实验组基因相对于对照组基因变化倍数表示.
| 表 1 斑马鱼CYP1A、CYP3A和GST引物设计序列 Table 1 Sequences of primers of CYP1A, CYP3A and GST for Zebrafish (Danio rerio) |
每个实验数据有3个平行样,处理结果用平均数±标准偏差(mean±S.D.)表示.数据采用SPSS软件(12.0版)进行分析,应用单侧ANOVA法差异性检验,p<0.05表明差异显著,p<0.01表明差异极显著.
3 结果(Results) 3.1 活性氧含量的变化活性氧是生物机体氧化应激过程的重要标志物,可以灵敏地反应机体的氧化损伤状况.图 1显示了不同剂量碘代乙酸暴露诱导斑马鱼肝脏组织活性氧含量变化的规律.Ⅱ(10μg·L-1)和Ⅲ(100μg·L-1)暴露组的斑马鱼经碘代乙酸急性暴露后,活性氧含量与对照组相比较,差异极显著,分别增加了0.41倍(p < 0.01)和0.73倍(p < 0.01).
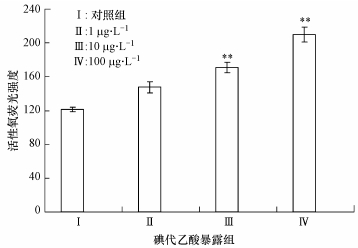 |
| 图 1 不同含量碘代乙酸急性暴露诱导斑马鱼肝脏组织中活性氧含量的变化 Fig. 1 Changes of ROS contents in the liver tissue of Zebrafish under acute exposure to different concentrations of iodine acetic acid |
丙二醛是细胞膜脂质过氧化的终产物之一,是判断脂质过氧化的重要指标.图 2显示了不同剂量碘代乙酸暴露诱导斑马鱼肝脏组织丙二醛含量变化的规律.Ⅱ(10μg·L-1)和Ⅲ(100μg·L-1)暴露组的斑马鱼经碘代乙酸急性暴露后,丙二醛含量与对照组相比较,差异极显著,分别增加了0.75倍(p < 0.01)和4.13倍(p < 0.01).
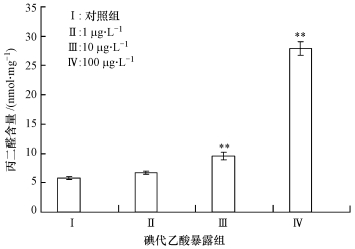 |
| 图 2 不同含量碘代乙酸急性暴露诱导斑马鱼肝脏组织中丙二醛含量的变化 Fig. 2 Changes of MDA contents in the liver tissue of Zebrafish under acute exposure to different concentrations of iodine acetic acid |
超氧化物歧化酶是抗氧化酶的典型代表,它对机体的氧化与抗氧化平衡起着至关重要的作用,能够有效清除超氧自由基,保护细胞免受损伤.图 3的结果表明,低剂量碘代乙酸急性暴露下,斑马鱼肝脏超氧化物歧化酶活性变化并不明显,当碘代乙酸暴露浓度增加到100μg·L-1,超氧化物歧化酶活性显著增加0.92倍(p < 0.01).
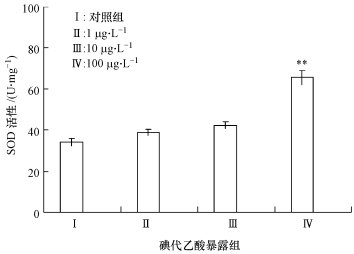 |
| 图 3 不同含量碘代乙酸急性暴露诱导斑马鱼肝脏组织中超氧化物歧化酶活性的变化 Fig. 3 Changes of SOD enzyme activities in the liver tissue of Zebrafish under acute exposure to different concentrations of iodine acetic acid |
过氧化氢酶同样是抗氧化酶的典型代表,它主要存在于生物的肝脏中,能够有效去除氧化应激产物过氧化氢.图 4的结果表明,低剂量碘代乙酸急性暴露下,斑马鱼肝脏过氧化酶活性变化并不明显,而当碘代乙酸暴露浓度增加到10μg·L-1后,过氧化氢酶活性受到抑制,下降0.17倍(p < 0.05);当碘代乙酸暴露浓度达到100μg·L-1,过氧化氢酶活性受到显著抑制,下降0.36倍(p < 0.01).
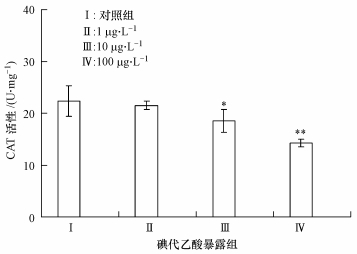 |
| 图 4 不同含量碘代乙酸急性暴露诱导斑马鱼肝脏组织中过氧化氢酶活性的变化 Fig. 4 Changes of CAT enzyme activities in the liver tissue of Zebrafish under acute exposure to different concentrations of iodine acetic acid |
谷胱甘肽S转移酶能够催化外来有害物质的亲电子基团与还原型谷胱甘肽的巯基偶联,增加其疏水性使其易于穿越细胞膜,从而解毒.图 5的结果表明,在低剂量碘代乙酸急性暴露下,斑马鱼肝脏谷胱甘肽S转移酶活性就明显升高,增加0.40倍(p < 0.05);当碘代乙酸暴露浓度增加到10μg·L-1和100μg·L-1后,谷胱甘肽S转移酶活性显著增加1.04倍(p < 0.01)和1.93倍(p < 0.01).
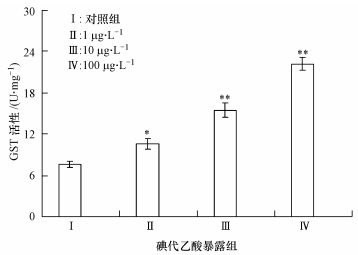 |
| 图 5 不同含量碘代乙酸急性暴露诱导斑马鱼肝脏组织中谷胱甘肽硫转移酶活性的变化 Fig. 5 Changes of GST enzyme activities in the liver tissue of Zebrafish under acute exposure to different concentrations of iodine acetic acid |
CYP1A是细胞色素P450混合功能酶中的重要一类亚族,能够催化多种体外异生质的降解和解毒过程.图 6的结果表明,低剂量碘代乙酸急性暴露下,斑马鱼肝脏CYP1A在mRNA水平上的表达并不明显,而当碘代乙酸暴露浓度增加到10μg·L-1和100μg·L-1后,其表达明显增强,分别增加1.7倍(p < 0.01)和5.3倍(p < 0.01).
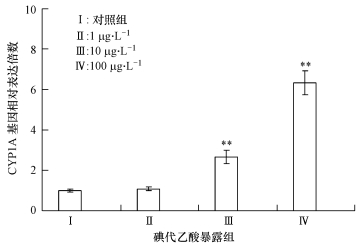 |
| 图 6 不同含量碘代乙酸急性暴露诱导斑马鱼肝脏组织中CYP1A基因表达的变化 Fig. 6 Changes of CYP1A mRNA expressions in the liver tissue of Zebrafish under acute exposure to different concentrations of iodine acetic acid |
CYP3A同样也是细胞色素P450混合功能酶中的重要亚族,能够将多种异生质转运到体外.图 7的结果表明,低剂量碘代乙酸急性暴露下,斑马鱼肝脏CYP3A在mRNA水平上的表达并不明显,而当碘代乙酸暴露浓度增加到10μg·L-1和100μg·L-1后,其表达明显增强,分别增加1.1倍(p < 0.01)和5.9倍(p < 0.01).
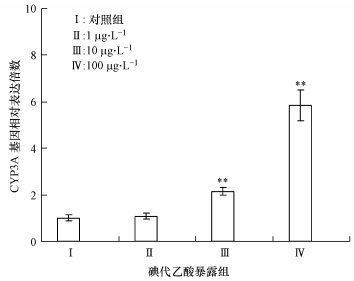 |
| 图 7 不同含量碘代乙酸急性暴露诱导斑马鱼肝脏组织中CYP3A基因表达的变化 Fig. 7 Changes of CYP3A mRNA expressions in the liver tissue of Zebrafish under acute exposure to different concentrations of iodine acetic acid |
GST主要是催化亲电反应,能够通过谷胱甘肽与产物结合成亲水化合物进行解毒.图 8的结果表明,在低剂量碘代乙酸急性暴露下,斑马鱼肝脏GST基因在mRNA水平上的表达显著增加,为对照组的1.8倍(p < 0.01);当暴露浓度增加到10μg·L-1和100μg·L-1后,其表达量增加更为显著,分别是对照组的3.2倍(p < 0.01)和7.7倍(p < 0.01).
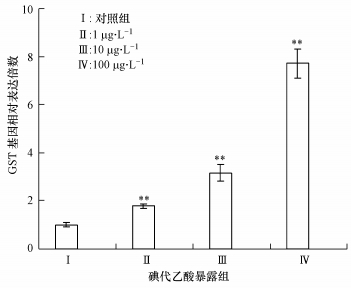 |
| 图 8 不同含量碘代乙酸急性暴露诱导斑马鱼肝脏组织中GST基因表达的变化 Fig. 8 Changes of GST mRNA expressions in the liver tissue of Zebrafish under acute exposure to different concentrations of iodine acetic acid |
外源异生质能够通过干扰组织内抗氧化酶系统,使脂质过氧化水平升高,诱导机体组织发生氧化应激(王玲等,2011);进一步可以破坏抗氧化防御系统,导致氧化性损伤(杜永兵等,2007),肝脏是机体最重要的解毒组织(徐维娜等,2008).ROS是生物机体中最主要的氧化应激产物,其含量的变化可以较好地反映氧化应激的强度.Bull等(2011)详细综述了消毒副产物氯代环戊烯、氯代腈、氯代胺等均能诱导ROS产生;近年来研究发现,氯苯醌类消毒副产物能够诱导生物体产生ROS(Li et al.,2015);碘代消毒副产物与氯代消毒副产物在化学结构上有所差异,但本研究证实,碘代乙酸急性暴露可以诱导斑马鱼肝脏产生活性氧,因此,诱导活性氧的产生有可能是消毒副产物的主要毒效应特点之一.针对LC106细胞的研究发现,相对于对照组,极低浓度的100μg·L-1的2,5-二氯苯醌体外暴露能够诱导细胞中产生两倍的ROS(p < 0.01)(Chen et al.,2015);而本研究中,当碘代乙酸的体内急性暴露剂量达到10μg·L-1,肝脏ROS含量即与对照组具有极显著差异,是对照组的1.41倍(p < 0.01);因此,从诱导剂量和暴露方式的角度两方面考虑,碘代乙酸具有更为明显的氧化应激能力.丙二醛作为脂质过氧化的终产物,同样可以表征氧化应激效应的强度.值得注意的是,并不是所有的消毒副产物都可以诱导生物体内丙二醛的产生,Du等(2013)报道4种氯代苯醌都不能够诱导T24细胞产生丙二醛;而本研究发现,10μg·L-1和100μg·L-1碘代乙酸急性暴露后,肝脏丙二醛含量与对照组相比较,分别增加了0.75倍(p < 0.01)和4.13倍(p < 0.01),差异均为极显著.这说明碘代乙酸对斑马鱼来说,是一种非常强力的氧化损伤诱导剂,在100μg·L-1等较高诱导剂量暴露后,斑马鱼肝脏的解毒功能酶系已经无法消除组织内产生的过量ROS物质,导致丙二醛含量成倍增加.
机体自身抗氧化系统包含有抗氧化酶系,保证机体正常运行.SOD和CAT是机体中清除氧自由基的关键酶,消毒副产物可以改变SOD等抗氧化酶的活性(范灿鹏等,2011).采用J774.A1细胞的研究发现,24 mmol·L-1剂量的消毒副产物二氯乙酸和三氯乙酸体外暴露都能够诱导该细胞系发生氧化应激,并且导致SOD酶活性分别增加4.2倍和3.1倍(Hassoun and Ray,2003);本实验发现,100μg·L-1碘代乙酸急性暴露96 h后,斑马鱼肝脏SOD活性显著增加0.92倍(p < 0.01);本研究中碘代乙酸诱导斑马鱼肝脏SOD活性增加量不如二氯乙酸和三氯乙酸对J774.A1细胞显著,主要原因在于本研究是采用体内暴露方法,而细胞体外暴露的方法诱导效果更明显.本研究还发现,当碘代乙酸暴露浓度达到100μg·L-1,过氧化氢酶活性受到显著抑制,下降0.36倍(p < 0.01).因此,文献报道和本文研究结果都证实在消毒副产物的暴露下,生物体内抗氧化酶系统会发生应答,力图消除外源物质入侵对机体造成的氧化损伤.作为非酶类还原性物质,GSH在鱼类肝脏组织的解毒功能中起关键作用,可以清除胞内ROS,而GST是GSH结合反应的关键酶,GST能够催化GSH巯基(—SH)与化合物结合,生成亲水物质(罗义等,2007;武小燕等,2013).对鲤鱼Cyprinus carpio的研究发现,二氧化氯消毒产生的副产物能够明显刺激GST的活性(Elia et al.,2006);本研究同样发现碘代乙酸对斑马鱼肝脏GST活性的刺激作用,当暴露浓度增加到10μg·L-1和100μg·L-1后,斑马鱼肝脏GST活性显著增加1.04倍(p < 0.01)和1.93倍(p < 0.01).上述这些结果都表明,在碘代乙酸作用下,斑马鱼肝脏可以明显产生抗氧化作用,SOD和GST酶会呈现一定的应激活性,清除体内自由基和外源异生质,使机体达到平衡稳定状态.
对本文实验结果进一步的比较可以发现,无论是氧化应激产物的含量、抗氧化酶和解毒酶活性还是解毒酶基因的表达都呈现出明显的剂量-效应关系.此外,相对于氧化应激产物以及抗氧化酶和解毒酶活性变化,斑马鱼肝脏P450酶CYP家族基因以及GST基因对于碘代乙酸的暴露更为敏感.CYP1A和CYP3A是细胞色素P450家族的重要成员,大量研究已经证实,在多种环境污染物的诱导下,鱼体组织中CYP1A和CYP3A的活性会由于调控基因被强烈诱导而显著增加(Hegelund et al.,2004).CYP1A和CYP3A都可以作为环境污染物生态健康风险评价的重要生物标志物(Hasselberg et al.,2004).谷胱甘肽硫转移酶是肝脏等组织中进行生物转化Ⅱ相反应的关键功能酶,其活性受到GST基因的调控.当碘代乙酸急性暴露浓度达到100μg·L-1,CYP1A、CYP3A和GST基因的表达强度分别是对照组的6.3倍(p < 0.01)、6.9倍(p < 0.01)和7.7倍(p < 0.01).它们的变化强度显然比ROS(1.73倍,p < 0.01)、SOD活性(1.92,p < 0.01倍)和CAT活性(0.36倍,p < 0.01)更强烈.因此,肝脏P450酶CYP基因以及GST解毒基因在mRNA水平上的表达变化,可以作为碘代乙酸生物毒性的重要敏感标志物.
5 结论(Conclusions)综上所述,10~100μg·L-1碘代乙酸急性暴露96 h后,斑马鱼的肝脏能够产生氧化应激效应,活性氧物质和脂质过氧化终产物都能够大量产生,抗氧化功能酶SOD和重要解毒酶GST的活性均被明显诱导.此外,调控肝脏解毒过程的重要基因CYP1A、CYP3A和GST在mRNA水平上的表达呈现显著增加的趋势.这些结果都表明,饮用水消毒过程导致的碘代消毒副产物对水生生物具有潜在的氧化损伤毒效应.CYP1A、CYP3A和GST基因的相对表达量比氧化应激指标更为灵敏,更适合作为碘代乙酸对水生生物毒效应评价的生物标志物.
| [${referVo.labelOrder}] | Bichsel Y, Gunten U V. 2000. Formation of Iodo-Trihalomethances during Disinfection and Oxidation of Iodide-Containing Waters[J]. Environmental Science & Technology , 34 : 2784–2791. |
| [${referVo.labelOrder}] | Bresolin T, De Freitas Rebelo M, Bainy A C D. 2005. Expression of PXR, CYP3A and MDR1 genes in liver of zebrafish[J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology , 140 (3/4) : 403–407. |
| [${referVo.labelOrder}] | Bull R J, Reckhow D A, Li X F, et al. 2011. Potential carcinogenic hazards of non-regulated disinfection by-products:Haloquinones, halo-cyclopentene and cyclohexene derivatives, N-halamines, halonitriles, and heterocyclic amines[J]. Toxicology , 286 (1/3) : 1–19. |
| [${referVo.labelOrder}] | Bull R J. 1982. Health effects of drinking water disinfectants and disinfectant by-products[J]. Environmental Science & Technology , 16 (10) : 554–559. |
| [${referVo.labelOrder}] | Chen Z L, Zhou Q H, Zou D D, et al. 2015. Chloro-benzoquinones cause oxidative DNA damage through iron-mediated ROS production in Escherichia coli[J]. Chemosphere , 135 : 379–386. DOI:10.1016/j.chemosphere.2015.04.076 |
| [${referVo.labelOrder}] | Colman J, Rice G E, Wright J M, et al. 2011. Identification of developmentally toxic drinking water disinfection byproducts and evaluation of data relevant to mode of action[J]. Toxicology and Applied Pharmacology , 254 (2) : 100–126. DOI:10.1016/j.taap.2011.02.002 |
| [${referVo.labelOrder}] | Du H Y, Li J H, Moe B, et al. 2013. Cytotoxicity and Oxidative Damage induced by Halobenzoquinones to T24 Bladder Cancer Cells[J]. Environmental Science & Technology , 47 (6) : 2823–2830. |
| [${referVo.labelOrder}] | 杜永兵, 李远友, 禹龙香, 等.2007. 三丁基锡对蓝子鱼的激素和酶指标及组织显微结构的影响[J]. 环境科学学报 , 2007, 27 (5) : 796–802. |
| [${referVo.labelOrder}] | Elia A C, Anastasi V, Dörr A J M. 2006. Hepatic antioxidant enzymes and total glutathione of Cyprinus carpio exposed to three disinfectants, chlorine dioxide, sodium hypochlorite and peracetic acid, for superficial water potabilization[J]. Chemosphere , 64 (10) : 1633–1641. DOI:10.1016/j.chemosphere.2006.01.035 |
| [${referVo.labelOrder}] | Fabbricino M, Korshin G V. 2009. Modelling disinfection by-products formation in bromide-containing waters[J]. Journal of Hazardous Materials , 168 (2/3) : 782–786. |
| [${referVo.labelOrder}] | 范灿鹏, 王奇, 刘昕宇, 等.2011. 四溴联苯醚对剑尾鱼毒性及其抗氧化系统的影响[J]. 环境科学学报 , 2011, 31 (3) : 642–648. |
| [${referVo.labelOrder}] | Fisher D, Yonkos L, Ziegler G, et al. 2014. Acute and chronic toxicity of selected disinfection byproducts to Daphnia magna, Cyprinodon variegates, and Isochrysis galbana[J]. Water Research , 55 : 233–244. DOI:10.1016/j.watres.2014.01.056 |
| [${referVo.labelOrder}] | Hasselberg L, Meier S, Svardal A, et al. 2004. Effects of alkylphenols on CYP1A and CYP3A expression in first spawning Atlantic cod (Gadus morhua)[J]. Aquatic Toxicology , 67 (4) : 303–313. DOI:10.1016/j.aquatox.2003.12.007 |
| [${referVo.labelOrder}] | Hassoun E A, Ray S. 2003. The induction of oxidative stress and cellular death by the drinking water disinfection by-products, dichloroacetate and trichloroacetate in J774[J]. A1 cells[J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology , 135 (2) : 119–128. |
| [${referVo.labelOrder}] | Hegelund T, Ottosson K, Rådinger M, et al. 2004. Effects of the antifungal imidazole ketoconazole on CYP1A and CYP3A in rainbow trout and killfish[J]. Envrionmental Toxicology and Chemistry , 23 (5) : 1326–1334. DOI:10.1897/03-155 |
| [${referVo.labelOrder}] | Hua G H, Reckhow D A, Kim J. 2006. Effect of bromide and iodide ions on the Formation and Speciation of Disinfection Byproducts during Chlorination[J]. Environmental Science & Technology , 40 (9) : 3050–3056. |
| [${referVo.labelOrder}] | Kim K H, Park H J, Kim J H, et al. 2013. Cyp1a reporter zebrafish reveals target tissues for dioxin[J]. Aquatic Toxicology , 134-135 : 57–65. DOI:10.1016/j.aquatox.2013.03.010 |
| [${referVo.labelOrder}] | Krasner S W, Weinberg H S, Richardson S D, et al. 2006. Occurrence of a new generation of disinfection byproducts[J]. Environmental Science & Technology , 40 (23) : 7175–7185. |
| [${referVo.labelOrder}] | Li J H, Wang W, Moe B, et al. 2015. Chemical and Toxicological Characterization of Halobenzoquinones, an Emerging Class of Disinfection Byproducts[J]. Chemical Research in Toxicology , 28 (3) : 306–318. DOI:10.1021/tx500494r |
| [${referVo.labelOrder}] | 李金燕, 金芬, 金晓辉, 等.2005. 北方某城市饮用水处理中卤乙酸浓度水平的调查研究[J]. 环境科学学报 , 2005, 25 (8) : 1091–1095. |
| [${referVo.labelOrder}] | 罗义, 纪靓靓, 苏燕, 等.2007. 2, 4-二氯苯酚诱导鲫鱼活性氧(ROS)的产生及其分子致毒机制[J]. 环境科学学报 , 2007, 27 (1) : 129–134. |
| [${referVo.labelOrder}] | Mukhopadhyay D, Priya P, Chattopadhyay A. 2015. Sodium fluoride affects zebrafish behaviour and alters mRNA expressions of biomarker genes in the brain:Role of Nrf2/Keap1[J]. Environmental Toxicology and Pharmacology , 40 (2) : 352–359. DOI:10.1016/j.etap.2015.07.003 |
| [${referVo.labelOrder}] | Plewa M J, Wagner E D, Richardson S D, et al. 2004. Chemical and Biological Characterization of Newly Discovered Iodoacid Drinking Water Disinfection Byproducts[J]. Environmental Science & Technology , 38 (18) : 4713–4722. |
| [${referVo.labelOrder}] | Richardson S D, Fasano F, Ellington J J., et al. 2008. Occurrence and Mammalian Cell Toxicity of Iodinated Disinfection Byproducts in Drinking Water[J]. Environmental Science & Technology , 42 (22) : 8330–8338. |
| [${referVo.labelOrder}] | 王玲, 郑明刚, 仝艳丽, 等.2011. 六溴环十二烷(hexabromocyclododecane, HBCD)暴露对生长阶段文昌鱼的毒性及其几种重要酶活性的影响[J]. 环境科学学报 , 2011, 31 (5) : 1086–1091. |
| [${referVo.labelOrder}] | Roccaro P, Vagliasindi F G A, Korshin G V. 2009. Changes of NOM Fluorescence Caused by Chlorination and their Associations with Disinfection by-Products Formation[J]. Environmental Science & Technology , 43 (3) : 724–729. |
| [${referVo.labelOrder}] | 武小燕, 彭颖, 廖伟, 等.2013. 布洛芬对黄颡鱼I相代谢酶及其抗氧化系统的影响[J]. 环境科学学报 , 2013, 33 (4) : 1208–1214. |
| [${referVo.labelOrder}] | 徐维娜, 谢国驷, 刘文斌, 等.2008. 敌百虫胁迫对异育银鲫鱼体中4种酶活性变化的影响[J]. 环境科学学报 , 2008, 28 (6) : 1198–1205. |
| [${referVo.labelOrder}] | Woo Y T, Lai D, McLain J L, et al. 2002. Use of mechanism-based structure-activity relationships analysis in carcinogenic potential ranking for drinking water disinfection by-products[J]. Environmental Health Prospect , 110 (1) : 75–87. |
| [${referVo.labelOrder}] | Yu S L, Lin T, Chen W, et al. 2015. The toxicity of a new disinfection by-product, 2, 2-dichloroacetamide (DCAcAm), on adult zebrafish (Danio rerio) and its occurrence in the chlorinated drinking water[J]. Chemosphere , 139 : 40–46. DOI:10.1016/j.chemosphere.2015.05.079 |
| [${referVo.labelOrder}] | 赵玉丽, 李杏放.2011. 饮用水消毒副产物:化学特征与毒性[J]. 环境化学 , 2011, 30 (1) : 20–33. |
 2016, Vol. 36
2016, Vol. 36


