2. 江苏省渔业技术推广中心, 南京 210036;
3. 江苏省太湖渔业管理委员会办公室, 苏州 215168
2. Jiangsu Provincial Fishery Technical Extending Center, Nanjing 210036;
3. Taihu Lake Fisheries Administration Committee Office of Jiangsu Province, Suzhou 215168
蓝藻水华在富营养化湖泊中频繁出现, 不仅严重影响湖泊的生态功能与水环境质量, 同时还会造成重大的经济损失和社会问题, 已成为全球关注的重大水环境问题(Sivonen et al., 1999).目前, 蓝藻水华的发生机理和规律成为研究热点, 有关蓝藻水华发生机理的各种理论和假说不断出现(马健荣等, 2013).孔繁翔等(2005)针对长江中下游大型浅水湖泊的蓝藻生长规律提出了蓝藻水华形成的“4阶段理论”, 并指出每个阶段蓝藻的生理特征和主导因子有所不同, 应进行针对性研究, 蓝藻生理特征及其动态变化成为认识蓝藻水华形成机理的重要环节.光合作用特性是蓝藻最基本、最重要的生理生态特征, 基于光合作用活性研究蓝藻生理状态变化的相关报道也逐渐增多(Zhang et al., 2008; Wu et al., 2011).
与传统的光合放氧法和14C示踪法测定浮游植物的光合作用活性相比, 叶绿素荧光作为光合作用研究的简单、快捷和无损伤探针, 得到了广泛应用.叶绿素荧光不仅能反映光能吸收、激发能传递和光化学反应等光合作用的原初反应过程, 而且与电子传递、质子梯度的建立及ATP合成和CO2固定等过程有关(Maxwell et al., 2000).脉冲调制荧光仪(PAM, Pulse Amplitude Modulated)基于叶绿素荧光原理设计, 能够提供光合作用过程中的诸多信息.Phyto-PAM是全球第一台专门用于检测水体中浮游植物光合作用活性的荧光仪, 它能够区分不同类群的浮游植物(蓝藻、绿藻和硅藻/甲藻), 并同时测定它们的光合作用活性, 已成为室内和野外研究蓝藻光合作用最常用的工具(吴晓东等, 2007; Zhang et al., 2012).
太湖是我国第三大淡水湖, 位于经济发达的长江三角洲地区, 是该地区重要的工农业用水和饮用水水源地.自1980s开始, 以微囊藻为优势属的蓝藻水华开始在太湖频繁出现, 并且微囊藻水华发生面积逐渐扩大, 持续时间延长, 强度增加(朱广伟, 2008; 孔繁翔等, 2009), 引起了国内外学者的高度关注.已有研究人员采用Phyto-PAM荧光仪调查了夏季太湖微囊藻光合作用活性的日变化规律及其竞争优势(Zhang et al., 2008; Wu et al., 2011), 但尚无关于太湖微囊藻光合作用活性周年动态变化的相关研究报道.因此, 本研究采用Phyto-PAM荧光仪测定太湖微囊藻光合作用活性的周年动态变化, 并分析微囊藻光合活性参数与环境因子之间的关系, 研究结果有利于揭示太湖微囊藻水华形成及发展过程中微囊藻生理特征变化及其适应机制, 同时可以为太湖微囊藻水华防控提供科学参考.
2 材料和方法(Materials and methods) 2.1 采样点和水样采集本研究在太湖设置2个采样点, 分别位于梅梁湾(S1:31°06′58″N, 120°06′08″E)和湖心(S2:31°16′03″N, 120°06′48″E)(图 1).采样时间为2014年1—12月, 每月采样一次.采用5.0 L有机玻璃采水器采集表层水样(水下50 cm), 混合均匀, 取2.5 L装入干净塑料容器中, 带回实验室进行检测分析.
 |
| 图 1 太湖采样点位图 Fig. 1 Two sampling locations in Lake Taihu |
采用YSI6600(Yellow Spring Instruments, USA)原位测定水体温度(Water temperature, WT)、pH、溶解氧(Dissolved Oxygen, DO)和混浊度(Turbidity).采用钼酸铵分光光度法测定总磷(Total Phosphorus, TP), 碱性过硫酸钾消解-紫外分光光度法测定总氮(Total Nitrogen, TN).溶解性氮、磷(NO3-、NH4+和PO43-)经GF/F滤膜过滤, 采用SKALAR流动分析仪测定.叶绿素a(Chlorophyll a, Chl-a)浓度采用90%的丙酮抽提, 分光光度法测定(Welschmeyer, 1994).
2.3 光合作用活性测定采用Phyto-PAM(Walz, Effeltrich, Germany)浮游植物荧光仪测定微囊藻的光合作用活性, 该仪器能区分浮游植物群落并分别测定它们的光合作用活性.取水样3.0 mL装入测量杯中, 充分暗适应(15 min).首先打开测量光(Measuring Light, ML), 仪器检测到最小荧光Fo, 随后打开饱和脉冲(Saturation Pulse, SP), 得到最大荧光Fm, Fm-Fo即为可变荧光Fv, Fv与Fm的比值(Fv/Fm)即为光系统PSII的最大光量子产量, 该值反映了浮游植物的潜在最大光合作用能力(Zhang et al., 2008).将仪器设定为每隔20 s加以强度逐渐增大的光化光(Actinic Light, AL), 同时记录光量子产量, 得到快速光响应曲线(Rapid Response Light Curve, RLC), 利用Phyto-PAM分析软件v2.13可以直接读取光响应曲线的3个特征参数:线性区间斜率(α)、最大电子传递速率(rETRmax)和饱和光照强度点(Ik)(Ralph et al., 2005).在光适应状态下, 打开饱和脉冲测定微囊藻的实际光量子产量(ΔF/Fm′)和最大荧光值Fm′.非光化学荧光淬灭(Non-Photochemical Quenching)NPQ=(Fm-Fm′)/Fm′(Zhang et al, 2008).
2.4 数据处理和分析采用软件Origin 8.0对数据进行作图.采用SPSS16.0软件分析微囊藻的荧光参数与环境因子之间的相关系数, 显著水平为p < 0.05.
3 结果(Results) 3.1 太湖水体环境因子的周年变化太湖梅梁湾和湖心采样点水体环境因子的周年变化如图 2所示.可以看出, 环境因子具有时空差异性:水温呈现出先上升后下降的趋势, 变化范围在2.6~32.6℃之间, 平均值为17.8℃.梅梁湾和湖心叶绿素a浓度分别在5.87~84.38μg·L-1和3.76~38.95μg·L-1之间, 平均值分别为37.41和16.72μg·L-1.采样点营养盐浓度较高, 其中, 梅梁湾总氮和总磷浓度分别在1.24~4.55 mg·L-1和0.0314~0.414 mg·L-1之间, 平均值分别为2.70和0.127 mg·L-1;湖心总氮和总磷浓度分别在0.90~4.49 mg·L-1和0.0263~0.160 mg·L-1之间, 平均值分别为2.11和0.0775 mg·L-1.从叶绿素a、总氮和总磷浓度来看, 梅梁湾和湖心水质全年呈富营养化状态, 梅梁湾水质富营养化水平高于湖心.梅梁湾和湖心pH值分别在7.58~9.41和7.42~9.22之间, 溶解氧浓度分别在6.53~12.61 mg·L-1和6.59~12.55 mg·L-1之间, 混浊度分别在14.2~249.0 NTU和26.5~290.0 NTU之间.
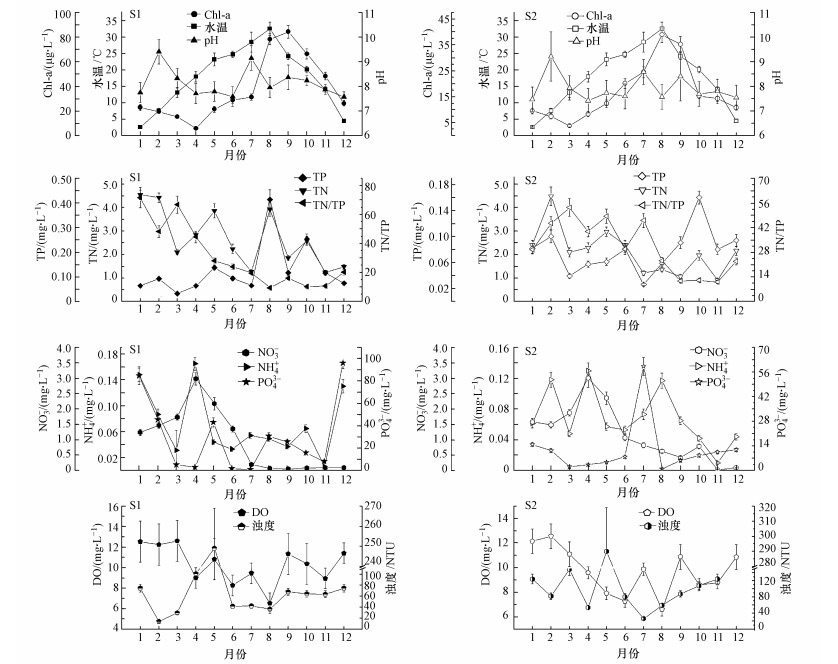 |
| 图 2 太湖梅梁湾(S1)和湖心(S2)水体环境因子 Fig. 2 The seasonal changes of environmental factors in Meiliang Bay (S1) and the center area (S2) of Lake Taihu |
太湖梅梁湾和湖心微囊藻的Fv/Fm和ΔF/Fm′周年变化如图 3所示.可以得出, 梅梁湾和湖心微囊藻光合作用活性周年变化趋势具有一致性:在冬季, 检测不到微囊藻的光合作用活性;在春季, 微囊藻的光合作用活性呈迅速增加趋势;在夏季, 微囊藻的光合作用活性表现出先增加后下降的趋势;在秋季, 则呈现出下降趋势.总体来看, 梅梁湾和湖心微囊藻的Fv/Fm变化范围在0.34~0.55和0.28~0.50之间, 平均值分别为0.42和0.39;ΔF/Fm′变化范围在0.15~0.38和0.10~0.38之间, 平均值分别为0.26和0.23.
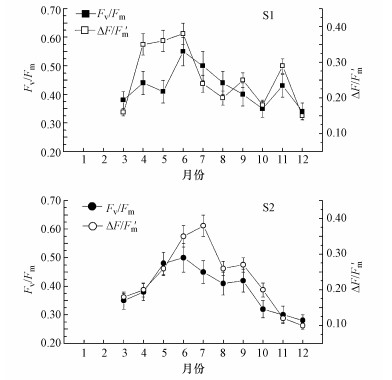 |
| 图 3 太湖梅梁湾(S1)和湖心(S2)微囊藻光合作用能力 Fig. 3 The seasonal changes of photosynthetic capacity of Microcysits in Meiliang Bay (S1) and the center area (S2) of Lake Taihu |
太湖梅梁湾和湖心微囊藻NPQ的周年变化如图 4所示.可以得出, 梅梁湾和湖心微囊藻NPQ的周年变化趋势基本一致:从3月到8月, NPQ值呈逐渐上升趋势, 在8月达到最大值, 随后开始下降.梅梁湾和湖心NPQ变化范围分别在0.055~0.280和0.083~0.260之间, 平均值分别为0.15和0.17.
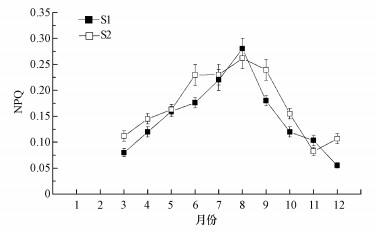 |
| 图 4 太湖梅梁湾(S1)和湖心(S2)微囊藻非光化学荧光淬灭 Fig. 4 The seasonal changes of NPQ of Microcystis in Meiliang Bay(S1) and the center area(S2) of Lake Taihu |
太湖梅梁湾和湖心微囊藻光响应曲线特征参数的周年变化如图 5所示.可以看出, 梅梁湾和湖心微囊藻的光响应曲线特征参数变化趋势基本一致:从3月到6月, 斜率(α)逐渐增加, 之后开始缓慢下降, 其变化范围分别在0.108~0.203和0.152~0.241之间, 平均值分别为0.167和0.180;从3月到6月, 最大电子传递速率(rETRmax)快速增加达到最大值, 然后急剧下降, 小幅上涨后又开始下降, 其变化范围分别在34.6~127.9μmol·m-2·s-1(以photons计, 下同)和28.6~97.7μmol·m-2·s-1之间, 平均值分别为73.8和53.2μmol·m-2·s-1;饱和光照强度点(Ik)呈双峰型, 其变化范围分别在136.8~417.7μmol·m-2·s-1(以photons计, 下同)和98.7~358.9μmol·m-2·s-1之间, 平均值分别为297.6和256.5μmol·m-2·s-1.
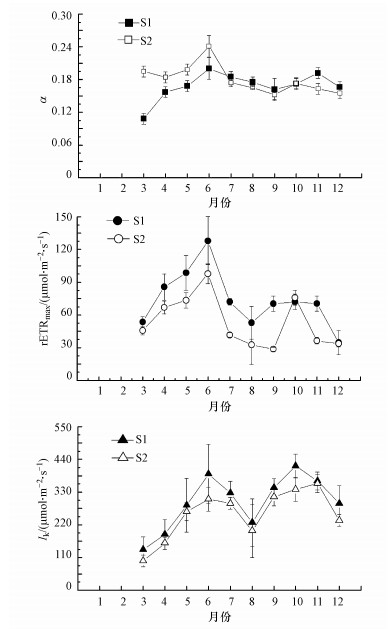 |
| 图 5 太湖梅梁湾(S1)和湖心(S2)蓝藻光响应曲线特征参数 Fig. 5 The seasonal changes of RLC of cyanobacteria in Meiliang Bay(S1) and the center area(S2) of Lake Taihu |
太湖微囊藻光合作用活性与环境因子之间的相关分析结果如表 1所示.可以得出, 太湖微囊藻的Fv/Fm、ΔF/Fm′和NPQ之间显著正相关(p < 0.05, p < 0.01), 且均与水温显著正相关(p < 0.05, p < 0.01).
| 表 1 微囊藻光合作用活性与环境因子之间的相关分析 Table 1 Correlation of photosynthetic activity of Microcystis with environmental factors |
光合作用活性是指示微藻生理生态状态的重要指标, 常被用于蓝藻竞争优势及水华发生机理的研究.叶绿素荧光参数众多, 所包含的信息丰富, 能综合反映蓝藻的生理状态特征, 叶绿素荧光技术已成为研究蓝藻光合作用活性的最常用方法.本研究采用Phyto-PAM浮游植物荧光仪首次测定了太湖微囊藻光合作用活性的周年变化, 并分析了光合作用活性参数与环境因子之间的相互关系.研究结果不仅有利于示太湖微囊藻水华形成及发展过程中微囊藻生理特征变化及其适应机制, 还可以为太湖微囊藻水华防控提供科学参考.
最大光量子产量(Fv/Fm)和有效光量子产量(ΔF/Fm′)是指示浮游植物光合作用活性最常用的荧光参数, 用于反映浮游植物的最大光合作用能力和实际光合作用能力(Goto et al., 2008; Wu et al., 2011).从本研究结果可以得出(图 1), 太湖微囊藻的Fv/Fm和ΔF/Fm′值呈现出季节波动性, 反映了微囊藻光合作用活性的季节差异性:在冬季期间(1—2月), 没有检测出太湖微囊藻的光合作用活性, 这是由于冬季水温较低(1月:2.6℃;2月:7.6℃), 微囊藻处于休眠状态, 代谢活动基本停滞.吴晓东等(2007)在越冬期间检测了太湖(10.3℃)和玄武湖(7.0℃)水体中浮游植物的光合作用活性, 结果显示, 也没有检出微囊藻的光合活性, 与本文结果是一致的;在春季期间(3—5月), 随水温持续上升(13.2~23.3℃), 微囊藻的光合活性快速升高, 与Zhang等(2012)在春季对太湖微囊藻光合作用活性的原位检测结果是一致的.光合活性的快速升高表明微囊藻的生长速度加快, 有利于微囊藻生物量快速积累, 为微囊藻水华形成奠定了基础;在夏季期间(6—8月), 水温从24.8℃升高到32.6℃, 微囊藻的光合活性呈现出先增加后下降的趋势, 但仍保持较高的光合活性.研究表明, 微囊藻生长的最适温度高于35℃(李小龙等, 2006), 而本研究中太湖水体温度最高值为32.6℃.因此, 水温不是导致微囊藻光合作用活性下降的因子.微囊藻的光合作用活性下降可能受到高光强抑制作用的影响, 高光强可以损伤微囊藻的光合作用系统, 进而导致微囊藻光合作用活性显著下降(Wu et al., 2011);在秋季期间(9—11月), 水温从24.2℃下降到14.1℃, 微囊藻的光合作用活性呈现出明显降下降, 微囊藻水华强度逐渐减弱.到12月份, 水温下降到4.5℃, 微囊藻的光合作用活性降至最低.整体来看, 微囊藻光合作用活性变化与太湖微囊藻水华形成及其发展动态相适应(孔繁翔等, 2005), 因此, 加强微囊藻光合作用活性的监测, 有利于掌握太湖微囊藻水华动态.
研究表明, 浮游植物的光合作用活性与温度、光照、营养盐、风浪扰动及藻类组成有关(Herrmann et al., 1996; Bergmann et al., 2002; Brookes et al., 2002; 李小龙等, 2006; Goto et al., 2008).在本研究中, 叶绿素荧光参数与环境因子相关分析结果显示(表 1), 太湖微囊藻的Fv/Fm和ΔF/Fm′均与水温有显著的正相关性, 这表明水温是决定太湖微囊藻光合作用能力大小的重要因子.已有研究结果显示, 温度对微囊藻生长及其生理活性有重要影响.比如, 研究者采用14C示踪法研究了4个温度梯度(15、20、25和30℃)对铜绿微囊藻生长和光和作用的影响, 结果表明, 光合作用速率和生长速率与温度有显著正相关性(Coles et al., 2000).李小龙等(2006)研究发现, 在10~35℃范围内, 铜绿微囊藻净光合放氧速率随温度升高而直线上升.由此推测, 全球气候变暖能提高蓝藻的光合作用活性, 加速蓝藻生长, 导致全球蓝藻水华强度逐渐加剧(Carey et al., 2012).
非光化学荧光淬灭是光合作用过程中的一种自我保护机制, 通过将过多的光能以热耗散形式释放出去, 避免对光合作用器官造成损伤, NPQ值的大小反映了热耗散能力的高低(Cosgrove et al., 2010).本研究结果显示(图 4), 太湖梅梁湾和湖心微囊藻NPQ值的动态变化具有一致性, 均表现出先增加后下降的趋势, 在8月达到最大.已有文献报道了浮游植物NPQ的日变化动态, 发现NPQ值呈现出先增加后下降的趋势, 在中午时达到最大, 与NPQ值的季节变化具有相似性(Zhang et al., 2008; Aikawa et al., 2008).整体来看, NPQ的季节变化趋势与微囊藻水华形成及发展动态具有对应性, 能够有效保护高光强对微囊藻光合作用器官造成损伤(Zhang et al., 2008; Wu et al., 2011).相关分析表明, 微囊藻的NPQ与Fv/Fm和ΔF/Fm′有显著正相关性, 说明微囊藻非光化学荧光淬灭与光合作用之间具有耦联性, 是微囊藻水华形成的重要保护机制.
快速光响应曲线(Rapid Response Light Curve, RLC)是评价浮游植物光合作用特征的重要方法.由该曲线可以获得3个荧光参数(Kashino et al, 2002; 张曼和曾波, 2007):斜率α, 用于指示光能利用效率;最大电子传递速率rETRmax, 用于指示最大光合作用速率;饱和光照强度点Ik, 用于指示耐受光强能力.通常情况下, RLC与光合作用放氧速率之间存在很好的线性关系(Heinze et al., 1996; Geel et al., 1997), 但在浮游植物受到胁迫时(高光强、高温度、营养盐限制), 电子传递速率与光合放氧速率间呈非线性关系(Masojídek et al., 2001; Kashino et al., 2002).本研究结果表明(图 5), 从3月到6月, RLC曲线的3个参数均呈上升趋势, 表明太湖微囊藻的光能利用效率、光合作用速率和耐受光强的能力增加, 与微囊藻的光合作用能力动态变化具有一致性(图 3);从7月至12月, 3个参数随季节变化表现出了较大波动性.相关分析结果表明(表 1), 太湖微囊藻的Fv/Fm和ΔF/Fm′与rETRmax之间有显著的正相关性(表 1), 表明微囊藻光合作用能力与电子传递速率之间具有密切关系.同时发现, 光响应曲线3个参数对环境因子的响应存在差异, 比如, rETRmax与TN有显著正相关性, 而Ik与TP有显著正相关性, 与TN/TP和NO3-有显著负相关性.可以得出, 太湖微囊藻的光合作用效率和耐受光强能力随总氮、总磷浓度升高而增加.因此, 降低氮、磷浓度一方面可以降低太湖富营养化水平, 另一方面可以抑制微囊藻光合作用, 有利于控制微囊藻水华发生.
5 结论(Conclusions)1) 太湖微囊藻的光合作用活性呈现出季节波动性:在冬季, 检测不到微囊藻的光合作用活性; 在春季, 微囊藻的光合作用活性随温度升高而增加; 在夏季, 微囊藻的光合作用活性受到抑制; 在秋季, 微囊藻的光合作用活性呈下降趋势.整体来看, 微囊藻的光合作用活性变化与微囊藻水华形成过程及发展动态相适应.
2) 太湖微囊藻的非光化学荧光淬灭呈现出先增加后下降趋势, 在夏季达到最大值.非光化学荧光淬灭与微囊藻光合作用活性之间具有耦联性, 是微囊藻水华形成和持续的重要保护机制.
3) 太湖微囊藻荧光参数之间有密切关系, 其中, Fv/Fm、ΔF/Fm′和NPQ之间有显著的正相关性, Fv/Fm和ΔF/Fm′与最大电子传递速率(rETRmax)之间有显著正相关性.水温是决定微囊藻光合作用能力的重要因子, rETRmax与TN有显著正相关性, Ik与TP有显著正相关性, 与TN/TP和NO3-有显著负相关性.控制全球变暖和削减氮、磷浓度有利于抑制微囊藻的光合作用活性.
| [1] | Aikawa S, Hattori H, Gomi Y, et al. 2009. Diel tuning of photosynthetic systems in ice algae at Saroma-ko Lagoon, Hokkaido, Japan[J]. Polar Science , 3 (1) : 57–72. DOI:10.1016/j.polar.2008.12.001 |
| [2] | Bergmann T, Richardson T L, Paerl H W, et al. 2002. Synergy of light and nutrients on the photosynthetic efficiency of phytoplankton populations from the Neuse River Estuary, North Carolina[J]. Journal of Plankton Research , 24 (9) : 923–933. DOI:10.1093/plankt/24.9.923 |
| [3] | Brookes J D, Regel R H, Ganf G G. 2003. Changes in the photo-chemistry of Microcystis aeruginosa in response to light and mixing[J]. New Phytologist , 158 (1) : 151–164. DOI:10.1046/j.1469-8137.2003.00718.x |
| [4] | Carey C C, Ibelings B W, Hoffmann E P, et al. 2012. Eco-physiological adaptations that favour freshwater cyanobacteria in a changing climate[J]. Water Research , 46 (5) : 1394–1407. DOI:10.1016/j.watres.2011.12.016 |
| [5] | Coles J F, Christian Jones R. 2000. Effect of temperature on photosynthesis-light response and growth of four phytoplankton species isolated from a tidal freshwater river[J]. Journal of Phycology , 36 (1) : 7–16. DOI:10.1046/j.1529-8817.2000.98219.x |
| [6] |
Cosgrove J, Borowitzka M A.2010.Chloreophyll Fluorescence Terminology:An Introduction//Sugget D J, Borowitzka M A, Ondrej P.Chlorophyll a Fluorescence in Aquatic Sciences:Methods and applications, Developments in Applied Phycology(vol.4.)[M].Berlin:Springer.1-18
http://www.academia.edu/13988481/Algal_ photosynthetic_responses_to_toxic_metals_and_herbicides_assessed_by_chlorophyll_a_fluorescence |
| [7] | Geel C, Versluis W, Snel J F H. 1997. Estimation of oxygen evolution by marine phytoplankton from measurement of the efficiency of photosystemⅡelectron flow[J]. Photosynthesis Research , 51 (1) : 61–70. DOI:10.1023/A:1005779112140 |
| [8] | Goto N, Kihira M, Ishida N. 2008. Seasonal distribution of photosynthetically active phytoplankton using pulse amplitude modulated fluorometry in the large monomictic Lake Biwa, Japan[J]. Journal of Plankton Research , 30 (10) : 1169–1177. DOI:10.1093/plankt/fbn073 |
| [9] | Heinze I, Dau H, Senger H. 1996. The relationship between the photochemical yield and variable fluorescence of photosystemⅡin the green alga Scenedesmus obliquus[J]. Journal of Photochemistry and Photobiology B:Biology , 32 (1/2) : 89–95. |
| [10] | Herrmann H, Häder D P, Köfferlein M, et al. 1996. Effects of UV radiation on photosynthesis of phytoplankton exposed to solar simulator light[J]. Journal of Photochemistry and Photobiology B:Biology , 34 (1) : 21–28. DOI:10.1016/1011-1344(95)07245-4 |
| [11] | Kashino Y, Kudoh S, Hayashi Y, et al. 2002. Strategies of phytoplankton to perform effective photosynthesis in the North Water[J]. Deep-Sea ResearchⅡ , 49 (22/23) : 5049–5061. |
| [12] | 孔繁翔, 高光.2005. 大型浅水富营养化湖泊中蓝藻水华形成机理的思考[J]. 生态学报 , 2005, 25 (3) : 589–595. |
| [13] | 孔繁翔, 马荣华, 高俊峰, 等.2009. 太湖蓝藻水华的预防、预测和预警的理论与实践[J]. 湖泊科学 , 2009, 21 (3) : 314–328. |
| [14] | 李小龙, 耿亚红, 李夜光, 等.2006. 从光合作用特性看铜绿微囊藻(Microcystis aeruginosa)的竞争优势[J]. 武汉植物学研究 , 2006, 24 (3) : 225–230. |
| [15] | 马健荣, 邓建明, 秦伯强, 等.2013. 湖泊蓝藻水华发生机理研究进展[J]. 生态学报 , 2013, 33 (10) : 3020–3030. |
| [16] | Masojídek J, Grobbelaar J U, Pechar L, et al. 2001. PhotosystemⅡelectron transport rates and oxygen production in natural waterblooms of freshwater cyanobacteria during a diel cycle[J]. Journal of Plankton Research , 23 (1) : 57–66. DOI:10.1093/plankt/23.1.57 |
| [17] | Maxwell K, Johnson G N. 2000. Chlorophyll a fluorence-a practice guide[J]. Journal of experimental Botany , 51 (345) : 659–668. DOI:10.1093/jexbot/51.345.659 |
| [18] | Ralph P J, Gademann R. 2005. Rapid light curves:A powerful tool to assess photosynthetic activity[J]. Aquatic Botany , 82 (3) : 222–237. DOI:10.1016/j.aquabot.2005.02.006 |
| [19] | Welschmeyer N A. 1994. Fluorometric analysis of chlorophyll-a in the presence of chlorophyll-b and pheopigments[J]. Limnology and Oceanography , 39 (8) : 1985–1992. DOI:10.4319/lo.1994.39.8.1985 |
| [20] | W HO. 1999. Toxic Cyanobacteria in Water:A Guide to Their Public Health Consequences, Monitoring and Management[M]. New York: E & FN Spon: 17 -20. |
| [21] | 吴晓东, 孔繁翔, 曹焕生, 等.2007. 越冬浮游植物光合作用活性的原位研究[J]. 湖泊科学 , 2007, 19 (2) : 139–145. |
| [22] | Wu X D, Kong F X, Zhang M. 2011. Photoinhibition of colonial and unicellular Microcystis cells in a summer bloom in Lake Taihu[J]. Limnology , 12 (1) : 55–61. DOI:10.1007/s10201-010-0321-5 |
| [23] | Zhang M, Kong F X, Wu X D, et al. 2008. Different photochemical responses of phytoplankters from the large shallow Taihu Lake of subtropical China in relation to light and mixing[J]. Hydrobiologia , 603 (1) : 267–278. DOI:10.1007/s10750-008-9277-4 |
| [24] | Zhang M, Yu Y, Yang Z, et al. 2012. Photochemical responses of phytoplankton to rapid increasing-temperature process[J]. Phycologica Research , 60 (3) : 199–207. DOI:10.1111/pre.2012.60.issue-3 |
| [25] | 张曼, 曾波.2007. PhytoPAM浮游植物分析仪用于微藻光合作用研究中几种参数设定的优化[J]. 植物生理通讯 , 2007, 43 (1) : 148–152. |
| [26] | 朱广伟.2008. 太湖富营养化现状及原因分析[J]. 湖泊科学 , 2008, 20 (1) : 21–26. |
 2016, Vol. 36
2016, Vol. 36

