硝化过程是废水中实现脱氮的必要步骤,其主要为铵态氮在亚硝化菌和硝化菌共同作用下,通过亚硝化和硝化作用,将氨氮转化为亚硝态氮和硝态氮,具体反应如式(1)、(2)所示(Ahn,2006),且由反应式(1)、(2)可得反应式(3).
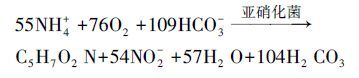
|
(1) |
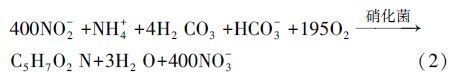
|
(2) |
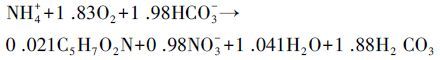
|
(3) |
在实际工程应用中,往往根据含氮废水特性选择不同的硝化类型,包括完全硝化和短程硝化.由于亚硝化过程反应时间短、氨氮负荷高、节省曝气量,且可为后续反硝化过程降低碳源投加,因此,选择性亚硝化成为研究的热点(刘俊新等,2002).实现选择性硝化过程中的控制因素主要包括溶解氧(DO)、pH、温度、游离氨浓度(FA)等(Park et al.,2010).根据亚硝化菌和硝化菌生长特性,在低溶解氧和碱度充足条件下可稳步实现体系亚硝态氮积累,进而实现短程硝化过程(Canziani et al.,2006;Chuang et al.,2007;张子健等,2008;Nisola et al.,2013).利用FA对硝化菌的抑制作用,使体系中FA控制在合适范围内,同样可以实现亚硝态氮积累(刘文如等,2013,但目前多数研究集中于亚硝化控制因素对亚硝态氮积累的影响方面.从微生物学和化学计量学角度研究亚硝化过程和亚硝化动力学参数,有助于选择性硝化过程深层次研究(彭永臻等,2008. 研究表明,当氨氮浓度低于3 mg·L-1时,硝化过程符合一级动力学特征,随着氨氮浓度由低到高,硝化过程逐渐由一级转变为零级反应动力学(Delgado et al.,2001).此外,根据亚硝化菌和硝化菌在硝化反应中氧的半饱和常数不同,可逐步实现硝化菌洗脱,进而实现亚硝化过程(Wang et al.,2004;Peng et al.,2006).但将硝化动力学优化硝化过程并结合硝化动力及过程控制方法实现体系选择性亚硝化的研究报道相对较少.
本试验基于亚硝化菌和硝化菌生长特点,对SBR体系中硝化过程和动力学进行研究,探讨SBR体系实现选择性硝化过程的控制方法,并实现SBR选择性亚硝化启动和稳步运行,强化系统氨氮去除能力和负荷.
2 材料与方法(Materials and methods) 2.1 试验装置本研究采用的试验装置如图 1所示.其中,反应器壳体为有机玻璃材质,具体尺寸为40 cm×25 cm×50 cm(长×宽×高),有效容积约40 L.反应器底部设有曝气头和布水装置,通过流量计调节曝气量以控制反应器内DO水平.为便于硝化过程研究,反应器采用序批式运行方式,即进水、曝气、静沉、排水、闲置.反应器内碱度由Na2CO3和NaOH调节,由加药泵提供加药,pH由在线加药控制系统控制在7.5~8.5之间,温度控制在20~25 ℃.
 |
| 图 1 试验装置图 Fig. 1 Schematic of experimental setup |
本次试验采用人工合成氨氮废水,主要成分为:NH+4-N 10~90 mg·L-1,KH2PO4 30 mg·L-1;由自来水提供各种微量元素,包括Fe2+、Mg2+、K+、Na+、Ca2+等.
本次试验接种污泥取自某炼化污水处理厂硝化污泥,因存贮时间较长,本次试验以35%污泥投加量进行反应器污泥接种,加入合成氨氮废水40 L,使反应器内初始氨氮浓度维持在10 mg·L-1左右;利用Na2CO3和NaOH缓冲溶液调节pH在7.5~8.0左右;调节曝气量,使溶解氧浓度维持在2~5 mg·L-1;经数次活化、驯化筛选,对固定供氧模式下硝化过程及动力学进行研究,而后进行SBR选择性亚硝化启动,逐渐提高进水氨氮浓度,并根据运行效果,及时调整SBR体系水力停留时间和氨氮负荷及其它运行参数.反应器运行周期为5~6 h,其中,进水0.25 h,曝气4~5 h,沉淀0.5 h,排水0.25 h,排水比为1/2.
本次试验NH+4-N采用纳氏试剂分光光度法测定,NO-2-N和NO-3-N采用离子色谱法,DO和温度采用便携式溶解氧测定仪进行测定,pH由在线pH计监测控制(国家环保总局,2002).
3 结果与讨论(Results and discussion) 3.1 固定供氧模式下氮组分和DO变化规律硝化过程中氮组分变化直观反映了亚硝化和硝化过程.SBR接种硝化污泥后,在曝气量Q=280~300 L·h-1、pH=7.5的条件下,反应器内氮组分及DO随时间的变化状况如图 2所示.由于采用固定供氧模式,反应器进水后,在0~160 min内,反应器内氨氮浓度由55.87 mg·L-1快速下降至1.32 mg·L-1,而NO-2-N浓度逐渐增加至23.98 mg·L-1,NO-3-N浓度同样逐渐增加至34.35 mg·L-1,亚硝态氮积累率达到41.11%,此时DO浓度维持在1.5 mg·L-1左右.这主要由于亚硝化菌与氧的亲和能力大于硝化菌,即在固定供氧模式下,反应初期供氧优先用于亚硝化反应,而硝化反应因供氧不足受到抑制,从而出现NO-2-N累积现象(Hanaki et al.,1990;祖波等,2009Wang et al.,2009).但由于接种污泥中亚硝化污泥并未占绝对优势,且亚硝态氮氧化过程相对较快,因此,即使在低溶解氧下,硝化过程仍可进行.随着亚硝化反应进行完全,在160~230 min之间,反应器内溶解氧浓度快速由2.14 mg·L-1上升至8.12 mg·L-1,而体系内NO-3-N浓度迅速由34.35 mg·L-1升至58.9 mg·L-1,从而完成全程硝化过程.
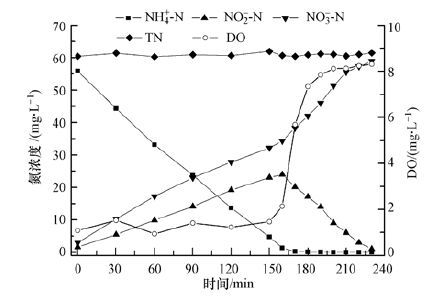 |
| 图 2 反应器内氮组分及溶解氧随时间变化 Fig. 2 Variations of nitrogen and DO in the reactor with the operation time |
在固定供氧模式下,由于亚硝化反应持续对氧的消耗,造成反应器供氧不平衡,从而致使反应器初期溶解氧维持在较低水平,但当氨氮浓度 <10 mg·L-1时,亚硝化反应因基质浓度而减缓,而硝化反应所需溶解氧小于亚硝化反应,因此,DO逐渐上升直至达到平衡状态,这种“DO的跃升”在反应器控制中具有重要意义.因为“DO跃升”之前氨氮降解基本完全,即亚硝化反应基本结束,而此时硝态氮氧化刚刚开始,因此,可通过控制DO水平实现选择性亚硝化过程,并完成亚硝化菌的筛选与分离,这为短程硝化研究创造了有利条件.此外,由图 2可知,将硝化过程选择性控制在亚硝化阶段,硝化反应时间节省1/3左右,不仅提升了氨氮降解负荷,而且减少了曝气量,节省了运行成本.
3.2 SBR硝化过程动力学分析微生物降解过程中,伴随着微生物的代谢活动,底物被降解、转化,而微生物自身也不断繁殖与死亡.微生物降解过程必然与微生物自身浓度和底物浓度有关,因此,在硝化过程中,氨氮降解过程必然与底物浓度有直接联系,也即关于硝化过程动力学研究将有助于优化硝化过程,提高反应效率和污染物降解效率.
在曝气量Q=300~310 L·h-1、pH=7.5的条件下,反应器内氨氮浓度、DO及氨氧化速率随时间的变化如图 3和图 4所示.由图 3可知,当0~150 min内,也即氨氮浓度>5 mg·L-1时,氨氮浓度随时间变化呈现较好的线性关系.由图 4可知,此时氨氧化速率维持在22.50 mg·L-1·h-1左右,反应器内DO维持在较低水平(1 mg·L-1左右);在150~180 min内,也即氨氮浓度 <5 mg·L-1时,氨氮浓度随时间进一步降低,但降解速率显著下降,由22.50 mg·L-1·h-1快速降至0.96 mg·L-1·h-1,而此时DO水平快速上升至7 mg·L-1.根据微生物基质降解动力学可知,反应器底物降解过程符合Monod模式(彭永臻等,2008;Gujer,2010;Dincer et al.,2001):
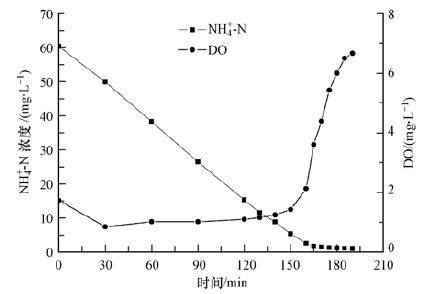 |
| 图 3 氨氧化过程及DO随时间变化 Fig. 3 The process of ammonia oxidation and variations of dissolved oxygen with the operation time |
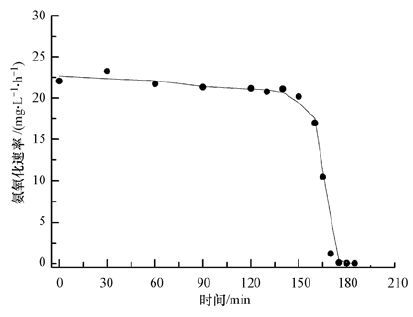 |
| 图 4 氨氧化速率随时间变化 Fig. 4 The rate of ammonia oxidation with the operation time |
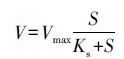
|
(4) |
式中,V为比底物降解速率(kg·kg-1·d-1),Vmax为底物的最大比降解速率(kg·kg-1·d-1),S为底物浓度(mg·L-1),Ks为饱和常数(mg·L-1),也即是半速常数,饱和常数为底物降解速率为最大降解速率1/2时的底物浓度.
图 5为不同浓度下氨氮比降解速率变化状况,经Orgin7.5软件y=p1x/(p2+x)模型非线性曲线拟合得:
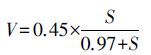
|
(5) |
其中,R2=0.98,根据Monod模式定义,可知在上述条件下氨氮降解饱和常数Ks为0.97 mg·L-1,且氨氮最大比降解速率Vmax为0.45 kg·kg-1·d-1(以每kg MLSS降解的NH+4-N量(kg)计,下同),这与常规硝化过程饱和常数和氨氮降解速率存在一定差别,主要由于该体系为混合优势硝化菌群体系.由拟合公式(5)可知,当氨氮浓度S >10 mg·L-1时,S>>Ks,拟合公式(5)可简化为V≈Vmax,即此时底物降解处于零级反应区.由图 5可知,此时氨氮比降解速率维持在0.45 kg·kg-1·d-1左右并逐渐趋于稳定;当氨氮浓度S <1 mg·L-1时,S<Ks,此时拟合公式(5) 可粗略简化为V≈VmaxS/Ks,此时氨氮比降解速率随底物浓度增加而呈线性增加(图 5),即底物降解处于一级反应区;而当1 mg·L-1 <S < 10 mg·L-1时,氨氮比降解速率随浓度增加而增加并处于稳定,此时氨氮降解应包含一级反应和零级反应,即属于混合反应区.上述硝化过程特点在工程应用中具有重要意义,尤其对于完全混合式反应器,反应方式将影响装置处理效果与负荷.一般情况下,传统曝气池为推流式曝气池,曝气池内氨氮浓度长时间维持在较低浓度,即硝化反应长期处于一级反应区或混合反应区,这不利于氨氮去除负荷的提高,此时应结合废水中氨氮污染物特点考虑选择合适的反应器形式.
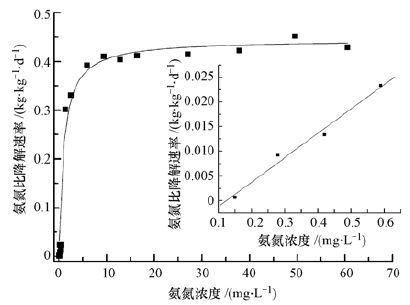 |
| 图 5 不同浓度下氨氮比降解速率变化 Fig. 5 Variations of ammonia nitrogen degradation rate under different concentrations of ammonia nitrogen |
由硝化反应式(1)、(2)可知,亚硝化菌和硝化菌在底物利用上存在互生关系,前者反应产物为后者提供底物,后者为前者解除产物抑制,但两者在碱度、DO和生长空间上存在一定竞争关系.
据文献报道,亚硝化细菌最佳生长pH为7.0~8.5,而硝化细菌最佳生长pH为6.0~7.5.因此,通过控制体系碱度可促进选择性硝化过程,当将pH控制在大于等于7.5时,硝化细菌生长将受到限制,从而抑制亚硝态氮氧化过程,进而实现亚硝态氮积累,但这种抑制作用只是延长了硝化菌硝化反应时间,并未使反应终止(张子健等,2008.为实现选择性亚硝化过程,在反应器启动初期可适当提高体系碱度,以促进亚硝化菌生长.
溶解氧对于选择性硝化过程的影响主要体现为亚硝化菌和硝化菌对氧的竞争能力.有研究表明,亚硝化菌和硝化菌对氧的饱和常数分别为0.2~0.4 mg·L-1和1.2~1.5 mg·L-1,即亚硝化菌对氧的竞争能力明显大于硝化细菌(Laanbroek et al.,1994).因此,在固定供氧模式下,会出现“DO跃升”现象(图 2),这种“DO跃升”可作为实现短程硝化过程控制的“特征点”,即通过DO曲线“特征点”控制体系曝气时间可实现选择性硝化过程.此外,在实际工程应用中,由于较低溶解氧下,亚硝化菌生长速率大于硝化菌,可通过缩短排泥时间实现亚硝化菌的富集和分离,以快速实现短程硝化过程的启动.
碱度和DO作为外部条件影响选择性硝化过程实现,而由硝化反应动力学分析可知,底物浓度是限制硝化反应速率的关键.由图 5可知,当底物浓度与氨氮降解饱和常数相差不大时,硝化反应停留在一级反应阶段,硝化反应速率快速下降,这不利于亚硝化过程选择和亚硝态氮累积.因此,在硝化反应过程中,选择序批式反应模式替代连续混合反应模式,可适当提高体系内初始底物反应浓度,以提高硝化反应速率.
3.4 SBR实现选择性亚硝化过程及氨氮去除效果根据SBR实现选择性硝化过程的分析,对反应器进行启动运行,其中,启动初期进水NH+4-N 10~40 mg·L-1,运行期间进水NH+4-N 40~90 mg·L-1,采用序批式方式运行:进水5 min,曝气3 h,并根据DO曲线“特征点”调整,静沉1 h,排水0.5 h,污泥龄为7~10 d,每天取固定时间段进行进、出水样品检测.
图 6为曝气量Q=300~320 L·h-1、pH=7.5~8.5条件下,SBR选择性亚硝化启动和亚硝态氮累积状况.由图 6可知,反应器启动至运行结束约75 d,在反应器启动初期(0~5 d),由于接种污泥活性不高,氨氮去除率较低,出水氨氮浓度在10~15 mg·L-1之间.由图 7可知,此时氨氮负荷小于0.025 kg·kg-1·d-1.当反应器启动1周后,出水氨氮浓度明显降低,去除率显著增加.当反应器运行10 d时,氨氮负荷已经提升至0.1 kg·kg-1·d-1,硝化活性明显增强,出水氨氮小于1 mg·L-1,去除率在98%以上,但此时亚硝态氮累积率仅有60%左右.这主要是因为接种污泥为全称硝化污泥,污泥中包含有大量硝化菌,为此在10~15 d对反应器进行定期排泥,使污泥浓度由5000 mg·L-1降至4000 mg·L-1(图 7),以加快亚硝化菌群的富集,可发现亚硝酸累积率由60%左右逐渐提高至82%左右,在此期间系统氨氮负荷逐渐上升至0.20 kg·kg·d-1.为进一步提高系统负荷,强化亚
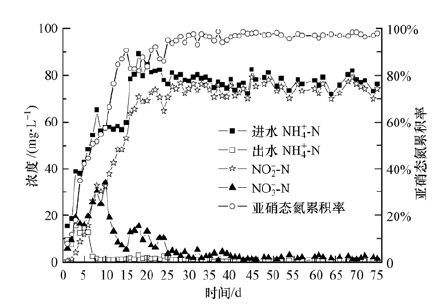 |
| 图 6 SBR选择性亚硝化过程及亚硝态氮累积率随时间变化 Fig. 6 The process of regioselective nitrification and nitrite accumulation rate with the operation time in sequencing batch reactor |
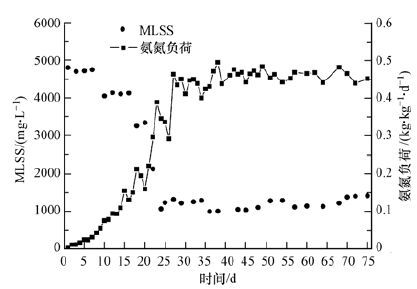 |
| 图 7 污泥浓度及氨氮负荷随时间变化 Fig. 7 Variations of MLSS concentrations and ammonia nitrogen loading with the operation time |
硝化过程,在15 d时将进水氨氮浓度提升至80~90 mg·L-1,并伴随反应器定期排泥,可发现系统亚硝态氮累积稳步提升至95%左右,并保持不变.由于系统排泥过量,由图 7还可知,在27~75 d,系统内硝化污泥浓度显著降低至1500 mg·L-1,但此时出水氨氮浓度并未增加,亚硝态氮累积率保持稳定;相反,此时污泥氨氮负荷已经提升至0.4~0.5 kg·kg·d-1,并连续运行了48 d左右,但更长周期的稳定运行仍需进一步考察.
有研究表明,传统普通曝气池硝态氮型氨氮负荷一般小于0.13 kg·kg-1·d-1,亚硝态氮型氨氮负荷可达到0.25 kg·kg-1·d-1(刘俊新等,2002.而由图 7可知,本序批式反应器曝气阶段氨氮负荷是传统硝态氮型氨氮负荷的3~4倍,是亚硝态氮型氨氮负荷的2倍,即与传统曝气池硝化过程相比,本序批式反应器硝化菌群拥有更高的硝化活性和氨氮去除能力.这主要由于经选择性硝化控制策略,系统内污泥多为亚硝化菌种优势菌,并结合硝化动力特征,选择序批式反应方式,充分提高硝化反应初始底物浓度,将硝化速率提升至最大.
4 结论(Conclusions)1) 固定供氧模式下,硝化过程中DO曲线出现跃升“特征点”,并伴随亚硝态氮累积现象,可由此实现SBR选择性硝化过程.
2) 硝化过程中,硝化过程可分为零级反应区、混合反应区和一级反应区,且亚硝化特性符合Monod动力学方程,硝化速率受底物浓度限制.
3) 通过亚硝化控制因素实施,可实现SBR选择性亚硝化控制,亚硝态氮累积率达到95%以上,氨氮负荷达0.45 kg·kg-1·d-1,显著提高了系统运行负荷.
| [1] | Ahn Y H. 2006.Sustainable nitrogen elimination biotechnologies: a review[J]. Process Biochemistry, 41 (8): 1709–1721. |
| [2] | Canziani R, Emondi V, Garavaglia M, et al. 2006.Effect of oxygen concentration on biological nitrification and microbial kinetics in a cross-flow membrane bioreactor(MBR) and moving-bed biofilm reactor(MBBR) treating old landfill leachate[J]. Journal of Membrane Science, 286 (1/2): 202–212. |
| [3] | Chuang H P, Ohashi A, Imachi H, et al. 2007.Effective partial nitrification to nitrite by down-flow hanging sponge reactor under limited oxygen condition[J]. Water Research, 41 (2): 295–302. |
| [4] | Delgado S, Elmaleh S, Dlaz F, et al. 2001.Ammonia removal in a deep reclaimed wastewater reservoir before agricultural reuse[J]. Water Science and Technology, 43 (10): 125–132. |
| [5] | Dincer A R, Kargi F. 2001.Salt inhibition kinetics in nitrification of synthetic saline wastewater[J]. Enzyme and Microbial Technology, 28 (7/8): 661–665. |
| [6] | Gujer W. 2010.Nitrification and me - a subjective review[J]. Water Research, 44 (1): 1–19. |
| [7] | |
| [8] | Hanaki K, Wantawin C, Ohgaki. 1990.Nitrification at low levels of dissolved oxygen with and without organic loading in a suspended-growth reactor[J]. Water Research, 2 (1): 297–302. |
| [9] | Laanbroek H J, Bodelier P L E, Gerards S. 1994.Oxygen consumption kinetics of Nitrosomonas europaea and Nitrobacter hamburgensis grown in mixed continuous cultures at different oxygen concentrations[J]. Archives of Microbiology, 161 (2): 156–162. |
| [10] | 刘文如, 丁玲玲, 王建芳, 等.2013.低C/N比条件下亚硝化颗粒污泥的培养及成因分析[J].环境科学学报, 33 (8):2226–2233. |
| [11] | 刘俊新, 王秀蘅.2002.高浓度氨氮废水亚硝酸型与硝酸型脱氮的比较研究[J].工业用水与废水, 33 (3):1–4. |
| [12] | Nisola G M, Orata-Flor J, Oh S, et al. 2013.Partial nitrification in a membrane-aerated biofilm reactor with composite PEBA/PVDF hollow fibers[J]. Desalination and Water Treatment, 51 (25/27): 5275–5282. |
| [13] | Park S, Bae W, Rittmann B E. 2010.Operational boundaries for nitrite accumulation in nitrification based on minimum/maximum substrate concentrations that include effects of oxygen limitation,pH,and free ammonia and free nitrous acid inhibition[J]. Environmental Science &Technology, 44 (1): 335–342. |
| [14] | 彭永臻, 孙洪伟, 杨庆.2008.短程硝化的生化机理及其动力学[J].环境科学学报, 28 (5):817–824. |
| [15] | Peng Y Z, Zhu G B. 2006.Biological nitrogen removal with nitrification and denitrification via nitrite pathway[J]. Applied Microbiology and Biotechnology, 73 (1): 15–26. |
| [16] | Rodgers J D, Jedral W, Bunce N J. 1999.Electrochemical oxidation of chcorinated phenols[J]. Environment Science &Technology, 33 (9): 1453–1457. |
| [17] | Wang J L, Ning Y. 2004.Partial nitrification under limited dissolved oxygen conditions[J]. Process Biochemistry, 39 (10): 1223–1229. |
| [18] | Wang W, Wang S Y, Peng Y Z, et al. 2009.Enhanced biological nutrients removal in modified step-feed anaerobic/oxic process[J]. Biotechnology and Bioengineering, 17 (15): 840–848. |
| [19] | 张子健, 王舜和, 王建龙, 等.2008.利用碱度控制SBR中短程硝化反应的进程[J].清华大学学报(自然科学版), 48 (9):95–98. |
| [20] | 祖波, 张代钧, 祖建, 等.2009.硝化过程中影响亚硝酸盐积累的因素[J].环境科学与技术, 32 (4):1–5. |
 2016, Vol. 36
2016, Vol. 36


