2. 工业聚集区污染控制与生态修复教育部重点实验室, 广州 510006
2. Key Laboratory of Pollution Control and Ecosystem Restoration in Industry Clusters, Ministry of Education, Guangzhou 510006
在经济与工业发展的同时,重金属污染水源的突发事故时有发生,造成了严重的社会危害.对于水体突发性重金属污染,常用的应急措施是向水体中投加碱和混凝剂进行絮凝沉淀(郑彤等,2013),通过吸附沉降使被污染水源中的重金属离子浓度达到集中供水的标准.但对于水体突发高浓度重金属污染,常规混凝技术难以保证沉入河流底部的重金属不再释放,从而存在二次污染的危险.
我国的磷矿岩资源十分丰富,且价格低廉.由于磷灰石具有特殊的晶体化学特征,使得它对多种金属阳离子具有广泛的容纳性和吸附固定作用,因此,磷灰石逐渐成为一种经济有效的新型环境矿物材料(陈炜,2006).已有很多学者对磷灰石吸附去除水中的重金属离子(刘羽等,2001),以及固定稳定化重金属污染的土壤和沉积物开展了研究(Basta et al.,2001;Du et al.,2014).其中,Cao等(2004)研究得出磷灰石对于铅的去除效果最好,主要是通过溶解-沉淀和离子交换作用生成难溶性磷酸铅矿物,而对铜和锌的去除效果一般,主要是通过表面吸附和络合作用.零价铁是一种极好的环境修复材料,它是一种强还原剂,且无毒性,价廉易得(Schreier et al.,1994).有研究表明,零价铁能够成功修复如Cd、Pb、Cu、Ag、Ni、As、Zn等重金属的污染,包括水中重金属的去除(Chen et al.,2008;Fu et al.,2015),以及土壤和沉积物中重金属的固定(Kumpiene et al.,2006;TomaŠeviĆ et al.,2014).
由于磷灰石对铅的去除效果较好,对其他重金属如Cu、Cd、Co、Mn、Ni、Zn的去除效果一般,而零价铁对其他种重金属也有一定的修复效果.另外,由于磷灰石在水体中存在释放出磷的风险,可能会引起富营养化,而零价铁对磷酸根离子有一定的去除作用.正是考虑到磷灰石和零价铁的这种特性,人们尝试将磷灰石与零价铁联合使用.研究表明,磷灰石-零价铁对重金属污染土壤具有较好的固定效果(Kaplan et al.,2007);Qian等(2009)利用磷灰石-水铁矿对复合多种重金属污染沉积物进行了固定化研究,也获得了较好的效果.但此前关于磷灰石-零价铁的研究都是单独针对土壤或者沉积物,未有过在常规混凝的同时投加磷灰石-零价铁,通过构建沉积物研究其对重金属的抑制效果,并且对磷灰石-零价铁的作用机理研究也较少.
因此,本研究以典型水源水质为模拟对象,在其受到重金属铜、铅污染时,采用投加磷灰石复合零价铁辅助常规应急药剂(碱+混凝剂)进行处理,将其引入河流沉积物与含重金属混凝絮体的体系中.通过静态释放实验,研究磷灰石复合零价铁稳定剂对含铜、铅沉积物中重金属释放的影响、释放过程中水质参数的变化及重金属的形态转化,以探讨磷灰石复合零价铁稳定剂应用到突发性铜、铅污染水体应急处理中的可行性.
2 材料与方法(Materials and methods) 2.1 实验材料实验所用原水取自珠江广州大学城段.原水pH值为7.05,浊度为42.5 NTU,Eh为236 mV,DO约为5.0 mg·L-1,CODMn为2.05 mg·L-1,NH+4-N为0.63 mg·L-1,Cu2+和Pb2+浓度分别为9 μg·L-1和1 μg·L-1.河流沉积物选取珠江广州大学城新造段表层河流沉积物.取回的新鲜河流沉积物湿泥样用珠江河水冲洗过20目的尼龙筛,除去较大体积的生物、树枝及垃圾等杂物,筛后于水中沉积30 d,使其性质稳定待用.试验所用磷灰石购买自济南骐源化工有限公司,还原铁粉购买自天津福晨化学试剂厂,为分析纯.试验其余所用试剂均为分析纯.河流沉积物及磷灰石的基本性质见表 1.
| 表 1 河流沉积物和磷灰石的基本性质 Table 1 Properties of sediment and apatite |
图 1为河流沉积物和磷灰石的X 射线衍射(XRD)图.由图 1a可知,河流沉积物的物相组成主要为石英、高岭土、尖晶石和白云母.磷灰石的物相组成主要为氟磷灰石、白云石和石英,说明实验所用的磷灰石属于天然氟磷灰石,并伴有少量石英(图 1b).另据X射线荧光光谱分析得到,河流沉积物的主要组成成分为SiO2,占59.61%,其次是Al2O3,占14.98%,CO3、Fe2O3、K2O分别占13.46%、5.85%、2.06%.磷灰石含22.29%的P2O5、39.57%的CaO、24.61% 的CO3及8.35%的MgO等.
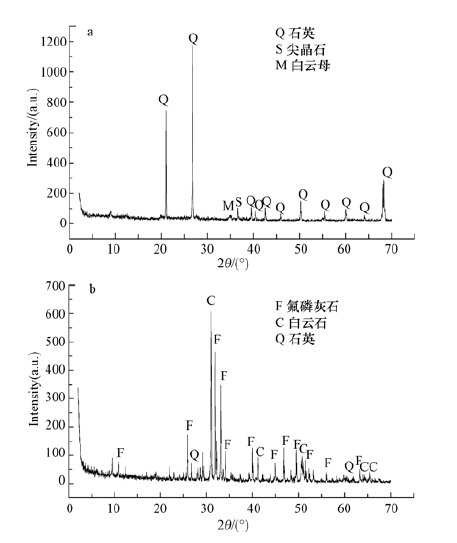 |
| 图 1 河流沉积物(a)和磷灰石(b)的X射线衍射(XRD)分析 Fig. 1 X-ray diffraction analysis of sediment(a)and apatite(b) |
静态释放试验历时45 d,根据沉积物组成将试验分成4组,实验设置3个平行,结果取平均值,共设置12个试验瓶.混凝絮体的制备过程如下:在4组10 L的珠江原水中投加50 mg·L-1的Cu2+和Pb2+溶液,混凝时对照组直接加3 mL 32%氢氧化钠溶液和8 mg·L-1氯化铝剂进行混凝,另外3组则分别再投加10 g磷灰石、9 g磷灰石+1 g零价铁、8 g磷灰石+2 g零价铁,混凝静置后倾倒去上层清液,获得混凝絮体.将上述混凝絮体与150 mL河流沉积物混合均匀后直接铺置于1 L反应瓶底部,将对照组絮体与河流沉积物混合记作A0,投加10 g磷灰石、9 g磷灰石+1 g零价铁、8 g磷灰石+2 g零价铁后絮体与河流沉积物混合后分别记作A1、A2和A3.
在4组反应瓶中缓慢加入750 mL珠江原水,瓶内泥水比为1∶5,开始释放试验.每个反应瓶保持开口状态,模拟自然水体下的溶解氧水平(DO 3~6 mg·L-1).每天用玻璃棒缓慢扰动反应瓶内的沉积物.定时取上层水样10 mL,过0.45 μm的微孔滤膜,滴加高纯硝酸后测定上覆水的Cu、Pb浓度,同时测定水体的pH、ORP和DO值等,并用珠江原水于反应瓶内补齐液面.
2.3 分析方法水中pH 直接使用酸度计(pHs-3C,上海精密科学仪器有限公司)测定,河流沉积物、磷灰石pH在1∶5水土比条件下测定;水中溶解氧(DO)的测定使用雷磁JPB-607A型便携式溶解氧测定仪;底泥中氧化还原电位(ORP或Eh)的测定使用三信SX712 ORP测定仪;水中总磷的检测采用国标钼酸铵分光光度法(GB 11893-89);有机质含量采用水合热重铬酸钾氧化-比色法测定(鲍士旦,2005);底泥和磷灰石中 Cu、Pb、Fe全量采用HCl-HNO3-HF-HClO4消解;静态释放实验结束后底泥中不同形态铜、铅含量测定采用BCR三步提取法进行浸提(张朝阳等,2012);用Optima 5300DV型ICP-OES测定样品中的Cu、Pb和Fe的含量.
3 结果与讨论(Results and discussion) 3.1 水相中重金属混凝沉降及沉积物中重金属的释放规律表 2为模拟水混凝构建沉积物过程水相中各组的铜、铅去除率,可以看出,各组去除率近似相同,都达到了99%以上,且相对于对照组,添加了磷灰石和零价铁的实验组去除效率有所提高,由此可以认为,制备的4种沉积物中的Cu和Pb含量接近.
| 表 2 水相中重金属铜、铅去除率 Table 2 The removal rate of copper and lead in an aqueous |
图 2为静态释放过程中河流沉积物Cu、Pb释放随时间的变化曲线.由图 2a可知,单独添加磷灰石(A1)对底泥重金属Cu的稳定效果不大,最终Cu的释放量仅略微低于对照组(A0),而添加了磷灰石+零价铁的样品组(A2、A3)对Cu的释放抑制效果明显,且随着零价铁剂量的增加复合稳定剂对Cu的稳定效果也随之增强,45 d时添加10 g磷灰石(A1)、9 g磷灰石+1 g零价铁(A2)、8 g磷灰石+2 g零价铁(A3)的实验组Cu释放量分别比对照组减少了7.1%、25.0%、55.9%.
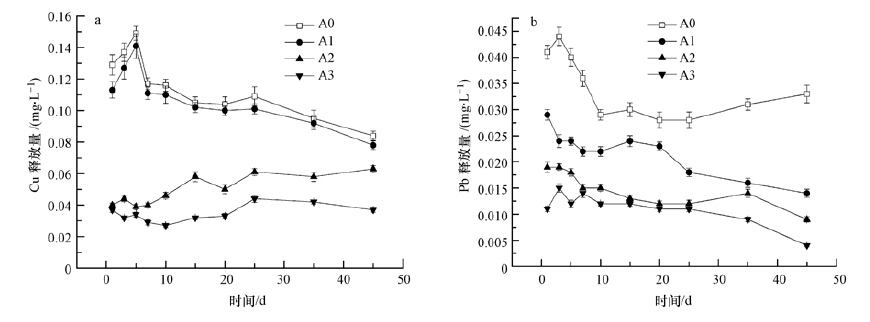 |
| 图 2 不同沉积物组分Cu(a)、Pb(b)的静态释放曲线 Fig. 2 The static release curve of copper(a)and lead(b)from different sediments |
由图 2b可知,对照组Pb的最终释放量均远高于其他加了磷灰石及其复合稳定剂的实验组,45 d时添加10 g磷灰石(A1)、9 g磷灰石+1 g零价铁(A2)、8 g磷灰石+2 g零价铁(A3)的实验组Pb释放量分别比对照组减少了57.6%、72.7%、87.9%.这说明磷灰石对底泥Pb的释放具有明显的抑制效果.有研究报道(Cao et al.,2004),磷灰石可以与Pb通过晶格置换形成Pb5(PO4)3F,它是一种溶度积十分小的矿物,而与Cu就没有这种反应.同时,对比只加磷灰石和添加了零价铁作复合稳定剂的实验组可以发现,添加了零价铁实验组Pb的释放量又明显低于未加零价铁的磷灰石实验组,且添加零价铁越多对Pb的稳定效果越好.
由图 2还可以发现,零价铁的加入对于Cu和Pb的固定都十分有效,这可能是因为Fe具有很强的还原性,其标准电极电位为-0.440 V,Cu为+0.34 V,Pb为-0.13 V,因此,铁可将在金属活动顺序表中排于其后的金属置换出来,而沉积在铁的表面,在水中会发生如式(1)、(2)的化学反应(Chen et al.,2008;Ponder et al.,2000;Rangsivek et al.,2005).

|
(1) |
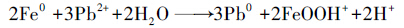
|
(2) |
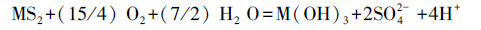
|
(3) |
同时,部分Fe2+会被氧化成Fe3+,Fe2+和Fe3+在水中会形成 Fe(OH)2和Fe(OH)3等水合物,Fe(OH)3还能通过水解生成具有很强絮凝性能的Fe(OH)2+、Fe(OH)2+等络离子(李雅,2011),这些络离子能与水中的重金属离子结合生成的稳定絮凝物进一步降低了Cu2+、Pb2+在水体的浓度.
3.2 静态释放过程中主要水质参数的变化图 3为静态释放过程中上覆水水质参数随时间的变化曲线.由图 3a可以看出,添加了磷灰石和零价铁后,水体的pH明显增加,且其随时间的变化规律均分为两个阶段,第一阶段:实验开始1~5 d,单独添加磷灰石与对照组pH呈下降趋势,而添加了零价铁的实验组pH则是先上升后下降;第二阶段:实验5~45 d,pH呈缓慢上升趋势,并达到稳定.
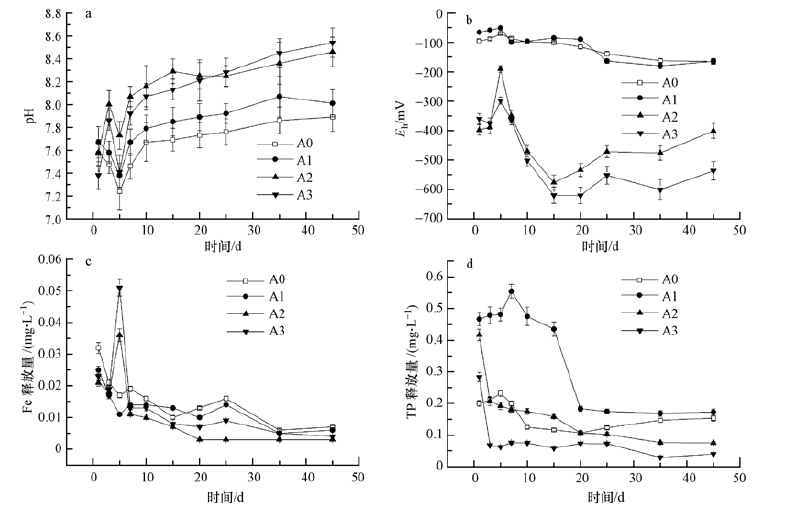 |
| 图 3 不同沉积物组分静态释放时水质参数变化 Fig. 3 The variation of water quality parameters of the overlying water in different sediments |
刚开始pH下降可能是由于沉积物经过搅拌,接触到少量氧气,使得沉积物中的有机物和酸可挥发性硫化物(AVS)被氧化,发生如式(3)的反应(Peng et al.,2009),产生酸性物质,导致pH下降.而在之后的实验中,由于上覆水的隔离作用,使得沉积物处于还原状态,并生成有机物和硫化物,该反应向左边进行,消耗H+,pH值缓慢上升至稳定.图 3b中前5 d的氧化还原电位(Eh)升高,之后总体呈现下降趋势,也说明了这一点.
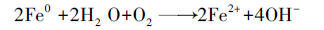
|
(4) |
另外,各实验组最终pH的大小顺序是A3>A2>A1>A0.磷灰石是一种碱性矿物,其加入会使水体 pH 值升高.而加入零价铁组的pH值升高更多,这是因为零价铁在水中会发生电化学腐蚀,发生如式(4)反应(Ruangchainikom et al.,2006).
由图 3b还可以看出,所有实验组氧化还原电位呈先升高后波动下降的趋势,与对照组相比,单独添加磷灰石底泥氧化还原电位值变化不大,说明磷灰石的加入对底泥环境影响不大.而添加了零价铁的底泥氧化还原电位先上升后下降到最低值,之后再上升,最低甚至达到了-500 mV以下,且零价铁加入越多底泥氧化还原电位越低.这是因为零价铁具有很强的还原性,它的加入使底泥从弱还原环境转变为强还原环境.另外,底泥处于强还原环境有利于硫酸盐还原菌的生长,并且零价铁氧化过程中会产生Fe2+,它是硫酸盐还原菌细胞中各种酶,如细胞色素酶、铁还原酶、红素还原酶、过氧化氢酶等的活性基成分,在细胞内部通过自身价态的相互转化实现所在酶传递电子的功能,由此促进了生物还原反应的进行,生成了更多的CuS、PbS沉淀,从而降低了重金属的释放量(冯颖等,2005; Kumar et al.,2015).
由图 3c可以看出,在4组沉积物中,上覆水中总 Fe 的含量总体呈现含量下降的趋势,其中,掺杂零价铁的实验组在5 d时有一个最高值,且加入零价铁越多总Fe含量越高,之后逐渐下降,且4组最终释放量近似,说明在实验模拟自然水体的弱氧化条件下(溶解氧3~6 mg·L-1),加入零价铁对总Fe释放影响很小.在静态释放过程中上覆水的总 Fe 含量逐渐下降可能是因为:水体中存在 Fe3+,Fe2+具有一定的氧化性和还原性,能够参与到水体的氧化还原反应及沉积物中的铁循环,更多地生成了铁氧化物胶体或是 FeS、FeS2等.
由图 3d可以看出,单独投加磷灰石的实验组总磷释放量在静态释放前15 d比对照组高很多,最高达到了0.55 mg·L-1,大约是对照组的2倍多,而15~20 d时急剧减少,后期20~45 d时释放曲线较平稳,比对照组略高,而对照组的总磷释放量在释放期间变化不大.由此可见,磷灰石加入底泥环境中,在稳定重金属类污染物的同时,前期有可能使水体总磷超标.
从图 3d还可发现,掺杂零价铁的实验组总磷的释放量要明显少于只加入磷灰石的实验组,其总磷释放曲线呈先下降后平稳的趋势,在20 d后释放量甚至低于对照组,并且加入零价铁越多总磷释放量越少,45 d时加入1 g零价铁和加入2 g零价铁的实验组相对只加入磷灰石组总磷释放量分别降低了56.3%、76.9%.这说明零价铁对磷的释放具有抑制作用,具体机理是:铁被腐蚀氧化之后会生成Fe3+及其水合物Fe(OH)2、Fe(OH)3,而(PO4)3-能与Fe3+反应生成难溶于水的磷酸铁沉淀或者与其水合物共沉淀(李亮,2008;张颖纯等,2015),从而降低了水体中总磷.
3.3 静态释放后底泥中重金属形态分析图 4为静态释放45 d后河流沉积物中铜和铅的赋存形态分布图.由图 4a可以看出,4种沉积物组分经过45 d静态释放后酸可提取态Cu的比例最高,都超过了60%,这主要是应急处理阶段投加了碱的缘故,混凝阶段生成的絮体主要组成部分就是Cu(OH)2、CuCO3、Pb(OH)2、PbCO3等,这部分的重金属对水体pH变化敏感,容易被醋酸所提取.添加10 g磷灰石、9 g磷灰石+1 g零价铁、8 g磷灰石+2 g 零价铁处理后酸可提取态所占比例由原来的 76.6%分别减少到73.5%、69.9%、62.1%,可还原态所占比例由原来的20.6%分别增加到22.8%、24.4%、30.1%,可氧化态所占比例由原来的2.1%分别增加到2.6%、4.6%、6.3%,与对照相比差异显著,残渣态略有增加,由0.7%分别增加到1.1%、1.0%、1.4%.
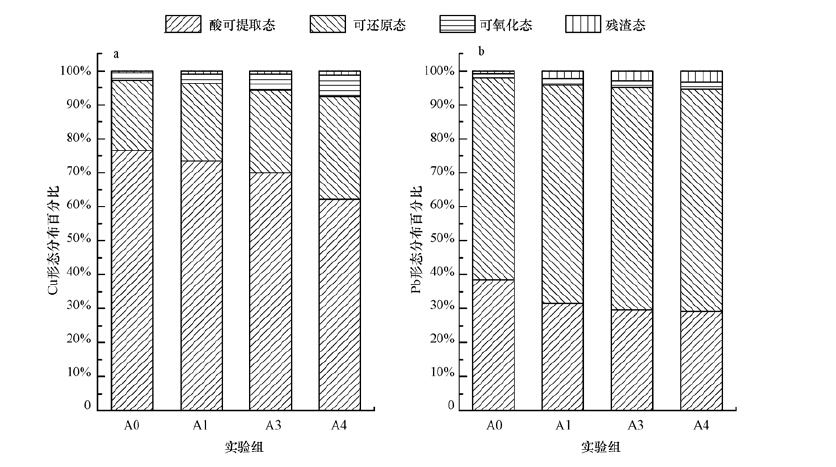 |
| 图 4 不同处理对河流沉积物中重金属分级形态的影响 Fig. 4 Effects of different treatments on heavy metal fractions in sediments |
由图 4b可以看出,4种沉积物组分经过45 d静态释放后可还原态Pb的比例最高,其次是酸可提取态、可氧化态、残渣态.添加10 g磷灰石、9 g磷灰石+1 g零价铁、8 g磷灰石+2 g零价铁处理后酸可提取态所占比例由原来的 38.5%分别减少到31.5%、29.5%、29.1%,可还原态所占比例由原来的59.3%分别增加到64.2%、65.5%、65.4%,可氧化态所占比例由原来的1.1%分别增加到1.9%、2.0%、2.2%,残渣态所占比例则由1.0%分别增加到2.3%、2.9%、3.2%,可氧化态和残渣态与对照相比差异显著.
与对照组相比,加入磷灰石或磷灰石与零价铁处理可使生物有效性高的酸可提取态Cu和Pb含量下降,生物有效性相对较低的可还原态、可氧化态、残渣态Cu和Pb含量升高.磷灰石的加入会提高底泥环境的pH值,减弱了 H+的竞争作用,使得底泥中的有机质、铁锰氧化物等与重金属结合得更为紧密,并且磷灰石主要含氟磷酸钙,可能会与重金属结合形成氟磷酸铅等沉淀,降低重金属的活性(殷飞等,2015).从图 4还可以看出,单独添加磷灰石处理对Pb的固定效果要好于Cu,特别是残渣态相比增加更为明显.
另外,添加磷灰石和零价铁处理效果比单一磷灰石处理更好,使得酸可提取态比例更低,其他形态重金属比例升高,特别是Cu和Pb的可氧化态比例、Pb的残渣态比例增加更多.可还原态比例的增加可以解释为加入的零价铁被腐蚀后会生成Fe2+、Fe3+,进而生成Fe(OH)2、Fe(OH)3絮体,它们与沉积物中的Cu、Pb作用,生成更多的铁氧化态重金属.可氧化态比例的升高应该是由于加入零价铁后沉积物中氧化还原电位较低,有利于生成更多的有机结合态和硫化态重金属.
4 结论(Conclusions)1) 在静态释放试验中,磷灰石和零价铁对河流沉积物中铜和铅的释放具有很好的抑制作用;Cu和Pb的释放量由大到小依次是对照组、投加10 g磷灰石的沉积物、投加9 g磷灰石+1 g零价铁的沉积物及投加8 g磷灰石+2 g零价铁的沉积物.
2) 在静态释放试验中发现,投加磷灰石和零价铁会使水体pH值升高;投加零价铁会降低底泥的氧化还原电位,而磷灰石对其影响较小;投加磷灰石及零价铁对水体中总Fe的释放影响都不大;单独投加磷灰石会增加水体中磷释放,而复合零价铁投加可以有效减少水中总磷.
3) 45 d释放实验后,由BCR形态分级实验得出,投加磷灰石和零价铁可使沉积物中生物有效性高的酸可提取态Cu和Pb的含量减少,生物有效性相对较低的可还原态、可氧化态、残渣态Cu和Pb含量增加.
致谢: 感谢工业聚集区污染控制与生态修复教育部重点实验室(华南理工大学)对本研究的支持.| [1] | Basta N T, Gradwohl R, Snethen K L, et al. 2001.Chemical immobilization of lead,zinc,and cadmium in smelter-contaminated soils using biosolids and rock phosphate[J]. Journal of Environmental Quality, 30 (4): 1222–1230. |
| [2] | |
| [3] | Cao X, Ma L Q, Rhue D R, et al. 2004.Mechanisms of lead,copper,and zinc retention by phosphate rock[J]. Environmental Pollution, 131 (3): 435–444. |
| [4] | Chen S Y, Chen W H, Shih C J. 2008.Heavy metal removal from wastewater using zero-valent iron nanoparticles[J]. Water Science&Technology, 58 (10): 1947–1954. |
| [5] | 陈炜.2006.氟磷灰石用于底泥重金属污染物就地稳定化的应用基础研究[D].上海:上海大学 |
| [6] | Du Y J, Wei M L, Reddy K R, et al. 2014.New phosphate-based binder for stabilization of soils contaminated with heavy metals: Leaching,strength and microstructure characterization[J]. Journal of Environmental Management, 146 : 179–188. |
| [7] | 冯颖, 康勇, 孔琦, 等.2005.硫酸盐生物还原的温度效应及Fe~0的强化作用[J].水处理技术, 31 (7):27–31. |
| [8] | Fu R, Yang Y, Xu Z, et al. 2015.The removal of chromium (VI) and lead (Ⅱ) from groundwater using sepiolite-supported nanoscale zero-valent iron (S-NZVI[J]. Chemosphere, 138 : 726–734. |
| [9] | Kumpiene J, Ore S, Renella G, et al. 2006.Assessment of zerovalent iron for stabilization of chromium,copper,and arsenic in soil[J]. Environmental Pollution, 144 (1): 62–69. |
| [10] | Kaplan D I, Knox A S. 2007.Wet/Dry cycling effects on soil contaminant stabilization with apatite and Fe(0)[J]. Journal of Materials in Civil Engineering, 19 (1): 49–57. |
| [11] | Kumar N, Chaurand P, Rose J, et al. 2015.Synergistic effects of sulfate reducing bacteria and zero valent iron on zinc removal and stability in aquifer sediment[J]. Chemical Engineering Journal, 260 : 83–89. |
| [12] | 刘羽, 彭明生.2001.磷灰石在废水治理中的应用[J].安全与环境学报, 1 (1):9–12. |
| [13] | 李亮.2008.铁内电解法应用于富营养化水体除磷研究[D].上海:同济大学 |
| [14] | 李雅.2011.Fe~0-PRB 修复地下水中铬铅复合污染的研究[D].陕西:西北农林科技大学 |
| [15] | Ponder S M, Darab J G, Mallouk T E. 2000.Remediation of Cr(VI) and Pb(Ⅱ) aqueous solutions using supported,nanoscale zero-valent iron[J]. Environmental Science&Technology, 34 (12): 2564–2569. |
| [16] | Peng J F, Song Y H, Peng Y, et al. 2009.The remediation of heavy metals contaminated sediment[J]. Journal of Hazardous Materials, 161 (4): 633–640. |
| [17] | Qian G R, Chen W, Teikthye L, et al. 2009.In-situ stabilization of Pb,Zn,Cu,Cd and Ni in the multi-contaminated sediments with ferrihydrite and apatite composite additives[J]. Journal of Hazardous Materials, 170 (2/3): 1093–1100. |
| [18] | Rangsivek R, Jekel M R. 2005.Removal of dissolved metals by zero-valent iron (ZVI): Kinetics,equilibria,processes and implications for stormwater runoff treatment[J]. Water Research, 39 (17): 4153–4163. |
| [19] | Ruangchainikom C, Liao C H, Jin A, et al. 2006.Effects of water characteristics on nitrate reduction by the Fe0/CO2 process[J]. Chemosphere, 63 (2): 335–343. |
| [20] | Schreier C G, Reinhard M. 1994.Transformation of chlorinated organic compounds by iron and manganese powders in buffered water and in landfill leachate[J]. Chemosphere, 29 (8): 1743–1753. |
| [21] | Tomašević D D, Kozma G, Kerkez D V, et al. 2014.Toxic metal immobilization in contaminated sediment using bentonite-and kaolinite-supported nano zero-valent iron[J]. Journal of Nanoparticle Research, 16 (8): 1–15. |
| [22] | 殷飞, 王海娟, 李燕燕, 等.2015.不同钝化剂对重金属复合污染土壤的修复效应研究[J].农业环境科学学报, 34 (3):438–448. |
| [23] | 郑彤, 杜兆林, 贺玉强, 等.2013.水体重金属污染处理方法现状分析与应急处置策略[J].中国给水排水, 29 (6):18–21. |
| [24] | 张朝阳, 彭平安, 宋建中, 等.2012.改进 BCR 法分析国家土壤标准物质中重金属化学形态[J].生态环境学报, 21 (11):1881–1884. |
| [25] | 张颖纯, 王伟.2015.纳米零价铁颗粒除磷反应机理[J].环境工程学报, 9 (5):2041–2047. |
 2016, Vol. 36
2016, Vol. 36


