锰作为一种用途广泛的金属元素,用于钢铁、有色冶金、化工、电子、电池和农业等行业,使得水中出现不同浓度的锰离子(Mn2+)(杜兵等,2010;郑雅杰等,2011).Mn2+作为微量营养物质,参与微生物的各种生理过程(Kehres et al.,2003),其浓度高低会对微生物生理产生影响,进而影响废水生化处理的效果.王秀蘅等(2003)研究了Mn2+对活性污泥硝化反应的影响,发现5 mg·L-1 Mn2+最有利于微生物硝化作用.Huang等(2012)对序批式反应器中Mn2+影响好氧污泥颗粒化的研究表明,10 mg·L-1 Mn2+可以加快好氧污泥颗粒化,使反应器表现出更高的有机物和氨氮去除效率.
生物膜法因具有复杂的微生态系统、高有机负荷率和强抗冲击能力等诸多优势(Karadag et al.,2015)而获得广泛应用,其胞外聚合物(Extracellular Polymeric Substances,EPS)对保持生物膜微观结构和功能的完整性起着关键作用(Sheng et al.,2010).金属离子与EPS间的架桥作用有助于微生物聚集(Sobeck et al.,2003),从而影响生物膜形成.微生物学研究表明,0.05~0.1 mmol·L-1 MnSO4最有利于变形链球菌生物膜的形成(Arirachakaran et al.,2007),而0.1 mmol·L-1 MnSO4能明显促进枯草芽胞杆菌生物膜的形成和EPS含量的增加(Shemesh et al.,2013).在贫营养水环境中的研究表明,锰的存在同样有利于生物膜的形成(Tsai et al.,2008),并促进生物膜对铅的吸附和富集(Dong et al.,2003;赵玉清等,2008).然而,目前在中富营养条件下,锰对水处理生物膜的影响研究相对空白,其对生物膜形成及功能等方面可能存在的优势鲜有报道.
因此,本研究利用自制固定床生物膜反应器(Fixed Bed Biofilm Reactor,FBBR),通过投加氯化锰考察进水中锰离子对生物膜生长、降解活性和EPS组成等方面的影响,以探讨锰离子影响载体挂膜和生物降解的机理,为生物膜反应器快速启动和优化调控提供理论依据.
2 材料与方法(Materials and methods) 2.1 实验装置及运行方式实验装置为固定床生物膜反应器(图 1),主体由有机玻璃制成,直径20 cm,高50 cm,有效容积8 L.实验采用的挂膜载体为聚氯乙烯(PVC)板,尺寸为100 mm×90 mm×2 mm,密度约1.55 g·cm-3.将清洗过的板材垂直固定在有机玻璃架上,随后将架子水平放置于反应器中.采用砂芯曝气头进行曝气,空气流量计调节曝气量.反应器运行控制参数:温度(22.0±2.7)℃,溶解氧DO(4.8±1.2)mg·L-1,pH 7.12±0.71.
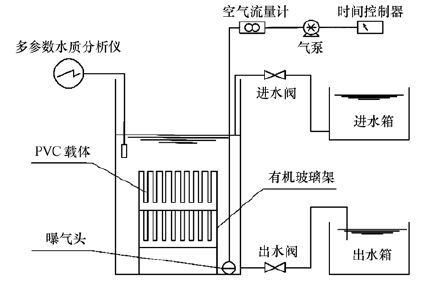 |
| 图 1 固定床生物膜反应器装置图 Fig. 1 Schematic diagram of FBBR |
本研究采用快速排泥法进行挂膜(胡学伟等,2014).反应器运行周期为24 h,分为进水-(循环曝气/停曝=1.5 h/0.5 h,共23 h)-沉淀0.5 h-出水-静置0.5 h.实验并列运行2个反应器,分别记为R1和R2,R1作为对照反应器不加锰盐,实验反应器R2分3个阶段投加MnCl2·4H2O,具体投加方式见表 1.
| 表 1 固定床生物膜反应器中Mn2+的投加量 Table 1 The dosages of Mn2+ in FBBRs |
实验所用的活性污泥采自昆明理工大学憬园污水处理站的好氧曝气池,其基本参数为:MLSS 1.76 g·L-1,MLVSS 1.245 g·L-1,SVI 85 mL·g-1.实验所用污水为人工合成,合成废水的组成为:蔗糖400 mg·L-1,NH4Cl 80 mg·L-1,K2HPO4·3H2O 30 mg·L-1,CaCl2 2.0 mg·L-1,MgCl2·6H2O 4.0 mg·L-1,NaHCO3 200 mg·L-1,微量元素溶液 0.2 mL·L-1.其中,微量元素溶液的组成为:Na2EDTA·2H2O 600 mg·L-1,ZnSO4·7H2O 600 mg·L-1,FeSO4·7H2O 800 mg·L-1,CuSO4·5H2O 200 mg·L-1,CoCl2·6H2O 600 mg·L-1,NiCl2·6H2O 400 mg·L-1,(NH4)6Mo7O24·4H2O 800 mg·L-1.进水的COD、氨氮(NH+4)和总磷分别为(499.4±13.4)mg·L-1、(21.6±0.4)mg·L-1和(4.2±0.2)mg·L-1.
2.3 生物膜及EPS分析在反应器运行第2周(W2)、第3周(W3)、第4周(W4)和第7周(W7)时,从每个反应器的相同位置各取两片PVC载体,之后用新的载体代替以保持与之前相同的环境.利用干净的刀片将生物膜从载体上全部刮下,并用去离子水稀释至100 mL,在-20 ℃下保存待用.该样品用于生物膜干重分析及EPS的提取分析.
生物膜的干重采用重量法测定.取25 mL混合均匀的生物膜在105 ℃下烘24 h,获得的质量即为生物膜干重,将烘干的生物膜在600 ℃下继续烘1 h,此时获得的质量即为生物膜中无机物的质量,损失的质量为有机物的质量(Volatile Dry Weight,VDW).
采用加热法(Chen,2013)分步提取EPS:取50 mL混合均匀的生物膜,在4 ℃、2000 g转速下离心15 min,上清液经0.45 μm滤膜过滤后,得到的溶液即为溶解性EPS(Soluble EPS,SEPS);将上述生物膜用去离子水重新悬浮于等体积溶液中,该悬浮液在恒温振荡器中在100 r·min-1转速下水平振动1 h后,再在4 ℃、5000 g下离心15 min,接着上清液经0.45 μm滤膜过滤后得到松散附着型EPS(Loosely Bound EPS,LB-EPS);将上述生物膜用磷酸盐缓冲液(PBS)(2 mmol·L-1 Na3PO4·12H2O,4 mmol·L-1 NaH2PO4·H2O,9 mmol·L-1 NaCl,1 mmol·L-1 KCl,pH=7)重新悬浮于等体积溶液中,此悬浮液于80 ℃水浴中处理30 min后,再在4 ℃、10000 g下离心15 min,接着上清液经0.45 μm滤膜过滤后得到紧密粘附型EPS(Tightly Bound EPS,TB-EPS).EPS中多糖(PS)含量测定采用苯酚-硫酸法(Lazarova et al.,1995),以葡萄糖作为标准物质;蛋白质(PN)含量测定采用改进的Lowry法(Frlund et al.,1996),以牛血清白蛋白(上海源叶生物科技有限公司)作为标准物质;DNA含量测定采用二苯胺显色法(Burton,1956),以小牛胸腺DNA(上海源叶生物科技有限公司)作为标准物质.
2.4 其他分析方法化学需氧量(COD)、氨氮(NH+4)、MLSS、MLVSS、SVI 依照《水和废水监测分析方法》(第4版)进行测定;温度、pH和DO采用水质多参数分析仪(DZS-707,上海精密科学仪器有限公司)进行实时测定;生物膜镜检采用光学显微镜(Leica DM1000,德国);生物膜的微观形态分析采用扫描电子显微镜(VR2A 3 SBU,捷克).
3 结果(Results) 3.1 Mn2+对生物膜生长的影响 3.1.1 生物膜量从图 2可见,随着生物膜的逐渐成熟,生物膜量出现逐渐增长的趋势,而且无论是生物膜中有机物还是无机物,R2中的含量对应同一时期R1的含量都要高.在生物膜成长初期(第2周),R2中生物膜干重比R1高出19.8%,这表明1 mg·L-1 Mn2+的投加明显促进了生物膜的形成.对于R1,培养3周、4周和7周后的生物膜干重比培养2周的生物膜干重分别高出20.2%、22.7%和115.5%,而对于R2,相应地分别高出7.9%、38.7%和125.1%.在第3周,R2中Mn2+投加量从1 mg·L-1增加至5 mg·L-1,生物膜中的微生物经历了一个逐渐适应的过程,使得生物膜的生长有所减缓,而从第4周开始,微生物已经完全适应了10 mg·L-1 Mn2+的环境,生物膜量得到迅速增长.
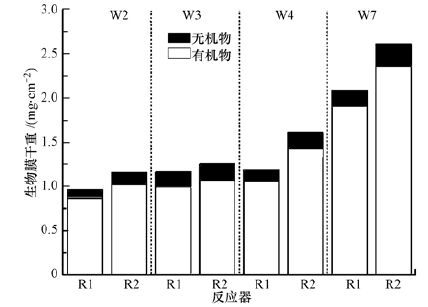 |
| 图 2 对照反应器R1和实验反应器R2的生物膜干重 Fig. 2 The dry weight of biofilm in control reactor R1 and experimental reactor R2 |
锰离子作为微生物生长代谢所必需的营养物质,是一些蛋白酶的重要辅助因子(Kehres et al.,2003),因此,适量锰离子的存在有助于增强微生物的活性并加速生物膜的成长.此外,水体中pH在6.9~8.1间变化,部分Mn2+由于水解等作用会产生氢氧化锰或碳酸锰等固体形式的Mn化合物,它们可以起到诱导核心或者载体的作用以吸引更多的微生物聚集生长(Huang等(2012)).更重要的是,Mn2+可能与EPS发生作用从而影响生物膜的生长.
3.1.2 生物膜宏观与微观形态在反应器运行第3周,随着微生物对环境的不断适应,在生物膜中可观察到大量轮虫和钟虫等,这些微生物的存在保证了系统良好的运行效果.图 3显示的是成熟生物膜的宏观形态,可以看到R1中的生物膜呈现浅棕色的平滑形态,而R2中的生物膜显得粗糙并表现为深棕色.这是由于Mn2+经水解和氧化作用会产生棕色的偏氢氧化锰MnO(OH)2,它会吸附在生物膜表面,加上生物膜本身较为密实的结构,使得R2中生物膜的颜色更深,表面更粗糙.
 |
| 图 3 成熟生物膜(56 d)的宏观形态(a.R1生物膜,b. R2生物膜) Fig. 3 The macro-morphology of mature biofilm on day 56 |
图 4显示的是成熟生物膜的微观形态,可以发现生物膜主要由一些球菌、杆菌等微生物组成,而EPS的存在促使其形成致密的菌群层.由图 4a和4c可见,R1生物膜由呈现小颗粒状的菌落聚集而成,并且菌落由小而密实的微生物构成.图 4b和4d显示,R2生物膜由呈现较大鳞片状的菌落团聚而成,并且菌落内的微生物呈现较大的体积.锰作为营养元素使得R2中生物膜的微生物显得更加饱满.此外,EPS作为生物膜的重要组成部分,其中带负电荷的基团能与Mn2+发生离子桥接作用,形成EPS-Mn2+-EPS连接体(Sobeck et al.,2002),从而促进较大聚集体的形成,使生物膜呈现密实的形态结构.
 |
| 图 4 成熟生物膜(56 d)的微观形态(a.R1生物膜(×1000),b. R2生物膜(×1000),c.R1生物膜(×5000),d.R2生物膜(×5000)) Fig. 4 The micro-morphology of mature biofilm on day 56 |
图 5显示的是Mn2+投加对反应器一个周期内成熟生物膜降解性能的影响.可以发现,两个反应器表现出了类似的COD和NH+4-N去除效果,分别为85.4%±1.5%和76.3%±1.9%,这表明Mn2+对成熟生物膜的短时间降解活性影响很小.Huang等(2012)研究了Mn2+对好氧颗粒污泥系统的影响,发现10 mg·L-1 Mn2+的投加同时提高了反应器对COD和NH+4-N的去除效率,这可能与不同的生物系统有关.王秀蘅等(2003)研究发现,Mn2+对硝化反应的最佳促进浓度为5 mg·L-1,而在本研究中生物膜成熟期使用的Mn2+投加浓度为10 mg·L-1,再加上每个周期的累积效应,从而不利于生物膜的硝化作用.此外,反应器的硝化效果可能与进水COD过高有关,从图 5中可以看出,反应器出水中仍然存在约73 mg·L-1 COD,这将不利于硝化反应进行(张耀斌等,2008),导致两个反应器的硝化效果无明显差异.
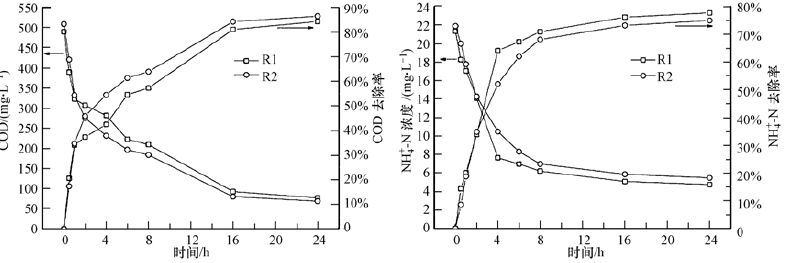 |
| 图 5 反应器运行第49天的一个周期内COD和NH+4-N的变化 Fig. 5 The removal of COD and NH+4-N in reactors on day 49 |
EPS根据其存在形态分为溶解性EPS(Soluble EPS,SEPS)和结合型EPS(Bound EPS,BEPS).SEPS又称为溶解性微生物产物(SMP),是生物处理出水中有机物的主要组成部分(Silva et al.,2000),因此,其含量高低很大程度上表明了出水COD的大小.图 6显示的是Mn2+投加对生物膜SEPS组成的影响.对比R1和R2中生物膜SEPS含量的变化可以发现,无论在哪个阶段,R2中SEPS的含量都要比R1低,这可能与R2中较强的生物膜活性有关.从图 6还可看出,R1中SEPS含量随周期呈现不稳定的变化,从第2周末的(6.14±0.74)mg·g-1(以VDW计,下同)先减少至第3周末的(0.85±0.31)mg·g-1后又突然增加到第4周末的(4.72±0.69)mg·g-1,第7周末又下降到(1.40±0.25)mg·g-1;而对于R2,在第2周其SEPS含量达到最大值(4.60±0.54)mg·g-1,之后呈现平稳减少的趋势,SEPS含量均值为(0.60±0.22)mg·g-1,这在一定程度上表明了反应器R2较R1具有更加长期稳定的有机物降解活性.
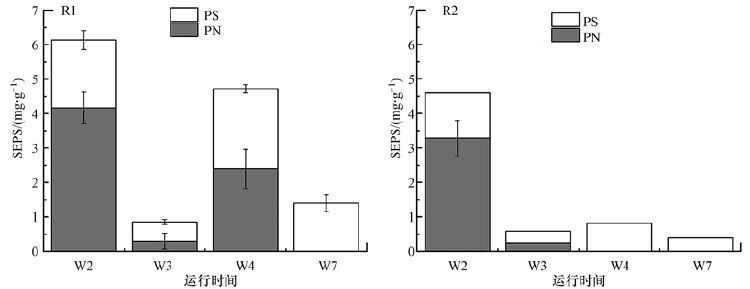 |
| 图 6 R1和R2反应器中生物膜SEPS含量变化 Fig. 6 The content variation of SEPS in biofilm from R1 and R2 |
在反应器运行初期(第2周),SEPS的大量存在有利于微生物的聚集(Eboigbodin et al.,2008),从而促进生物膜的生长.第3周末,较低的SEPS含量表明反应器中生物膜已经逐渐发展成熟,而R1中第4周末SEPS含量的急剧增加,可能是由于反应器中营养缺乏而引起的(Zhang et al.,2003),此外,初期生物膜SEPS中蛋白质含量明显比多糖高,而逐渐成熟的生物膜SEPS中多糖含量较蛋白质高,在第7周末,SEPS中只含有多糖,这可能是由于锰离子是一些蛋白酶的重要辅助因子(Kehres et al.,2003),从而促进生物膜对蛋白质的降解利用.
3.3.2 生物膜BEPS结合型EPS(Bound EPS,BEPS)根据其存在形态可分为松散附着型EPS(Loosely Bound EPS,LB-EPS)和紧密粘附型EPS(Tightly Bound EPS,TB-EPS).图 7显示的是Mn2+投加对生物膜LB-EPS和TB-EPS组成的影响.可以发现,无论是LB-EPS还是TB-EPS,其中蛋白质含量都比多糖的要多,这与水体中较低的C/N比有关(Ye et al.,2011),有研究表明,胞外DNA对生物膜形成起着关键性作用(Whitchurch et al.,2002),然而胞外DNA只存在于TB-EPS中,这也表明了TB-EPS在生物膜形成中的重要作用.此外,R1和R2反应器中生物膜TB-EPS的PN/PS值从第3周开始都呈现逐渐增大的趋势,在第7周末成熟生物膜TB-EPS的PN/PS值分别达到4.5和5.1,这与Liang等(2010)的研究结论相符.
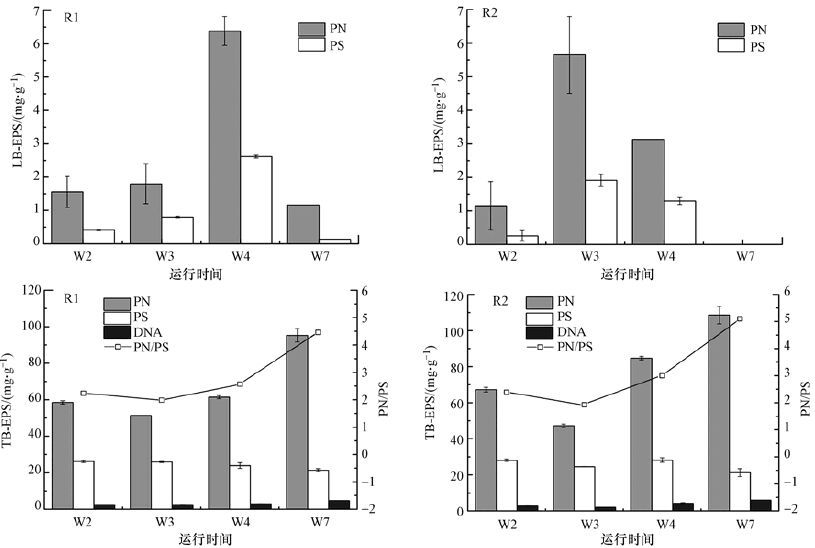 |
| 图 7 R1和R2反应器中生物膜BEPS含量变化 Fig. 7 The content variation of BEPS in biofilm of R1 and R2 |
从R1和R2反应器中生物膜LB-EPS的含量变化图中可以知道,它们的LB-EPS含量包括其中蛋白质和多糖含量随时间都呈现先增长后下降的趋势,其中,R1的蛋白质和多糖含量在第4周末具有最大值,而R2在第3周末就已经达到最大值.在第7周末,LB-EPS的急剧减少甚至消失可能与成熟生物膜较强的有机物降解能力有关(Zhang et al.,2003),与SEPS一样,生物膜中LB-EPS含量的增加同样有助于微生物聚集体的形成(Zhao et al.,2015),并促进生物膜的持续生长,这表明在第4周末R1中的生物膜已经完全成熟,而在R2中生物膜的完全成熟可能只需要3周.
结合图 6和图 7可知,TB-EPS含量占总EPS的86.6%~99.7%,表明TB-EPS在维持生物膜结构和功能方面起着十分重要的作用.从图 7中TB-EPS含量变化可以看出,R1和R2反应器中的生物膜TB-EPS含量及其中蛋白质含量都呈现先下降后增长的趋势,在第3周末蛋白质含量都达到各自的最低值,分别为51.41 mg·g-1和(47.29±0.90)mg·g-1.反应器运行的第3周可能是生物膜成熟的重要时间段,在这个阶段由于生物膜活性较强,导致营养不足,需要额外的碳源补充,而TB-EPS能够转化为小分子的LB-EPS和SEPS(Laspidou et al.,2002),从而被微生物利用和消耗.对于成熟生物膜(第7周),TB-EPS中蛋白质含量都达到各自的最高值,此时R2的TB-EPS中蛋白质含量比R1的高出约14%.然而R1和R2生物膜的TB-EPS中多糖含量在各阶段都保持在相对稳定的含量,分别为(24.32±2.23)mg·g-1和(25.55±3.32)mg·g-1.Mn2+可以作为维持微生物酶活性的关键物质,或者作为酶的激活剂来提高酶促反应效率,使微生物分泌更多的蛋白质,蛋白质会限制Mn2+扩散及通过化学反应来延缓或防止其进入微生物,从而保护微生物免受伤害(Nielsen et al.,1999),此外,Mn2+还能够与多糖和蛋白质中的羧基等官能团产生络合作用,这也对微生物形成了重要的保护作用.
4 结论(Conclusions)1) Mn2+可以通过以下物理化学作用促进生物膜形成,增强生物膜致密性,并加速生物膜成熟:Mn2+的营养学作用、Mn2+与EPS间的架桥作用,以及固体形式的Mn化合物作为诱导核心和载体的作用.
2) Mn2+对一个运行周期内成熟生物膜的降解活性影响很小,但其能够使生物膜反应器表现出长期稳定的有机物降解活性.
3) Mn2+能够刺激生物膜分泌更多的紧密粘附型EPS(TB-EPS),从而加速生物膜的成熟,TB-EPS中的蛋白质和多糖可以通过络合等生物化学作用来保护微生物免受Mn2+伤害.
| [1] | Arirachakaran P, Luengpailin S J, Mazurkiewicz J, et al. 2007.Effects of manganese on Streptococcus mutans planktonic and biofilm growth[J]. Caries Research, 41 (6): 497–502. |
| [2] | Burton K. 1956.A study of the conditions and mechanism of the diphenylamine reaction for the colorimetric estimation of deoxyribonucleic acid[J]. Biochemical Journal, 62 (2): 315–323. |
| [3] | Chen Y P. 2013.Functional groups characteristics of EPS in biofilm growing on different carriers[J]. Chemosphere, 92 (6): 633–638. |
| [4] | Dong D M, Derry L A, Lion L W. 2003.Pb scavenging from a freshwater lake by Mn oxides in heterogeneous surface coating materials[J]. Water Research, 37 (7): 1662–1666. |
| [5] | 杜兵, 周长波.2010.电解锰废水处理技术现状及展望[J].工业水处理, 30 (12):34–37. |
| [6] | Eboigbodin K E, Biggs C A. 2008.Characterization of the extracellular polymeric substances produced by Escherichia coli using infrared spectroscopic,proteomic,and aggregation studies[J]. Biomacromolecules, 9 (2): 686–695. |
| [7] | Frølund B, Palmgren R, Keiding K, et al. 1996.Extraction of extracellular polymers from activated sludge using a cation exchange resin[J]. Water Research, 30 (8): 1749–1758. |
| [8] | 胡学伟, 李姝, 荣烨, 等.2014.Cu2+对生物膜及其胞外聚合物的影响[J].化工学报, 65 (3):1062–1067. |
| [9] | Huang L H, Yang T, Wang W L, et al. 2012.Effect of Mn2+ augmentation on reinforcing aerobic sludge granulation in a sequencing batch reactor[J]. Applied Microbiology & Biotechnology, 93 (6): 2615–2623. |
| [10] | Karadag D, Köroğlu O E, Ozkaya B, et al. 2015.A review on anaerobic biofilm reactors for the treatment of dairy industry wastewater[J]. Process Biochemistry, 50 (2): 262–271. |
| [11] | Kehres D G, Maguire M E. 2003.Emerging themes in manganese transport,biochemistry and pathogenesis in bacteria[J]. FEMS Microbiology Reviews, 27 (2/3): 263–290. |
| [12] | Laspidou C S, Rittmann B E. 2002.A unified theory for extracellular polymeric substances,soluble microbial products,and active and inert biomass[J]. Water Research, 36 (11): 2711–2720. |
| [13] | Lazarova V, Manem J. 1995.Biofilm characterization and activity analysis in water and wastewater treatment[J]. Water Research, 29 (10): 2227–2245. |
| [14] | Liang Z W, Li W H, Yang S Y, et al. 2010.Extraction and structural characteristics of extracellular polymeric substances (EPS),pellets in autotrophic nitrifying biofilm and activated sludge[J]. Chemosphere, 81 (5): 626–632. |
| [15] | Nielsen P H, Jahn A. 1999. Extraction of EPS // Wingender J,Neu T R,Flemming H C.Microbial Extracellular Polymeric Substances:Characterization,Structure and Function[M]. Berlin: Springer-Verlag: 49 -72. |
| [16] | Shemesh M, Chai Y R. 2013.A combination of glycerol and manganese promotes biofilm formation in Bacillus subtilis via the histidine kinase KinD signaling[J]. Journal of Bacteriology, 195 (12): 2747–2754. |
| [17] | Sheng G P, Yu H Q, Li X Y. 2010.Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems:A review[J]. Biotechnology Advances, 28 (6): 882–894. |
| [18] | Silva D G V D, Rittmann B E. 2000.Nonsteady-state modeling of multispecies activated-sludge processes[J]. Water Environment Research, 72 (5): 554–565. |
| [19] | Sobeck D C, Higgins M J. 2002.Examination of three theories for mechanisms of cation-induced bioflocculation[J]. Water Research, 36 (3): 527–538. |
| [20] | Tsai Y P, Pai T Y, Yang Q Z. 2008.Interaction of colloidal Fe/Mn oxides concentration and shear stress on biofilm formation[J]. Environmental Engineeringence, 25 (6): 929–939. |
| [21] | 王秀蘅, 任南琪, 王爱杰, 等.2003.铁锰离子对硝化反应的影响效应研究[J].哈尔滨工业大学学报, 35 (1):122–125. |
| [22] | Whitchurch C B, Tolker-Nielsen T, Ragas P C, et al. 2002.Extracellular DNA required for bacterial biofilm formation[J]. Science, 295 (5559): 1487–1487. |
| [23] | Ye F X, Ye Y F, Li Y. 2011.Effect of C/N ratio on extracellular polymeric substances (EPS) and physicochemical properties of activated sludge flocs[J]. Journal of Hazardous Materials, 188 (1/3): 37–43. |
| [24] | Zhang X, Bishop P L. 2003.Biodegradability of biofilm extracellular polymeric substances[J]. Chemosphere, 50 (1): 63–69. |
| [25] | 张耀斌, 吴广华, 邢亚彬, 等.2008.COD进水浓度对SBMBBR脱氮除磷效果影响[J].大连理工大学学报, 48 (3):329–333. |
| [26] | Zhao W Q, Yang S S, Huang Q Y, et al. 2015.Bacterial cell surface properties:Role of loosely bound extracellular polymeric substances (LB-EPS)[J]. Colloids Surf B Biointerfaces, 128 : 600–607. |
| [27] | 赵玉清, 陈吉群, 边海涛.2008.生物膜的驯化及其对废水中铅离子的吸附[J].大连海事大学学报, 34 (1):103–106. |
| [28] | 郑雅杰, 彭映林, 乐红春, 等.2011.酸性矿山废水中锌铁锰的分离及回收[J].中南大学学报(自然科学版), 42 (7):1858–1864. |
 2016, Vol. 36
2016, Vol. 36


