2. 广东省高校水土环境毒害性污染物防治与生物修复重点实验室, 广州 510632;
3. 广东省环境污染控制与修复材料工程技术研究中心, 广州 510632
2. Key Laboratory of Water/Soil Toxic Pollutants Control and Bioremediation, Department of Education of Guangdong Province, Guangzhou 510632;
3. Guangdong Provincial Research Center for Environment Pollution Control and Remediation Materials,Guangzhou 510632
全氟辛酸(Pentadecafluorooctanoic acid,PFOA)因其具有极强的化学稳定性和很好的疏水疏油性被大量应用于造纸、纺织、制革等工业,以及灭火剂、润滑剂、表面活性剂的生产,由于PFOA具有难降解性、生物蓄积性和沿食物链在生物体内富集作用,所造成的环境污染已遍及全球生态系统,是一种分布广泛的环境持久性有机污染物.(Lindstrom et al., 2011).
PFOA可以引起肝脏细胞凋亡和癌变,并还具有遗传毒性、免疫毒性等(Grasty et al., 2005;Shan et al., 2013),已证实对人体细胞(韦荣国等,2012;Coperchini et al., 2015;Florentin et al., 2011;Gorrocjategui et al., 2014)、动物以及原生动物(韩建等,2010;Jiang et al., 2014)具有细胞毒性.尽管有研究(刘红艳等,2015)称PFOA对青海弧菌 Q67具有抑制作用,但PFOA对环境微生物的影响的研究却非常少,其对真核微生物的毒性影响还未见报道.
流式细胞术(Flow Cytometry,FCM)通过细胞与不同荧光染料作用后荧光强度、荧光颜色来区分细胞完整性、细胞生理功能的不同程度的变化,进而区分反应过程中细胞的状态(活细胞、受损细胞和死亡细胞),从微观角度了解单细胞的生理状态.其快速准确的单细胞分析能力,近年来逐渐被应用到微生物领域.酵母菌作为一种单细胞真核微生物,结构和功能与高等生物细胞相似,对污染物的毒性反应及机制同高等生物相似,其作为模式生物已被广泛应用于重金属、有机污染物、杀虫剂、纳米材料等的生物毒性评价(文航等,2011;李博等,2014;陆其聪等,2013;李娜等,2011).因此,本文以酵母菌株为受试生物,通过流式细胞术测定PFOA对酵母菌细胞膜通透性、活性氧(Reactive oxygen species,ROS)和线粒体跨膜电位(Mitochondrial transmembrane potential)、膜脂过氧化作用、ATP酶活性的影响,研究PFOA对酿酒酵母细胞的毒性效应,以期探讨PFOA对酿酒酵母的生理毒性机制,为PFOA的环境生物毒理测定方法和环境安全性评价提供依科学依据.
2 材料与方法(Materials and methods) 2.1 实验菌株及试剂实验菌株:酿酒酵母(Saccharomyces cerevisiae)菌种编号:ATCC26785,保种于暨南大学环境学院微生物实验室.
PFOA:购于Sigma公司,纯度99%,配置1 g · L-1储备液,根据实验需要稀释至相应倍数待用.4 ℃冰箱保存.
无机盐培养基: K2HPO4 4.0 g,KH2PO4 2.0 g,(NH4)2SO4 20.0 g,MgSO4 1.0 g,KCl 2.0 g,去离子水1 L(10倍母液).
其他:生理盐水(0.9%),磷酸盐缓冲液(PBS)、1%多聚甲醛溶液购于Sigma公司,PI染液、JC-1染液、DCFH-DA染液均购自碧云天生物技术公司,丙二醛(MDA)试剂盒(A003-1)、超微量ATP酶试剂盒(A070-6)购自南京建成生物工程研究所.
2.2 方法 2.2.1 实验方案设计分别向含有1、10、100 mg · L-1 PFOA的培养基中加入1 mL培养至对数期的酿酒酵母菌悬液,使培养体系总体积为20 mL,在30 ℃,160 r · min-1下避光培养,以不添加PFOA的无机盐培养基体系作为对照.分别于培养开始后0 h、24 h、36 h收集酿酒酵母细胞进行分析.
2.2.2 细胞膜通透性、ROS、线粒体跨膜电位的测定采用FCM法测定酿酒酵母细胞膜通透性、ROS、线粒体跨膜电位.
菌体细胞前处理:在无机盐培养体系中定时收集细胞,6000 r · min-1离心10 min,收集酿酒酵母细胞后,用PBS洗涤2次,每次洗涤后6000 r · min-1离心5 min,倾倒上清液.
细胞膜通透性测定:向预处理好的细胞中加入1%多聚甲醛固定,然后在6000 r · min-1离心5 min,倾倒上清液后,加入0.5 mL PBS溶液混匀后在6000 r · min-1离心5 min,倾倒上清液后,再加入0.2 mL PI染液,混匀,37 ℃避光孵育15 min,过膜后进行检测.
ROS测定:向预处理好的细胞中加入1 mL PBS配置菌悬液,分出200 μL不染色.在进行流式细胞检测之前,将细胞在6000 r · min-1离心5 min,倾倒上清液后,加入200 μL DCFH-DA,混匀,37 ℃避光孵育20 min后,加入0.5 mL PBS在6000 r · min-1离心5 min,倾倒上清液后,加入 0.2 mL PBS混匀后进行检测,计数10000个细胞.
线粒体跨膜电位测定:向预处理好的细胞加入200 μL JC-1 混匀,37 ℃避光孵育15 min,加入0.5 mL JC-1洗液在6000 r · min-1离心5 min,倾倒上清液后,加入0.2 mL JC-1洗液混匀后进行检测,计数10000个细胞.
2.2.3 菌体MDA含量测定定时收集细胞,用PBS洗涤2次后,加入 1 mL生理盐水混匀,超声破碎(4℃,40%功率,开启5 s,停止7 s,共计10 min),然后在1000 r · min-1离心5 min收集上清液,按照试剂盒说明书进行测定.
2.2.4 菌体ATP酶活性测定定时收集细胞,用生理盐水洗涤2次,洗涤后采用与MDA测定相同的条件进行超声破碎,收集上清液,按照试剂盒说明书进行测定.
3 结果与分析(Results and analysis) 3.1 PFOA胁迫对酿酒酵母细胞膜通透性的影响碘化丙啶(PI)是一种核酸染料,不能进入细胞膜结构完整的细胞中,但可以进入细胞膜通透性改变和细胞膜结构破损的细胞,与细胞内DNA或RNA结合.因此,可以利用PI染料染色来进行细菌细胞膜通透性的检测(Vives-Rego et al., 2000).实验以未加PI染料染色的细胞作为阴性对照,PI染色的细胞作为阳性对照,结果如图 1所示.
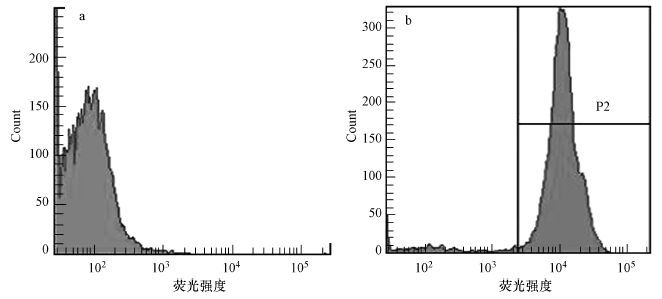 |
| 图1 阴性对照以及阳性对照(注: a表示未染色细胞位置,b表示染色细胞即受损细胞与死亡细胞位置,将此位置设为P2,即处于P2位置的细胞,即为细胞膜通透性改变的细胞.) Fig.1 Negative control and positive control |
图 2为PFOA胁迫对酵母菌细胞膜通透性的影响.结果表明,在刚加入PFOA时,1 mg · L-1、10 mg · L-1对细胞膜通透性影响较小,染色比在10.2%左右,但100 mg · L-1对细胞膜通透性影响较大,染色比达到了39.4%.说明,PFOA对酵母菌具有即时毒性,导致酿酒酵母细胞膜受损,较低浓度的PFOA对细胞的即时毒性较小,100 mg · L-1PFOA对细胞有强的即时毒性.随着时间的增加,染色细胞所占比例都有所增加.36 h后,1 mg · L-1 PFOA的体系,染色细胞比例从10.2%增加为16.9%,10 mg · L-1 PFOA的体系,染色细胞比例从10.8%增加为19.8%,而100 mg · L-1 PFOA的体系,24 h染色细胞比例达到了89.1%,在36 h时达到了94.5%,说明染色细胞比例与PFOA浓度呈正相关,即PFOA浓度越大,染色细胞比例增加越多.结果同时表明,随着胁迫浓度和时间的增加,PFOA对酿酒酵母细胞膜通透性影响越大,染色细胞的比例越大.
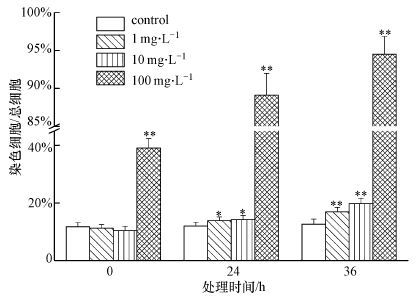 |
| 图2 PFOA对酿酒酵母细胞膜通透性的影响(**代表p<0.01,*代表p<0.05) Fig.2 Effect of PFOA on membrane permeability of Saccharomyces cerevisiae. The symbol(**) and (*)indicated p<0.01 and p<0.05,respectively |
通过JC-1染液对酿酒酵母细胞线粒体跨膜电位进行检测,以相对荧光强度RFI(红色荧光与绿色荧光的比值)来表明线粒体跨膜电位的变化,代表线粒体的去极化程度(向明灯等,2015).图 3为PFOA对酿酒酵母线粒体跨膜电位的影响.由图 3可知,与对照相比,在0 h,1和10 mg · L-1的PFOA处理下,RFI分别只下降了4.0%与4.2%,但是当PFOA胁迫浓度达到100 mg · L-1时,RFI显著下降,下降幅度达33.1%,说明100 mg · L-1 PFOA对酿酒酵母具有即时毒性,引起线粒体跨膜电位显著下降,线粒体活性迅速降低.这与前面PFOA对细胞膜通透性的影响相一致.在24和36 h,1、10和100 mg · L-1 PFOA处理体系中,RFI均出现显著下降,降幅分别达到9.9%、16.5%、33.1%和16.8%、29.7%、35.4%.研究结果表明酿酒酵母线粒体RFI下降与PFOA胁迫浓度和时间呈正相关:PFOA胁迫浓度越大,RFI下降越迅速;时间越长,RFI下降越多.
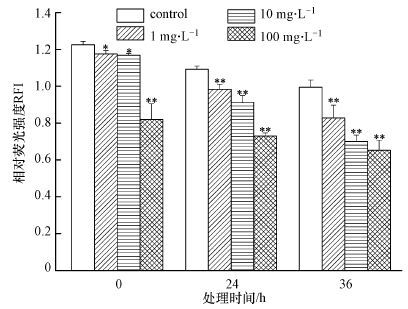 |
| 图3 PFOA对酿酒酵母细胞线粒体跨膜电位(相对荧光强度)的影响(**代表p<0.01 *代表p<0.05) Fig.3 Effect of different time and PFOA concentrations on mitochondrial transmembrane potential(RFI)of Saccharomyces cerevisiae. The symbol(**) and (*)indicated p<0.01 and p<0.05,respectively |
ROS为生物有氧代谢中的一种产物,主要包括过氧化氢(H2O2)、氧自由基(O2-)、羟自由基(OH-)等,其中H2O2、O2-是细胞内最主要、最早期的两类ROS.利用荧光探针DCFH-DA可以检测细胞内活性氧的水平:DCFH-DA穿过细胞膜进入细胞后,细胞内的酯酶可将DCFH-DA水解生成DCFH,而DCFH因不能自由通过细胞膜而存在细胞内,细胞内ROS可与无荧光的DCFH发生反应转变成能发出荧光的DCF,然后通过流式细胞仪检测DCF的荧光值来评估细胞内活性氧的水平.图 4为PFOA对酿酒酵母细胞内ROS含量的影响.结果显示,PFOA的存在,能使酿酒酵母细胞内ROS增加.在0 h,1和10 mg · L-1的PFOA对酿酒酵母ROS基本无影响,但在100 mg · L-1 PFOA条件下,酿酒酵母细胞内ROS含量是对照的2倍,说明100 mg · L-1 PFOA对酿酒酵母具有即时毒性,这与前述线粒体跨膜电位和膜通透性的结果相一致.当处理时间为24与36 h,在PFOA浓度为1、10、100 mg · L-1时,与空白对照相比,ROS含量分别升高了4.8%与22.1%;12.7%与35.6%;169.8%与215.3%.实验结果表明,酿酒酵母细胞体内ROS含量与PFOA胁迫浓度和时间呈显著正相关.
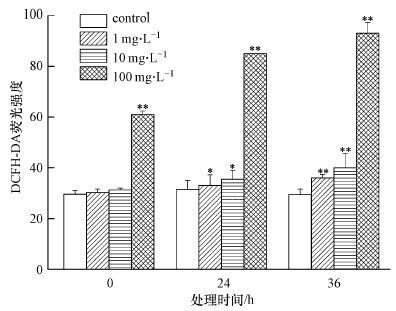 |
| 图4 PFOA对酿酒酵母细胞内活性氧含量的影响(**代表p<0.01 *代表p<0.05) Fig.4 Effect of PFOA on ROS of Saccharomyces cerevisiae. The symbol(**) and (*)indicated p<0.01 and p<0.05,respectively |
当细胞内ROS含量过高时,会攻击细胞膜与蛋白质,使膜发生过氧化作用,使得膜不饱和度下降,进而影响膜的流动性与稳定性(Anwer et al., 2007).MDA是膜脂过氧化的主要产物之一,通常将它作为膜脂过氧化作用强弱的一个重要标志.由图 5可知,PFOA可以导致酿酒酵母细胞内MDA增加.加入PFOA 0 h时,高浓度PFOA(100 mg · L-1)体系中酿酒酵母细胞MDA含量与对照相比升高了50.0%,说明此浓度下的PFOA对酿酒酵母具有即时毒性.当处理时间延长,菌体细胞内MDA上升,结果与前文中ROS、膜通透性结果呈高度相似性:与空白对照相比,在处理24与36 h,在PFOA浓度为1、10、100 mg · L-1时,MDA含量分别升高了20.8%与40.9%,65.5%与181.8%,112.5%与286.4%,研究结果说明菌体内MDA 与PFOA胁迫时间和浓度也呈正相关.
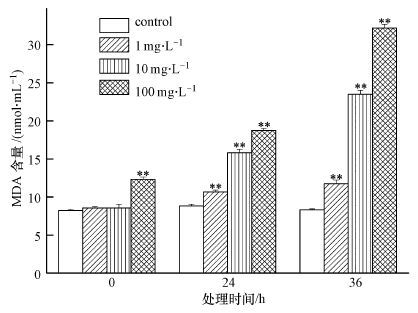 |
| 图5 PFOA对酿酒酵母细胞MDA含量的影响(**代表p<0.01 *代表p<0.05) Fig.5 Effect of different time and PFOA concentrations on MDA of Saccharomyces cerevisiae. The symbol(**) and (*)indicated p<0.01 and p<0.05,respectively |
ATP酶广泛存在于细胞膜系统上,是生物膜上的一种蛋白酶,它在能量转换、物质运输以及信息传递上有着十分重要的作用.在细胞受到胁迫时,ATP酶活性会发生变化(段学军等,2005).图 6 表明 PFOA对酿酒酵母Na+K+-ATPase(图 6 a)、Ca2+Mg2+-ATPase(图 6 b)、总 ATPase(图 6 c)酶活性产生了影响.其中,1和10 mg · L-1PFOA对酿酒酵母Na+K+-ATPase、Ca2+Mg2+-ATPase、总ATPase有相似的规律性:0 h 基本无影响,24 h活性明显升高.而100 mg · L-1PFOA的处理在0 h酿酒酵母Na+K+-ATPase、Ca2+Mg2+-ATPase、总ATPase活性显著升高,在24 h时Na+K+-ATPase、Ca2+Mg2+-ATPase、总ATPase已显著低于对照组.但在36 h后,3个PFOA处理组的Na+K+-ATPase、Ca2+Mg2+-ATPase、总ATPase均已显著低于对照组.说明在一定浓度的PFOA胁迫下,酿酒酵母细胞在一定时间内自身通过增强ATPase的活性来抵御PFOA对本身的胁迫,这是一种细胞自身的应激反应,但是随着时间的增长,在PFOA胁迫下,酿酒酵母细胞自身膜完整性遭到破坏,ROS、MDA含量逐渐升高,线粒体膜电位不断降低,菌体细胞出现损伤,菌体细胞不能通过自身调节来适应这种胁迫环境,导致ATP酶活性下降.
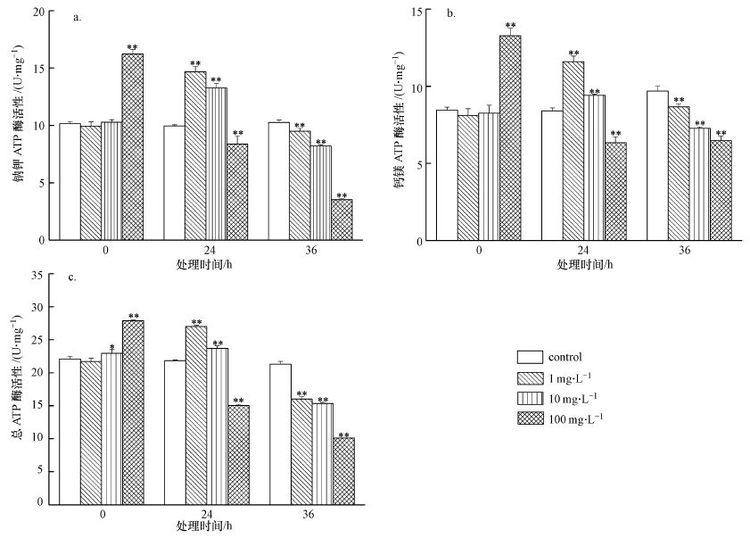 |
| 图6 PFOA对酿酒酵母Na+K+-ATPase(a)、Ca2+Mg2+-ATPase(b)、Total ATPase(c)酶活性的影响(**代表p<0.01 *代表p<0.05) Fig.6 Effect of different time and PFOA concentrations on Na+K+-ATPase(a)、Ca2+Mg2+-ATPase(b)、Total ATPase(c)of Saccharomyces cerevisiae. The symbol(**) and (*)indicated p<0.01 and p<0.05,respectively |
在细胞受到外界胁迫时,细胞内ROS含量会升高(Wang et al., 2013),虽然适量ROS是细胞生长、增殖和分化所必需的,但是体内ROS水平升高会影响细胞的生理活性(陆其聪等,2013).过量ROS会攻击膜和蛋白质(Ma et al., 2011),它与细胞膜中不饱和脂肪酸发生氧化反应,导致细胞质膜的过氧化,从而引起膜氧化损伤(Zhang et al., 2014),同时外界的不良环境会影响细胞膜结构(王飚等,2009),改变菌体细胞膜的通透性,使膜流动性与稳定性遭到破坏,菌体细胞膜完整性受损,正常生理活动与物质能量代谢受阻,导致菌体生理活性受到抑制(Shapiro,1993),进而导致细胞损伤与凋亡(Anwer et al., 2007).同时,ROS还可以降低线粒体膜电位,而线粒体膜电位的降低也被认为是细胞凋亡的早期标志之一(Ly et al., 2003).随着研究的深入,线粒体跨膜电位降低的机制越来越清晰,这有利于进一步了解细胞凋亡,并可利用线粒体跨膜电位变化来检测细胞凋亡.MDA是细胞膜脂过氧化作用的产物之一,不仅可以用来表征细胞膜脂过氧化程度,它还可以与细胞内一些成分发生反应,放大ROS作用,进一步造成细胞膜损伤,导致膜不饱和度降低,降低膜的流动性,最终也会导致膜完整性和结构的破坏.
本研究中,当PFOA与酿酒酵母接触后,细胞内的ROS水平升高,质膜通透性改变,引起细胞膜过氧化作用,MDA含量增高,同时降低线粒体跨膜电位.线粒体作为细胞生产ATP的主要场所,当其膜电位下降时,就会导致线粒体呼吸链受抑,从而导致细胞凋亡(Ly et al., 2003; Lucken et al., 2005).由于线粒体功能受到削弱、膜结构完整性遭到破坏,又会进一步使细胞产生更多的ROS,进一步增大酿酒酵母细胞膜通透性,使得更多的PFOA可以进入细胞中,出现恶性循环,最终使得酿酒酵母细胞活性下降,并诱导细胞出现凋亡.已有研究表明(Wang et al., 2013),全氟化合物PFOS可抑制人鼠杂交细胞线粒体呼吸,并诱导线粒体肿胀,从而诱导线粒体衰亡.本实验表明,PFOA的存在也可以导致酿酒酵母线粒体跨膜电位下降,进而通过影响线粒体活性导致细胞凋亡.
在细胞内部,ATP酶是一种十分重要的酶系统,广泛存在于细胞膜及细胞器膜上,是生物膜上的一种蛋白酶,参与多种代谢活动,维持细胞正常的生理活性.其中,ATP酶主要有Na+K+-ATPase(钠泵)、Ca2+Mg2+-ATPase(钙泵)等,它们在维持细胞内外渗透压的平衡与细胞膜完整性中起到了重要的作用(Zhou et al., 2011).当Na+K+-ATP酶被激活时,会逆浓度梯度将细胞内的Na+转运到细胞外,同时将细胞外的K+转运到细胞内,从而维持细胞内外渗透压的平衡(尹飞等,2011).Na+K+-ATP酶活性变化将会改变细胞离子的运输从而影响细胞活性.而Ca2+Mg2+-ATP酶是转运Ca2+的一种蛋白,起到维持细胞体内Ca2+平衡作用(刘柿良等,2013).当细胞受到外界刺激胁迫时,会使得细胞体内Ca2+浓度升高,高浓度Ca2+会干扰细胞正常能量代谢和很多生理功能(Tsukamoto et al., 2011).
本实验中,在PFOA胁迫下,酿酒酵母细胞内Na+K+-ATP酶活性、Ca2+Mg2+-ATP酶活性与总ATP酶活性随着时间的延长出现了先上升后下降的趋势,说明当细胞受到PFOA胁迫时,生理活动受到了影响,菌体细胞对外界胁迫环境做出反应,通过提高Na+K+-ATP酶的活性来维持细胞本身的离子交换和渗透压的平衡,同时通过Ca2+Mg2+-ATP酶活性的变化来维持体内Ca2+水平相对稳定.但随着时间的延长,细胞膜通透性改变,菌体细胞体内产生了过多的ROS,导致细胞膜系统发生过氧化反应,细胞膜系统完整性受损,使得ATP酶活性出现下降,最终导致细胞活性下降甚至进入凋亡.
不同生物体对同一种污染物毒性的敏感程度是存在差异的,并且受试生物和环境条件的不同也会影响污染物的毒性效应及毒性机制.因此,选用适宜的模式生物来研究污染物的毒性效应可为污染物的安全性评价提供依据.酿酒酵母属于单细胞真核生物,结构和功能与高等生物细胞相似,对污染物的毒性反应及机制同高等生物相似,因此,本研究不仅对推导PFOA对高等生物乃至人体的生理毒性机制有参考作用,也可以为PFOA对环境中真核微生物的毒性效应研究、环境生物毒理测定方法及环境影响提供依科学依据和参考.
5 结论(Conclusions)1)PFOA的存在能使酿酒酵母细胞膜通透性增大,随着PFOA胁迫时间和浓度的增加,对酿酒酵母细胞膜通透性影响越大,染色细胞的比例越高.
2)PFOA可使酿酒酵母细胞内ROS和MDA含量上升,RFI降低,且ROS含量、MDA 含量与RFI降幅均与PFOA胁迫浓度和时间呈正相关.
3)PFOA胁迫下,酿酒酵母细胞内Na+K+-ATP酶活性、Ca2+Mg2+-ATP酶活性与总ATP酶活性随着处理时间的延长呈先上升后下降的趋势.
4)PFOA对酿酒酵母具有生物毒性,其中100 mg · L-1PFOA对酿酒酵母具有即时毒性.
| [1] | Anwer T, Sharma M, Pillai K K, et al. 2007. Protective effect of bezafibrate on streptozotocin-induced oxidative stress and toxicity in rats [J]. Toxicology, 229: 165-172 |
| [2] | Coperchini F, Pignatti P, Lacerenza S, et al. 2015. Exposure to perfluorinated compounds: in vitro study on thyroid cells[J]. Environmental Science and Pollution Research, 22: 2287-2294 |
| [3] | 段学军,闵航. 2005.稻田土壤细菌对重金属镉的氧化应激反应研究[J].安全与环境学报, 5(2):50-53 |
| [4] | Florentin A, Deblonde T, Diguio N, et al. 2011. Impacts of two perfluorinated compounds (PFOS and PFOA) on human hepatoma cells: cytotoxicity but no genotoxicity? [J]. International Journal of Hygiene and Environmental Health, 214: 493-499 |
| [5] | Frostegard A, Baath E, Tunlid A. 1993.Shift in the structure of soil microbial communities in limed forests as revealed by phospholipid fatty acid analysis[J]. Soil Biology and Biochemistry, 25(6): 723-730 |
| [6] | Gorrochategui E, Perez-Albaladejo E, Casas J, et al. 2014. Perfluorinated chemicals: Differential toxicity, inhibition of aromatase activity and alteration of cellular lipids in human placental cells[J]. Toxicology and Applied Pharmacology, 277: 124-130 |
| [7] | Grasty R C, Bjork J A, Wallace K B, et al. 2005. Effects of prenatal perfluorooctane sulfonate (PFOS) exposure on lung maturation in the perinatal rat [J]. Birth Defects Res Part B-Dev Reprod Toxicol, 74(5): 405-416 |
| [8] | 韩建,方展强. 2010.水环境PFOS和PFOA的污染现状及毒理效应研究进展[J]. 水生态学杂志, 31(2):99-105 |
| [9] | Jiang Y, Kong Q, Roland K L, et al. 2014. Membrane vesicles of Clostridium perfringens type a strains induce innate and adaptive immunity[J]. International Journal of Medical Microbiology, 304: 431-443 |
| [10] | 李博,王志谨,曹军,等. 2014.污水处理传统工艺与新工艺出水中有机提取物的雌激素样作用比较[J].卫生研究, 03:477-482 |
| [11] | Lindstrom A B, Strynar M J, Libelo E L. 2011. Polyfluorinated Compounds: Past, Present, and Future [J]. Environmental Science & Technology, 45(19): 7954-7961 |
| [12] | 刘红艳,秦光军,莫凌云,等. 2015.PFOA和PFOS对青海弧菌Q67的毒性作用评估[J]. 桂林理工大学学报, 1:121-125 |
| [13] | 李娜,陈建明,张珏锋,等. 2011.褐飞虱共生解脂假丝酵母抗吡虫啉菌株的驯化[J].微生物学通报, 02:237-241 |
| [14] | 刘柿良,杨容孑,潘远智,等. 2013.外源NO对镉胁迫下长春花质膜过氧化ATP酶活性及光合特性的影响[J].农业环境科学学报,32(12):2360-2368 |
| [15] | 陆其聪,方涛,戴和平,等. 2013.纳米氧化铜对酿酒酵母的细胞毒性机制研究[J].环境科学学报, 33(8):2341-2348 |
| [16] | Lucken-Ardjomande S, Matinou J C. 2005. Newcomers in the process of mitochondrial permeabilization [J]. Journal of Cell Science, 118(3): 473-483 |
| [17] | Ly J D, Gubb D R, Lawen A. 2003. The mitochondrial membrane potential (Delta psim) in apoptosis; an update [J]. Apoptosis, 8: 115-128 |
| [18] | Ma Q, Fang H, Shang W, et al. 2011. Superoxide flashes: early mitochondrial signals for oxidative stress-induced apoptosis [J]. Journal of Biological Chemistry, 286(31): 27573-27581 |
| [19] | Shan G, Ye M, Zhu B, et al. 2013. Enhanced cytotoxicity of pentachlorophenol by perfluorooctane sulfonate or perfluorooctanoic acid in HepG2 cells[J]. Chemosphere, 93: 2101-2107 |
| [20] | Shapiro L. 1993. Protein localization and asymmetry in the bacterial cell[J]. Cell, 73: 841-855 |
| [21] | Tsukamoto A, Higashiyama S, Yoshida K, et al. 2011. Stable cavitation induces increased cytoplasmic calcium in L929 fibroblasts exposed to 1-MHz pulsed ultrasound[J]. Ultrasonics, 51(8): 982-990 |
| [22] | Vives-Rego J, Lebaron P, Nebe-Von Caron G. 2000. Current and future applications of flow cytometry in aquatic microbiology [J]. Fems Microbiol Reviews, 24(4): 429-448 |
| [23] | 王飚,田丰伟,励建荣,等. 2009.冷冻干燥对乳酸菌细胞膜通透性的影响[J].微生物学通报, 36(5):684-688 |
| [24] | Wang X, Zhao G, Liang J, et al.2013. PFOS-induced apoptosis through mitochondrion-dependent pathway in human-hamster hybrid cells [J]. Mutation Research-DNA Repair, 754: 51-57 |
| [25] | 韦荣国,张银凤,秦占芬. 2012. 全氟化合物发育神经毒性研究进展[J]. 生态毒理学报, 7(5):483-490 |
| [26] | 文航,黄艺. 2011.粟酒裂殖酵母菌对环境压力响应的研究进展[J]. 生态学杂志, 08:1845-1850 |
| [27] | 向明灯,李良忠,玉琳,等. 2015.四溴双酚A对HepG2细胞线粒体膜电位及凋亡的影响[J].环境卫生学杂志,01:6-9 |
| [28] | 尹飞,孙鹏,彭士明,等. 2011.低盐度胁迫对银鲳幼鱼肝脏抗氧化酶、鳃和肾脏ATP酶活力的影响[J].应用生态学报, 22(4):1059-1066 |
| [29] | Zhou J, Cai Z H, Xing K Z. 2011. Potential mechanisms of phthalate ester embryotoxicity in the abalone Haliotis diversicolor supertexta[J]. Environmental Pollution, 159(5): 1114-1122 |
 2016, Vol. 36
2016, Vol. 36


