2. 华南理工大学环境与能源学院, 广州 510006
2. College of Environment and Energy, South China University of Technology, Guangzhou 510006
抗生素是指能够抑制或杀死微生物的一类天然或人工合成的化学物质.环境中抗生素的主要来源有抗生素生产废水、医用抗生素、人用抗生素和兽用抗生素(Li et al.,2015).研究发现,抗生素可通过暴露在土壤中的未经处理的动物粪便、化粪池、地表径流、渗滤等形式进入环境,然后在环境中进行迁移和转化(郭学涛等,2014).进入到环境中的抗生素不仅会对水生生态系统、环境中的微生物、动植物产生一定的危害,还会诱发微生物产生抗性基因,因而受到了国内外学者们的广泛关注(Zhou et al.,2014).磺胺二甲基嘧啶(4-氨基-N-(4,6-二甲基-2-嘧啶基)),因具有抗菌广谱、疗效强、方便安全等优点被广泛用于人和动物疾病的治疗,并且磺胺二甲基嘧啶还可以作为动物饲料添加剂用于预防动物疾病和促进动物生长(Guo et al.,2015). 目前国内外学者已经广泛报道了环境中磺胺类药物的残留,其残留浓度从几μg·L-1到几百μg·L-1.因此,了解磺胺类药物在环境中的迁移特性,对于评估此类抗生素的环境风险具有重要的现实意义(Guo et al.,2013).
目前,国内外学者对磺胺类药物在环境中迁移的研究主要集中在其在土壤上的吸附,且发现溶液pH值、离子强度、土壤有机质含量和矿物是影响磺胺类药物在土壤上吸附的主要因素(Guo et al.,2014;Zhao et al.,2014).针铁矿广泛存在于土壤、河流、海洋、湖泊的沉积物中,是表生环境中最稳定存在的矿物,具有较大的比表面积、较高的反应活性,对多种污染物和营养物具有强烈的亲和及吸附作用(Zhao et al.,2014). 目前,关于针铁矿对抗生素吸附的研究仅有零星报道,例如,Zhao等(2014)报道了四环素在针铁矿上的吸附特性,发现pH值是影响四环素在针铁矿上吸附的主要因素.本课题组在之前的研究中发现,针铁矿对磺胺二甲基嘧啶有一定的吸附,且对其在针铁矿上的吸附动力学和热力学进行了系统研究,但对于磺胺二甲基嘧啶在针铁矿上的吸附机制还不明确(Guo et al.,2013).而且以上研究对于科学合理地评价抗生素的生态环境风险明显不够. 因此,本文以磺胺二甲基嘧啶作为磺胺类药物的代表,考察不同的环境条件对针铁矿吸附的影响机制,这不仅有助于人们进一步了解抗生素药物的环境行为,而且可为正确评估其环境风险提供基础数据.
2 材料与方法(Materials and methods) 2.1 实验材料磺胺二甲基嘧啶(纯度> 99%)购自美国Sigma公司,-20 ℃保存;乙腈和甲醇均为色谱纯,购自上海安谱科学仪器有限公司;其它试剂均为分析纯,购自国药试剂有限公司;实验用水为超纯水,由Milli-Q超纯水仪制备(Merck Millipore Advantage A10). 磺胺二甲基嘧啶的分子结构及其在不同pH水溶液中呈现的不同形态为:溶液pH<2.28时带正电荷,2.28<溶液pH<7.42时,以不带电荷的分子态形式存在,溶液pH>7.28时以带负电荷的离子态存在.
2.2 针铁矿制备针铁矿(α-FeOOH)的制备参考Brigante方法(Brigante et al.,2010),在Fe(NO3)3水溶液中加入 2.5 mol·L-1的KOH,直至悬浮液pH值达到12.0.混合悬浮液置于60 ℃烘箱陈化24 h,将沉淀倒入透析袋,在去离子水中浸泡,定时换水,直至pH值透析到9.0.离心分离沉淀物,将沉淀置于真空干燥箱中干燥,研磨后过200目筛,备用.制得的针铁矿样品分别用扫描电镜(SEM,COXEM)、透射电镜(TEM,菲利普)、X射线衍射仪(XRD,岛津XD-3A 型)、傅里叶变换红外光谱仪(FTIR,Nicolet 6700)、比表面分析仪(Micromeritics,ASAP2000 型)及表面电位分析仪(Zetasizer Nano ZS 90,Malvern,UK)进行表征,表征结果见图 1.
 |
| 图 1 针铁矿的扫描电镜(a)、透射电镜(b)、XRD(c)和FTIR(d)图 Fig. 1 SEM(a),TEM images(b),XRD patterns(c)and FTIR spectrum(d)of goethite |
通过SEM和TEM分析可知,合成的针铁矿呈针状结构,为平均长度约1 μm,直径约100 nm的针状体;将其XRD 图谱与标准矿物(针铁矿Goethite卡片号29-0713)及相关文献(Brigante et al.,2010)对照,可以确定为针铁矿.相应的比表面积为34.1 m2·g-1,等电点为8.5. FTIR分析可知,在3400cm-1和3125 cm-1处有很强的—OH的伸缩振动,在1632、862和806 cm-1处有—OH的伸缩振动,在640 cm-1处有Fe—O 键的弯曲振动(Davidson et al.,2008).
2.3 吸附实验及检测方法吸附等温线:配置一系列初始浓度为0.5~50 mg·L-1的磺胺二甲基嘧啶吸附液,针铁矿的用量为0.05~0.2 g,用35 mL的玻璃离心管作为反应容器;放入(25±2)℃、150 r·min-1的摇床中振荡达到平衡.每个样品重复3个平行样,每个浓度设置空白样品对照.平衡后,所有样品于3000 r·min-1条件下离心10 min,然后静置12 h取上清液,使针铁矿颗粒完全沉淀.用玻璃滴管吸取1.5 mL的上清液于棕色色谱瓶中待测,在吸附背景溶液中加入0.001 mol·L-1叠氮化钠以抑制微生物的作用.
解吸采用吸附-解吸单循环方法进行,在吸附过程完成后,移去试管里的上清液,称重;立即注入不含磺胺二甲基嘧啶的背景溶液,再次称重;在(25±2)℃、150 r·min-1的摇床中平衡振荡24 h,使吸附解吸达到平衡.平衡后,所有样品于3000 r·min-1条件下离心10 min,然后静置12 h,使针铁矿颗粒完全沉淀.用玻璃滴管吸取1.5 mL的上清液于棕色色谱瓶中待测.
离子强度影响实验中设置磺胺二甲基嘧啶的初始浓度为10 mg·L-1,用 KNO3将体系离子强度分别调节至0~0.1mol·L-1,pH值为8.0.
pH值影响实验中磺胺二甲基嘧啶的初始浓度为10mg·L-1,用硝酸或氢氧化钾把体系pH值调为2.0~12.0,离子强度为0.01 mol·L-1的硝酸钾.
磺胺二甲基嘧啶的分析检测用高效液相色谱(日立2459)进行,色谱条件:Luna,C18(2)型色谱柱(250mm×4.6 mm,5 μm);流动相为0.05%甲酸溶液∶乙腈=40∶60;流速0.5 mL·min-1;进样量100 μL;检测波长264nm.
2.4 吸附模型吸附等温线分别用线性(Linear)吸附模型(式(1))、Freundlich吸附模型(式(2))、Langmuir吸附模型(式(3))进行拟合((Mutavdzic′ Pavlovic′ et al.,2014),.
7

|
(1) |

|
(2) |
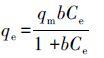
|
(3) |
式中,qe为污染物在固相中的平衡浓度(mg·kg-1);Ce为污染物在液相中的平衡浓度(mg·L-1);Kd为污染物在固相和液相中的线性分配系数(L·kg-1);Kf是Freundlich分配系数((mg·kg-1)/(mg·L-1)n),用于表征吸附作用强弱;n无量纲,可以表征吸附等温线的非线性程度;qm为Langmuir 饱和吸附量(mg·kg-1);b是Langmuir吸附常数.
3 结果与讨论(Results and discussion) 3.1 磺胺二甲基嘧啶在针铁矿上的吸附解吸吸附等温线是吸附性能的重要特征,可反映吸附剂和吸附质之间的平衡关系、亲和力、吸附体系的作用机理及评价吸附材料的吸附能力.磺胺二甲基嘧啶在针铁矿上的吸附等温线如图 2所示.用经典的线性吸附模型、Langmuir模型和Freundlich模型对吸附数据进行拟合,结果见表 1.
 |
| 图 2 磺胺二甲基嘧啶在针铁矿上的吸附(a)、解吸(b)等温线 Fig. 2 Sorption(a)and desorption(b)isotherms of SMT on goethite |
| 表 1 针铁矿吸附磺胺二甲基嘧啶的吸附等温线拟合参数 Table 1 SMT sorption isotherm parameters |
从拟合结果可以看出,磺胺二甲基嘧啶在针铁矿上的吸附用3个吸附模型均能较好地拟合,拟合的可决系数均在0.90以上.因此,磺胺二甲基嘧啶在针铁矿上吸附具有明显的非线性,且吸附的n都小于1,这说明磺胺二甲基嘧啶初始浓度越大其吸附的趋势减小.这可能是与针铁矿表面的吸附位点有关,吸附刚开始时,磺胺二甲基嘧啶首先被针铁矿表面的高能吸附位点吸附,当这些高能的吸附位点被完全占据,再由低能吸附位点进行吸附.因此,吸附是多种作用力共同作用的结果.这种非线性的吸附也证明了针铁矿表面上的官能团与磺胺二甲基嘧啶之间发生了一定的化学作用(Thiele-Bruhn et al.,2004).
由表 1可知,磺胺二甲基嘧啶在针铁矿上吸附的线性模型的拟合参数Kd为5.08 L·kg-1,这与其他学者的研究结果一致.Thiele(2004)报道了磺胺类药物在不同pH值和有机质含量土壤上吸附的Kd分别为2.4 L·kg-1和3 L·kg-1.Langhammer(1989)报道了SMT在不同土壤上的吸附Kd值为1.0~3.1 L·kg-1. 磺胺二甲基嘧啶是一个具有苯环结构的大分子,在其苯环分子上有—NH2和—SO2NH—等活性官能团,其可以和针铁矿通过π-π EDA共用电子对作用进行结合((Teixidó et al.,2011),.
为了更进一步验证前面的推测,引入解吸等温线来说明吸附的滞后性.为了定量说明解吸过程的滞后性,解吸滞后系数(H)被引入:
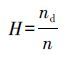
|
(4) |
式中,n和nd分别指Freundlich模型的拟合值.
通过计算得出磺胺二甲基嘧啶在针铁矿上的吸附解吸的解吸滞后系数H为1.87,因此,其在针铁矿上的解吸存在滞后现象,这与Wu等(2013)报道的环氧沙星在粘土矿物上的吸附解吸滞后一致.解吸滞后的现象可能与磺胺二甲基嘧啶在针铁矿上吸附的不可逆有关,而一般这种不可逆的吸附与化学吸附有关.
3.2 pH值对针铁矿吸附磺胺二甲基嘧啶的影响磺胺二甲基嘧啶是一种可以离子化的有机污染物,在不同的pH条件下呈现不同的形态,因此,pH对其在针铁矿上的吸附有一定的影响.磺胺二甲基嘧啶有两个pKa值,因此,其在水溶液中会以正价态、分子态和负价态形式存在.图 3所示为磺胺二甲基嘧啶在不同pH条件下所呈现的存在形式及SMT在针铁矿上的吸附随着pH的变化.磺胺二甲基嘧啶的不同形态在不同pH条件下所占的比例可以通过pH与pKa的关系式来计算(Gschwend et al.,1992). 从图 3可以看出,吸附在pH值为8.0时达到最大,随着pH从8.0增加到13.0吸附迅速减小,随着pH值从8.0减小到3.0吸附有微弱的减小,当pH减小到3.0以下时吸附迅速减小.在这里Kd被用来表征磺胺二甲基嘧啶在针铁矿上的总吸附系数,其表达式如下(Gschwend et al.,1992;( Teixidó et al.,2011),:

|
(5) |
 |
| 图 3 pH值对针铁矿吸附磺胺二甲基嘧啶的影响 Fig. 3 Effects of pH on SMT sorption on goethite |
式中,α+、α0和α-分别代表不同类型的磺胺二甲基嘧啶分子在溶液中的比例,Kd+、Kd0和Kd-分别代表不同类型的磺胺二甲基嘧啶分子在针铁矿上的分配系数(L·kg-1).不同类型的分子在溶液中的比例计算方式如下:

|
(6) |

|
(7) |
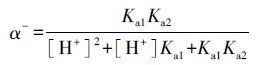
|
(8) |
根据式(5)~(8),分别计算得到Kd0= 5.19 L·kg-1,K+d= 1.52 L·kg-1,K-d= 0.29 L·kg-1.而且根据文献报道(Teixidó et al.,2011),在对应的logKow值,带正电荷的磺胺二甲基嘧啶(SMT+)、带负电荷的离子态(SMT-)和不带电荷的分子态(SMT0)分别为-1.3、-2.09和0.27.因此,SMT0比SMT+和SMT-具有更强的疏水性.
当溶液的pH值为8.0时,SMT-占据了溶液中SMT的79.17%,针铁矿的等电点为8.5.因此,此时静电吸引力成为了吸附的主导因素.当溶液的pH在3.0~8.0之间时,分子态的SMT成为了SMT在溶液中的主导形式,此时吸附随着分子态SMT所占比例的增加而增加,这也在一定情况下强调了分子态SMT在吸附中的重要性. 因此,分子态的SMT在吸附中的贡献明显大于离子态的SMT的贡献,这也与前面计算得到的吸附系数相吻合.而且质子化的SMT在水中的溶解度更大,其亲水能力更强.而针铁矿表面提供的疏水性的吸附位点可以更好地与疏水性较强的SMT分子进行结合.当水溶液的pH小于3.0时,带正电荷的离子态的SMT在溶液中占据主导位置,此时针铁矿表面也带正电荷,因此,此时静电斥力存在从而使吸附明显减弱. 相同的现象也在高pH的体系中存在(Yang et al.,2011). 相比于pH值大于9.0的溶液体系,pH小于3.0时吸附能力更强,原因可能是在低pH环境条件下SMT分子上有一个—NH+3基团,这个基团可以通过氢键作用力与针铁矿进行结合(图 4).类似的现象在生物碳吸附SMT的实验中得到了验证((Teixidó et al.,2011),.
 |
| 图 4 针铁矿吸附磺胺二甲基嘧啶随着pH值的增加作用力的变化 Fig. 4 Proposed evolution of SMT speciation on goethite and bottom structure shows electrostatic repulsion between the negative charges |
由于磺胺二甲基嘧啶是可以质子化的污染物,因此,溶液中的离子强度会对其在针铁矿上的吸附产生一定的影响(图 5).在pH等于2.1时,SMT+和SMT0分别占据了总SMT的65.58%和34.42%. 此时磺胺二甲基嘧啶在针铁矿上的吸附随着离子强度的增加开始有所增加,然后保持不变,因此,离子交换可能是针铁矿在酸性条件下吸附磺胺二甲基嘧啶的机理.当溶液的pH值为10时,SMT-和SMT0分别占据了溶液中总SMT的99.74%和0.26%,离子强度对针铁矿吸附磺胺二甲基嘧啶没有明显的影响,此时针铁矿对磺胺二甲基嘧啶的吸附不可能是离子交换(Richter et al.,2009).在pH值为6.2时,SMT0占了溶液中总SMT的96.32%,吸附随着离子强度的增加而有所减小,此时单价的K+对吸附有一定的影响,可能是因为针铁矿在此时通过外部络合的作用吸附磺胺二甲基嘧啶,这个结果与Th(IV)在凹凸棒上的吸附是通过内部和外部络合机制类似(Wu et al.,2007).
 |
| 图 5 离子强度对针铁矿吸附磺胺二甲基嘧啶的影响 Fig. 5 Effects of ionic strength on SMT sorption on goethite |
根据前面的推测,为了进一步证明针铁矿对磺胺二甲基嘧啶的吸附机制,对针铁矿吸附磺胺二甲基嘧啶前后做了红外光谱分析(图 6).从图 6可以明显看出,针铁矿吸附SMT前后其表面也发生了明显的官能团变化,在1021、1130、1374和1620 cm-1处都有明显的官能团改变的振动.因此,针铁矿吸附SMT是通过一定的化学作用来进行的.并且在1620 cm-1和1130 cm-1这两个地方对应的是氨基的伸缩振动,在1021 cm-1处对应的是羟基的伸缩振动,在1374 cm-1处对应的是芳香环的伸缩振动(Brigante et al.,2010; Villalobos et al.,2001). 因此,通过红外光谱的分析得知,针铁矿对SMT的吸附主要是氨基、羟基和芳香基团与针铁矿表面的活性基团通过表面络合作用结合的(Zhao et al.,2012).
 |
| 图 6 针铁矿吸附SMT前后的红外光谱图(a.针铁矿;b.吸附磺胺二甲基嘧啶后的针铁矿;c.磺胺二甲基嘧啶) Fig. 6 FTIR spectra of goethite(a),SMT sorbed on goethite(b)and SMT(c) |
1) 磺胺二甲基嘧啶在针铁矿上的吸附具有明显的非线性,吸附解吸存在明显的滞后现象.
2) pH值对针铁矿吸附磺胺二甲基嘧啶的影响较大,离子强度对吸附的影响与反应体系的pH值有关.磺胺二甲基嘧啶在针铁矿上的吸附主要受静电作用、范德华力、氢键作用、表面络合作用共同主导.
3) 在考察抗生素生态环境风险时,应考虑环境中普遍存在的铁氧化物的影响,对于富含铁氧化物的土壤,抗生素的迁移特性减弱.
| [1] | Brigante M, Zanini G, Avena M. 2010.Effect of humic acids on the adsorption of paraquat by goethite[J]. Journal of Hazardous Materials, 184 (1/3): 241–247. |
| [2] | Davidson L E, Shaw S, Benning L G. 2008.The kinetics and mechanisms of schwertmannite transformation to goethite and hematite under alkaline conditions[J]. American Mineralogist, 93 (8/9): 1326–1337. |
| [3] | Gschwend P M, Schwarzenbach R P. 1992.Physical chemistry of organic compounds in the marine environment[J]. Marine Chemistry, 39 (1/3): 187–207. |
| [4] | Guo X, Yang C, Dang Z, et al. 2013.Sorption thermodynamics and kinetics properties of tylosin and sulfamethazine on goethite[J]. Chemical Engineering Journal, 223 : 59–67. |
| [5] | Guo X T, Yang C, Wu Y N, et al. 2014.The influences of pH and ionic strength on the sorption of tylosin on goethite[J]. Environmental Science and Pollution Research, 21 (4): 2572–2580. |
| [6] | 郭学涛, 杨琛, 曾晓明, 等.2014.环境因素对针铁矿光解泰乐菌素的影响[J].中国环境科学, 34 (2):364–370. |
| [7] | Guo X T, Ge J H, Yang C, et al. 2015.Sorption behavior of tylosin and sulfamethazine on humic acid: kinetic and thermodynamic studies[J]. RSC Advances, 5 : 58865–58872. |
| [8] | Langhammer J P.1989.Untersuchungen zum Verbleib antimikrobiell wirksamer Arzeistoffe als Rückstände in Gülle und im landwirtschaftlichen Umfeld[D].Bonn,Germany: Universität Bonn |
| [9] | Li J R, Wang Y X, Wang X, et al. 2015.Intercalation and adsorption of ciprofloxacin by layered chalcogenides and kinetics study[J]. Journal of Colloid and Interface Science, 453 : 69–78. |
| [10] | Mutavdžić Pavlović D, Ćurković L, Blažek D, et al. 2014.The sorption of sulfamethazine on soil samples: Isotherms and error analysis[J]. Science of the Total Environment, 497-498 : 543–552. |
| [11] | Richter M K, Sander M, Krauss M, et al. 2009.Cation Binding of antimicrobial sulfathiazole to leonardite humic acid[J]. Environmental Science &Technology, 43 (17): 6632–6638. |
| [12] | Teixidó M, Pignatello J J, Beltrán J L, et al. 2011.Speciation of the ionizable antibiotic sulfamethazine on black carbon (Biochar)[J]. Environmental Science &Technology, 45 (23): 10020–10027. |
| [13] | Thiele-Bruhn S, Seibicke T, Schulten H R, et al. 2004.Sorption of sulfonamide pharmaceutical antibiotics on whole soils and particle-size fractions[J]. Journal of Environmental Quality, 33 (4): 1331–1342. |
| [14] | Villalobos M, Leckie J O. 2001.Surface complexation modeling and FTIR study of carbonate adsorption to goethite[J]. Journal of Colloid and Interface Science, 235 (1): 15–32. |
| [15] | Wu Q F, Li Z H, Hong H L, et al. 2013.Desorption of ciprofloxacin from clay mineral surfaces[J]. Water Research, 47 (1): 259–268. |
| [16] | Wu W S, Fan Q H, Xu J Z, et al. 2007.Sorption-desorption of Th(IV) on attapulgite: effects of pH,ionic strength and temperature[J]. Applied Radiation and Isotopes, 65 (10): 1108–1114. |
| [17] | Yang W B, Zheng F F, Lu Y P, et al. 2011.Adsorption interaction of tetracyclines with porous synthetic resins[J]. Industrial &Engineering Chemistry Research, 50 (24): 13892–13898. |
| [18] | Zhao Y P, Gu X Y, Gao S X, et al. 2012.Adsorption of tetracycline (TC) onto montmorillonite: Cations and humic acid effects[J]. Geoderma, 183-184 : 12–18. |
| [19] | Zhao Y P, Tong F, Gu X Y, et al. 2014.Insights into tetracycline adsorption onto goethite: Experiments and modeling[J]. Science of the Total Environment, 470-471 : 19–25. |
| [20] | Zhou D D, Chen B F, Wu M, et al. 2014.Ofloxacin sorption in soils after long-term tillage: The contribution of organic and mineral compositions[J]. Science of the Total Environment, 497-498 : 665–670. |
 2016, Vol. 36
2016, Vol. 36


