2. 中国市政工程东北设计研究总院有限公司, 长春 130021
2. China Northeast Municipal Engineering Design & Research Institute Co. Ltd, Changchun 130021
酸性矿山废水(acid mine drainage,AMD)是硫化矿物长期暴露于地表,与水、大气及微生物相互作用,发生氧化性溶解而形成的(冯颖等,2004).酸性矿山废水pH极低,通常在3以下(Bank et al.,1997),同时含有高浓度的Fe、Al、Cu等金属离子,危害十分严重.以黄铁矿(FeS2)为主的硫化矿物氧化过程中,Fe3+是最主要的氧化剂,其反应方程式为:FeS2+14Fe3++8H2O→15Fe2++2SO44+16H+,Fe3+的浓度是这个反应的限制因素(Johnson et al.,2003).在自然界,氧气充足时Fe2+可迅速被氧化成Fe3+,但此过程在低pH的条件下反应极为缓慢.然而嗜酸菌可以通过氧化Fe2+获取能量用于自身的生长、繁殖,从而加速了Fe2+向Fe3+的转化过程,由此黄铁矿的氧化速率显著提高,极大促进酸性矿山废水的形成(华凤林,1993).因此,要理解酸性矿山废水的形成机制及演变过程,控制酸性矿山废水的产生,就需要我们真正认识酸性矿山废水区域的嗜酸菌群落组成和变化规律.
传统的微生物学方法建立在平板分离的基础之上,但由于大多数嗜酸菌生理生化性质和生存环境特殊,所以很难在人工配制的培养基上得到纯种分离(Hackett et al.,1997).20世纪90年代以来,分子克隆文库、PCR-DGGE和T-RFLP等分子生态学技术的确立和发展,为我们全面客观地研究微生物生态系统提供了新的技术手段.各国学者利用分子生态学技术对世界各地酸性环境中的嗜酸菌多样性进行了系统的研究,使人们对嗜酸菌的认识进入了一个新的时代.美国加州的Iron Mountain矿区、西班牙的Rio Tinto矿区、德国东部Lusatia的褐煤矿区已经成为嗜酸菌研究的典型样本,十几年来已经有大量的研究成果产生(Mendez-Garcia et al.,2015).通过这些研究人们发现,一些新的嗜酸菌类群如Leptospirillum spp.和Ferroplasma spp.在酸性矿山废水的形成过程中发挥着主导作用,而并非人们以前认为的氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans).同时人们认识到,自然界的嗜酸菌多样性远比人们过去想象的复杂(Schrenk et al.,1998; Edwards et al.,2000; Amaral-Zettler et al.,2002).
安徽某铁矿排土场的酸性矿山废水库是一个典型的污染场地.排土场是该铁矿主要的固体废物堆放地,每年都会有大量的废土和废矿石堆放于此.这些长期露天堆放的含硫固体废物在自然条件下发生氧化分解,逐渐变为含有硫酸的酸性废水,汇集到排土场中央并于20世纪70年代形成一个封闭的酸水废水库.该废水库东西宽约300 m,南北长约700 m,库容量约300万m3,pH长年在3.0以下.值得注意的是,酸水库周边的固体废物经过长期的风化,已有较好的植被覆盖,乔木、灌木和草本植物均有分布.
过去人们关注的酸性矿山废水多产生于尾矿、矿山内的巷道、煤矿或者铁矿的采坑(Chen et al.,2013; Druschel et al.,2004; Siebert et al.,2009; Gadanho et al.,2006).这些酸性矿山废水一般酸性很强,营养物质尤其是磷缺乏.而本研究的酸性矿山废水库,由于周边植被覆盖较好,每年都会输入数量可观的营养物质.其次,该矿山的铁矿石伴生磷,所以废矿石在发生氧化淋溶的过程中,会有大量的磷进入酸水库.因此,与大多数酸性矿山废水不同,本研究的酸水库营养物质并不缺乏.在酸性条件下,同时具有较高的营养水平,这样环境条件下栖息的微生物群落应较为特殊.
为研究该酸性矿山废水库中嗜酸微生物的群落组成和变化规律,分别于2012年夏秋两季对该区域废水进行了定点采样,并用分子生物学技术系统分析了该区域微生物群落结构随时间和空间的变化.研究结果有利于加深人们对酸性环境中微生物群落的认识,以期为探讨酸性矿山废水的形成、演变机理,以及酸性矿山废水的原位治理和修复提供理论基础.
2 材料和方法(Materials and methods) 2.1 样品采集和分析分别于2012年8月(夏)和9月(秋)对酸性水库周围4个不同水平位点的表层水样进行了采集.采样点距离库边约0.5 m.水样温度、pH、溶解氧(DO)和氧化还原电位(ORP)等化学参数现场通过哈纳水质测定仪(HANNA,意大利)进行了原位测定.水样采集后储存于4 ℃保温箱中,尽快返回实验室进行操作.
2.2 基因组DNA的提取取500 mL采集的水样于0.22 μm细菌滤膜上进行真空抽滤,并将滤膜浸泡于5 mL 0.02 mol·L-1的H2SO4中,超声震荡10 min,使膜上细胞完全进入溶液中.10000 r·min-1离心3 min收集菌体.然后用基因组DNA提取试剂盒分别提取样品中的基因组DNA(参照MP bio试剂盒生产商建议的步骤).随后将提取的DNA放置于-80 ℃超低温冰箱保存.
2.3 16S rRNA/18S rRNA基因片段的扩增利用细菌通用引物27F(5′-AGA GTT TGA TCM TGG CTC AG-3′)和1492R(5′-TAC GGY TAC CTT GTT ACG ACT T-3′),以样品基因组DNA为模板,扩增样品中细菌的目的基因片段.PCR反应条件设置为预变性95 ℃ 5 min,变性94 ℃ 30 s,退火52 ℃ 30 s,延伸72 ℃ 2 min,35个循环后,72 ℃延伸7 min.反应产物用1%琼脂糖凝胶电泳检测.
利用真核微生物通用引物EK82F(5′-GAA DCT GYG AAY GGC TC -3′)和EK1520R(5′-CYG CAG GTT CAC CTA C -3′)扩增样品中真核微生物的目的基因片段.PCR反应条件设置为预变性95 ℃ 5 min,变性94 ℃ 30 s,退火50 ℃ 30 s,延伸72 ℃ 2 min,35个循环后,72 ℃延伸5 min.反应产物用1%琼脂糖凝胶电泳检测.
利用古菌通用引物ARC21F(5′-TTC YGG TTG ATC CYG CCR GA-3′)和ARC958R(5′-YCC GGC GTT GAM TCC AWT T-3′)对目的基因进行扩增.PCR反应条件为: 预变性95 ℃ 5 min,变性94 ℃ 40 s,退火48 ℃ 40 s,延伸72 ℃ 90 s,35个循环后,72 ℃延伸 2 min.反应产物用1%琼脂糖凝胶电泳检测.
2.4 克隆文库的构建古菌经反复扩增,未得到相应产物.因此只构建了细菌和真核微生物文库.文库构建流程如下:PCR产物连接到北京全式金公司的pEASY-T1载体上,将连接好的环状质粒转化到大肠杆菌感受态细胞内,随后将其涂布在含有Amp/X-Gal/IPTG的LB平板上,37 ℃静置培养15 h.以少许菌体为模板,利用载体特异性引物对M13M4(5′-GTT TTC CCA GTC ACG AC-3′)和M13RV(5′-CAG GAA ACA GCT ATG AC-3′)进行PCR扩增,验证插入片段的大小,筛选出阳性克隆.对于细菌的阳性克隆采用Hha I和HaP II两种限制性内切酶进行双酶切分型,排除叶绿体基因片段,随后编号送往测序.对于真核微生物阳性克隆采用Hha I限制性内切酶进行酶切分析,确定ARDRA类型数目,然后将典型代表克隆送交测序.
2.5 系统发育分析获得测序序列后,首先用Bellerophon程序检测是否存在嵌合体(Huber et al.,2004).待剔除嵌合体后,用BioEdit软件进行比对分析,建立矩阵文件.然后利用Dotur软件进行分型,获得代表性操作分类单元(Operational Taxonomic Unit,OTU)序列,建立饱和曲线.将所得序列输入NCBI网站,用Blast程序与GenBank中已有序列进行比对,选取具有高相似性的序列作为参考.将所得序列用BioEdit软件进行比对,用MEGA6.0软件绘制系统发育树.
2.6 序列登录号本研究所得序列均已提交GenBank中,序列登录号为JF817223,KT327181-KT327197.
3 结果和分析(Results and analysis) 3.1 样品的物化参数2 012年夏季和秋季所采集的酸性矿山废水物化参数如表 1所示.可以看出,两次采样所得的8个样品pH较为接近,均在2.80左右,表明整个废水库水质呈现较强的酸性.同时,该废水库中含有大量的金属离子.在夏季样品中,金属Al3+的含量最高,达1108~1138 mg· L-1;Mn2+的含量其次,达435 ~459 mg· L-1;Fetot的含量为78.1~82.4 mg·L-1,而Fe2+的浓度相对较低(0.47~0.95 mg· L-1),说明水体中大部分Fe2+已被嗜酸菌氧化为Fe3+.水体中的阴离子主要为SO44,其含量在20000 mg· L-1以上,远远超过我国地表水质量标准的250 mg· L-1(中华人民共和国环境保护部,2002).如此高浓度的阴阳离子,即使废水库中的废水不外溢,仅仅通过下渗以及地下水循环也会对周边农田以及居民饮用水造成严重的影响.两次采样期间正值当地雨季,秋季水库水位相对夏季有很大升高,雨水的注入很大程度上稀释了废水库中各离子浓度,秋季样品中金属离子和阴离子的含量普遍下降,其中Al3+降至850 mg· L-1左右,Mn2+降至400 mg· L-1左右,Fetot降至60 mg· L-1以下.SO44降至16000 mg· L-1左右.在秋季,由于1、2点周边堆积大量新的废矿石,导致样品中Fetot的含量分布不均匀,1、2号点较之3、4号点含量偏高.
| 表 1 2012年夏季(8月)和秋季(9月)酸性矿山废水的物化参数 Table 1 Geochemical characteristics of the acid mine drainage samples in summer(August)and autumn(September)of 2012 |
与大多数酸性矿山废水的寡营养环境相比,本研究酸性矿山废水的氮磷含量较高,NH44-N的含量为5.6~9.6 mg· L-1,TP为1.24~2.30 mg· L-1,均超过我国地表水五类水标准(NH44-N≤2.0 mg· L-1和TP≤0.2 mg· L-1).这些营养物质可能主要来自岸边废矿石和植物的根系土壤.由于水体中丰富的氮磷资源,酸性水库中光合藻类生长旺盛,在夏季,样品中叶绿素a的含量高达63.8~94.2 μg· L-1,使水体呈现墨绿色,这甚至比许多淡水湖泊发生水华时叶绿素a的含量还高.
3.2 细菌群落研究2012年夏季样品的细菌文库经过剔除嵌合体以及叶绿体16S rRNA基因后,AMD-1、AMD-2、AMD-3、AMD-4 4个样品分别得到41、35、31、38个有效序列.同样,秋季AMD-1、AMD-2、AMD-3、AMD-4 4个样品分别得到28、23、23、26个有效序列.利用Dotur软件对夏秋两季的细菌序列分别进行分型并绘制饱和度曲线(图 1).从图中可以看出,各文库均趋于饱和,因此本文所研究序列已能体现样品中主要的细菌群落组成.
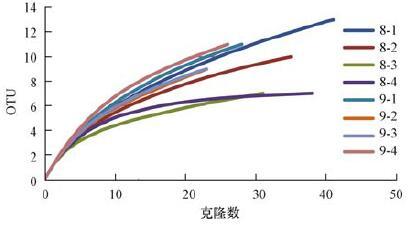 |
| 图 1 2012年夏季(8月)和秋季(9月)样品细菌类群饱和度曲线 Fig. 1 Saturation curve of bacteria in summer(August)and autumn(September)samples of 2012 |
将上述8个文库的基因序列经过处理后,输入RDP网站,利用Classifier进行分型,确定样品中各类群细菌所占比例.结果表明,夏秋两季的细菌群落所含类群一致,分别为Actinobacteria、Acidobacteria、Alphaproteobacteria、 Betaproteobacteria、Gammaproteo- bacteria、Firmicutes和Unclassified bacteria 7大类群.无论在夏季还是秋季群落中,Alphaproteobacteria在各个位点(除夏季AMD-1外)始终占据优势地位.该类群在各位点群落中所占比例:夏季为17.1%~37.1%,秋季为30.4%~46.4%.值得注意的是,Unclassified bacteria在夏季各位点具有较高比例(31.4%~45.2%),而在秋季其比例大幅降低.各类群在各采样点的具体分布见图 2.
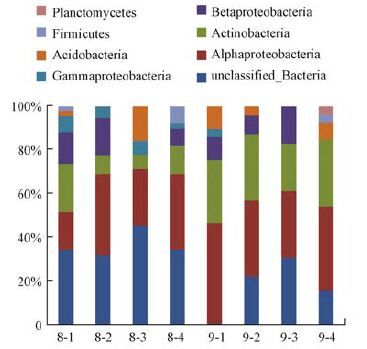 |
| 图 2 2012年夏季(8月)和秋季(9月)样品中各细菌类群比例 Fig. 2 Proportion of bacteria phyla in summer(August)and autumn(September)samples of 2012 |
通过Dour分型,结果表明夏季样品中共有17种OTU,秋季样品中共有22种OTU,有7种OTU在夏季和秋季样品中均检测到,将所得每种OTU的代表序列输入GenBank进行比对,获得与之最为相近的基因序列,主要比对结果见表 2.通过比对发现,与本研究所得序列亲缘关系较近的克隆和已培养种绝大多数来自于酸性环境,例如酸性矿山废水、酸性沉积物以及污染的土壤.为了进一步了解样品中各细菌OTU的系统发育关系,从GenBank数据库中下载与各OTU基因序列同源性较高的已知菌种序列作为参考,用MEGA6.0软件构建系统发育树(图 3).本研究中所获得的序列在系统发育树中均做加粗处理.
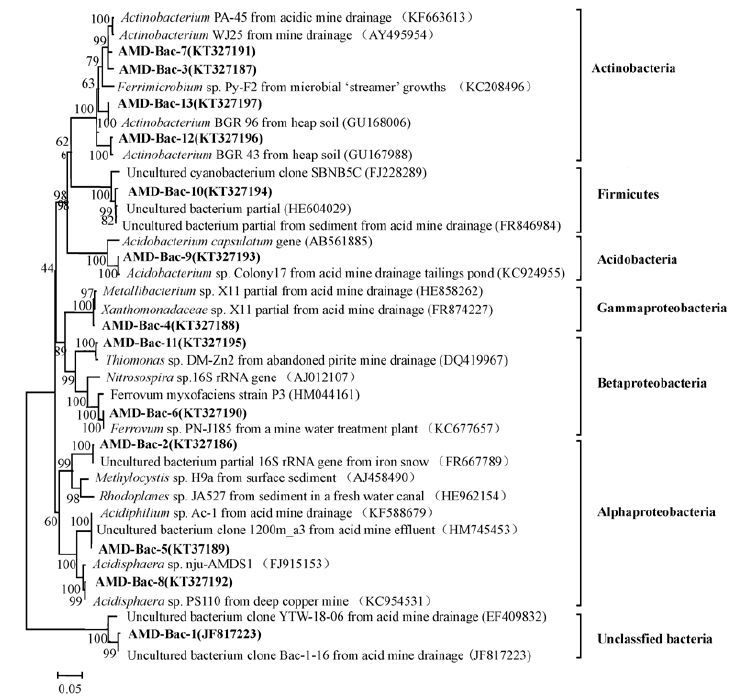 |
| 图 3 2012年夏秋两季酸性矿山废水中细菌类群的系统发育树 Fig. 3 Phylogenetic tree for the bacteria in summer and autumn samples of 2012 The number in parentheses is accession number in GenBank,the node number represents the confidence level of relatives,and the length of branches represents the evolutionary distance and the coefficient is 0.05 |
| 表 2 2012年夏季(8月)和秋季(9月)样品主要16S rRNA基因序列比对结果 Table 2 Comparison of the main 16S rRNA gene sequence in summer(August)and autumn(September)samples of 2012 |
下面分别描述各类群代表OTU系统发育关系,以及空间时间上的分布变化:
(1) Alphaproteobacteria类群分析
Alphaproteobacteria在夏秋两季样品中所占比例分别为17.1%~37.1%和30.4%~46.4%.共检测到3种OTU属于该类群,分别为AMD-Bac-2、AMD-Bac-5、AMD-Bac-8.AMD-Bac-5在两次采样的8个样品中均有检出,所占比例均在20%左右,分布相对比较稳定.它在系统发育树上与Acidiphilium属聚在一个分枝.Acidiphilium属为革兰氏阴性杆菌,最适pH值在3.0左右,以氧为最终电子受体进行呼吸代谢,吸收简单有机物进行生长.该属的一些菌株还可以在好氧或厌氧条件下以三价铁为电子受体氧化多种有机物,并在缺氧条件下以氧气和三价铁进行共呼吸(Küsel et al.,2002;Hiraishi et al.,2005).AMD-Bac-2在夏季4个样品中分布比例为5%左右,在秋季4个样品中所占比例在3%左右.该OTU与Methylocystis属有较近的亲缘关系.该属典型菌种Methylocystis heveri分离自德国泥炭沼和泰国的森林土壤,嗜酸,pH生长范围4.4~7.5,最适pH为5.8~6.2,可利用甲烷和甲醇生长(Dedysh et al.,2007).AMD-Bac-8在夏季样品中所占比例较低,为3.2%~5.7%.但在秋季其在4个样品中所占比例相对较高,在10%左右.该OTU序列与Acidisphaera sp. PS110和Acidisphaera sp. nju-AMDS1有较近的亲缘关系,其中Acidisphaera sp. nju-AMDS1是1株分离于安徽铜陵鸡冠山铜矿酸性废水的化能异养嗜酸菌.
(2) Actinobacteria类群分析
Actinobacteria在秋季所占比例为21.7%~30.8%,明显高于其在夏季样品中所占比例6.5%~22.0%.AMD-Bac-3、AMD-Bac-7、AMD-Bac-12、AMD-Bac-13为该门类细菌,其中AMD-Bac-3仅在夏季样品中有分布,在各样品中所占比例在2.9%~7.9%之间.AMD-Bac-12、AMD-Bac-13仅在秋季样品中有分布,其中AMD-Bac-12在样品AMD-1、AMD-2、AMD-4中所占比例在 4.3%~7.1%之间;AMD-Bac-13在AMD-1、AMD-2、AMD-4 3个样品中所占比例相对较高,在17%左右.AMD-Bac-7在夏季和秋季样品中均有分布,所占比例在7%左右.通过系统发育树发现,这4种OTU与Ferrimicrobium属有较近的亲缘关系,该属为革兰氏阴性菌,呈杆状,嗜酸,嗜温,不能形成孢子,专性异养,可以在好氧条件下氧化铁,在厌氧环境下还原铁(Bridge et al.,1990).
(3) Gammaproteobacteria类群分析
该类群细菌在夏季样品中分布相对广泛,所占比例为2.6%~7.3%,而在秋季样品中仅检测出一个该类群的克隆.该类群代表OTU为AMD-Bac-4,在夏季4个样品中所占比例分别为7.3%、5.7%、6.5%、2.6%.通过系统发育树分析发现,该OTU和Metallibacterium sp. X11亲缘关系较近.Metallibacterium 属为革兰氏阴性菌,不产生孢子,棒状兼性厌氧,为化能异养型,分离自酸性环境,可在很宽的pH范围内生长.研究发现它本身可以生成铵,作用于细胞周围的介质从而将pH调向其最佳生长pH(Zieqler et al.,2013).
(4) Betaproteobacteria类群分析
该类群除在夏季AMD-3和秋季AMD-4样品中未能检出外,在其他位点均有检出,所占比在10%左右,OTU为AMD-Bac-6、AMD-Bac-11.AMD-Bac-6在夏季样品中的比例为7.9%~17.1%,在秋季为3.6%~8.7%,所占比例显著降低.通过系统发育树可看出AMD-Bac-6与Ferrovum myxofaciens亲缘关系较近. 该菌属嗜酸耐冷,为专性自养菌,以氧作为电子受体氧化Fe2+获取能量供自身生长繁殖.此外其耐酸性比嗜酸菌Leptospirllum ferrooxdians和Acidithiobacillus ferrooxidans差(Rowe et al.,2008).该细菌在本研究的酸性矿山废水生态系统中,是最主要的铁氧化菌.AMD-Bac-11仅在秋季AMD-1和AMD-3中有分布,且所占比例较低分别为7.1%、4.3%,在系统发育树上与Thiomonas属细菌聚为一簇.该属最初是由Moreira等在1997年从Thiobacillus属中单独划分出的一个新属,最适生长pH在3~6之间,兼性化能自养,可氧化还原态硫和有机物,不能氧化Fe2+(Moreira et al.,1997).该属的中温菌最适生长温度为30~36 ℃,中度嗜热菌最适生长温度为50 ℃.
(5) Acidobacteria类群分析
该类群在夏季和秋季样品中所占比例相对较低,OTU为AMD-Bac-9,检测自夏季AMD-1、AMD-3样品和秋季AMD-1、AMD-2样品,在夏季AMD-3中所占比例较高,为16.1%,在系统发育树上与Acidobacterium capsulatum聚为一簇.Acidobacterium capsulatum为好氧化能异养嗜酸菌,pH生长范围3.0~6.0,能以葡萄糖、纤维二糖、淀粉等多种糖类作为唯一碳源生长,但不能以元素硫和二价铁作为能源(Kishimoto et al.,1991).
(6) Firmicutes类群分析
属于该类群的OTU为AMD-Bac-10,分布在夏季的AMD-1和AMD-4样品中,所占比例分别为2.4%、7.9%.与其相近的基因序列大多为未培养细菌,无法确定其具体菌种,但其相似序列在极端酸性环境中常有检出.该类群有些菌种可以产生内生孢子,抵抗脱水和极端环境.在秋季所有样品中未能检测出该类型OTU,但发现一个基因序列与之类似的克隆.该克隆与Alicyclobacillus属具有较近的亲缘关系,相似性为94%.该属微生物属于专性异养的嗜酸菌,能够氧化Fe2+,是酸性矿山废水中十分常见的一种微生物(Johnson et al.,2008).
(7) Unclassified bacteria类群分析
该类群在夏秋两季样品中分布广泛,仅检测到1种OTU(AMD-Bac-1),AMD-Bac-1在夏季样品中是最丰富的序列类型,所占比例为31.4%~45.2%,然而在秋季,该OTU在AMD-1中未能检出,在其他三个样品中所占比例显著下降(15.4%~30.4%).该OTU序列不属于任何一个目前已知的细菌类群,它在数据库中最为相似的序列为本课题组2011年在该酸性矿山废水库检测到的一条序列,第二相似的序列检测自江西德兴一铜矿的酸性矿山废水,其生理生化性质还不得而知.
3.3 真核微生物群落研究夏季样品共测序得到201条序列,分为3个OTU;秋季样品共得到186条序列,也分为3个OTU,各个采样点的测序覆盖率皆达97%以上,表明所得序列已能充分体现各采样点真核微生物群落的主要组成.
将夏秋两季所得OTU经过处理后,输入NCBI网站,与GenBank的序列进行比对,并获得与之最为相近的基因序列,主要比对结果见表 3.
| 表 3 2012年夏季(8月)和秋季(9月)样品18S rRNA基因序列比对结果 Table 3 Comparison of the 18S rRNA gene sequence in summer(August)and autumn(September)samples of 2012 |
夏秋两季样品真核微生物类群具体分布情况见图 4.2012年夏季样品中所含真核微生物共分属为2个类群Chlorophyta和Ciliophora.秋季样品中所含真核微生物也分属为2个类群,与夏季不同的是秋季样品中未检测到Ciliophora,而检测出大量Chrysophyta.
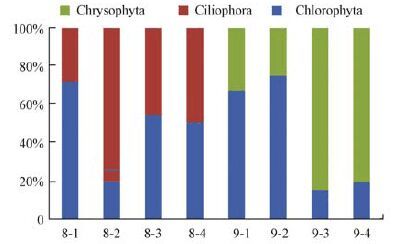 |
| 图 4 2012年夏季(8月)和秋季(9月)样品中真核微生物类群分布 Fig. 4 Proportion of eukaryotic organisms phyla in summer(August)and autumn(September)samples of 2012 |
为了进一步了解样品中各真核微生物OTU的系统发育关系,从GenBank数据库中下载与各OTU基因序列同源性较高的已知真核微生物序列作为参考,用MEGA6.0软件构建真核微生物的系统发育树(图 5).本研究中所获得序列在系统发育树中均做加粗处理.下面分别描述各类群代表OTU在系统发育树上的关系,以及空间时间上的分布变化:
 |
| 图 5 2012年夏秋两季酸性矿山废水中主要真核微生物类群的系统发育树 Fig. 5 Phylogenetic tree for the eukaryotic organisms in summer and autumn samples of 2012 The number in parentheses is accession number in GenBank,the node number represents the confidence level of relatives,and the length of branches represents the evolutionary distance and the coefficient is 0.2 |
(1) Chlorophyta类群分析
AMD-Euk-1属于Chlorophyta类群,在夏季4个样品中所占比例为25.5%~71.4%,秋季为15.1%~74.4%,在各样点中分布变化较大.通过系统发育树,发现AMD-Euk-1和Chlorella protothecoides var. acidicola亲缘关系最近,该种小球藻最初是由Pinto在研究意大利酸性土壤中的真核微生物时发现的,该属藻类在30 ℃以下、pH为1.8~2.5的生存环境中占有优势地位(Pinto,1993).Mario Gandanho等曾在pH值极低、又含有高浓度重金属离子的伊比利亚硫铁矿带也发现过与之类似物种的存在,这表明此类小球藻能够抵抗这种极端恶劣的环境,暗示着Chlorella protothecoides类物种可能广泛存在于低pH的环境中(Gadanho et al.,2006).小球藻是一种高效的光合植物,细胞内含有大量的能源物质,其在酸性矿山废水这样的寡营养环境中属于初级生产者,具有十分重要的能源意义.
(2) Chrysophyta类群分析
Chrysophyta类群在该酸性矿山废水中存在两种分型分别为AMD-Euk-4、AMD-Euk-5,通过系统发育树分析发现这两种基因型均与Ochromonas属(棕鞭藻)具有很近的亲缘关系,属于Ochromonas属.该属真核微生物仅在秋季4个样品中检出,且分布变化较大,所占比例依次为33.3%、25.6%、84.9%、81.0%.Ochromonas.sp属于混合营养型真核微生物,既可以通过光合作用,又可以通过捕食藻类和细菌的方式来获取满足自身生长繁殖所需求的能源和物质,但以捕食作为主要的生长方式(Corno,2006).Burkert等曾在研究Ochromonas sp.对铜绿微囊藻生长的影响过程中发现Ochromonas sp.生长过程会优先利用异养细菌(Burkert et al.,2001).另外Schmidtke等在酸性环境中也曾发现过此类生物的存在,其可大量吞噬异养细菌,改变水体中细菌的群落结构(Schmidtke et al.,2006).
(3) Ciliophora类群分析
AMD-Euk-2和AMD-Euk-3属于Ciliophora类群,仅在夏季样品中检出.Ciliophora是一种种类非常丰富的异养原生生物,主要捕食细菌和其他一些原生生物,在水域微食物网生态系统中起着很重要的作用(Zingel et al.,2006).其中AMD-Euk-2在AMD-2样品中所占比例最高为72.3%,在AMD-1、AMD-3、AMD-4中比例相对较低,分别为24.5%、44.2%、48.1%,该基因型与Oxytricha sp.(尖毛虫)基因序列相似度最高.AMD-Euk-3含量较低,仅在AMD-3和AMD-4两个样点检出,所占比例分别为7.8%和2.0%,与之最为相似的序列为Sterkiella sp. FG-2015a.
4 讨论(Discussion)在酸性矿山废水生态系统中,人们所熟知的嗜酸微生物,通常为与酸性矿山废水形成有关的化能自养铁硫氧化菌,例如Leptospirillum、Ferroplasma和Acidithiobacillus等.这些化能自养菌在酸性矿山废水中通常占据优势地位(Bond et al.,2000; Druschel et al.,2004).然而在本研究中并没有发现这些十分常见的嗜酸菌.化能自养菌只检测到2个属:Thiomonas和Ferrovum,而且在文库中所占的比例相对较低.在该生态系统中Acidiphilium等异养嗜酸菌占据着主导地位,这可能主要由于该酸性矿山废水已处于酸水形成末期阶段,水体中Fe2+的含量很低,已经不足以维持化能自养嗜酸菌的大量生长.其次,该酸性水库周边有大量植被覆盖,南方天气潮湿多雨,会产生大量的腐殖酸等有机物,并随雨水汇入酸性水库.这些大分子有机物降解后形成的小分子物质(如甲酸、乙酸和丙酮酸等)能够促进异养嗜酸菌的大量生长(Kamjunke et al.,2005).
对比夏秋两季细菌群落,发现Acidiphiliuum属嗜酸菌在群落中一直处于优势地位.Acidiphiliuum属嗜酸菌属于化能异养细菌,在好氧条件下以氧作为最终电子受体氧化简单的有机物,在厌氧条件下以Fe3+为电子受体氧化有机物,在缺氧条件下能够以氧气和Fe3+进行共呼吸(Küsel et al.,2002;Hiraishi et al.,2005).另外该嗜酸菌对重金属具有很强的抗性,它通过在细胞中富集和沉淀金属以除去过量金属所产生的毒性,因而能够在高浓度的铜、铝、锌环境中很好的生长(Matsuzawa et al.,2000).然而这并不是其可以在酸性矿山废水中得以大量生存的全部原因.Acidiphiliuum属嗜酸菌还具备另一个令人瞩目的特征,它可产生以Zn-BChl a为主要成分的光合色素进行光合作用(Hiraishi et al.,1998).在酸性矿山废水这种资源有限的环境中,这种生存策略能够扩大其生存空间.
另外通过分析发现Ferrovum myxofaciens在夏秋两季各样品细菌群落中所占比例与其Fe2+的浓度变化趋势一致,随Fe2+浓度的升高而升高,随Fe2+浓度的降低而降低.该菌属专性自养(Rowe et al.,2008),是该酸性水库中最主要的铁氧化菌.由此可见,在该酸性水库中Fe2+的浓度是影响该菌属分布的主要因素.
相对于丰富的细菌群落,该废水库真核微生物群落的多样性较低,且随时间不同群落结构发生了巨大变化.Oxytricha sp.在秋季样品群落中不复存在,被Ochromonas sp.所取代.Oxytricha sp.和Ochromonas sp.都可以通过捕食细菌的方式来获取营养以满足自身的生长繁殖需求,在该生态系统中起着相似作用(Corno,2006; Zingel et al.,2006).在秋季样品中Ochromonas sp.之所以能够取代Oxytricha sp.主要是由于温度变化所致.纤毛类原生动物最适生长温度在25~35 ℃之间,当温度低于25 ℃时,很难生长,与之相反Ochromonas sp.的生长温度较低,在秋冬季节生长比较旺盛(赖英,2009).在当地9月份已进入秋季,温度开始下降,采样时温度在26 ℃左右,此时Oxytricha sp.的活性已然下降,Ochromonas sp.正进入生长旺盛的时期,Oxytricha sp.不再具有竞争优势,因而被逐渐替代.
Chlorella protothecoides var. acidicola在两次采样中均有大量检出,这与该酸性水库中含有较高浓度的氮磷有关.该种光合自养藻类在该酸性矿山废水生态系统中承担着最为主要的初级生产者.在该酸性水库中,通过叶绿素a的含量可以得知,Chlorella protothecoides var. acidicola的丰度在夏季远高于秋季.主要是由于夏季温度较高,光照充足,该藻类光合作用强烈,代谢旺盛,更加利于其生长增殖.Chlorella protothecoides var. acidicola在夏季4个样品中分布相对均匀,而在秋季4个样品中分布变化较大,在秋季AMD-1和AMD-2两个样品群落中所占比例在70%左右,然而在AMD-3和AMD-4仅占17%左右.综合数据分析发现,这可能与Ochromonas sp.捕食特性有关,由于其特殊的生长方式,它与Chlorella protothecoides var. acidicola之间既是竞争关系又是捕食关系,Ochromonas sp.在AMD-3和AMD-4中大量分布必然导致Chlorella protothecoides var. acidicola所占比例骤减.
5 结论(Conclusions)该酸性矿山废水与许多典型的酸性矿山废水不同,其处于酸水形成末期,水体中含有大量的氮磷等营养物质.在该生态系统中,细菌的多样性远高于真核微生物多样性.在细菌群落中,Acidiphilium spp.等化能异养菌占据着主导地位,化能自养菌所占比例较低,随着时间和空间的变化细菌的群落结构相对稳定.真核微生物群落主要由小球藻、棕鞭藻和尖毛虫构成,随着时间的变化,群落结构发生了明显的改变,分析原因这主要是温度变化所致.
| [1] | Amaral-Zettler L A, Gómez F, Zettler E, et al. 2002.Eukaryotic diversity in Spain's River of Fire[J]. Nature, 417 (6885): 137. |
| [2] | Bank D, Younger P L, Arnesen R T, et al. 1997.Mine-water chemistry: the good and the ugly[J]. Environmental Geology, 32 : 157–174. |
| [3] | Bond P L, Druschel G K, Banfield J F. 2000.Comparison of acid mine drainage microbial communities in physically and geochemically distinct ecosystems[J]. Applied Environmental Microbiology, 66 (11): 4962–4971. |
| [4] | Bridge T A M, Johnson D B. 1990.Reduction of soluble iron and reductive dissolution of ferric iron-containing minerals by moderately thermophilic iron-oxidizing bacteria[J]. Applied and Environmental Microbiology, 64 (6): 2181–2186. |
| [5] | Burkert U, Hyenstrand P, Drakare S, et al. 2001.Effects of the mixotrophic flagellate Ochromonas sp[J]. on colony formation in Microcystis aeruginosa[J]. Aquatic Ecology, 35 (1): 11–17. |
| [6] | Chen L X, Li J T, Chen Y T, et al. 2013.Shifts in microbial community composition and function in the acidification of a lead/zinc mine tailings[J]. Environmental Microbiology, 15 (9): 2431–2444. |
| [7] | Corno G. 2006.Effects of nutrient availability and Ochromonas sp[J]. predation on size and composition of a simplified aquatic bacterial community[J]. FEMS Microbiology Ecology, 58 (3): 354–363. |
| [8] | Dedysh S N, Belova S E, Bodelier P E. 2007.Methylocystis heyeri sp[J]. nov., a novel type II methanotrophic bacterium possessing ‘signature’ fatty acids of type I methanotrophs[J]. International Journal of Systematic and Evolutionary Microbiology, 57 (3): 472–479. |
| [9] | Druschel G K, Baker B J, Gihring T M, et al. 2004.Acid mine drainage biogeochemistry at Iron Mountain, California[J]. Geochemical Transactions, 5 (2): 13–32. |
| [10] | Edwards K J, Bond P L, Gihring T M, et al. 2000.An archaeal iron-oxidizing extreme acidophile important in acid mine drainage[J]. Science, 287 (5459): 1796–1799. |
| [11] | 冯颖, 康勇, 张忠国.2004.含重金属离子酸性废水的厌氧生物处理[J].环境科学与技术, 27 (6):104–106. |
| [12] | Gadanho M, Sampaio J P. 2006.Microeukaryotic diversity in the extreme environments of the Iberian Pyrite Belt: a comparison between universal and fungi-specific primer sets, temperature gradient gel electrophoresis and cloning[J]. FEMS Microbiology Ecology, 57 (1): 139–148. |
| [13] | Hackett C A, Griffiths B S. 1997.Statistical analysis of time-course of biolog substrate utilization[J]. Journal of Microbiological Methods, 30 : 63–69. |
| [14] | Hiraishi A, Nagashima K V P. 1998.Phylogeny and photosynthetic features of Thiobacillus acidophilus and related acidophilic bacteria: its transfer to the genus Acidiphilium as Acidiphilium acidophilum comb[J]. nov[J]. International Journal of Systematic and Evolutionary Microbiology, 48 (4): 1389–1398. |
| [15] | Hiraishi A, Imhoff J F. 2005.Genus Acidiphilium[J]. In: Boone DR, Castenholz RW, Garrity GM (eds) [J]. Bergey's Manual of Systematic Bacteriology, 2 (2): 54–61. |
| [16] | 华凤林.1993.矿山酸性废水的形成机理及防治途径初探[J].河海大学学报, 21 (5):55–56. |
| [17] | Huber T, Faulkner G, Hugenholtz P. 2004.Bellerophon: A program to detect chimeric sequences in multiple sequence alignments[J]. Bioinformatics, 20 (14): 2317–2319. |
| [18] | Johnson D B, Hallberg K B. 2003.The microbiology of acidic mine waters[J]. Research in Microbiology, 154 (7): 466–473. |
| [19] | Johnson D B, Hallberg K B. 2008.Carbon, iron and sulfur metabolism in acidophilic microorganisms[J]. Advances in Microbial Physiology, 54 (1): 201–255. |
| [20] | Kamjunke N, Tittel J, Krumbeck H. 2005.High heterotrophic bacterial production in acidic, iron-rich mining lakes[J]. Microbial Ecology, 49 (3): 425–433. |
| [21] | Kishimoto N, Kosako Y, Tano T. 1991.Acidobacterium capsulatum gen[J]. nov., sp. nov.: an acidophilic chemoorganotrophic bacterium containing menaquinone from acidic mineral environment[J]. Current Microbiology, 22 (1): 1–7. |
| [22] | Küsel K, Roth U, Drake H L. 2002.Microbial reduction of Fe(III) in the presence of oxygen under low pH conditions[J]. Environmental Microbiology, 4 (7): 414–421. |
| [23] | 赖英.2009.博斯腾湖浮游植物季节变化的研究[J].水生态学杂志, 2 (5):103–106. |
| [24] | Matsuzawa Y, Kanbe T, Suzuki J, et al. 2000.Ultrastructure of the acidophilic aerobic photosynthetic bacterium Acidiphilium rubrum[J]. Current Microbiology, 40 (6): 398–401. |
| [25] | Mendez-Garcia C, Pelaez A I, Victoria M, et al. 2015.Microbial diversity and metabolic networks in acid mine drainage habitats[J]. Frontiers in Microbiology, 6 : 475. |
| [26] | Moreira D, Amils R. 1997.Phylogeny of Thiobacillus and other mixotrophic Thiobacilli: Proposal for Thiomonas gen[J]. nov[J]. International Journal of Systematic Bacteriology, 47 (2): 522–528. |
| [27] | Pinto G. 1993.Acid-tolerant and acidophilic algae from Italian environments[J]. Giornal Botanico Italiano, 127 (3): 400–406. |
| [28] | Rowe O F, Johnson D B. 2008.Comparison of ferric iron generation by different species of acidophilic bacteria immobilized in packed-bed reactors[J]. Systematic and Applied Microbiology, 31 (1): 68–77. |
| [29] | Schmidtke A, Bell E M, Weithoff G. 2006.Potential grazing impact of the mixotrophic flagellate Ochromonassp[J]. (Chrysophyceae) on bacteria in an extremely acidic lake[J]. Journal of Plankton Research, 28 (11): 991–1001. |
| [30] | Schrenk M O, Edwards K J, Goodman R M, et al. 1998.Distribution of Thiobacillus ferrooxidans and Leptospirillum ferrooxidans: implications for generation of acid mine drainage[J]. Science, 279 (5356): 1519–1522. |
| [31] | Siebert H M, Rohwerder T, Sand W, et al. 2009.Evidence for Iron- and Sulfur-Oxidizing Bacteria and Archaea in a Currently Active Lignite Mining Area of Lusatia (Eastern Germany)[J]. Advanced in Materials Research, 71 : 97–100. |
| [32] | 中华人民共和国环境保护部,国家质量监督检验检疫总局. 2002. GB3838-2002地表水环境质量标准[S]. 北京:中国环境科学出版社 |
| [33] | Zingel P, Agasild H, Noges T, et al. 2006.Ciliates are the dominant grazers on picoand nanoplankton in a shallow, naturally highly utrophic lake[J]. Microbial Ecology, 53 (1): 134–142. |
| [34] | Zieqler S, Waidner B, Itoh T, et al. 2013. Metallibacterium scheffleri gen. nov., sp. nov., an alkalinizing gammaproteobacterium isolated from an acidic biofilm[J]. International Journal of Systematic and Evolutionary Microbiology, 63(4): 1499-1504 |
 2016, Vol. 36
2016, Vol. 36


