2. 中国科学院生态环境研究中心 中国科学院饮用水科学与技术重点实验室, 北京 100085;
3. 中国科学院城市环境研究所 中国科学院城市污染物转化重点实验室, 厦门 361021
2. Key Laboratory of Drinking Water Science and Technology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085;
3. Key Laboratory of Urban Pollutant Conversion, Institute of Urban Environment, Chinese Academy of Sciences, Xiamen 361021
抗生素的生产及使用过程中,大量富含抗生素的废水被排放到环境中(Hartmann et al.,1999).环丙沙星是一种在传染性疾病治疗方面最常用的抗生素(Martins et al.,2008;Hartmann et al.,1998),在环境中不易降解(Hirsch et al.,1999),易引发人类的口腔炎症、白细胞减少症及呕吐等疾病(Kummerer et al.,2000;Cox et al.,2002).此外,水环境中环丙沙星的含量过高会导致抗药性细菌增加(Diwan et al.,2010),对水质产生不利的影响.因此,富含环丙沙星水体的排放受到严格的限制.
目前,去除废水中环丙沙星的处理方法包括膜分离法(Avella et al.,2010)、臭氧氧化法(Witte et al.,2010)、光催化降解法(Van Doorslaeret al.,2011;何占伟 et al.,2011)和吸附法(Carabineiro et al.,2012)等.其中,吸附法因设备简单、操作简便及成本低廉,被认为是去除废水中环丙沙星的一种最有前景的方法(Zhang et al.,2011).
用于水中环丙沙星去除的传统吸附剂有活性炭(Carabineiro et al.,2012)、粉煤灰(Zhang et al.,2011)、壳聚糖金属微粒(Reynaud et al.,2011)、高岭土(Li et al.,2011)、粘土矿物(Wang et al.,2011)、无定型氧化铁、活性炭负载锌(Khoder et al.,2010)、溶解性有机碳(Carmosini et al.,2009)、碳纳米管(Kumar et al.,2009)及土壤(Carrasquillo et al.,2008)等.活性炭颗粒尺寸小、难以回收及再生温度高(800~850℃),限制了其在水处理中的应用(Shim et al.,2006);粘土矿物具有较强的亲水性,但其细微颗粒在吸附污染物过程中难于分离沉降(Sune et al.,2011);膨润土最大吸附量为39.76 mg·g-1,但在碱性条件下吸附量急剧下降(路来福等,2013);碳纳米管最大吸附量不超过100 mg·g-1(陆炜品等,2012);氧化石墨烯负载藻酸钙最大吸附量仅为11.8 mg·g-1,吸附时间也长达24 h(Wu et al.,2013).这些材料都存在一些缺点,促使科研人员寻求新型的吸附材料.
氧化石墨烯是一种单原子层sp2杂化结构的新型碳纳米材料,具有很大的比表面积、优越的机械性能和特殊的物理化学特性(Li et al.,2011).作为石墨烯的一种氧化物形式,氧化石墨烯富含许多官能团,如羟基、羧基和环氧基,这些官能团不仅提高了它的分散性,而且对于水中各种污染物起到吸附位点的作用(Ramesha et al.,2011).近年来的研究表明,氧化石墨烯对于F-、Pb2+、Cd2+(Deng et al.,2010)、Cu2+(Yang et al.,2010)、苯酚(Li et al.,2012)和亚甲蓝(Liu et al.,2012)等水体污染物都具有卓越的吸附性能.研究表明,氧化石墨烯和污染物之间的作用受控于一些机理,包括静电吸引(Ramesha et al.,2011)、氢键作用(Hartono et al.,2009)、表面酸碱作用(Hartono et al.,2009; Goncalves et al.,2011)和π-π堆积作用(Chen et al.,2008; Yang et al.,2006)等.
纳米铁(1~100 nm)具有比表面积大、表面活性强的特点,广泛应用于环境污染物的消除(杨娟等,2014).但由于其存在粒径较小,在制备过程中比较容易发生团聚等不足,因此,可以考虑将其固定于氧化石墨烯上,以有效提高反应活性.与此同时,氧化石墨烯负载纳米铁材料因具有磁性而便于回收,并且纳米铁的引入也大大降低了成本.因此,本研究结合氧化石墨烯和纳米铁材料的优点,研制氧化石墨烯负载零价纳米铁吸附剂,并通过表征氧化石墨烯与零价纳米铁吸附剂的表面特性,考察其对环丙沙星的去除效能及吸附机制.
2 材料与方法(Materials and methods) 2.1 实验材料氧化石墨烯(GO)的制备:采用Hummer法制备GO(Hummers et al.,1958),依次将70 mL、98%的浓硫酸和1.5 g NaNO3加入250 mL的烧杯中,搅拌至NaNO3完全溶解后,将烧杯置于冰水浴中,当其温度降至4 ℃左右时,加入3 g石墨,用搅拌器剧烈搅拌30 min;然后缓慢加入9 g KMnO4,保持溶液温度不高于20 ℃,搅拌反应90 min,溶液为紫绿色;将烧杯从冰水浴中置于35 ℃的温水浴中,搅拌反应30 min,溶液变为褐色;之后将138 mL去离子水缓慢加入到烧杯中,温度控制在98 ℃以下,继续搅拌30 min后,用温水将溶液稀释到420 mL;然后缓慢加入3 mL 30%的双氧水,此时混合物的颜色变为金黄色.依次用10%的盐酸和去离子水洗涤至中性,并将其置于60 ℃的真空干燥器中干燥得到棕色固体.
零价纳米铁(NZVI)的制备:将100 mL去离子水和50 mL无水乙醇倒进三口烧瓶中,充N2 鼓泡30 min.将一定量的FeSO4·7H2O加入三口烧瓶,在N2保护下搅拌30 min,将适量浓度的NaBH4溶液匀速缓慢滴加到溶液中,滴加完毕后继续搅拌反应50 min,然后用无水乙醇真空抽滤洗涤3次,于80 ℃的真空条件下烘干20 h左右,得到黑色粉末状的材料,密封保存.
氧化石墨烯负载零价纳米铁(F16G1)的制备:取50 mg氧化石墨烯粉末分散在50 mL去离子水中,搅拌20 h,将溶液放置于三口烧瓶中,并加入100 mL去离子水和50 mL无水乙醇,充N2 鼓泡30 min后将一定量的FeSO4·7H2O加入到溶液中继续搅拌30 min;然后将适量浓度的NaBH4溶液匀速缓慢滴加到溶液中,滴加完毕后继续搅拌反应50 min,再用无水乙醇真空抽滤洗涤3次,于80 ℃的真空条件下烘干20 h左右,得到黑色粉末状的材料,密封保存.铁和氧化石墨烯含量比为2∶1、4∶1、8∶1、12∶1、16∶1、32∶1的复合材料分别被合成,并分别记为F2G1、F4G1、F8G1 、F12G1、F16G1、F32G1.
2.2 实验方法分别取一定浓度的环丙沙星溶液置于锥形瓶中,溶液的pH值通过pH计用NaOH和HCl调节,N2除氧后加入一定量的F16G1粉末后放置于恒温振荡培养箱中,在25 ℃下以300 r·min-1的转速振荡一定时间.取样后过滤,再用液相色谱仪测定环丙沙星的浓度.F16G1对水中环丙沙星的去除率和吸附量分别用式(1)和(2)表示.

|
(1) |

|
(2) |
式中,R为环丙沙星去除率,qe是吸附平衡时的吸附量(mg·g-1);Co和Ct分别是吸附前后溶液中环丙沙星的浓度(mg·L-1);V为溶液体积(L);m为F16G1的质量(g).
2.3 实验仪器真空干燥箱(DZF-6020,上海一恒仪器科技有限公司);恒温振荡培养箱(ZHTY-70,上海知楚仪器有限公司);高效液相色谱(Agilent Technologies 1260 Infinity,中国安捷伦科技有限公司);pH计(UB-7,美国丹佛仪器公司);X射线衍射仪(X′Pert Pro型,荷兰PANalytical B.V.公司),测试条件为:Cu Kα辐射(λ=0.1541 nm),电压40 kV,电流40 mA,扫描速度为1°·min-1,扫描范围2θ = 5°~55°;场发射扫描电子显微镜(S-4800型,日本Hitachi公司),测试条件:加速电压0.5~30 kV;Zeta电位分析仪(Zetasizer Nano型,英国马尔文公司);X射线能谱仪(Genesis XM2型,美国EDAX公司),测试条件:电压15 kV,电流10 μA;热重分析仪(TG 209 F3,德国耐驰仪器公司),测试条件为:载气为N2,载气流速为20 mL·min-1,升温速率为20 K·min-1,测试温度范围为40~500 ℃.
3 结果与讨论(Results and discussion) 3.1 X射线衍射(XRD)分析结果图 1是氧化石墨烯(GO)和F16G1的X射线衍射(XRD)图.从图 1a可以明显看出,在衍射角2θ=10.36°处出现一个很尖锐的衍射峰,此为氧化石墨烯的特征峰.图 1b显示在2θ=44.72°处出现的衍射峰,与零价铁的X射线衍射标准图谱基本一致,由此可知,氧化石墨烯负载上了零价铁;图 1b在2θ=33.16°和2θ=35.64°处出现的较弱的Fe2O3的衍射峰,说明所制材料存在一定程度的氧化.
 |
| 图 1 GO(a)和F16G1(b)的XRD图 Fig. 1 XRD patterns of GO(a) and F16G1(b) |
通过分析零价纳米铁和F16G1的SEM图来对零价纳米铁在氧化石墨烯中的分散情况和形态特征进行分析.由图 2可见,纳米铁粒子受地磁力、小粒子间的静磁力及表面张力共同作用,比较容易团聚.而氧化石墨烯起到了分散剂的作用,纳米铁粒子基本上均匀分散在半透明的褶皱上.
 |
| 图 2 扫描电镜图(a,b:F16G1,c,d:NZVI) Fig. 2 SEM of F16G1 (a,b) and NZVI (c,d) |
图 3为氧化石墨烯和F16G1的红外光谱图.由图可知,氧化石墨烯在3430 cm-1附近有一个较宽、较强的吸收峰,这归属于—OH的伸缩振动峰;在1725 cm-1处为氧化石墨烯羧基上的C=O的伸缩振动峰;在1630 cm-1的吸收峰属于C—OH的弯曲振动吸收峰;在1110 cm-1的峰为C—O—C的振动吸收峰;而 F16G1除拥有氧化石墨烯的官能团外,在600 cm-1左右出现Fe—O键,说明氧化石墨烯与零价纳米铁的结合主要通过Fe—O键来完成.
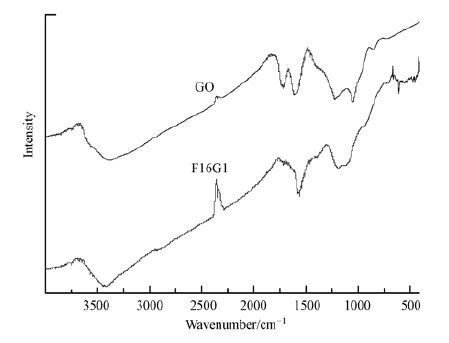 |
| 图 3 GO和F16G1的红外光谱图 Fig. 3 FTIR spectra of GO and F16G1 |
零价纳米铁的等电位点约为8.0 (Bang et al.,2005),而根据图 4可知,F16G1的等电位点约为4.5.当溶液pH小于4.5时,其ζ电位为正值,材料表面所带电荷为正电荷,随着pH的增加,正电荷减少;当pH大于4.5时,其ζ电位为负值,材料表面所带电荷为负电荷.
 |
| 图 4 F16G1的Zeta电位曲线 Fig. 4 Zeta(ζ)-potential of F16G1 |
对于F16G1含量的测定,本研究所采用的方法是热重分析法.由图 5a可知,零价纳米铁在氮气下加热至400 ℃,由于自身少量Fe2O3向Fe3O4转化导致失重2.6%;由图 5b可知,氧化石墨烯在氮气气氛下在200 ℃处有明显失重,且随着温度升高失重也随之增加,其原因是氧化石墨烯含有很多的氧化基团,随着温度的升高氧化基团分解成水、二氧化碳等气体;由图 5c可知,F16G1在氮气下加热至400 ℃自身失重7.6%.根据所得数据计算得出F16G1铁含量为94.27%,与理论值94.12%基本一致.
 |
| 图 5 NZVI(a)、GO(b)、F16G1(c)的TG和DTG曲线 Fig. 5 TG and DTG curves for the NZVI(a),GO(b) and F16G1(c) |
氧化石墨烯负载零价纳米铁中载体的量会影响纳米颗粒的反应活性.因此,分别制备了氧化石墨烯与零价纳米铁负载比为1∶2、1∶4、1∶8、1∶12、1∶16、1∶32的氧化石墨烯负载零价纳米铁,将10 mg材料分别加入通过氮气除氧后的环丙沙星溶液中(50 mg·L-1,100 mL),在300 r·min-1的摇床中恒温(25 ℃)连续振荡3 h.由图 6可知,负载比为1∶16时去除效果最佳.
 |
| 图 6 氧化石墨烯负载量对环丙沙星吸附的影响 Fig. 6 Effect of GO content on CIP adsorption |
pH是影响吸附量的重要因素.为了研究pH的影响,将25 mg F16G1材料分别加入通过氮气除氧后的pH=2~11的环丙沙星溶液中(50 mg·L-1,50 mL),反应3 h,研究pH对环丙沙星吸附的影响(图 7).由图可知,在pH=4~5之间,溶液的pH对吸附的影响很小,其吸附量接近且去除率都可以超过90%.环丙沙星在水介质中的化学平衡分别为pKa1=6.10,pKa2=8.70.当4<pH<6时,环丙沙星主要的存在形态为CIP+,此时pH>pHpzc,F16G1表面含有电荷为负,两者静电吸引致使吸附效果较佳.
 |
| 图 7 pH值和反应时间对环丙沙星吸附的影响 Fig. 7 Effect of pH and reaction time on CIP adsorption |
反应时间是影响吸附量的重要因素.将25 mg F16G1材料加入通过氮气除氧后的环丙沙星溶液中(50 mg·L-1,50mL),反应3 h.由图 7可知,在初始15 min内,去除率非常快;超过15 min,去除率会降低.这主要是由于在初始阶段,在F16G1中有充足的吸附位点,但随着时间的增加,吸附位点越来越少,因而去除率就会降低,其达到吸附平衡的时间均为30 min.
3.9 投加量的影响图 8为不同F16G1投加量对于环丙沙星去除率的影响.由图可知,在其他条件保持不变的情况下,F16G1投加量由0.1 g·L-1增加到1 g·L-1,反应3 h,初始浓度为50 mg·L-1的环丙沙星的去除率由42.91%增至90.19%;F16G1投加量增加到0.5 g·L-1,环丙沙星的去除率有很大提高,反应3 h可达91.39%;增大F16G1初始投加量至1 g·L-1,环丙沙星的去除率和F16G1投加量为0.5 g·L-1时基本一致.
 |
| 图 8 投加量对环丙沙星吸附的影响 Fig. 8 Effect of dosing quantity on CIP adsorption |
由于F16G1与水中环丙沙星的反应是固液界面的反应,可知其反应速率与F16G1的表面形态和表面积有关,F16G1的投加量越大,F16G1的表面积也越大,可供吸附的活性位点越多,对于环丙沙星的去除效果就越好.但在环丙沙星初始浓度一定的情况下,所需的吸附活性位点数量也是一定的,F16G1增加到一定投加量时,活性位点基本可以满足吸附环丙沙星的需要,再增加吸附材料的投加量,去除率不会有明显提高.
3.10 反应平衡浓度的影响图 9是在F16G1投加量为0.5 g·L-1的条件下对环丙沙星的等温吸附线.由图可知,F16G1对环丙沙星的吸附量均随着平衡浓度的升高而逐步增加.这是由于F16G1中有足够的活性位点可以与环丙沙星发生吸附作用,但随着浓度的升高,可以吸附的活性位点越来越达到极限,最后即使环丙沙星的浓度再增加,也不会有更多的活性位点进行吸附作用,所以吸附量越来越趋于平衡.
 |
| 图 9 平衡浓度对环丙沙星去除的影响 Fig. 9 Effect of equilibrium concentration on CIP adsorption |
分别将25 mg 零价纳米铁、氧化石墨烯和F16G1材料加入通过氮气除氧后环丙沙星溶液中(50 mg·L-1,50 mL),反应3 h.由图 10可知,在初始15 min内,氧化石墨烯由于其富含的大量官能团,吸附位点充足使其吸附速率极快;零价纳米铁的等电位点约为8.0(Bang et al.,2005),环丙沙星在水介质中的化学平衡分别为pKa1=6.10,pKa2=8.70.当pH <8时,环丙沙星主要的存在形态为CIP+,此时pH <pHpzc,纳米零价铁表面含有的电荷为正,两者静电排斥,同时,纳米零价铁自身的团聚也使其吸附位点数量减少最终致使吸附效果不佳.
 |
| 图 10 NZVI、F16G1和GO对环丙沙星的去除效果 Fig. 10 Result of NZVI、F16G1 and GO on CIP adsorption |
为了研究F16G1对环丙沙星的等温吸附行为,选用Langmuir方程(3)对数据进行拟合.

|
(3) |
式中,Ce是环丙沙星的初始浓度(mg·L-1);qe和qm 分别是平衡吸附能力和吸附剂的最大吸附能力(mg·g-1);KL是Langmuir吸附平衡常数(L·mg-1).用无量纲的分离常数RL(式(4))进一步分析Langmuir模型,当RL=0时,说明吸附过程不可逆;当RL在0~1之间,说明吸附过程为优势吸附;当RL=1时,说明吸附过程为线性吸附;当RL>1时,说明吸附过程为劣势吸附.

|
(4) |
拟合结果见表 1,F16G1与环丙沙星静电吸引作用的过程类似于单分子层吸附过程.此外,分离常数RL介于0~1之间,说明环丙沙星容易被F16G1所吸附.
| 表 1 不同投加量下F16G1吸附环丙沙星的Langmuir等温模型参数 Table 1 Langmuir isotherm models parameters for adsorption of Ciprofloxacin by F16G1 at different dosing quantity |
F16G1通过静电吸引作用可有效去除水中环丙沙星污染物,吸附平衡过程符合Langmuir等温吸附模型.NZVI与GO比例为16∶1时吸附效果最佳,溶液的pH(pH=4~5)对吸附量没有太大影响且能保持稳定.F16G1对环丙沙星的最大吸附量为656.66 mg·g-1.
| [1] | Avella A C, Delgado L F, Albasi C, et al. 2010.Effect of cytostatic drug presence on extracellular polymeric substances formation in municipal wastewater treated by membrane bioreactor[J]. Bioresource Technology, 101 (2): 518–526. |
| [2] | Bang S, Johnson M D, Korfiatis G P, et al. 2005.Chemical reactions between arsenic and zero-walent iron in water[J]. Water Research, 39 (5): 763–770. |
| [3] | Carabineiro S A C, Thavorn-amornsri T, Pereira M F R, et al. 2012.Comparison between activated carbon,carbon xerogel and carbon nanotubes for the adsorption of the antibiotic ciprofloxacin[J]. Catalysis Today, 186 (1): 29–34. |
| [4] | Carmosini N, Lee L S. 2009.Ciprofloxacin sorption by dissolved orgnic carbon from reference and bio-waste materials[J]. Chemosphere, 77 (6): 813–820. |
| [5] | Carrasquillo A J, Bruland G L, Mackay A A, et al. 2008.Sorption of ciprofloxacin and oxytetracycline zwitterions to soils and soil minerals:influence of compound structure[J]. Environmental Science & Technology, 42 (20): 7634–7642. |
| [6] | Chang X, Meyer M T, Liu X, et al. 2010.Determination of antibiotics in sewage from hospitals,nursery and slaughter house,wastewater treatment plant and source water in Chongqing region of three Gorge Reservoir in China[J]. Environmental Pollution, 158 (5): 1444–1450. |
| [7] | Chen J Y, Chen W, Zhu D. 2008.Adsorption of nonionic aromatic compounds to single-walled carbon nanotubes:effects of aqueous solution chemistry[J]. Environmental Science & Technology, 42 (19): 7225–7230. |
| [8] | Cox C E, Marbury T C, Pittman W G, et al. 2002.A randomized,Double-blind,multicenter comparison of gatifloxacin versus ciprofloxacin in the treatment of complicated urinary tract infection and pyelonephritis[J]. Clinical Therapeutics, 24 (2): 223–236. |
| [9] | Deng X, Li H, Luo F, et al. 2010.The adsorption properties of Pb(Ⅱ) and Cd(Ⅱ) on functionalized graphene prepared by electrolysis method[J]. Journal of Hazardous Materials, 183 (1/3): 923–930. |
| [10] | Diwan V, Tamhankar A J, Khandal R K, et al. 2010.Antibiotics and antibiotic-resistant bacteria in waters associated with a hospital in Ujjain[J]. India BMC Public Health, 10 : 414–422. |
| [11] | Goncalves M, Oliverira Jardim E D, Silvestre-Albero J, et al. 2011.Ammonia removal using activated carbons:effect of the surface chemistry in dry and moist conditions[J]. Environmental Science & Technology, 45 (24): 10605–10610. |
| [12] | 何占伟, 刘国光, 刘海津, 等.2011.水体中不同形态氮对环丙沙星溶液光降解影响[J].环境科学学报, 31 (11):2413–2414. |
| [13] | Hartmann A, Alder A C, Koller T, et al. 1998.Identification of fluoroquinolone antibiotics as the main source of umuC genotoxicity in native hospital wastewater[J]. Environmental Toxicology and Chemistry, 17 (3): 377–382. |
| [14] | Hartmann A, Golet E M, Gartiser S, et al. 1999.Primary DNA damage but not mutagenicity correlates with ciprofloxacin concentrations in German hospital wastewaters[J]. Archives of Environmental Contamination and Toxicology, 36 (2): 115–119. |
| [15] | Hartono T, Wang S, Ma Q, et al. 2009.Layer structure graphite oxide as a novel adsorbent for humic acid removal from aqueous solution[J]. Journal of Colloid and Interface Science, 333 (1): 114–119. |
| [16] | Hirsch R, Ternes T, Haberer K, et al. 1999.Occurrence of antibiotics in the aquatic environment[J]. Science of the Total Environment, 225 (1/2): 109–118. |
| [17] | Hummers W S, Offeman R E. 1958.Preparation of graphitic oxide[J]. Journal of the American Chemical Society, 80 (6): 1339–1339. |
| [18] | Khoder M, Tsapia N, Domergue-Dupon V, et al. 2010.Removal of residual colonic ciprofloxacin in the rat by activated charcoal entrapped within zinc-pectinate beads[J]. European Journal of Pharmaceutical Sciences, 41 (2): 281–288. |
| [19] | Kumar S A, Wang S F. 2009.Adsorption of ciprofloxacin and its role for stabilizing multi-walled carbon nanotubes and characterization[J]. Materials Letters, 63 (21): 1830–1833. |
| [20] | Kummerer K, Al-Ahmad A, Mersch-Sundermann V. 2000.Biodegradability of some antibiotics,Elimination of the genotoxicity and affection of wastewater bacteria in simple test[J]. Chemosphere, 40 (7): 701–710. |
| [21] | 陆炜品, 江淼, 郑芳芳, 等.2012.多孔树脂及碳纳米管对环丙沙星的吸附行为与机理[J].化工学报, 63 (11):3571–3672. |
| [22] | 路来福, 高芒来, 杨森锋, 等.2013.两性表面活性剂改性膨润土的制备及其对环丙沙星的吸附性能[J].材料研究学报, 27 (6):579–581. |
| [23] | Li Y H, Zhang P, Du Q J, et al. 2011.Adsorption of fluoride from aqueous solution by grapheme[J]. Journal of Colloid and Interface Science, 363 (1): 348–354. |
| [24] | Li Y, Du Q, Liu T, et al. 2012.Equilibrium,kinetic and thermodynamic studies on the adsorption of phenol onto graphene[J]. Materials Research Bulletin, 47 (8): 1898–1904. |
| [25] | Li Z, Hong H, Liao L, et al. 2011.A mechanistic study of ciprofloxacin removal by kaolinite[J]. Colloids and Surfaces B:Biointerfaces, 88 (1): 339–344. |
| [26] | Liu T, Li Y, Du Q, et al. 2012.Adsorption of methylene blue from aqueous solution by graphene[J]. Colloids and Surface B:Biointerfaces, 90 : 197–203. |
| [27] | Martins A F, Vasconcelos T G, Henriques D M, et al. 2008.Concentration of ciprofloxacin in Brazilian hospital effluent and preliminary risk assessment:a case study[J]. Clean, 36 (3): 264–269. |
| [28] | Ramesha G K, Vijavya Kumara A, Muralidhara H B, et al. 2011.Graphene and grapheme oxide as effective adsorbents toward anionic and cationic dyes[J]. Journal of Colloid and Interface Science, 361 (1): 270–277. |
| [29] | Ramesha G K, Vijavya Kumara A, Muralidhara H B, et al. 2011.Graphene and grapheme oxide as effective adsorbents toward anionic and cationic dyes[J]. Journal of Colloid and Interface Science, 361 (1): 270–277. |
| [30] | Reynaud F, Tsapis N, Deyme M, et al. 2011.Spray-dried chitosan-metal microparticles for ciprofloxacin adsorption:kinetic and equilibrium studies[J]. Soft Matter, 7 : 7304–7312. |
| [31] | Shim W G, Kim C, Lee J W, et al. 2006.Adsorption characteristics of benzene on electrospun-derived porous carbon nanofibers[J]. Journal of Applied Polymer Science, 102 (3): 2454–2462. |
| [32] | Sune S P, Hatton T A, Chung T S. 2011.Hyperbranched polyethyleneimine induced cross-linking of polyamide-imide nanofiltration hollow fiber membrances for effective removal of ciprofloxacin[J]. Environmental Science & Technology, 45 (9): 4003–4009. |
| [33] | Van Doorslaer X, Demeestere K, Heynderickx P M, et al. 2011.UV-A and UV-C induced photolytic and photocatalytic degradation of aqueous ciprofloxacin and moxifloxacin:reaction kinetics and role of adsorption[J]. Applied Catalysis B:Environmental, 101 (3/4): 540–547. |
| [34] | Wang C J, Li Z, Jiang W T. 2011.Adsorption of ciprofloxacin on 2:1 dioctahedral clay minerals[J]. Applied Clay Science, 53 (4): 723–728. |
| [35] | Witte B D, Langenhove H V, Demeestere K, et al. 2010.Ciprofloxacin ozonation in hospital wastewater treatment plant effluent:Effect of pH and H2O2[J]. Chemosphere, 78 (9): 1142–1147. |
| [36] | Wu S L, Zhao X D, Li Y H, et al. 2013.Adsorption of ciprofloxacin onto biocomposite fibers of grapheme oxide/calcium alginate[J]. Chemical Engineering Journal, 230 : 389–395. |
| [37] | 杨娟, 李咏梅.2014.纳米零价铁去除水中微量N-亚硝基二甲胺的研究[J].中国环境科学, 34 (7):1696–1702. |
| [38] | Yang K, Zhu L Z, Xing B S. 2006.Adsorption of polycyclic aromatic hydrocarbons by carbon nanomaterials[J]. Environmental Science & Technology, 40 (6): 1855–1861. |
| [39] | Yang S T, Chang Y, Wang H, et al. 2010.Folding/aggregation of graphene oxide and its application in Cu2+ removal[J]. Journal of Colloid and Interface Science, 351 (1): 122–127. |
| [40] | Zhang C L, Qiao G L, Zhao F, et al. 2011.Thermodynamic and kinetic parameters of ciprofloxacin adsorption onto modified coal fly ash aqueous solution[J]. Journal of Molecular Liquids, 163 (1): 53–56. |
 2016, Vol. 36
2016, Vol. 36


