2. 扬州自来水集团公司, 扬州 225127;
3. 江苏鑫东方环保设备科技有限公司, 扬州 225807
2. Yangzhou Tap Water Co., Ltd., Yangzhou 225127;
3. Jiangsu Xindongfang Environmental Protection Equipment Technology Co., Ltd., Yangzhou 225807
蓝藻普遍存在于我国湖泊水库水源中(黄廷林等, 2009;吴宇, 2008;Yang et al., 2008), 其中铜绿微囊藻是最常见的水华优势藻种.由于常规混凝沉淀工艺处理效果不佳, 目前水处理中常采用预氧化沉淀工艺和预氧化气浮工艺去除(梁恒等, 2005), 藻类去除率可达70%~90%(胡澄澄等, 2010;黎雷等, 2008), 但预氧化过程容易导致藻细胞破裂, 细胞内的藻毒素和藻液外泄释放到水体后, 威胁供水安全(Shen et al., 2003;戴瑾瑾等, 2009;Karner et al., 2001), 同时气浮工艺需要消耗处理水量10%~15%的高压溶气水, 存在能耗大、水处理成本高等问题(丛海兵等, 2013).
研究表明(Walsby et al., 1994;Olver et al., 2000;储昭升等, 2006;胡鸿钧, 2011;丛海兵等, 2009;孔繁翔等, 2011), 大多数铜绿微囊藻细胞内存有气囊, 这些气囊为藻细胞提供浮力, 同时可以通过调节自身浮力来改变其在水体中的纵向位置以适应环境, 这也是藻类容易漂浮于水体表面, 并在常规水处理工艺中难以沉淀去除的主要原因.这些气囊由众多圆柱形的气泡(伪空胞)叠加而成.伪空胞是两端为锥形, 中间为圆柱体的中空、充有气体的细胞内结构, 长约200~1200 nm, 宽约65~115 nm, 壁厚2 nm(Bowen et al., 1965;Walsby et al., 1989;张永生等, 2010).气囊壁为蛋白质成分, 能透气而不透水.气囊能够承受一定的外部压力, 当压力达到某个阈值时, 气囊会突然坍塌破裂, 藻类失去浮力而下沉(Walsby et al., 1991;储昭升等, 2007).
利用受压后气囊会坍塌破裂的特性, 本课题组设计出了深水循环混凝沉淀工艺, 即采用深水循环井预处理含藻水, 使气囊在深水高压作用下坍塌破裂, 藻类失去浮力, 再经后续混凝沉淀去除, 该方法已获得专利授权(丛海兵等, 2013).本文采用U形管模拟深水循环井装置对含有铜绿微囊藻的原水进行加压预处理, 再进行混凝沉淀实验, 研究深水循环混凝沉淀工艺去除藻类的效果, 同时探究深水循环去除藻类的机理及其水质安全性.
2 材料与方法(Materials and methods) 2.1 实验材料实验用含藻原水取自无锡太湖梅梁湾, 优势藻种为铜绿微囊藻, pH为8.0左右.将水样放入实验室临时培养装置, 给予适当光照、搅拌, 培养待用, 水样在3 d内用完.经检测原水浑浊度为60.1 NTU、叶绿素a为114.8μg·L-1、藻毒素(MCs)为0.539μg·L-1、DOC为9.972 mg·L-1.
本实验预氧化剂采用NaClO分析纯, 配置成有效氯1.0 g·L-1使用液.混凝剂采用Al2(SO4)3·18H2O分析纯, 配置成5.0 g·L-1使用液.
2.2 实验装置(1)深水循环装置
实验用U型管深水循环装置如图 1所示, 采用一塑料软管(可承受压力1.2 MPa), 口径Φ12 mm, 将该装置安置于一高层建筑内, 保持进出口间存在一定高差, 总高度可调.
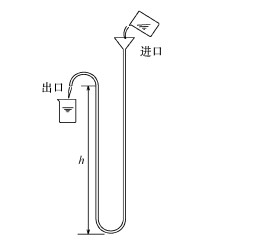 |
| 图 1 U形管深水循环实验装置 Fig. 1 U shaped tube to simulate the deep water circulation device |
(2)混凝沉淀静态实验装置
混凝沉淀静态实验装置采用深圳中润水工业公司生产的ZR4-6型六联搅拌机.
2.3 实验方法 2.3.1 深水循环、预氧化实验通过漏斗向深水循环装置U形管进口注入原水, 原水经重力自流到出口, 排入到盛水容器中.调节U形管高度h, 可制得不同循环深度的水样.本实验的循环深度分别为40 m、50 m、60 m、70 m、80 m.
另取一份含藻原水, 充分混匀后装入1 L的烧杯中, 加入有效氯为2 mg·L-1的NaClO, 60 r·min-1搅拌30 min后, 取出预氧化后的水样.
将部分含藻原水、深水循环水、预氧化水用0.45μm孔径的滤膜过滤, 滤液测定藻毒素和DOC浓度.另取原水、深水循环水、预氧化水中的藻细胞制作成超薄切片, 然后用透射电镜对其进行扫描拍照, 最后对扫描图像进行分析.其余各类水样用于下述混凝沉淀实验.
2.3.2 混凝沉淀实验取适量各自混匀的含藻原水、深水循环水、预氧化水, 将每类水样分别装入3个1 L的烧杯中, 依次加入10 mg·L-1、20 mg·L-1、30 mg·L-1的混凝剂量, 经200 r·min-1搅拌1 min, 100 r·min-1搅拌10 min, 60 r·min-1搅拌10 min, 静沉30 min后, 虹吸出烧杯上层800 mL水, 混匀后测定浑浊度、叶绿素a、藻毒素和DOC浓度.
2.4 测定方法 2.4.1 藻细胞气囊体积分数测定对待测水样进行低速离心, 吸取2 mL高浓度藻液, 委托扬州大学分析测试中心进行藻细胞超薄切片电镜扫描, 过程主要包括先用2.5%戊二醛固定样品, 经0.1 mol·L-1磷酸缓冲液清洗3次, 再用1%锇酸室温下固定4 h, 再经0.1 mol·L-1磷酸缓冲液清洗3次, 随后进行30%、50%、70%、80%、90%、95%和100%乙醇系列脱水, 丙酮置换, 环氧812树脂浸透与包埋, 接着放入37℃的烘箱中聚合24 h, 60℃聚合48 h, 再将包埋修养好的树脂块用钻石刀在Leica EM UC6超薄切片机下切成厚100 nm的薄片, 用200目的铜网捞片后, 经2%醋酸双氧铀和1%柠檬酸铅双重染色, 最后在Tecnai-12型透射电子显微镜下观察和拍照, 得到藻细胞切片电镜扫描照片, 见图 2a.
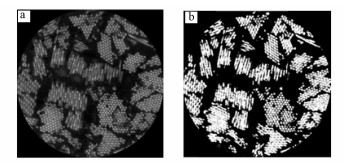 |
| 图 2 藻细胞电镜扫描照片及其图像分析(a.藻细胞切片电镜扫描照片; b.切片照片图像分析) Fig. 2 SEM micrograph and image analysis of Microcystis aeruginosa cell |
利用图像分析软件, 进一步对藻细胞切片照片进行分析.图片分成黑白两部分, 白色部分为气囊, 黑色部分为藻液.藻细胞切片照片图像分析见图 2b.统计出白色气囊部分所占的面积比例X, 再换算成气囊占球体藻细胞的体积比例(体积分数)Y=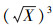
浑浊度采用哈希2100q01型浊度仪测定;叶绿素a采用丙酮提取, 上海精科UV759S型分光光度计测定;藻毒素委托扬州大学测试中心测定, 采用固相萃取液相色谱-串联质谱法检测, 液质联用仪为美国Agilent公司Agilent1200-6460 QQQ型;DOC采用岛津TOC-VCPN仪测定.
3 结果与讨论(Results and discussion) 3.1 深水循环混凝沉淀处理含藻水效果在10~30 mg·L-1投药量下, 原水直接混凝沉淀、预氧化混凝沉淀和40~80 m深水循环混凝沉淀后的出水浑浊度、叶绿素a测定结果见图 3.
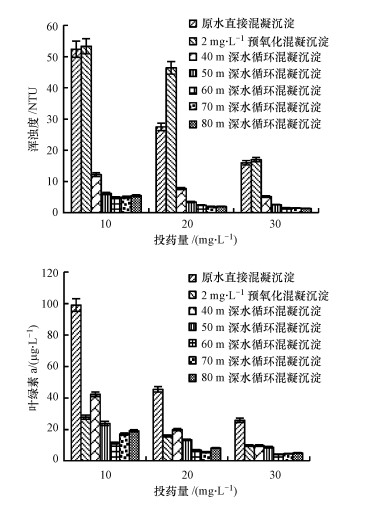 |
| 图 3 不同处理方式后出水浑浊度和叶绿素a浓度 Fig. 3 Changes of turbidity and chlorophyll-a of the effluent after different treatments |
实验数据表明, 相同投药量下, 深水循环混凝沉淀工艺去除效果总体上优于原水直接混凝沉淀工艺和预氧化混凝沉淀工艺;随着循环深度的加大, 去除效果越好, 60~80 m间趋于稳定;随着混凝剂投加量的增加, 各工艺混凝沉淀后出水浑浊度、叶绿素a都呈现总体下降趋势, 去除效果增强, 在投药量30 mg·L-1时, 去除率达到最大, 60~80 m深水循环混凝沉淀出水浑浊度为1.35~1.57 NTU, 叶绿素a去除率为95.5%~96.3%, 原水直接混凝沉淀出水浑浊度为16 NTU, 藻类叶绿素a去除率为77.5%, 预氧化混凝沉淀出水浑浊度为17 NTU, 叶绿素a去除率为91.5%.预氧化混凝沉淀工艺出水浑浊度较高, 而藻类去除率却较好的原因是, 藻细胞内的色素被NaClO氧化, 颜色从绿色变成淡黄色或白色, 因而测得的叶绿素偏低, 实际上藻细胞群体被NaClO氧化溶解成了较多的单细胞藻类, 不易在混凝沉淀过程去除, 使得水体浑浊度仍较高(丛海兵等, 2014).
3.2 深水循环除藻机理分析对含藻原水水样、40~80 m深水循环水样、2 mg·L-1 NaClO预氧化水样中的藻细胞进行切片、透射电镜扫描, 照片如图 4所示.
 |
| 图 4 不同处理方式后藻细胞内的气囊形态变化 Fig. 4 Changes of gas vesicles morphology after different treatments |
扫描照片分析及体积分数测定表明, 原水藻细胞中存在白色的有如蜂窝状的气囊, 其体积分数为27%;经40~80 m深水循环后部分气囊消失, 剩余气囊数量逐渐减少, 60~80 m深水循环后气囊所剩无几;40 m、50 m、60 m、70 m、80 m深水循环残余气囊的体积分数分别为12.6%、10%、3.6%、3.3%、3.4%, 体积分数逐渐减小并趋于稳定.气囊体积分数的变化趋势与含藻水经深水循环后观察到的实验现象、实验测定的藻类去除效果呈现相关性, 即随着循环深度的加大, 消失的气囊数量逐渐增多, 剩余气囊体积分数逐渐减小, 水体上部漂浮的藻类越来越少, 下部沉淀的藻类越来越多, 藻类去除效果越来越好.深水循环利于藻类去除的机理是, 因藻细胞壁具有透气透水性, 在深水循环过程中, 水分子在水压作用下透过细胞壁进入细胞内部, 保持了细胞壁内外水压平衡;而气囊只透气不透水, 气囊受到外部水压作用后被压缩, 可能坍塌或破裂, 导致气体从气囊内被压出进入到细胞液中, 并透过细胞壁扩散到细胞外的水中, 同时细胞内气囊原有的空间被细胞液或水填充, 从而使藻细胞失去气囊浮力, 平均密度增大;在浮力减小、重力增大的双重协同作用下, 藻体由上浮转而下沉, 再经后续混凝沉淀去除.此外, 对比分析大量不同循环深度作用后藻细胞的超薄切片, 没有观察到细胞破裂、结构坍塌等现象, 可以初步推测深水循环不会对藻细胞的整体结构形态造成破坏.
预氧化后的水样, 其藻细胞内的气囊有小部分消失, 残余的气囊仍很多, 其气囊体积分数为18.4%, 结果大部分藻类仍漂浮于水面没有沉淀, 这是因为氧化剂除了氧化藻类胞外胶质鞘及表面结构, 导致胞内部分物质外泄外, 还进入细胞内部, 破坏气囊的蛋白质外壁, 导致部分气囊消失, 气囊体积分数下降, 但2 mg·L-1 NaClO的量不足以氧化更多的气囊.
3.3 深水循环混凝沉淀处理含藻水水质安全性分析含藻原水、40~80 m深水循环后的含藻水、2 mg·L-1 NaClO预氧化后的含藻水, 其藻毒素和DOC浓度测定结果见图 5.
 |
| 图 5 不同预处理方式后藻毒素和DOC浓度 Fig. 5 Changes of microcystins and DOC after different pre-treatments |
实验数据表明, 含藻水经过不同循环深度后, 藻毒素和DOC都没有增加, 大部分还表现为一定程度的减小, 进一步说明了深水循环未造成藻细胞结构破裂.数据减小的原因可能是, 深水循环过程引起水体中有机物相对分子质量改变造成的(陈雯静等, 2014).预氧化后的含藻水, 其藻毒素和DOC显著增大, 分别增加为含藻原水的3.47倍、1.1倍, 原因是藻细胞结构被NaClO氧化破裂, 导致藻细胞内的藻毒素、藻液等不同程度的外泄(叶琳琳等, 2011;王立宁等, 2005).因此, 预氧化过程水质是不安全的, 而深水循环过程是安全的.
进一步对后续混凝沉淀出水的藻毒素、DOC进行分析.在混凝剂投加量30 mg·L-1下, 含藻原水直接混凝沉淀、70 m深水循环混凝沉淀、2 mg·L-1NaClO预氧化混凝沉淀出水的藻毒素和DOC浓度情况见图 6.
 |
| 图 6 不同组合工艺混凝沉淀后藻毒素和DOC比较 Fig. 6 Comparison of microcystins and DOC after different processes following coagulation and sedimentation |
70 m深水循环后的含藻水, 再经混凝沉淀处理, 其出水藻毒素和DOC均进一步降低, 藻毒素去除率为60.9%, 与直接混凝沉淀去除效果相当, DOC去除率为38.8%, 是原水直接混凝沉淀的两倍多, 说明深水循环混凝沉淀工艺处理水质不仅是安全的, 而且对藻毒素、DOC的去除是有效的, 尤其是对溶解性有机物.预氧化后的含藻水, 再经混凝沉淀, 其出水藻毒素和DOC均进一步升高, 分别增加到原水浓度的5.34倍和1.29倍, 说明NaClO预氧化过程不仅使细胞内藻毒素释放出来, 而且在后续的混凝沉淀过程中持续氧化释放, 对混凝沉淀的去除效果产生不利影响.
4 结论(Conclusions)1)深水循环混凝沉淀处理含藻水效果显著, 随着循环深度的加大, 去除效果越好, 其中深水循环60~80 m时效果趋于稳定, 在投药量30 mg·L-1时, 藻类去除率可达到95%以上, 浑浊度小于1.6 NTU, 处理效果比原水直接混凝沉淀、预氧化混凝沉淀显著提高.
2)深水循环混凝沉淀处理含藻水, 随着循环深度的加大, 藻细胞内气囊在深水水压作用下消失的数量越多, 剩余体积分数越小;气囊的坍塌破裂导致藻细胞失去浮力, 藻类得以下沉.
3)深水循环混凝沉淀组合工艺中藻毒素、DOC均没有增加, 该工艺处理含藻水是安全的.
| [${referVo.labelOrder}] | Bowen C C, Jensen T E. 1965. Blue-green algae:fine structure of the gas vacuoles[J]. Science , 147 (3664) : 1460–1462. DOI:10.1126/science.147.3664.1460 |
| [${referVo.labelOrder}] | 陈雯静, 丛海兵, 徐亚军, 等.2014. 预压力混凝沉淀除藻工艺中DOC变化规律研究[J]. 环境科学 , 2014, 35 (7) : 2579–2584. |
| [${referVo.labelOrder}] | 储昭升, 金相灿, 杨波, 等.2006. 不同群体形态蓝藻的气囊与光的相互作用研究[J]. 环境科学学报 , 2006, 26 (11) : 1909–1913. |
| [${referVo.labelOrder}] | 储昭升, 杨波, 金相灿, 等.2007. 6株蓝藻伪空胞的临界破裂压力研究[J]. 环境科学 , 2007, 28 (12) : 2695–2699. |
| [${referVo.labelOrder}] | 丛海兵, 陈雯婧, 徐亚军, 等.2013. 压力强化混凝沉淀除藻工艺研究[J]. 环境科学学报 , 2013, 33 (7) : 1–6. |
| [${referVo.labelOrder}] | 丛海兵, 高郑娟, 孙秀秀.2014. 压力作用后太湖蓝藻沉淀性能及其去除研究[J]. 中国给水排水 , 2014, 30 (1) : 43–47. |
| [${referVo.labelOrder}] | 丛海兵, 黄廷林. 2013.深水循环强化混凝沉淀除藻水处理系统和方法[P].中国专利:CN201210109541.9, 06-26 |
| [${referVo.labelOrder}] | 丛海兵, 黄廷林, 周真明.2009. 于桥水库铜绿微囊藻上浮运动规律及其控制[J]. 给水排水 , 2009, 35 (11) : 140–145. |
| [${referVo.labelOrder}] | 戴瑾瑾, 陈德辉, 高云芳, 等.2009. 蓝藻毒素的研究概况[J]. 武汉植物学研究 , 2009, 27 (1) : 90–97. |
| [${referVo.labelOrder}] | 胡澄澄, 高乃云, 楚文海.2010. 沉淀与气浮工艺单位处理太湖原水效果比较[J]. 给水排水 , 2010, 36 (2) : 13–17. |
| [${referVo.labelOrder}] | 胡鸿钧. 2011. 水华蓝藻生物学[M]. 北京: 科学出版社 . |
| [${referVo.labelOrder}] | 黄廷林, 丛海兵, 柴蓓蓓. 2009. 饮用水水源水质污染控制[M]. 北京: 中国建筑工业出版社 . |
| [${referVo.labelOrder}] | Karner D A, Standridge A J H, Harrington G W, et al. 2001. Microcystin algal toxins in source and finished drinking water[J]. Journal American Water Works Association , 93 (8) : 72–81. |
| [${referVo.labelOrder}] | 孔繁翔, 宋立荣. 2011. 蓝藻水华形成过程及其环境特征研究[M]. 北京: 科学出版社 . |
| [${referVo.labelOrder}] | 黎雷, 高乃云, 殷娣娣, 等.2008. 控制饮用水源水中藻类、藻毒素的水厂处理工艺[J]. 中国给水排水 , 2008, 24 (6) : 20–24. |
| [${referVo.labelOrder}] | 梁恒, 李圭白, 李星, 等.2005. 不同水处理工艺流程对除藻效果的影响[J]. 中国给水排水 , 2005, 21 (3) : 5–7. |
| [${referVo.labelOrder}] | Olver R L, Ganf G G. 2000. FreshwaterBlooms[A]. In:Whitten B A, Potts(Eds.). The Ecology of Cyanobacteria[M]. Netherlands:Kluwer Acdemic Publishers, 149-194 |
| [${referVo.labelOrder}] | Shen P P, sh iQ, Hua Z C, et al. 2003. Analysis of microcystns in cyanobacteria blooms and surfacee water samples from Meiliang Bay, taihu Lake, China[J]. Environment International , 29 : 641–647. DOI:10.1016/S0160-4120(03)00047-3 |
| [${referVo.labelOrder}] | Walsby A E. 1994. Gas vesicles[J]. Microbiology Reviews , 58 : 94–104. |
| [${referVo.labelOrder}] | Walsby A E. 1989. The gas vesicle:a stable gas-filled structure in bacteria[A]. In Brubakk A O, Hemmingsen B B, SundnesG(eds).Supersaturation and Bubble Formation in Fluids and Organisms[C]. Trondheim, Norway:Tapir Publishers, 69-103 |
| [${referVo.labelOrder}] | Walsby A E. 1991. The mechanical properties of the microcystis gas vesicle[J]. Journal of General Microbiology , 137 : 2401–2408. DOI:10.1099/00221287-137-10-2401 |
| [${referVo.labelOrder}] | 王立宁, 方晶云, 马军, 等.2005. 化学预氧化对藻类细胞结构的影响及其强化混凝除藻[J]. 东南大学学报(自然科学版) , 2005, 35 (1) : 182–185. |
| [${referVo.labelOrder}] | 吴宇.2008. 富营养化:中国湖泊面临的治理难题[J]. 生态经济 , 2008 (9) : 14–19. |
| [${referVo.labelOrder}] | Yang M, Yu J W, Li Z L, et al. 2008. TaihuLake not to blame for Wuxi's woes[J]. Science , 11 : 158. |
| [${referVo.labelOrder}] | 叶琳琳, 史小丽, 吴晓东, 等.2011. 西太湖秋季蓝藻水华过后细胞裂解对溶解性有机碳影响[J]. 中国环境科学 , 2011, 31 (1) : 131–136. |
| [${referVo.labelOrder}] | 张永生, 孔繁翔, 于洋, 等.2010. 蓝藻伪细胞的特性及浮力调节机制[J]. 生态学报 , 2010, 30 (18) : 5077–5090. |
 2016, Vol. 36
2016, Vol. 36


