近年来,由于畜禽尸体的不恰当处理处置而引发的环境污染、疾病传播等危害公众健康的事件频发,如2013年初国内外共同关注的黄浦江死猪事件以及2015年病死猪肉违规流入餐桌事件等.据统计,我国每年因各类疾病及自然灾害所引发的畜禽死亡率约为8%~12%(猪),12%~20%(家禽),2%~5%(牛),7%~9%(羊)和2%以上(其他家畜)(浦华等,2014).为了防止这些畜禽尸体带来危害,它们的安全处理处置十分重要.
截至目前,畜禽尸体处理处置的主要方式为焚烧、掩埋、化制和生物发酵.这些传统方式大都存在其局限性,如填埋可能产生高浓度的渗滤液,污染地下水源(Renou et al.,2008);焚烧会产生挥发性有机物和有毒气体,危害人类健康(González et al.,2012);化制法对温度和压力要求高,并且前期投入成本高,存在着一定生物风险(续彦龙等,2015).生物发酵作为一项我国近年引进的新兴技术,主要包括生物堆肥、生物发酵床、滚筒式生物降解和粉碎加温生物降解等方法,它能利用天然有益微生物复合菌群的极强好氧发酵能力分解动物尸体,虽然在一定程度上改善了前述几种方法的缺点,仍避免不了投入成本高、工作量大、不能实现能源回收等局限性(卢珍兰等,2015). 因此,为了更好的普及和实施畜禽尸体的安全处理处置,研究和开发高效且低成本的技术方法尤为必要.
大量研究表明,厌氧消化技术因其具有大幅降低BOD和COD含量、去除病原菌以及产生可再生能源(沼气)等优点在农业固体废弃物、餐厨垃圾和污水厂剩余污泥等有机废弃物的处理处置中得到广泛的应用(Coté et al.,2006;Chen et al.,2008).畜禽尸体这类高蛋白有机废物若能作为厌氧消化的基质,便可以在对其进行安全处理处置的同时产生大量可再生能源,从而大幅降低处理处置成本.但是,在厌氧消化系统中添加大量高蛋白有机废物,会使得系统中由于蛋白质降解所产生的氨氮大量积累,进而引发氨抑制问题,影响系统的稳定性(Ahring et al.,2003).因此,利用厌氧消化技术处理高蛋白有机废物的工业应用至今在国内外都鲜有报道,目前在欧洲运行的12000多个沼气发电厂中所采用的厌氧消化原料没有一个是以高蛋白有机废物为主(Kovács et al.,2015).
为了缓解乃至消除厌氧消化系统中的氨抑制问题,科学家们从微生物驯化及共消化提高抑制阈值等方面展开了研究.Kovács等在2014年的研究表明经过一个适应驯化的阶段后,厌氧微生物能够适应系统内的高浓度氨氮,C/N为3.32的肉膏因而能够作为中温厌氧消化系统的基质(Kovács et al.,2015).Dai等(2015)也验证了畜禽尸体(以猪肉作为替代样品)与酒糟联合厌氧消化的可行性,且系统并未受到高浓度氨氮的明显影响.可见,高蛋白有机废物所带来的氨抑制瓶颈问题有被突破的可能,其厌氧消化具有广阔的前景和应用价值.同时,相比于厌氧共消化系统,单独厌氧消化系统更有利于反应器容积的有效利用,但在不添加其他辅料(如酒糟)的情况下,系统可能因为过高的蛋白负荷而导致运行失败.因此,对高蛋白有机废物单独厌氧消化的有机负荷条件的探索尤为必要.
本研究以猪肉作为高蛋白有机废物的替代品进行单相厌氧消化,探究不同有机负荷条件下高蛋白物料厌氧消化系统的稳定性、VS降解率以及产气性能等;同时探讨系统内的氨氮浓度对相应厌氧消化系统性能的影响;并通过对可行的有机负荷条件下系统中古菌种群相对密度变化的深入分析,探寻高氨氮条件下产甲烷菌驯化的可能性,以期为该条件下氨抑制问题的缓解乃至消除提供理论研究基础.该研究能对畜禽尸体这类高蛋白有机废物的无害化处理暨能源回收的工艺设计提供参考.
2 试验材料和方法(Materials and methods) 2.1 试验材料本研究所用动物尸体的替代样品为采购于上海市某农贸市场的猪肉.为了模拟动物尸体的灭菌过程,首先,将猪肉经绞肉机绞碎后加入灭菌锅,在121 ℃条件下热水解2 h后去除油脂(可作生物柴油的原料).厌氧消化反应器的接种泥取自之前运行的高含固污泥厌氧消化反应器.接种泥及物料的基本性质具体见表 1.所有的物料均储存在4 ℃环境下,并在加入反应器前在烘箱中预热至35 ℃.
| 表 1 接种泥和物料的基本性质 Table 1 Characteristics of inoculum and feedstock |
本研究所采用的3台小试反应器(R1~R3)的有效容积均为9 L,反应器装置图如图 1所示.反应器内置螺带式搅拌器,搅拌速度为30 r·min-1,以转动/停止为10 min/10 min的方式交替运行.该反应器通过水浴夹套内热水程控加热控制反应器内物料温度为(35±1)℃.每日产气量由湿式气体流量计(LMF-1,长春汽车滤清器有限责任公司)测得.
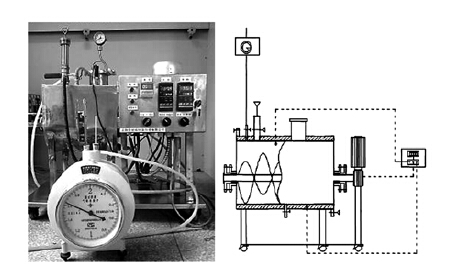 |
| 图 1 反应器装置示意图及其照片 Fig. 1 Schematic diagram and photo of the digesters |
3个反应器(R1,R2和R3)的初始接种量均为9.0 L污泥,通过不同的进料含固率(5%(R1),10%(R2)和15%(R3))逐步提高各自的有机负荷至设定值.3个反应器的SRT均设置为20 d,以每天同一时间进出料的半连续方式运行.R1和R2分别运行了60 d,R3由于迅速不稳定,只运行了30 d,R1~R3中进料基质参数如表 2所示.同时为了使反应器中物料质量保持平衡,出料的质量为进料质量减去VS的减少量(其中VS的减少量通过前1天的产气量按照1 L·g-1估算所得(Angelidaki等,2004)).
| 表 2 R1~R3进料基质的基本参数 Table 2 Characteristics of the feedstock for each digester |
每周采集2次厌氧消化系统产生的沼气和消化后出料,分析测量气体中甲烷含量、出料的pH、TS、VS、总氨氮(total ammonia nitrogen,TAN)浓度、游离氨浓度(free ammonia nitrogen,FAN)、挥发性脂肪酸(volatile fatty acids,VFA)浓度和总碱度(total alkalinity).pH值由pH计(S210,METTLER,Switzerland)测试.气体中的甲烷量由气相色谱(GC,Agilent Technologies 6890N,CA,USA)利用TCD检测器利用Hayseq Q mesh and Molsieve 5A 色谱柱在80 ℃温度下以氮气为载气(0.1 MPa)进行测量.TS、VS、总氨氮(TAN)和总碱度(TA)采用标准方法(APHA,2005)测试.消化后出料样品在13000 r·min-1 下离心15 min后过滤,滤液经0.45μm微孔滤膜抽滤后,添加甲酸溶液调节pH≤2.0,用气相色谱仪(火焰离子化检测器)(2010 plus,Shimadzu,Japan)测试VFA浓度.FAN浓度的计算采用Siles等(2010)的方法,VS降解率(VS reduction,VSr)采用Koch等(2015)所报道的方法计算(假设物料中的无机部分即灰分在厌氧消化前后质量是不变的),计算公式如下:
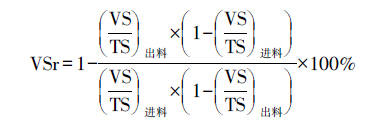
|
(1) |
取R2在运行过程中第1、5、10、15、20、25、30、35、40、50和60 d的出料各2.0 g用PowerSoil强力土壤DNA提取试剂盒抽提其中的DNA.抽提出的DNA样品用超微量紫外/可见分光光度计(Nanodrop 2000,Thermofisher,USA)测定DNA浓度,利用344F(5' -ACGGGGYGCAGCAGGCGCGA-3')/915R(5' -GTGCTCCCCCGCCAATTCCT-3')古细菌引物对DNA进行扩增,再将PCR(Polymerase Chain Reaction)扩增之后的产物采用新一代高通量测序454平台进行焦磷酸测序.并将得到的16S rDNA基因序列利用QⅡME 1.8软件进行序列优化,OTU聚类,再根据RDP数据库(Cole et al.,2013)作分类学分析,最终得到每个样品内的古细菌在属(genus)水平上的群落组成.
3 结果与讨论(Results and discussion) 3.1 不同有机负荷下的VS降解率和产气性能反应器R1~R3在SRT为20 d时的VS降解率和产气性能参数分别如图 2和图 3所示.其中R1和R2运行60 d,达到稳定状态(日产气量基本恒定);R3未能达到稳定运行状态,运行24 d后产气量开始持续下降,到第30 d时产气量为零,运行以失败告终.
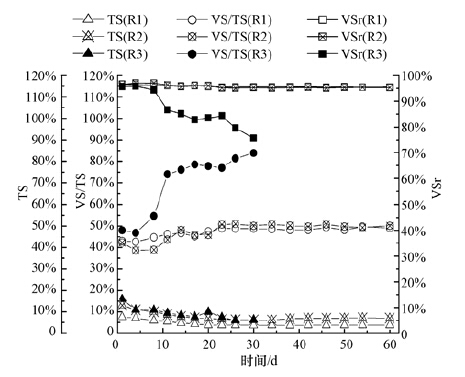 |
| 图 2 3个反应器中TS、VS/TS以及VS降解率VSr的变化 Fig. 2 The variation of TS,VS/TS and VSr in three reactors |
由图 2和图 3可知,当猪肉负荷由R1中的(2.38±0.21)kg·m-3·d-1提高到R2中的(4.76±0.41)kg·m-3·d-1时,单位体积沼气产率由(1.81±0.11)L·L-1·d-1上升到(3.72±0.21)L·L-1·d-1(甲烷含量均为65%),提升了1倍;单位添加VS的产气量没有明显差别,R1和R2均稳定在(0.50±0.02)m3·kg-1 VSadded;同时两个系统的VS降解率也均稳定在95%.这表明将有机负荷提高到(4.76±0.41)kg·m-3·d-1时,反应器的容积利用率提升了1倍,但是系统内微生物对于所添加的有机物的利用率没有受到明显影响,因此可以推断该负荷没有超出系统的承载能力.而当猪肉负荷继续提高到R3中的(8.49±0.52)kg·m-3·d-1时,产气量以及甲烷含量(66%)相比于R2提高并不明显,波动幅度较大,且VS降解率呈明显降低趋势,系统在30 d内即运行失败,这表明有机负荷为(8.49±0.52)kg·m-3·d-1时可能超出了系统的承载能力,系统内的环境抑制了微生物对有机物的降解和利用,导致反应器不能稳定运行.因此在反应器稳定运行的前提下,从综合产气率和VS降解率两方面评价,R2中的有机负荷为本研究中保持较高产气率和降解率的同时提高反应器容积利用率的最佳选择.
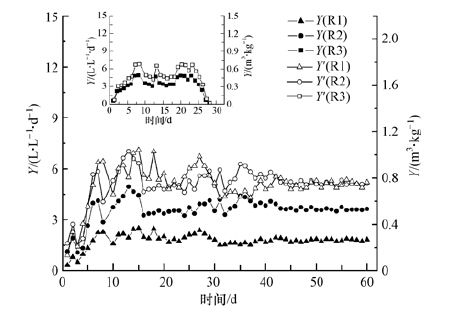 |
| 图 3 不同负荷下的单位体积沼气产率(Y)和单位添加VS的沼气产率(Y') Fig. 3 The biogas production Y and Y' based on VSadded in three reactors |
表 3对比了R2以及文献报道的以其他有机物作为基质的反应器的运行性能.在相似的有机负荷条件下,R2中猪肉的VS降解率远高于污水厂剩余污泥、餐厨垃圾和城市有机固体废弃物.这是由于,污泥在厌氧消化过程中将微生物细胞内的有机物释放并水解的过程比较消耗能量,会限制污泥厌氧消化的效率(Pilli et al.,2011);其次,污泥、餐厨垃圾和城市有机固体废弃物都含有部分较难降解的纤维素等大分子有机物;最后,经热水解去除油脂后猪肉中主要成分为更易被蛋白酶水解的变性蛋白质,在厌氧消化系统中容易被微生物利用.另外,Ariesyady等(1990)研究表明蛋白质、碳水化合物和脂质等组分不同的有机物经厌氧消化,在不受抑制的条件下每降解1g VS的理论产气量在0.8~1.4 m3·kg-1范围内,从表 3可知R2中猪肉产气性能以单位降解VS计时与其他基质相差不大,都在理论范围之内,且以单位添加VS沼气产量计时明显高于其他基质,这是因为经热水解后的猪肉可生化性能好,容易被微生物利用,降解率高.因此,由以上比较可知,在(4.76±0.41)kg·m-3·d-1负荷下将动物尸体(以猪肉作为实验样品)作为厌氧消化的基质,降解率和产气率均能达到比较理想的效果,能够实现在降解动物尸体中有害物质的同时,产生可再生能源-沼气.
| 表 3 本研究中基质(猪肉)与文献中不同基质的VS降解率以及产气性能的对比 Table 3 The comparisons on VS reduction and biogas production among substrate in this study and the previous literatures |
在厌氧消化系统的运行中,VFA、TA以及pH等参数的变化在很大程度上能够反应系统的稳定性.不少文献也报道VFA/TA的比值可以作为反应器系统稳定性的重要参数(Duan et al.,2012; Koch et al.,2015).反应器R1-R3在运行过程中系统内的VFA与TA以及pH与VFA/TA的变化分别如图 4和图 5所示.
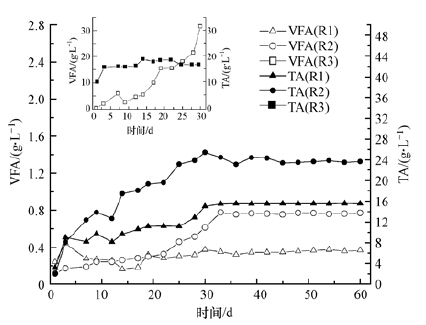 |
| 图 4 3个反应器中挥发性脂肪酸浓度(VFA)和总碱度(TA)的变化 Fig. 4 The variation of VFA and TA in three digesters |
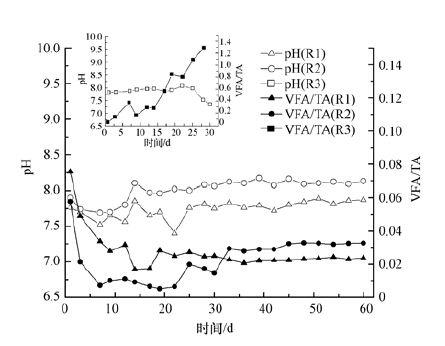 |
| 图 5 3个反应器中pH值和VFA/TA值的变化 Fig. 5 The variation of pH and VFA/TA in three digesters |
R1和R2中的VFA浓度以及TA(如图 4)在前30 d的启动阶段中持续上升,最终VFA浓度分别稳定在350 mg·L-1和760 mg·L-1,可见系统中无明显的VFA积累,而系统产气量正常,这说明系统内产甲烷菌利用挥发性脂肪酸产甲烷的过程未受到明显的抑制作用;碱度分别稳定在(15500±100)mg·L-1和(23600±200)mg·L-1,据Chen等(2008)报道,在运行稳定的有机废物中温厌氧消化系统中,碱度大都在2000~4000 mg·L-1的范围内,可见R1和R2中碱度远高于报道值,这可能是由于基质中的主要成分(蛋白质)的降解产生了大量的氨氮的缘故(氨氮对碱度的影响见反应式(2)).R1和R2中pH值和VFA/TA(如图 5)在经历了启动阶段的轻微浮动后,最终pH值分别稳定在7.5和8.1左右,在Lee等(2009)所报道的产甲烷菌产甲烷合适的pH范围(6.5~8.2)之内;VFA/TA分别稳定在0.02和0.03左右,VFA/TA是评价厌氧消化系统稳定性的重要指标,VFA浓度表征影响系统稳定性的因素而碱度表征系统的缓冲能力(Duan等(2012)),Switzenbaum等(1990)研究表明在传统的厌氧消化系统中VFA/TA的值低于0.3时系统稳定性良好,可见R1和R2都具有良好的稳定性.由以上分析可知,R2虽然有机负荷为R1的2倍,但二者都运行稳定,且在稳定性上没有明显的差异,这说明将蛋白负荷由(2.38±0.21)kg·m-3·d-1提高到(4.76±0.41)kg·m-3·d-1时没有明显影响系统的稳定性.
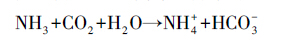
|
(2) |
但将负荷提高到R3中的(8.49±0.52)kg·m-3·d-1时,由图 4和图 5可知,由于负荷过高,R3内VFA大量积累,到第25 d时高达18200 mg·L-1,据Batstone等(2000)报道,高浓度的VFA会对系统内的微生物,尤其是产甲烷菌的新陈代谢造成毒害作用,抑制产甲烷菌利用VFA产甲烷,进而加剧VFA的累计,因此虽然系统内一直维持较高的碱度((17000±1000)mg·L-1),还是未能避免系统内pH值从第25 d开始迅速下降,VFA/TA迅速升高,与此同时系统产气性能迅速下降,至第30 d停止产气,运行失败.以上说明高蛋白负荷提高到(8.49±0.52)kg·m-3·d-1时,系统的稳定性较差,不利于系统的正常运行.
3.3 不同有机负荷下厌氧消化系统内的氨氮浓度研究表明物料中含氮有机质(大部分以蛋白质形式存在)在厌氧消化过程中会产生氨氮(TAN(NH3+ NH+4))(Kayhanian et al.,1994),游离氨(NH3)能够通过细胞膜扩散进入细胞,影响细胞质机制酶的活性,NH+4在细胞内的积累会影响细胞内的pH值,从而影响微生物细胞的新陈代谢(Sprott et al.,1986),而厌氧消化系统内中产甲烷菌对于外界因素的变化最为敏感,因此最容易受到氨氮浓度的影响(Kayhanian et al.,1994).关于氨氮在厌氧消化系统中的抑制浓度已有大量的文献报道,Van等(1979)研究表明氨氮(TAN(NH3+ NH+4))浓度在200~1500 mg·L-1时不会抑制产甲烷性能,但氨氮浓度升高到1500~3000 mg·L-1、pH值高于7.4时便会产生抑制作用;Koster等(1988)发现在污泥的厌氧消化系统中当氨氮浓度积累至4051~5734 mg·L-1时产甲烷菌会丧失56.5%的活性;Angelidaki和Ahring(1993)研究发现氨氮浓度高于4000 mg·L-1时会对牛粪的高温厌氧消化产生抑制作用;Sawayama等(2004)研究也发现氨氮浓度在4090~5550 mg·L-1时产甲烷菌会丧失50%的活性,当氨氮浓度继续升高到5880~6000 mg·L-1时产甲烷菌的活性会完全丧失.
由于本研究中厌氧消化的基质为高蛋白有机废物,因而氨抑制问题会是影响系统稳定运行的主要风险因素.R1-R3在运行过程中系统内的TAN与FAN的变化如图 6所示,由图中可知R1和R2中的TAN与FAN在前30 d的启动阶段持续积累,最终TAN分别稳定在(2500±100)mg·L-1和(5600±100)mg·L-1;同时R1和R2中FAN的浓度最终分别稳定在(180±10)mg·L-1和(700±50)mg·L-1,Duan等(2012)研究表明当FAN浓度低于300 mg·L-1时不会产生明显的抑制作用,但高于600 mg·L-1时会严重抑制高含固污泥厌氧消化的产气性能.由以上可知R1中TAN和FAN浓度皆处于正常水平,受到氨氮抑制的风险很小;而R2中的TAN和FAN均高于文献报道中明显抑制系统厌氧消化性能的浓度值,但R2中的VS降解率、产气率以及稳定性仍未受到明显的影响,即氨氮抑制现象并不明显,这表明R2中氨抑制风险在一定程度上得到了缓解或消除.有研究报道称厌氧消化系统内微生物对高浓度氨氮的适应性以及阳离子对抗作用能够提高系统对氨氮的耐受性(Chen et al.,2008).Angelidaki和Ahring(1993)研究发现经驯化阶段后厌氧消化系统对氨氮的耐受程度可以由700~1100 mg·L-1提高到3000~4000 mg·L-1,且Edström等(2003)也研究发现将高蛋白基质与餐厨垃圾进行厌氧共消化时系统在氨氮浓度高达4000~5000 mg·L-1时仍能稳定运行,因此R2中氨抑制风险的缓解或消除的原因很有可能是由于高蛋白基质厌氧消化系统的特殊性,该系统内的微生物尤其是产甲烷菌在高浓度氨氮的环境下可能受到一定程度的驯化.
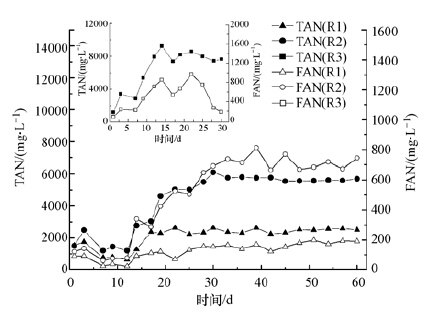 |
| 图 6 3个反应器中总氨氮(TAN)和游离氨(FAN)浓度的变化 Fig. 6 The variation of TAN and FAN in three digesters [TS)] |
R3中由于大量蛋白质的降解使系统中TAN和FAN在第14 d时便累积至9200 mg·L-1和853 mg·L-1,远高于R1和R2,此时系统内的产气性能波动,但并未呈现下降趋势.在运行第23 d后,TAN稳定在7000~8000 mg·L-1这一较高浓度,系统的产气性能急剧下降,但FAN浓度并未上升反而迅速下降.可见R3在运行过程中产气性能的变化与FAN的变化并不直接相关,而可能受到的是高浓度氨氮的影响.
3.4 R2中古菌种群密度分析为了验证2.3节中产甲烷菌可能被驯化的假设,本研究利用454高通量焦磷酸测序法对R2在不同运行阶段系统内古菌种群相对密度进行分析.表 4给出了古细菌454高通量焦磷酸测序信息,通过表 4可见,取自第1、5、10、15、20、25、30、35、40、50和60 d的这11个样品所得到的有效16S rDNA基因序列数量分别为2100、3556、4274、3357、2828、1360、3151、2612、2637、2213和5316,同时在97%的相似水平下对基因序列进行OTU聚类得到的OTU数量分别为197、197、278、382、196、191、560、330、312、363和699.
| 表 4 古菌454高通量焦磷酸测序信息 Table 4 The summary of archaeal pyrosequencing results |
经分类学分析,R2中古菌种群密度在属(genus)的水平上的分布比例随时间的变化如图 7所示,可见R2中在属(genus)水平上主要存在的古菌菌种为甲烷八叠球菌属(Methanosarcina)和甲烷囊菌属(Methanoculleus)(共占90%以上),还有少量的其他菌种如甲烷丝状菌属(Methanosaeta)、甲烷杆菌属(Methanobacterium)以及vadinCA11.甲烷八叠球菌属(Methanosarcina)生长速率高,相比于其他产甲烷菌能够抵御由pH值变化等带来的系统条件突变(Conklin et al.,2006),而且甲烷八叠球菌属(Methanosarcina)除了能利用乙酸产甲烷,是乙酸利用型产甲烷菌以外,同时还能够利用H2和CO2产甲烷(Cole et al.,2013).因此,甲烷八叠球菌属(Methanosarcina)为主要优势菌群时的厌氧消化系统能在很大程度上保证比较稳定的产气性能(Boucias et al.,2013).甲烷囊菌属(Methanoculleus)能够利用H2加CO2,或者甲酸盐作为碳源产甲烷,是典型的氢利用型产甲烷菌.从图 7可以看出,R2内甲烷八叠球菌属(Methanosarcina)为主要优势菌群,在整个厌氧消化过程中相对密度都在60%以上,这保障了该系统在高氨氮浓度下稳定的产气性能;同时R2内的古菌种群在系统运行过程中呈现出了明显的驯化过程,即甲烷八叠球菌属(Methanosarcina)的相对密度呈波动式下降,在1个SRT内由88.1%下降至62.4%,并在反应器运行后期(50~60 d)保持相对稳定的状态;而甲烷囊菌属(Methanoculleus)的相对密度则呈波动式上升,经1个SRT后由6.7%上升至29.1%,并且两个菌属的相对密度在反应器运行的后期(50~60 d)也呈现稳定状态.该驯化过程与Dai等(2015)的研究中高蛋白有机物厌氧消化系统内产甲烷菌种群密度的变化趋势类似,即甲烷囊菌属(Methanoculleus)对氨氮耐受性相对较强,其相对密度逐渐增大,而其他乙酸利用型产甲烷菌的种群相对密度逐渐减小,且由于氢利用型产甲烷菌的产甲烷效率不如乙酸利用型产甲烷菌,两个系统都呈现出稳定阶段的产气性能略低于启动阶段的现象,由此可推断高蛋白有机物厌氧消化系统之间产甲烷菌种群的驯化过程可能提高了系统对氨氮的耐受性.综上可知,虽然本研究中R2系统内的环境(高蛋白和高氨氮)不利于甲烷八叠球菌属(Methanosarcina)的新陈代谢,但是甲烷八叠球菌属(Methanosarcina)所呈现的系统内的优势地位,以及整个甲烷菌种群的驯化过程,可能是系统内氨抑制风险得到缓解或消除的原因.
 |
| 图 7 R2中古菌种群密度的变化 Fig. 7 Taxonomic composition of archeae for the sequencesretrieved from digestate taken in R2 |
1) 高蛋白有机废弃物(如动物尸体等)作为厌氧消化的主要基质时,在有机负荷为(4.76±0.41)kg·m-3·d-1的条件下系统能够稳定运行,VS降解率、单位体积沼气产率、单位添加VS沼气产率、单位降解VS沼气产率以及甲烷含量分别能达到95%、(3.72±0.21)L·L-1·d-1、(0.78±0.02)m3·kg-1 VSadded、(0.82±0.02)m3·kg-1 VSreduced以及65%.
2) 本研究中厌氧消化系统内TAN和FAN的浓度与系统产气性能并不直接相关,且在浓度分别为5700 mg·L-1和700 mg·L-1时系统厌氧消化性能并未受到明显影响.在适宜的有机负荷条件下,氨抑制问题在一定程度上的得到缓解或消除的主要原因可能为系统内甲烷八叠球菌属(Methanosarcina)优势地位的稳定,甲烷囊菌属(Methanoculleus)这一氨氮耐受性相对较强的种属相对密度的提高,以及产甲烷菌种群在系统运行过程中得到的明显驯化.
| [1] | Ahring B K. 2003. Biomethanation I[M]. Springer Science&Business Media . |
| [2] | Angelidaki I, Ahring B K. 1993.Thermophilic anaerobic digestion of livestock waste: the effect of ammonia[J]. Applied Microbiology and biotechnology, 38 (4): 560–564. |
| [3] | Angelidaki I, Sanders W. 2004.Assessment of the anaerobic biodegradability of macropollutants[J]. Re/Views in Environmental Science&Bio/Technology, 3 (2): 117–129. |
| [4] | Ariesyady H D, Ito T, Okabe S. 2007.Functional bacterial and archaeal community structures of major trophic groups in a full-scale anaerobic sludge digester[J]. Water Research, 41 (7): 1554–1568. |
| [5] | Batstone D J, Keller J, Newell R B, et al. 2000.Modelling anaerobic degradation of complex wastewater. I: model development[[J]. Bioresource Technology, 75 (1): 67–74. |
| [6] | Benbelkacem H, Bollon J, Bayard R, et al. 2015.Towards optimization of the total solid content in high-solid (dry) municipal solid waste digestion[J]. Chemical Engineering Journal, 273 : 261–267. |
| [7] | Boucias, Cai Y, Sun Y, et al. 2013.The hindgut lumen prokaryotic microbiota of the termite Reticulitermes flavipes and its responses to dietary lignocellulose composition[J]. Molecular Ecology, 22 (7): 1836–1853. |
| [8] | Chen Y. 2008.Inhibition of anaerobic digestion process: a review[J]. Bioresour Technol, 99 (10): 4044–4064. |
| [9] | Cho S K, Im W T, Kim D H, et al. 2013.Dry anaerobic digestion of food waste under mesophilic conditions: performance and methanogenic community analysis[J]. Bioresource Technology, 131 : 210–217. |
| [10] | Cole J R, Wang Q, Fish J A, et al. 2013.Ribosomal Database Project: data and tools for high throughput rRNA analysis[J]. Nucleic acids research, : gkt1244. |
| [11] | Conklin A, Stensel H D, Ferguson J. 2006.Growth kinetics and competition between Methanosarcina and Methanosaeta in mesophilic anaerobic digestion[J]. Water Environment Research, : 486–496. |
| [12] | Coté C, Massé D I, Quessy S. 2006.Reduction of indicator and pathogenic microorganisms by psychrophilic anaerobic digestion in swine slurries[J]. Bioresource Technology, 97 (4): 686–691. |
| [13] | Dai X, Chen S, Xue Y, et al. 2015.Hygienic treatment and energy recovery of dead animals by high solid co-digestion with vinasse under mesophilic condition: feasibility study[J]. Journal of Hazardous Materials, 297 : 320–328. |
| [14] | Duan N, Dong B, Wu B, et al. 2012.High-solid anaerobic digestion of sewage sludge under mesophilic conditions: feasibility study[J]. Bioresource Technology, 104 : 150–156. |
| [15] | Edström M, Nordberg Å, Thyselius L. 2003.Anaerobic treatment of animal byproducts from slaughterhouses at laboratory and pilot scale[J]. Applied biochemistry and Biotechnology, 109 (1-3): 127–138. |
| [16] | Federation W E, American Public Health Association. 2005.Standard methods for the examination of water and wastewater[S]. Washington, DC, USA:American Public Health Association (APHA) |
| [17] | González C R N, Björklund E, Forteza R, et al. 2012.Volatile organic compounds in landfill odorant emissions on the island of Mallorca[J]. International Journal of Environmental Analytical Chemistry, 93 (4): 434–449. |
| [18] | Kayhanian M. 1994.Performance of a high-solids anaerobic digestion process under various ammonia concentrations[J]. Journal of Chemical Technology and Biotechnology, 59 (4): 349–352. |
| [19] | Koch K. 2015.Calculating the degree of degradation of the volatile solids in continuously operated bioreactors[J]. Biomass and Bioenergy, 74 : 79–83. |
| [20] | Koster I W, Lettinga G. 1988.Anaerobic digestion at extreme ammonia concentrations[J]. Biological Wastes, 25 (1): 51–59. |
| [21] | Kovács E, Wirth R, Maróti G, et al. 2015.Augmented biogas production from protein-rich substrates and associated metagenomic changes[J]. Bioresource Technology, 178 : 254–261. |
| [22] | Lee M J, Song J H, Hwang S J. 2009.Effects of acid pre-treatment on bio-hydrogen production and microbial communities during dark fermentation[J]. Bioresource Technology, 100 (3): 1491–1493. |
| [23] | 卢珍兰.2015.浅谈病死动物生物发酵无害化处理技术[J].农村百事通, (2):52–53. |
| [24] | Pilli S, Bhunia P, Yan S, et al. 2011.Ultrasonic pretreatment of sludge: a review[J]. Ultrasonics Sonochemistry, 18 (1): 1–18. |
| [25] | 浦华, 白裕兵.2014.我国病死动物无害化处理与发展对策[J].生态经济, 30 (5):135–137. |
| [26] | Renou S, Givaudan J G, Poulain S, et al. 2008.Landfill leachate treatment: Review and opportunity[J]. Journal of Hazardous Materials, 150 (3): 468–493. |
| [27] | Sawayama S, Tada C, Tsukahara K, et al. 2004.Effect of ammonium addition on methanogenic community in a fluidized bed anaerobic digestion[J]. Journal of Bioscience and Bioengineering, 97 (1): 65–70. |
| [28] | Siles J A, Brekelmans J, Martín M A, et al. 2010.Impact of ammonia and sulphate concentration on thermophilic anaerobic digestion[J]. Bioresource Technology, 101 (23): 9040–9048. |
| [29] | Sprott G D, Patel G B. 1986.Ammonia toxicity in pure cultures of methanogenic bacteria[J]. Systematic and Applied Microbiology, 7 (2): 358–363. |
| [30] | Switzenbaum M S, Giraldo-Gomez E, Hickey R F. 1990.Monitoring of the anaerobic methane fermentation process[J]. Enzyme and Microbial Technology, 12 (10): 722–730. |
| [31] | Van Velsen A F M. 1979.Adaptation of methanogenic sludge to high ammonia-nitrogen concentrations[J]. Water Research, 13 (10): 995–999. |
| [32] | 续彦龙, 王丽丽, 龚改林, 等.2015.堆肥法无害化处理染疫动物尸体的研究进展[J].畜牧与兽医, (4):138–141. |
 2016, Vol. 36
2016, Vol. 36


