2. 西北农林科技大学生命科学学院, 杨凌 712100;
3. 农业部西北植物营养与农业环境重点实验室, 杨凌 712100
2. College of Life Sciences Northwest A&F University, Yangling 712100;
3. Key Laboratory of Plant Nutrition and the Agri-environment in Northwest China, Ministry of Agriculture, Yangling 712100
镉(Cd)是广泛存在自然界且没有任何生物学功能的重金属元素,被认为是环境污染中最危险元素之一(Vig et al.,2003 ,其主要随污灌、采矿、冶炼等活动进入环境,影响水体和土壤质量,并通过食物链威胁人畜健康(Luo et al.,2009Karace et al.,2010 .据统计2006年我国镉污染耕地面积约2 万hm2,每年生产的镉超标农产品1.46×109 kg;2014年全国土壤污染调查公报显示土壤污染总超标率16.1%,其中Cd严重污染点位超标率达7%(环境保护部和国土资源部,2014).可见Cd已成为我国农田土壤污染的主要重金属之一.镉污染不仅会使土壤微生物生物量减少,而且还会引起微生物群落的结构和功能甚至遗传多样性发生改变(Giller et al.,1998Gans et al.,2005 .硝化作用是土壤中主要的生物化学过程,其由两种化能自养细菌作用,先后将NH4+-N氧化为NO2--N和NO3--N,在全球N循环中占据重要地位.因此有必要探讨Cd对农田土壤硝化活性的影响.
国内外学者先后对铜、镍、锌、汞和银污染的土壤硝化活性进行了研究,发现硝化活性可较好指示土壤污染的程度(Smolders et al.,2004Oorts et al.,2006Broos et al.,2007Liu et al.,2010 Langdon et al.,2014孙晋伟等,2008;林蕾等,2012),并揭示出土壤pH、粘粒含量、有机碳含量和阳离子交换量是影响二者关系的主要因素.但针对Cd污染土壤,Smolders发现外源2 mg·kg-1 Cd时农田土壤硝化活性降低14%(Smolders et al.,2001) ,而Dušek却认为10 mg·kg-1 Cd导致土壤硝化活性增高(Dušek,1995),可见硝化活性对土壤Cd污染响应并不一致.现有研究多是采用某一地区土壤完成,应用很难有普遍性;加之我国地域辽阔,土壤类型丰富,土壤性质差异较大,因此亟需开展我国主要类型土壤上Cd的土壤硝化活性效应研究,以便更好服务国家环境保护事业.本文选取我国10种类型的12个土样,采用模拟方法,探讨Cd污染后土壤硝化活性的变化规律,并揭示影响二者关系的主要控制因素,最终为土壤污染评估及调控提供重要依据
2 材料与方法(Materials and methods) 2.1 供试土壤采自我国12个省份的典型类型、未污染农田土壤.采样时先去除0~5 cm表层后,采集5~20 cm土壤,风干,过1 mm尼龙筛备用.常规方法测定土壤基本理化性质(鲁如坤,2000),HCl-HNO3-HF-HClO4高温高压密闭消解法、ICP-MS(X-7,Thermo-Elemental,USA)测定土壤Cd背景值,同时采用国家标准土壤(酸性砖红壤和碱性黄土)为Cd的质控样.结果见表 1.
| 表 1 供试土壤基本理化性质 Table 1 Physico-chemical properties of soils |
调节风干土样水分至最大饱和持水量的60%,在25 ℃活化14 d后,称取5.00 g鲜土,分别加入不同浓度的 Cd2+(3(CdSO4)·8H2O)溶液,使土壤最终Cd含量分别为0、0.6、5、25、50、100、200、300、500 mg·kg-1干土,混匀并稳定30 min后,加入0.1 mL 1.5 mol·L-1 NaClO3和20 mL 1 mmol·L-1(NH4)2SO4溶液,25 ℃培养8 h后,添加5 mL 2 mol·L-1 KCl溶液振荡,滤液采用对氨基苯磺酰胺比色法测定NO2-含量,计算硝化活性(Kurola et al.,2005 .每处理重复3次,并设无底物、无土壤处理作对照.
2.3 数据分析及统计 2.3.1 逻辑斯蒂克分布模型(Log-logistic distribution)(Doelman and Haanstra,1986 ):
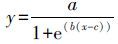
|
(1) |
(Full inhibition model)(Speir et al.,1995) :
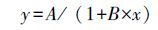
|
式中,y 为硝化活性,x 为土壤Cd含量(mg·kg-1),a(A)为污染物浓度为0 mg·kg-1的土壤硝化活性理论值,b为剂量-效应曲线斜率,B 为一定底物浓度下受到抑制常数Ki、最大反应速度Vmax和米氏常数Km及抑制类型等共同作用下形成的复合参数,c 为生态剂量(Ecological dose,ED)以10 为底的对数值.
通过拟合曲线来计算出土壤硝化活性的生态剂量(Ecological dose)ED25、ED50值(其分别代表处理硝化活性是未污染土壤硝化活性变幅为25%、50% 时土壤Cd浓度).方程拟合及多重比较等采用SPSS18.0软件完成的.
3 结果和讨论(Results and discussion) 3.1 供试土壤硝化活性变化对照处理土壤硝化活性结果见图 1,可看出土壤的硝化活性变化较大,且大多数达到了显著差异,其值为35~258 μg·kg-1·h-1,其中滨海盐土、褐土和塿土硝化活性最高,分别达258、251和246 μg·kg-1·h-1,而灌淤土和红壤的较低,仅34.49和39.29 μg·kg-1·h-1,最大相差达7.48倍.表明土壤类型和性质等对硝化活性影响较大.
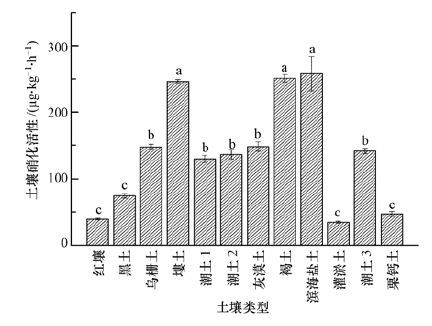 |
| 图 1 供试土壤的硝化活性 Fig. 1 Soil nitrification activities |
不同类型土壤硝化活性存在较大的差异,这主要是由于供试土壤分属于10种类型,理化性质差异较大,如有机质、粘粒、阳离子交换量的最大变幅分别为5.57、6.05、3.83 倍,从而导致土壤微生物数量变化较大.在本研究中土壤pH范围在6.8到8.2 之间时,土壤硝化活性相对高于其他土壤.有研究表明土壤pH为4.6~5.1时硝化作用不明显,当pH为5.8~6.0 时土壤硝化作用缓慢进行,而pH为6.4~8.3时硝化作用最强烈(Katyal et al.,1988 ;而且土壤硝化活性与土壤pH 存在显著正相关(Dancer et al.,1973;Smolders et al.,2001) .主要是因为土壤中NH3的有效性随pH降低呈指数下降,从而减少氨氧化细菌或古菌对底物的利用(Nicole et al.,2008).但在本研究中土壤硝化活性与pH并未达到显著相关,仅与土壤硝态氮含量(r=0.607,p﹤0.05) 呈显著相关,这可能是由于供试土壤pH分布不均匀,多数集中在8.0左右的缘故.此外除土壤pH外,无定形铁、碳酸钙、CEC、矿质氮、全磷和氯离子等都会影响到土壤硝化作用的强弱(Megda et al.,2014张树兰等,2000;鲍俊丹等,2009;孙波等,2009).故研究硝化活性与重金属关系时,必须考虑土壤性质对硝化活性的直接影响.
3.2 Cd对土壤硝化活性的影响从不同Cd浓度下土壤硝化活性结果(图 2)可看出,(1) Cd加入后,不同类型土壤的硝化活性变化大相径庭,如乌栅土硝化活性增加,在500 mg·kg-1 Cd时增幅达130%;黑土呈波动性变化,幅度为-12.29%~14.69%,其余土样则降低.可能是由于乌栅土和黑土的有机碳、粘粒含量及阳离子交换量较高(表 1),从而降低了Cd的有效性(Tan et al., 2014) . (2) 随镉浓度增加,除乌栅土和黑土外,潮土2和滨海盐土硝化活性则呈现为低剂量升高,高剂量抑制的变化;其中当Cd浓度增加至100 mg·kg-1后,土壤硝化活性急剧降低;特别是Cd浓度达到200和500 mg·kg-1时,潮土1、灌淤土和粟钙土的硝化活性均降至0 μg·kg-1·h-1.表明高浓度的Cd强烈地抑制大多数土壤的硝化活性. (3) 在国家土壤质量的二级污染标准浓度(0.6 mg·kg-1)时,除潮土1硝化活性降低48.55%外,其余土壤硝化活性变化较小,变幅-12.29%~15.26%,且均未达显著水平差异.揭示出土壤硝化活性对二级污染标准浓度响应不灵敏,从侧面反映出我国标准制定的严格性.由于黑土和乌栅土硝化活性并未受到外源Cd的抑制,因此这两种土壤不参与剂量-效应关系的模型拟合.
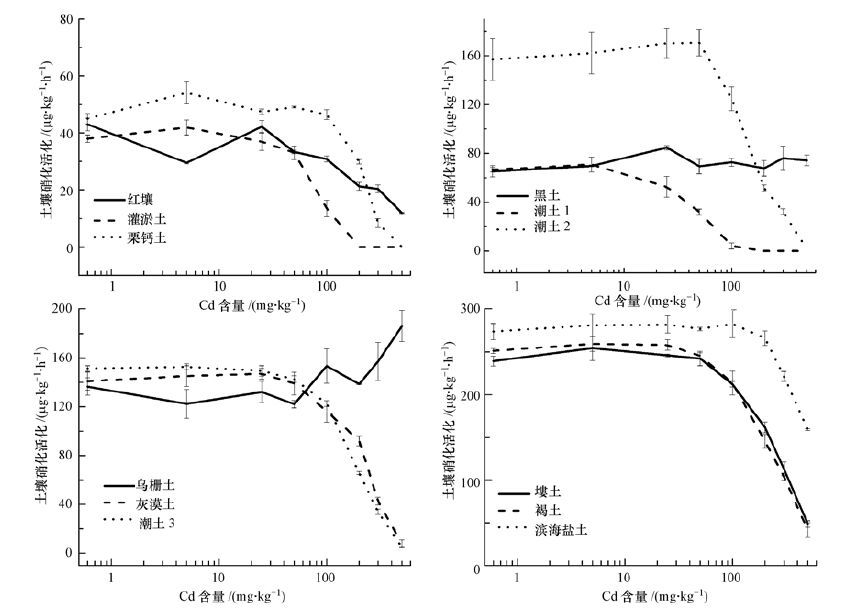 |
| 图 2 Cd对土壤硝化活性剂量-效应曲线 Fig. 2 Dose-response curves between Cd contents and soil nitrification activities |
其余土壤采用Logistic和完全抑制模型进行拟合,结果见表 2、3,反映出:①拟合方程均达极显著水平,揭示土壤硝化活性在一定范围内可表征土壤Cd污染程度,可作为土壤Cd污染的监测辅助指标;②完全抑制模型结果揭示出Cd与土壤硝化活性之间存在一种完全竞争(包括竞争性抑制和非竞争性抑制)作用机理;③土壤Cd的生态剂量ED差异较大,其中Logistics模型获得的ED25为2.44~363.03 mg·kg-1、ED50为10.99~553.64 mg·kg-1;完全抑制模型计算的生态剂量值ED25为5.58~335.35 mg·kg-1、ED50为16.73~1006.04 mg·kg-1;可见一方面不同模型获得的生态剂量值存在差异,另一方面不同土壤的ED值差异较大,如Logistics计算出的ED25和ED50最大(滨海盐土)和最小值(盐土1) 分别相差149和50倍.④根据ED值越小,反应越敏感的原则,从土壤硝化活性角度获得我国土壤轻度Cd污染的临界浓度为2.44 mg·kg-1,高于国家土壤质量中的二级污染标准.
| 表 2 Logistic模型参数和Cd生态剂量值 Table 2 Parameters of Logistic equation and Cd ecological dose |
| 表 3 完全抑制模型参数和Cd生态剂量值 Table 3 Parameters of full inhibition model and Cd ecological dose |
由于Logistic模型的显著水平更高、更符合实际,故在筛选二者关系主控因素时,采用Logistic模型的生态剂量来完成多元逐步回归拟合.由Cd 生态剂量与土壤性质间回归结果(表 4)可知,土壤有机碳(TOC)含量控制ED25变异的79.1%.土壤CEC控制ED50变异的80.4%.当引入第二个因子土壤pH到ED50值回归模型后,模型预测的准确性进一步提高,两因子的变化共同解释了回归模型变异的95.6%,所以影响Cd的ED50值的主要因素是CEC和pH.
| 表 4 基于土壤主控因子和生态剂量的简单和多元逐步回归方程 Table 4 Simple and multiple regression for ecological dose and soil properties |
将从方程3(表 4)获得的土壤ED50预测值与实测值进行比较,发现二者呈极显著正相关(r=0.749**,p<0.01,n=10) ;但是由于红壤ED50预测值与实测值相差770倍,表明Cd对红壤土壤硝化活性的生态剂量值不宜采用方程3来预测.在排除红壤后,实测和预测值间也达极显著相关(r=0.883**,p﹤0.01,n=9) ,且相关系数更高.线性回归图(图 3)显示全量Cd预测值和实测值中8个土壤处于95% 置信区间,1个位于95% 置信区间之外.因此利用土壤CEC含量和pH通过方程3能很好地预测土壤(pH在6.82以上)外源Cd对硝化活性生态剂量及污染临界值.
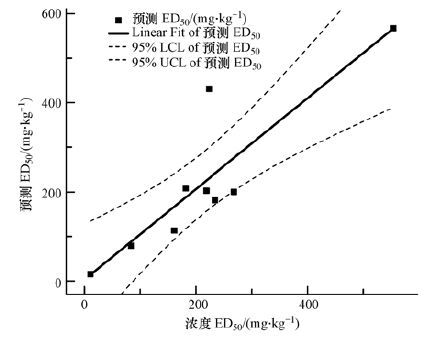 |
| 图 3 测定的硝化活性生态剂量和预测的生态剂量之间的相关性(全量Cd) Fig. 3 Relationship between measured and predicted ecological doses to potential nitrification activities(Total Cd) |
供试土壤硝化活性对Cd的响应并不一致.低剂量Cd可抑制潮土1的硝化活性,但对黑土硝化活性影响不显著,而促进了乌栅土硝化活性.重金属在土壤中的环境行为(吸附和解吸过程)是受到土壤pH、有机碳、粘粒、CEC和Eh等性质影响,进而影响重金属在土壤中赋存形态和毒性(Giller et al.,2009 .由土壤理化性质可知(表 1),相比其他类型土壤,乌栅土和黑土有机碳、粘粒含量以及阳离子交换量均较高;而潮土1和灌淤土的有机碳、粘粒含量以及阳离子交换量均偏低;另外通过对污染土壤中水溶态Cd的研究表明,潮土1和灌淤土中水溶态Cd浓度均高于乌栅土和黑土,这导致Cd在土壤中呈现出不同的生物毒性(Tan et al.,2014).其他的研究中也获得类似的结果,如基于土壤微生物还原Fe(Ⅲ)过程测定Cd毒性,得出ED10在5~95 mg·kg-1之间(Welp and Brümmer,1997),Cd对土壤芳基硫酸酯酶活性的ED10为3.4~28.1 mg·kg-1(Haanstra and Doelman,1991).表明不同种类的土壤具有不一样的生态剂量值,揭示出土壤性质是影响Cd生物毒性的重要因素.为此本文对理化性质的影响进行了定量化分析,多元回归分析表明土壤CEC和pH是控制Cd对硝化活性毒性的主要因子,其在一定程度上解释95.6%的变异信息,可用来预测不同类型和性质土壤中Cd对硝化活性的毒性阈值(图 3).
另一方面Cd对土壤硝化活性、芳基硫酸酯酶活性、微生物还原Fe(Ⅲ)活性的Cd的 ED10(2.44、3.4和5 mg·kg-1)值均大于国家土壤质量标准中的二级污染标准(0.6 mg·kg-1).Vig等(2003) 认为Cd通常在较高的浓度才会对微生物生物量、硝化活性等微生物学指标产生抑制效应.因为微生物普遍具有3种抗Cd的转运蛋白(P-type ATPase、CBA transporters和CDF family transporters)从而抵御环境中Cd的胁迫(Saluja et al.,2011 ,且不同土壤微生物群落对重金属的抗性也不同(Smolders et al.,2001 .本研究主要关注Cd对土壤硝化活性的急性毒性.然而,重金属进入土壤后,其有效性随时间而发生改变;同时微生物群落对重金属都具有一定的抵抗力和恢复力,短时间内的一些抑制现象可能随着时间的延长而消失.因此,有必要对Cd老化过程中土壤硝化活性的响应方式做进一步的研究
4 结论(Conclusions)综上所述我国不同类型土壤的硝化活性差异较大,且土壤硝化活性对外源Cd的响应不一,这主要是由于土壤性质差异所导致的;剂量-效应关系可用Logistic和完全抑制模型很好的拟合,揭示出在一定程度上可表征我国主要类型土壤上的Cd污染程度,Cd对硝化活性的作用机理为完全抑制(包括竞争性抑制和非竞争性抑制)作用.不同土壤的性质对Cd的生态剂量值具有显著的影响,基于土壤主要性质中的CEC含量和pH这两个因子的回归方程能很好地预测土壤中外源Cd对硝化活性的抑制作用.从土壤硝化活性得到我国主要类型土壤Cd污染临界值为2.44 mg·kg-1.
| [1] | 鲍俊丹, 张妹婷, 吴雄平, 等.2009.13 种土壤硝化过程中亚硝态氮的累积与土壤性质的关系[J].农业环境科学学报, 28 (9):1952–1958. |
| [2] | Broos K, Warne M S J, Heemsbergen D A, et al. 2007.Soil factors controlling the toxicity of copper and zinc to microbial processes in australian soils[J]. Environmental Toxicology and Chemistry, 26 (4): 583–590. |
| [3] | Dancer W, Peterson L, Chesters G. 1973.Ammonification and nitrification of N as influenced by soil pH and previous N treatments[J]. Soil Science Society of America Journal, 37 (1): 67–69. |
| [4] | Doelman P, Haanstra L. 1986.Short-and long-term effects of heavy metals on urease activity in soils[J]. Biology and Fertility of Soils, 2 (4): 213–218. |
| [5] | Dušek L. 1995.The effect of cadmium on the activity of nitrifying populations in two different grassland soils[J]. Plant and Soil, 177 (1): 43–53. |
| [6] | Gans J, Wolinsky M, Dunbar J. 2005.Computational improvements reveal great bacterial diversity and high metal toxicity in soil[J]. Science, 309 (5739): 1387–1390. |
| [7] | Giller K E, Witter E, Mcgrath S P. 1998.Toxicity of heavy metals to microorganisms and microbial processes in agricultural soils: A review[J]. Soil Biology and Biochemistry, 30 (10): 1389–1414. |
| [8] | Giller K E, Witter E, McGrath S P. 2009.Heavy metals and soil microbes[J]. Soil Biology and Biochemistry, 41 (10): 2031–2037. |
| [9] | Haanstra L, Doelman P. 1991.An ecological dose-response model approach to short- and long-term effects of heavy metals on arylsulphatase activity in soil[J]. Biology and Fertility of Soils, 11 (1): 18–23. |
| [10] | 环境保护部,国土资源部. 2014.全国土壤污染调查公报[R]. http://www.zhb.gov.cn/gkml/hbb/qt/201404/t20140417_270670.htm |
| [11] | Karaca A, Cetin S C, Turgay O C, et al. 2010. Effects of heavy metals on soil enzyme activities//Sherameti, I, Varma A. Soil heavy metals [M]. Berlin Heidelberg: Springer. 237-262 |
| [12] | Katyal J, Carter M, Vlek P. 1988.Nitrification activity in submerged soils and its relation to denitrification loss[J]. Biology and Fertility of Soils, 7 (1): 16–22. |
| [13] | Kurola J, Salkinoja-Salonen M, Aarnio T, et al. 2005.Activity, diversity and population size of ammonia-oxidising bacteria in oil-contaminated landfarming soil[J]. FEMS microbiology letters, 250 (1): 33–38. |
| [14] | Langdon K A, McLaughlin M J, Kirby J K, et al. 2014.The effect of soil properties on the toxicity of silver to the soil nitrification process[J]. Environmental Toxicology and Chemistry, 33 (5): 1170–1178. |
| [15] | Liu Y R, Zheng Y M, Shen J P, et al. 2010.Effects of mercury on the activity and community composition of soil ammonia oxidizers[J]. Environmental Science and Pollution Research, 17 : 1237–1244. |
| [16] | 林蕾, 刘继芳, 陈世宝, 等.2012.基质诱导硝化测定的土壤中锌的毒性阈值,主控因子及预测模型研究[J].生态毒理学报, 7 (6):657–663. |
| [17] | Luo L, Ma Y, Zhang S, et al. 2009.An inventory of trace element inputs to agricultural soils in china[J]. Journal of Environmental Management, 90 (8): 2524–2530. |
| [18] | Megda M X V, Mariano E, Leite J M, et al. 2014.Chloride ion as nitrification inhibitor and its biocidal potential in soils[J]. Soil Biology and Biochemistry, 72 : 84–87. |
| [19] | Nicol G. W, Leininger S, Schleper C, et al. 2008.The influence of soil pH on the diversity, abundance and transcriptional activity of ammonia oxidizing archaea and bacteria[J]. Environmental Microbiology, 10 (11): 2966–2978. |
| [20] | Oorts K, Ghesquiere U, Swinnen K, et al. 2006.Soil properties affecting the toxicity of CuCl2 and NiCl2 for soil microbial processes in freshly spiked soils[J]. Environmental Toxicology and Chemistry, 25 (3): 836–844. |
| [21] | 鲁如坤. 2000. 土壤农化分析[M]. 北京: 中国农业出版社 . |
| [22] | Saluja B, Gupta A, Goel R. 2011. Microbial Management of Cadmium and Arsenic Metal Contaminants in Soil// Khan M S, Zaidi A, Goel R, Musarrat J. Biomanagement of Metal-Contaminated Soils [M]. Springer Netherlands: Dordrecht. 257-275 |
| [23] | Smolders E, Brans K, Coppens F, et al. 2001.Potential nitrification rate as a tool for screening toxicity in metal-contaminated soils[J]. Environmental Toxicology and Chemistry, 20 (11): 2469–2474. |
| [24] | Smolders E, Buekers J, Oliver I, et al. 2004.Soil properties affecting toxicity of zinc to soil microbial properties in laboratory-spiked and field-contaminated soils[J]. Environmental Toxicology and Chemistry, 23 (11): 2633–2640. |
| [25] | 孙波, 郑宪清, 胡锋, 等.2009.水热条件与土壤性质对农田土壤硝化作用的影响[J].环境科学, 30 (1):206–213. |
| [26] | 孙晋伟, 黄益宗, 招礼军, 等.2008.Cu 对我国 17 种典型土壤硝化速率的影响[J].生态毒理学报, 3 (5):513–520. |
| [27] | Speir T W, Kettles H, Parshotam A, et al. 1995.A simple kinetic approach to derive the ecological dose value, ED50, for the assessment of Cr (vi) toxicity to soil biological properties[J]. Soil Biology and Biochemistry, 27 (6): 801–810. |
| [28] | Tan X, Kong L, Yan H, et al. 2014.Influence of soil factors on the soil enzyme inhibition by Cd[J]. Acta Agriculturae Scandinavica, Section B - Soil & Plant Science, 64 (8): 666–674. |
| [29] | Vig K, Megharaj M, Sethunathan N, et al. 2003.Bioavailability and toxicity of cadmium to microorganisms and their activities in soil: A review[J]. Advances in Environmental Research, 8 (1): 121–135. |
| [30] | Welp G, Brümmer G W. 1997.Microbial toxicity of Cd and Hg in different soils related to total and water-soluble contents[J]. Ecotoxicology and Environmental Safety, 38 (3): 200–204. |
| [31] | 张树兰, 杨学云, 吕殿青, 等.2000.几种土壤剖面的硝化作用及其动力学特征[J].土壤学报, 37 (3):372–379. |
 2016, Vol. 36
2016, Vol. 36


