2. 淡水水产健康养殖湖北省协同创新中心, 武汉 430070;
3. 池塘健康养殖湖北省工程实验室, 武汉 430070
2. Freshwater Aquaculture Collaborative Innovation Center of Hubei Province, Wuhan 430070;
3. Hubei Provincial Engineering Laboratory for Pond Aquaculture, Wuhan 430070
硝化作用作为全球氮循环中的关键环节,由氨氧化作用和亚硝化作用两个过程组成(董莲华等,2008).其中氨氧化过程被认为是硝化作用的限速步骤,也是氮循环的中心环节(贺纪正等,2009),主要由功能微生物氨氧化古菌(ammonia-oxidizing archaea,AOA)和氨氧化细菌(ammonia-oxidizing bacteria,AOB)所驱动.据本实验室未发表研究结果以及Lu等(2014)研究结果,池塘水体氨氧化微生物以AOB占绝对优势,AOA浓度非常低,一年四季均在检测限以下(< 20 copies·mL-1).氨氧化细菌广泛分布于自然界的土壤、淡水及海洋中,并被作为微生物生态学研究的模式生物(Kowalchuk et al.,2001;Phillips et al.,2000; Horz et al. 2004).目前关于AOB丰度与分布的报道主要见于江河、海洋、湿地以及土壤生态系统(贺纪正等,2009; Francis et al.,2005; Liu et al.,2011; Wang et al.,2011; Sim et al.,2012a; Cao et al.,2011),而对于池塘养殖水体中的氨氧化细菌研究较少.故本研究重点讨论AOB丰度季节分布及其与环境因子之间的关系.
目前池塘养殖已成为我国最主要的水产养殖方式之一(农业部渔业局,2013),养殖过程中大量使用配合饲料引起的有害氮素积累过高等环境问题日益突出.有研究表明,水产养殖系统中人工投入的氮素约有70%进入到水体等环境中(Hargreaves et al.,1998),如高攀等(2009)发现荆州地区草鱼主养池塘中以鱼体形式积累的氮占投入总氮量百分比未超过38%,Nhan等(2008)报道,越南养殖池塘中输入总氮中仅5%~6%转化为鱼生物量,其余则残留在沉积物和水体中.因此,研究AOB数量时空分布特征对了解养殖池塘的氮循环状况具有重要意义.本文采用实时荧光定量PCR(RT-PCR)技术,以功能基因amoA作为分子标记,对AOB进行定量研究,分析养殖池塘水体中不同水层AOB数量的季节变化及其与环境因子的关系,以期为池塘水质有害氮素降解和调控技术研发提供基础资料与依据.
2 材料与方法(Materials and methods) 2.1 样品来源采样地点位于湖北省荆州公安县崇湖渔场(北纬29°54′6.61″,东经112°15′56.41″),选取其中的5口草鱼池塘作为研究对象,养殖期间投喂广东海大集团股份有限公司生产的草鱼饲料(蛋白含量约为28%)与苏丹草,池塘东西走向,面积为2800 m2(70 m ×40 m),养殖期间水深平均在 1.6~1.8 m 之间,5口研究池塘均以草鱼为主养对象,套养花白鲢,放养规格及数量一致,水源与养殖管理相同.
2.2 水样采集于2014年5月14日、8 月28日和11月8日采集水样,分别代表春、夏、秋三季.每口池塘采样点共5个,位于池塘2条对角线的三等分点及对角线交叉点处.使用采水器采集表层(离水面约0.2 m)水样1 L,再将5个点的水样混合均匀,取混匀后的 500 mL水样作为池塘表层水样,底层(离底约0.4 m)水样采集使用同样的方法.样品置于冰盒中,带回实验室24 h内处理.
2.3 样品理化分析水体溶解氧浓度(DO)、温度(T)现场通过哈希多功能水质分析仪HQ30d(HACH,美国)进行测定;总磷(TP)、氨氮(NH4+-N)、总氮(TN)、亚硝态氮(NO2--N)、硝态氮(NO3--N)和总有机碳(TOC)的分析参照《水和废水监测分析方法》第4版进行.
2.4 水样DNA提取取水样50 mL,经0.22 μm混纤膜过滤,再将滤膜剪碎,参照Lu等(2012)池塘底泥核酸提取方法,提取水体总 DNA.提取的 DNA 用紫外分光光度计(NANODROP 2000c,Thermo)检测所提核酸的浓度与纯度,-20 ℃ 保存,用于后续实验.
2.5 AOB amoA基因PCR扩增AOB扩增采用amoA基因引物为amoA1F(5′GGGGTTTCTACTGGTGGT3′)和amoA2R(5′CCCCTCKGSAAAGCCTTCTTC3′)(Rotthauwe et al.,1997).PCR扩增的20 μL体系配置如下:DNA模版 1 μL,正反向引物各 0.4 μL,2×Taq PCR Master Mix(天根生化科技,北京)10 μL,ddH2O补足至20 μL.PCR反应扩增程序见文献(Lu et al.,2012).扩增产物用1%的琼脂凝胶电泳检测.
2.6 AOB的荧光定量PCRqPCR反应在Qiagen Rotor Q(Qiagen,Germany)荧光定量PCR仪上进行,选用引物参见普通 PCR 扩增.反应使用SYBR Green 为荧光染料,反应体系为:SYBR Premix Ex Taq Ⅱ(2×)10 μL;模板DNA 1 μL;正方向引物各0.4 μL;补ddH2O到20 μL.反应程序为:95 ℃ 30 s;95 ℃ 5 s,54 ℃ 35 s,72 ℃ 60 s,35个循环;72 ℃ 5 min.使用含有细菌amoA 基因的质粒系列稀释液制作标准曲线.
2.7 数据处理数据分析使用软件 SPSS21.0分析,采用单因素方差分析(One way ANOVA)比较各参数水层、季节变化的显著性,细菌丰度与环境因子的相关分析采用皮尔森(Pearson)相关系数法和主成分分析.
3 结果(Results) 3.1 池塘水体理化因子池塘同一水层主要环境因子季节之间ANOVA分析结果见图 1.DO、温度、TN、TOC表层普遍要高于底层,而NO2--N与TP则是表层低于底层.表层水中,DO夏季最低,春季与秋季差异不显著(p>0.05).温度变化幅度较大,最高温度出现在夏季,最低温度出现在秋季.NH4+-N与TN季节变化均没有显著差异(p>0.05).NO2--N最低值出现在春季,而NO3--N与TOC在春季时最高.TP最高值出现在夏季,夏季与春、秋季节差异显著(p<0.05).底层水中,DO、NH4+-N、NO2--N、TN、TP季节变化趋势与表层相同.温度最高值出现在夏季,春季与秋季差异不显著(p>0.05).NO3--N春季与夏、秋季节差异显著(p<0.05).TOC夏季与春、秋季节差异显著(p<0.05).
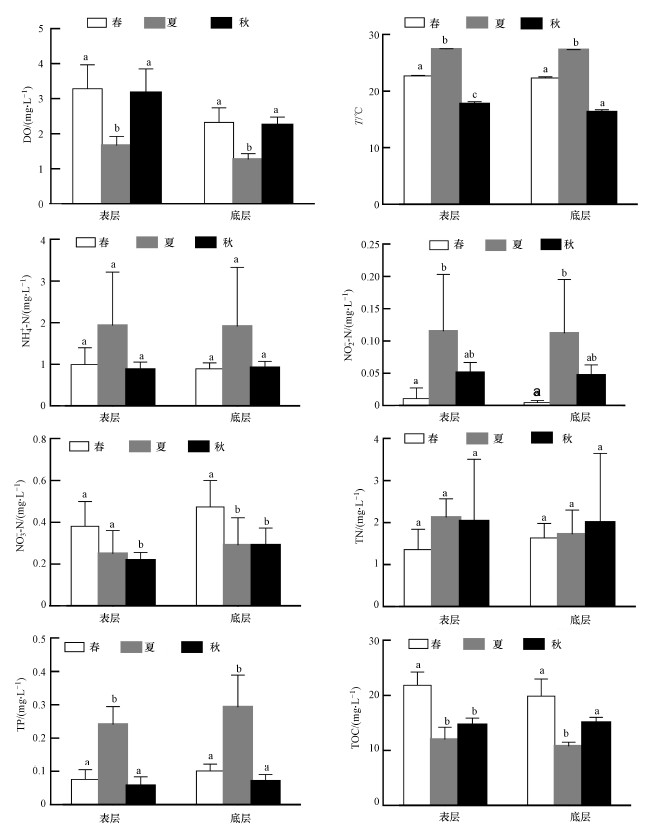 |
| 图 1 池塘同一水层不同季节理化因子均值比较(柱状图上标有相同字母表示差异不显著(p>0.05),不同字母表示差异显著(p<0.05)) Fig. 1 Comparison of environmental parameters among different seasons in the same water layer in ponds |
不同季节池塘水体AOB amoA 基因丰度检测结果如图 2所示.表层水体AOB amoA 基因拷贝数变化范围为(4.47±1.63)×103 ~(1.22±1.33)×105 copies·mL-1,最大值出现在夏季,最小值出现在春季,最大值约为最小值的27倍左右;夏季AOB amoA丰度显著高于春、秋季节(p<0.05),而春秋两季间无显著差异(p>0.05);底层水体AOB amoA 基因拷贝数变化于(1.24±0.45)×104copies·mL-1~(8.09±4.57)×104copies·mL-1,季节变化情况与表层水体相同,即夏季显著高于春、秋季节(p<0.05),春秋两季间无显著差异(p>0.05).相同季节,池塘表、底层水体AOB amoA 丰度无显著差异(p>0.05).
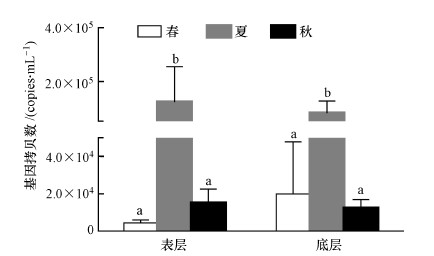 |
| 图 2 池塘水体AOB amoA丰度季节变化(柱状图上标有相同字母表示差异不显著(p>0.05),不同字母表示差异显著(p<0.05)) Fig. 2 Comparison of AOB amoA gene copies among different seasons in the same water layer in ponds |
AOB amoA 基因丰度与池塘不同水层环境因子Pearson的相关性结果见表 1.表层水中,氨氧化细菌丰度与水温(r=0.514,p=0.05)、总磷(r=0.735,p=0.002)呈显著正相关;与溶解氧(r=-0.709,p=0.003)、总有机碳(r=-0.792,p=0.000)呈显著负相关;与氨氮、亚硝氮、硝氮及总氮相关性不显著.底层水中,氨氧化细菌丰度与温度(r=0.636,p=0.011)、总磷(r=0.661,p=0.007)呈显著正相关;与溶解氧(r=-0.602,p=0.018)显著负相关;与氨氮、硝氮、亚硝氮、总氮、总有机碳相关性不显著.
| 表 1 不同水层氨氧化细菌丰度与环境因子相关系数 Table 1 Pearson correlation coefficient of AOB abundance and environmental parameters in different water layers |
为进一步了解池塘环境因子对氨氧化细菌丰度的影响,利用SPSS21.0统计软件分别对不同水层8个环境因子的特征值进行了分析.主成分分析计算表明,表、底层环境因子对氨氧化细菌丰度具有不同的影响.表、底层环境因子均被分成3个主成分.表层的第一主成分为水温、溶解氧、氨氮与总磷,第二主成分为硝态氮与总有机碳,第三主成分为总氮与亚硝态氮(表 2);底层的第一主成分为水温、溶解氧、氨氮、总磷与总有机碳,第二主成分为硝态氮与亚硝态氮,第三主成分为总氮(表 3).表、底层3个主成分的累积百分比分别为84.84%和86.73%,即对前3个主成分进行分析已经能够反映全部数据的大部分信息.
| 表 2 表层初始因子载荷矩阵及方差贡献率 Table 2 Component matrix and contribution rates of the surface layer |
| 表 3 底层初始因子载荷矩阵及方差贡献率 Table 3 Component matrix and contribution rates of the bottom layer |
目前,关于氨氧化细菌丰度调查主要集中在土壤(钟文辉等,2008)、江河沉积物(向燕等,2010;叶磊等,2011)等,池塘水体氨氧化细菌丰度调查相对较少.本次调查的池塘水体AOB丰度夏季平均为(1.02±0.96)×105 copies·mL-1,较Cébron)等(2003检测的河湾水体AOB丰度高出一个数量级,而较人工湿地低一个数量级(Sims et al.,2012b),与Lu等(2014)调查的池塘水体结果相当.池塘水体氨氧化细菌丰度表现出明显的季节性波动:夏季显著高于春、秋两季(p<0.05),而春、秋两季无显著差异(p>0.05).相关性分析结果表明表、底层水体AOB丰度均与水温呈显著正相关(p<0.05)(表 1).上述结果说明,水温在AOB丰度季节性变化中起着至关重要作用.AOB属中温生长菌,其生长适宜温度范围为 20~ 30 ℃;当温度低于 10 ℃时,AOB的生长显著减慢(Grunditz et al.,2001).
与Kumari等(2011)研究的印度养殖池塘水体AOB丰度分布结果类似,同一季节草鱼池塘表层水体与底层水体AOB丰度无显著差异(p>0.05).结果提示,对于池塘等浅水水体,因其上下水层DO、温度、有机质、氨氮浓度等环境因子差异不大,故上下水层AOB丰度差异也不大.
相关性分析结果表明,DO与草鱼池塘表、底层水体氨氧化细菌丰度均呈极显著负相关(p<0.01)(表 1).这与印度养殖池塘沉积物(Kumari et al.,2011)、美国Acton湖泊沉积物(French et al.,2012)和玄武湖沉积物(Ruan et al.,2009)研究结果不一致.这种差异可能与不同环境中AOB群落组成不同有关.我国的精养池塘,因鱼种放养量及投饲量大、耗氧因子多,池塘水体常常处于DO不足状态,促进了适应低DO环境生长的AOB种类(如,Nitrosospira分支细菌等)大量出现,故精养池塘中的氨氧化细菌更耐低DO.Wells等(2009)在研究运行于低DO(3.1~4.5 mg·L-1)环境活性污泥反应器中氨氧化微生物对环境因子响应关系时发现,DO与Nitrosospira分支细菌丰度呈显著负相关(p<0.01),也与AOB丰度呈显著负相关(p<0.01);而AOB中的Nitrosospira分支细菌广泛分布于我国精养池塘水体(陆诗敏,2014).Hanaki等(1990)发现在低DO(0.5 mg·L-1)条件下,AOB的生长量会增加.Park等(2004)也发现并非所有的氨氧化细菌在高DO下生长得更迅速,AOB中N. Europaea分支的某些种类更适应低DO环境;生长动力学显示,低DO处理的AOB富集物在高DO条件下生长速率较低,却在DO低于4.7 mg·L-1时生长迅速.这种现象与适应低DO的AOB种类对氧气具有更高的亲和力有关(Laanbroek et al.,1993;Park et al.,2002),也与低DO环境可促进某些AOB生长酶系的合成有关.王歆鹏等(1999)研究表明,DO低于0.8 mg·L-1时会对AOB的生长酶系产生促进作用.因此,在长期溶解氧不足的水体中,AOB群落组成会发生适应性改变,更耐低氧的种类将成为优势,并对此类水体的硝化作用发挥关键作用.本研究结果表明,我国精养池塘水体中AOB可能以耐低氧种类为主,能够适应低DO环境;在溶解氧不足的池塘水体中,AOB仍然驱动着氨氧化反应的进行;但其种类组成及其适应低DO机制值得深入探究.
草鱼池塘表、底层水体氨氧化细菌丰度与NH4+-N、NO2--N、NO3--N均无显著相关性(p>0.05),与Lu等(2014)的池塘水体研究结果类似.水体中NH4+-N、NO2--N、NO3--N浓度均与AOB的底物NH3浓度存在着密切关联性,因而NH4+-N、NO2--N、NO3--N等各种无机态氮素与AOB的相关性倍受研究人员关注.从已有的研究报道来看,许多环境中AOB丰度与NH4+-N、NO2--N、NO3--N均未呈现出统计意义上的显著相关性,如北京密云水库沉积物及其附近土壤氨氧化细菌丰度与NH4+-N、NO2--N相关性不显著(Wang et al.,2014);江西鹰潭红壤、江苏宿迁潮土、江苏无锡水稻土(黄泥土)3种农田土壤(袁飞等,2004)、艾比湖湿地(陈登稳等,2012)及黄河三角洲湿地(吕艳华等,2007)氨氧化细菌丰度与NH4+-N均无显著相关性.原因可能是氨氧化细菌的底物是游离态NH3而不是NH4+-N(陈登稳等,2012).NO2--N与NO3--N不仅是氨氧化细菌进行硝化作用过程中的产物,同时也是反硝化作用的底物,与反硝化作用强度密切相关.所以NO2--N与NO3--N浓度同时受硝化作用与反硝化作用的双重影响.在精养池塘富氮水体中,相比于其它限制性营养元素(如,P),AOB的底物NH3浓度是充足的,以至于其浓度波动并未影响到AOB的正常生长,故水体无机氮素浓度与AOB丰度未显现出显著的相关性.
池塘表层水体AOB丰度与TOC呈极显著负相关(p<0.01),而底层水体无显著相关性(p>0.05)(表 1).Wang等(2014)对水库沉积物中AOB丰度与多样性研究也发现,沉积物AOB丰度与TOC无显著相关性.氨氧化细菌是典型的化能无机自养细菌,水体中的TOC并不是其直接碳源或能源物质.作为异养菌的碳源,表层水体髙浓度的TOC有助于异养细菌大量生长,从而对氨氧化细菌生长产生一定的竞争性抑制作用.总之,池塘水体AOB的时空分布是诸多环境因子共同影响的结果.
| [1] | 鲍林林, 陈永娟, 王晓燕.2015.北运河沉积物中氨氧化微生物的群落特征[J].中国环境科学, 35 (1):179–189. |
| [2] | Cao H L, Hong YG, Li M, et al. 2011.Diversity and abundance of ammonia-oxidizing prokaryotes in sediments from the coastal Pearl River estuary to the South China Sea[J]. Antonie van Leeuwenhoek, 100 (4): 545–556. |
| [3] | Cébron A T, Berthe T, Garnier J. 2003.Nitrification and nitrifying bacteria in the lower Seine River and estuary (France)[J]. Applied and environmental microbiology, 69 (12): 7091–7100. |
| [4] | 陈登稳, 王孝国, 胡文革, 等.2012.艾比湖湿地氨氧化细菌数量空间分布及其与土壤环境相关性分析[J].微生物学通报, 39 (3):334–343. |
| [5] | 董莲华, 杨金水, 袁红莉.2008.氨氧化细菌的分子生态学研究进展[J].应用生态学报, 19 (6):1381–1388. |
| [6] | Francis C A, Roberts K J, Beman J M, et al. 2005.Ubiquity and diversity of ammonia-oxidizing archaea in water layers and sediments of the ocean[J]. Proceedings of the National Academy of Sciences of the United States of America, 102 (41): 14683–14688. |
| [7] | French E, Kozlowski J A, Mukherjee M, et al. 2012.Ecophysiological characterization of ammonia-oxidizing archaea and bacteria from freshwater[J]. Applied and Environmental Microbiology, 78 (16): 773–5780. |
| [8] | 高攀, 蒋明, 赵江宇, 等.2009.主养草鱼池塘水质指标的变化规律和氮磷收支[J].云南农业大学学报, 24 (1):71–77. |
| [9] | Grunditz C, Dalhammar G. 2001.Development of nitrification inhibition assays using pure cultures of Nitrosomonas and Nitrobacter[J]. Water Research, 35 (2): 433–440. |
| [10] | Hanaki K, Wantawin C, Ohgaki S. 1990.Nitrification at low levels of dissolved oxygen and without organic loading suspended-growth reactor[J]. Water Research, 24 (3): 297–302. |
| [11] | Hargreaves J A. 1998.Nitrogen biogeochemistry of aquaculture ponds[J]. Aquaculture, 166 (3): 181–212. |
| [12] | 贺纪正, 张丽梅.2009.氨氧化微生物生态学与氮循环研究进展[J].生态学报, 29 (1):406–415. |
| [13] | Horz H P, Barbrook A, Filed C B, et al. 2004.Ammonia-oxidizing bacteria respond to multifactorial global change[J]. Proceedings of the National Academy of Sciences of the United States of America, 101 (42): 15136–15141. |
| [14] | Kowalchuk G A, Stephen J R. 2001.Ammonia-oxidizing bacteria:a model for molecular microbial ecology[J]. Annual Reviews in Microbiology, 55 (1): 485–529. |
| [15] | Kumari V, Rathore G, Chauhan U K, et al. 2011.Seasonal variations in abundance of nitrifying bacteria in fish pond ecosystem[J]. Journal of Environmental Biology, 32 (2): 153–159. |
| [16] | Laanbroek H J, Gerards S. 1993.Competition for limiting amounts of oxygen between Nitrosomanas europaea and Nitrobacter winogradskyi grown in mixed continuous cultures[J]. Arch Microbiology, 159 (6): 453–459. |
| [17] | Liu Z, Huang S, Sun G, et al. 2011.Diversity and abundance of ammonia-oxidizing archaea in the Dongjiang River, China[J]. Microbiological Research, 166 (5): 337–345. |
| [18] | Lu S M, Liao MJ, Xie C X, et al. 2014.Seasonal dynamics of ammonia-oxidizing microorganisms in freshwater aquaculture ponds[J]. Annals of Microbiology, 65 (2): 651–657. |
| [19] | Lu S M, Liao M J, Zhang M, et al. 2012.A rapid DNA extraction method for quantitative real-time PCR amplification from fresh water sediment[J]. Journal of Food Agriculture and Environment, 10 (3/4): 1252–1255. |
| [20] | 吕艳华. 2007. 黄河三角州湿地硝化细菌生态特征及硝化作用研究[D]. 青岛:中国海洋大学 |
| [21] | Nhan D K, Verdegam M C J, Milstein A, et al. 2008.Water and nutrient budgets of ponds in integrated agriculture-aquaculture systems in the Mekong Delta, Vietnam[J]. Aquaculture Research, 39 (11): 1216–1228. |
| [22] | 农业部渔业局. 2013. 2013中国渔业统计年鉴[M]. 北京: 中国农业出版社 . |
| [23] | Park H D, Noguera D R. 2004.Evaluating the effect of dissolved oxygen on ammonia-oxidizing bacterial communities in activated sludge[J]. Water Research, 38 (14/15): 3275–3286. |
| [24] | Park H D, Regan J M, Noguera D R. 2002.Molecular analysis of ammonia-oxidizing bacterial populations in aerated-anoxic Orbal processes[J]. Water Science Technology, 46 (1-2): 273–280. |
| [25] | Phillips C J, Harris D, Dollhope S L, et al. 2000.Effects of agronomic treatments on structure and function of ammoina-oxidizing communities[J]. Applied and Environmental Microbiology, 66 (12): 5410–5418. |
| [26] | Rotthauwe J H, Witzel K P, Liesack W. 1997.The ammonia monooxygenase structural gene amoA as a functional marker:molecular fine-scale analysis of natural ammonia-oxidizing populations[J]. Applied and Environmental Microbiology, 63 (12): 4704–4712. |
| [27] | Ruan A, He R, Xu S, et al. 2009.Effect of dissolved oxygen on nitrogen purification of microbial ecosystem in sediments[J]. Journal of Environmental Science and Health Part A, 44 (4): 397–405. |
| [28] | Sims A, Horton J, Gajaraj S, et al. 2012a.Temporal and spatial distributions of ammonia-oxidizing archaea and bacteria and their ratio as an indicator of oligotrophic conditions in natural wetlands[J]. Water Research, 46 (13): 4121–4129. |
| [29] | Sims A, Gajaraj S, Hu Z. 2012b.Seasonal population changes of ammonia-oxidizing organisms and their relationship to water quality in a constructed wetland[J]. Ecological Engineering, 40 : 100–107. |
| [30] | Wang S, Wang Y, Feng X, et al. 2011.Quantitative analyses of ammonia-oxidizing Archaea and bacteria in the sediments of four nitrogen-rich wetlands in China[J]. Applied Microbiology and Biotechnology, 90 (2): 779–787. |
| [31] | 王歆鹏, 陈坚, 华兆哲, 等.1999.硝化菌群在不同条件下的增殖速率和硝化活性[J].应用与环境生物学报, 5 (1):64–68. |
| [32] | Wang X Y, Wang C, Bao L L, et al. 2014.Abundance and community structure of ammonia-oxidizing microorganisms in reservoir sediment and adjacent soils[J]. Applied Microbiology and Biotechnology, 98 (4): 1883–1892. |
| [33] | Wells G F, Park H D, Yeung C H, et al. 2009.Ammonia-oxidizing communities in a highly aerated full-scale activated sludge bioreactor:betaproteobacterial dynamics and low relative abundance of Crenarchaea[J]. Environmental Microbiology, 11 (9): 2310–2328. |
| [34] | 向燕, 吴宇澄, 刘国峰, 等.2010.太湖兰山湾沉积物中氨氧化原核生物的垂直分布与多样性[J].生态学报, 30 (6):1423–1430. |
| [35] | 叶磊, 祝贵兵, 王雨, 等.2011.白洋淀湖滨湿地岸边带氨氧化古菌与氨氧化细菌的分布特性[J].生态学报, 31 (8):209–2215. |
| [36] | 袁飞. 2004. 不同农田土壤中的硝化作用及硝化细菌种群[D]. 南京:南京农业大学 |
| [37] | 钟文辉, 蔡祖聪, 尹力初, 等.2008.种植水稻和长期施用无机肥对红壤氨氧化细菌多样性和硝化作用的影响[J].土壤学报, 45 (1):105–111. |
 2016, Vol. 36
2016, Vol. 36


