活性污泥法是最重要的污水处理工艺之一,在世界范围内已被广泛地应用于处理市政污水和工业废水,其工艺流程通常是将厌氧、缺氧和好氧环境结合起来实现除碳磷和脱氮的功能.活性污泥系统是一个功能强大的微生态系统,其中,最主要的自养菌是硝化细菌,即氨氧化细菌(AOB)与亚硝酸盐氧化菌(NOB).为了实现持续稳定的硝化效果,污水处理厂通常将曝气池中的溶解氧(DO)浓度控制在2 mg·L-1以上(Grady et al.,2011).但在较低的DO浓度下,完全混合式或者生物膜反应系统中也能实现完全的硝化作用(Nicolas et al.,2001; Hibiya et al.,2003; Metcalf et al.,2003; Satoh et al.,2004; Guo et al.,2013; Liu et al.,2013; Fitzgerald et al.,2015).如果污水处理厂能在低DO环境下实现稳定达标,那么将大大降低污水厂的运行能耗(Liu et al.,2013).本研究通过一个长期运行的缺氧/好氧(A/O)推流式活性污泥小试试验系统,考察系统的脱氮效果和系统内硝化细菌群落结构随DO浓度变化的规律,探讨低DO生物脱氮的可能性,以期为实际污水厂在低DO浓度下实现稳定高效的硝化效果,节约能耗提供可靠的理论依据.
2 材料与方法(Material and methods) 2.1 材料接种污泥取自北京北小河污水处理厂;进水为人工配水,COD为300~400 mg·L-1,NH4+-N浓度为45~55 mg·L-1,pH控制在7.5~8.5.
2.2 反应器装置和运行条件采用缺氧/好氧(A/O)推流式活性污泥工艺,缺氧和好氧池总体积为37.5 L,缺氧池/好氧池的体积比为1:4,水力停留时间为9 h;沉淀池体积为24 L,停留时间为3 h.进水流量为96 L·d-1,混合液回流比R=200%,污泥回流比r=150%.实验装置如图 1所示.
 |
| 图 1 反应器装置示意图(1.进水桶,2.进水泵,3.A/O反应池,4.搅拌器,5.曝气头,6.内回流泵,7.污泥回流泵,8.二沉池) Fig. 1 Diagram of experimental system |
在实验过程中,温度维持在20~25 ℃,SRT为20 d,反应器初始污泥浓度在3000 mg·L-1左右.以DO为3 mg·L-1启动反应器,待系统稳定后将DO逐渐降低到2、1、0.5、0.3和0.2 mg·L-1运行,在本研究中,3和2 mg·L-1属于高DO浓度工况,而1、0.5、0.3和0.2 mg·L-1属于低DOI浓度工况.
2.3 水质和污泥性质测定系统运行期间每隔2~4 d取水样测定进出水水质,采用国标法进行测定(国家环境保护总局,1989),检测项目包括COD、NH4+-N、NO2--N、NO3--N和TN.在每个工况的运行后期采集活性污泥样品,置于-80 ℃保存. MLSS和SVI分别采用马弗炉燃烧减重法和30 min沉降法测定.
2.4 硝化细菌群落结构分析 2.4.1 DNA的提取用改进的Zhou法(Zhou et al.,1996)提取活性污泥的DNA,即玻璃珠振荡-SDS-氯仿异戊醇法.
2.4.2 硝化细菌的聚合酶链式反应(PCR)扩增AOB的扩增:采用其功能基因amoA的引物对amoA-1F(GGGGTTTCTACTGGTGGT)和amoA-2R(CCCCTCTGCAAAGCCTTCTTC)进行PCR扩增,扩增程序为:94 ℃预变性5 min;94 ℃变性 60 s,51 ℃退火 90 s,72 ℃延伸90 s,共40个循环;最后在72 ℃下延伸10 min,冷却至4 ℃保存.
NOB的扩增:对于Nitrobacter,选用F1370 F1(CAGACCGACGTGTGCGAAAG)和F2843 R2(TCCACAAGGAACGGAAGGTC)进行PCR扩增,扩增程序为:94 ℃预变性3 min;94 ℃变性 30 s,55 ℃退火45 s,72 ℃延伸 45 s,共35个循环;最后在72 ℃下延伸5 min,冷却至4 ℃保存;对于Nitrospira,选用NSR 1113f(CCTGCTTTCAGTTGCTACCG)和NSR 1264r(GTTTGCAGCGCTTTGTACCG)进行PCR扩增,扩增程序为:94 ℃预变性5 min;94 ℃变性30 s,65 ℃退火30 s,72 ℃延伸30 s,共40个循环;最后在72 ℃下延伸15 min,冷却至4 ℃保存.
每种引物对的前端引物附40 bp的GC夹(Muyzer et al.,1993),便于后续的变性梯度凝胶电泳(DGGE)分析,PCR反应的产物用2%琼脂糖凝胶电泳检测.
2.4.3 DGGE分析将4 μL PCR样品和1.5 μL 6倍加样缓冲液混合,采用Bio-rad突变检测系统,用8%的聚丙烯酰胺凝胶,变性剂浓度为45%~75%,在110 V的电压下60 ℃电泳6 h,用SYBR GREEN I染料对凝胶进行染色,获得DGGE指纹图谱.
2.4.4 基因测序用洁净的手术刀切取DGGE图谱中的目的条带,利用聚丙烯酰胺DNA回收试剂盒(索莱宝科技公司,北京)进行回收,回收纯化后的DNA用同样的对应引物对进行PCR扩增,产物送上海英骏生物公司进行测序.序列通过NCBI基因库进行在线BLAST比对分析.
2.4.5 相似性和多样性分析通过比较相似性系数(Cs)来分析样品图谱的相似性(李娜等,2010).试验所得图像用BIO-RAD的Quantity One软件分析.微生物多样性指数采用Shannon指数(H)表示(魏健等,2014),公式为:H=-∑PilgPi,其中,Pi=ni/N,ni为峰面积,N为所有峰的总面积.
3 结果讨论(Results and discussion) 3.1 不同DO条件下A/O系统的脱氮效果和污泥性质 3.1.1 不同DO条件下A/O系统的脱氮效果图 2和图 3分别显示了在不同DO条件下A/O小试系统内进出水的氮素浓度和去除率.硝化过程是耗氧反应,当小试系统曝气池中的DO浓度维持在3 mg·L-1和2 mg·L-1时,系统在很短的时间内就能实现很好的硝化效果,当改变曝气池中的溶解氧浓度,系统在几天之内氨氮的去除率即可稳定.当把系统曝气池中的DO调至1 mg·L-1时,由于突然从高DO状态调节至低DO状态,运行初始阶段出水水质存在波动,但经过2周左右的培养和驯化后出水氨氮和总氮均达到了稳定状态,继续降低曝气池中的DO浓度,使其维持在0.5 mg·L-1时,出水氨氮和总氮并未出现较大的波动,氨氮的平均去除率均为98%以上,总氮的平均去除率为85%以上.当进一步降低DO至0.3 mg·L-1时,尽管经过30 d的连续运行,氨氮的平均去除率下降到了95.4%,总氮的平均去除率为83.46%,整个过程出水水质波动较大,难以达到稳定的状态. 然而,当DO继续降低到0.2 mg·L-1时,系统出现了大幅度波动,出水氨氮和总氮浓度非常高,连续运行了30 d后,出水水质也未达标. 这些水质结果表明该系统的运行DO浓度只能降低到0.5 mg·L-1.
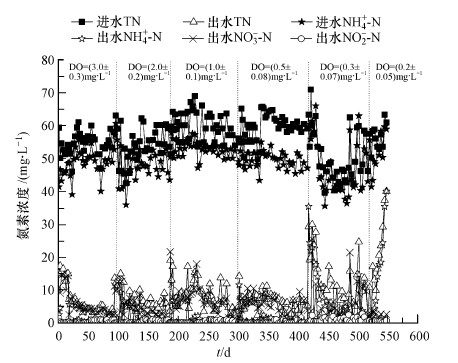 |
| 图 2 A/O小试系统内进出水的氮素浓度 Fig. 2 Influent and effluent nitrogen concentration in the A/O activated sludge system |
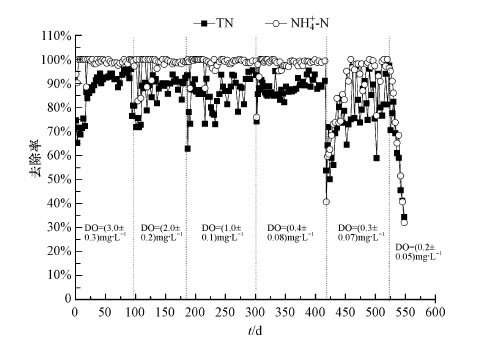 |
| 图 3 A/O小试系统内氨氮和总氮的去除率 Fig. 3 The removal rate of ammonia and total nitrogen in the activated sludge system |
传统生物脱氮过程的硝化反应是在好氧条件下进行的,氧气作为电子受体,氮元素作为电子供体,将氨氮氧化为硝酸盐氮.因此,为了能充分实现硝化反应,污水处理厂往往将DO设计到2 mg·L-1以上(Park et al.,2004). 根据本研究的结果,在DO为0.5 mg·L-1的情况下,系统也能很好地实现硝化作用,这样可以大幅度节约硝化反应所需要的能源.当DO从0.5 mg·L-1继续降低到0.3 mg·L-1甚至到0.2 mg·L-1,系统曝气池中的硝化效果受到了较大的制约,这可能是因为在此DO浓度下曝气池中污泥易于沉降,泥水难以达到充分的混合.为了保证在此浓度下依然能达到较好的脱氮效果,可以在曝气池中加装搅拌器通过搅拌作用使泥水充分混合,但这会增加能量的消耗.另外,还可以通过增大污泥停留时间(SRT)来补偿低DO工况下由于氧气不足所造成的脱氮效果下降. Liu等(2013)的研究结果也证明了这一点,他们考察了SRT为10 d和40 d两种情况下,当DO降低到0.2 mg·L-1以下时,在SRT为10 d的系统中硝化效果很难达到稳定,而在SRT为40 d的系统中硝化效果较为稳定.
3.1.2 不同DO条件下A/O系统的MLSS和SVI的变化规律随着DO浓度的降低,活性污泥的MLSS和SVI均呈上升趋势. MLSS增加的幅度不是很大,DO为3、2、1、0.5和0.3 mg·L-1时,系统达到相对稳定状态时活性污泥的平均MLSS分别为3925、4155、4550、4910和5150 mg·L-1.总的来说,MLSS随着DO的降低而增加,这也与其它文献报道的研究结果相一致(Liu et al.,2007; Park et al.,2008). SVI也是随着DO的降低而升高,系统内的DO为3和2 mg·L-1时,活性污泥的SVI值在60~100 mL·g-1之间,活性污泥具有很好的沉降性能. DO为1 mg·L-1的工况下,活性污泥的SVI值在100~120 mL·g-1之间,沉降和凝聚性能依然很强.DO为0.5 mg·L-1时,活性污泥的SVI值在140~160 mL·g-1之间,也属于较正常的范围(彭永臻等2008; Liu et al.,2013). 但当DO浓度降低到0.3 mg·L-1运行时,系统中的活性污泥的SVI值在160~180 mL·g-1之间,处于膨胀状态,这也很好地证明了DO浓度为0.3 mg·L-1时,系统出水水质很难稳定达标的结果.
3.2 硝化细菌群落分析 3.2.1 AOB群落结构和多样性变化5个不同DO工况下AOB的amoA功能基因DGGE图谱如图 4a所示.由图可以看出,各个工况下的AOB菌群丰富度相对较单一,共检测到8条优势条带,分别标记为1~8. AOB的群落结构随着DO浓度的降低而发生了变化,在每个工况下都存在的优势细菌为条带4和6所代表的细菌. 当DO降低后,DO浓度为3 mg·L-1时存在的优势条带7却消失了,而且在DO浓度为0.5 mg·L-1时,出现了新的优势条带5.
 |
| 图 4 不同DO条件下AOB的DGGE图谱(a)和所有条带的检测示意图(b) Fig. 4 DGGE profiling (a) and detecting analysis (b) of AOB under different DO conditions |
图 4b显示,从高DO变化到低DO,系统内AOB群落结构的动态变化率约为20%~40%,属于中等程度的变化(Miura et al.,2007; Wang et al.,2012),高DO(3和2 mg·L-1)和低DO(1、0.5和0.3 mg·L-1)环境中AOB种群多样性指数(H)较为相似(表 1).在不同的DO环境下,A/O小试系统中AOB的多样性均处于较高的水平.DO为3 mg·L-1时小试A/O系统中AOB的多样性最高,AOB的种群多样性随DO浓度的降低而减小,但减小的幅度很小,DO的降低并未对AOB的群落结构造成太大的影响,系统中各种优势细菌分布的均匀性和稳定性使得系统中AOB群落始终处于很稳定的状态,保证了系统氨氧化功能的稳定性.
| 表 1 不同DO条件下各种硝化细菌的多样性指数(H) Table 1 Shannon index of nitrifying bacteria under different DO conditions |
图 4a中标有阿拉伯数字的优势条带的测序结果显示(表 2),AOB均属于Nitrosomonas,未检测出有Nitrosospira,其中,条带1、2、3和4属于Nitrosomonas-like cluster,条带 5属于Nitrosomonas europaea,条带6和7均为Nitrosomonas oligotropha所属的细菌.条带5和7均属于低DO(0.5 mg·L-1)环境中的优势AOB,由此说明,所属Nitrosomonas europaea和Nitrosomonas oligotropha 的AOB均可在低DO的环境中生存,特别是Nitrosomonas europaea所属的AOB非常适合在0.5 mg·L-1的DO浓度下生存.这一结果也与其他研究者的结果相一致(Park et al.,2008; Liu et al.,2013).
| 表 2 DGGE条带的测序结果 Table 2 Sequencing analysis of DNA from DGGE bands |
由图 5a可知,Nitrobacter的群落结构随DO的降低发生了明显的变化,高DO环境(3和2 mg·L-1)的Nitrobacter群落与低DO环境(1、0.5和0.3 mg·L-1)的Nitrobacter群落结构存在较大的差异,DO为1和0.5 mg·L-1工况下Nitrobacter的群落结构最为相似,共同的优势种群为条带Nb1、Nb2、Nb3、Nb4、Nb5、Nb6、Nb7,Nb8则在DO为0.5 mg·L-1的环境下更为丰富,Nb18是DO为1 mg·L-1工况下存在的优势条带.当DO继续降低至0.3 mg·L-1时,系统中的优势种群转变为Nb4、Nb21、Nb22、Nb23,系统中的优势种群数量明显降低.
 |
| 图 5 不同DO条件下Nitrobacter的DGGE图谱(a)和所有条带的检测示意图(b) Fig. 5 DGGE profile (a) and detecting analysis (b) of Nitrobacter under different DO conditions |
图 5b显示,DO为1和0.5 mg·L-1工况下的Nitrobacter群落结构最为相似,高DO(3和2 mg·L-1)和低DO(1、0.5和0.3 mg·L-1)环境下Nitrobacter的群落结构相似性较低,不同DO环境中的Nitrobacter群落结构差异较大,但1、0.5和0.3 mg·L-1工况下的Nitrobacter群落结构相似性较高. Shannon-Weiner 指数(H)显示(表 1),不同DO环境下的Nitrobacter群落结构差异较大,但每个DO工况下的优势种群数量均较高,优势细菌的均匀性也较高,因此,每个DO工况下的Nitrobacter群落均处于稳定状态,保证了系统硝化功能的稳定性.
测序结果显示(表 2),系统中鉴定出的Nitrobacter可分为3类,分别为Group1 Nitrobacter、Group2 Nitrobacter和Group3 Nitrobacter,其中,Nb1、Nb2、Nb3、Nb4、Nb5、Nb6、Nb7、Nb8、Nb9、Nb21、Nb22和Nb23属于Group1 Nitrobacter,也是数量最多的一类Nitrobacter,Nb15、Nb16、Nb17、Nb18、Nb19和Nb20属于Group2 Nitrobacter,Nb12、Nb13和Nb14属于Group3 Nitrobacter.因此,结合图 5b可以进一步看出,系统DO从高浓度(3、2 mg·L-1)降低到低浓度(1、0.5和0.3 mg·L-1)时,系统中的Nitrobacter的种类从Group2和Group3转变成了Group1.另外,从测序结果也可以看出,N. winogradskyi系统中的优势Nitrobacter,但在高低DO工况下,它们属于不同的发育分支.
3.2.3 NOB群落中Nitrospira群落结构的变化由图 6a可知,不同DO条件下的Nitrospira群落结构变化较小,系统中的优势细菌始终为Np3和Np4,相比于有着丰富群落结构的Nitrobacter,系统中Nitrospira的优势种群较少.
 |
| 图 6 不同DO条件下Nitrospira的DGGE图谱(a)和所有条带的检测示意图(b) Fig. 6 DGGE (a) and detecting analysis (b) profiles of Nitrospira under different DO conditions |
图 6b显示了Nitrospira的DGGE图谱的条带分布、强度及每个工况的DGGE图谱各样品间的相似性.总体而言,不同DO条件下小试A/O系统曝气池中的Nitrospira种群相似性较高,种群结构没有发生较大的改变. 高DO(3和2 mg·L-1)和低DO(1、0.5和0.3 mg·L-1)环境下Nitrospira的群落结构相似性较高,从高DO变化到低DO,系统内细菌群落结构的动态变化率约为10%~40%,变化程度较小.因此,DO的变化并未对Nitrospira的种群结构和多样性产生较大的影响,不同DO环境中的Nitrospira群落结构相类似. Shannon-Weiner 指数(H)显示(表 1),高DO下的Nitrospira多样性相对较低,而在0.5 mg·L-1的系统中,两种Nitrospira均为优势菌,其均匀度较高,因此,相应的多样性指数较高.
测序结果显示(表 2),系统中鉴定出的Nitrospira均属于Group1 Nitrospira,系统中并未检测出Group2 Nitrospira中的细菌,Np1、Np2、Np3、Np4所代表的细菌均属于同一类细菌,而且同源性很高,由此也说明,小试A/O系统中Nitrospira的种类较单一,相比于Nitrobacter丰富的种群,Nitrospira的种类较少. 这也与类似的研究结果相一致(Park et al.,2008).
由Nitrobacter和Nitrospira的多样性指数可以看出,小试A/O系统中最主要的NOB为Nitrobacter.虽然Liu等(2013)的研究结果表明,在长期的低DO环境下,Nitrospira-like比Nitrobacter-like的NOB数量更多,但Nitrobacter和Nitrospira具有不同的生存策略,Nitrospira遵循的是K策略,更适应于在低浓度的亚硝酸盐环境中生存,Nitrobacter的生长实行的是r策略,在亚硝酸盐浓度很低的环境中竞争不过Nitrospira,但当有足够的亚硝酸盐存在时,Nitrobacter的生长速度比Nitrospira更快. 在缺少亚硝酸盐的环境中,Nitrospira的含量更丰富,而在本研究的A/O系统中亚硝酸盐并不是NOB生长的限制因子,因此,Nitrobacter是小试A/O系统中最主要的NOB,主要贡献了亚硝酸盐的氧化作用.
4 结论(Conclusions)1)当DO浓度从3 mg·L-1降低到0.5 mg·L-1时,本研究中的推流式A/O小试系统仍然能保持很好的脱氮效果,氨氮和总氮的去除率分别达到了98%和85%以上;当DO进一步降低到0.3和0.2 mg·L-1时,出水水质指标不能达标,系统运行难以达到稳定状态.
2)PCR-DGGE的解析结果表明,A/O小试系统中AOB群落结构的动态变化水平约为20%~40%,Nitrospira群落结构的动态变化水平约为10%~40%,AOB和Nitrospira的群落结构随DO的变化并不显著. 而Nitrobacter的群落结构随DO的降低发生了明显的变化,不同DO环境中的Nitrobacter群落结构存在较大差异.
3)测序结果表明,A/O小试系统活性污泥中的优势AOB主要为Nitrosomonas oligotropha、Nitrosomonas-like和Nitrosomonas europaea,Nitrosomonas oligotropha的AOB更适宜在低DO的环境中生存. 系统中的Nitrobacter包括Group1 Nitrobacter、Group2 Nitrobacter和Group3 Nitrobacter 3类中的细菌,其中,Group1 Nitrobacter是最多的一类Nitrobacter,也是适应在低DO环境下生存的Nitrobacter.小试A/O系统中Nitrospira主要的优势菌种始终是Group 1 Nitrospira.
| [1] | Fitzgerald C M, Camejo P, Oshlag J Z, et al. 2015.Ammonia-oxidizingmicrobial communities in reactors with efficient nitrification at low-dissolved oxygen[J]. Water Research, 70 : 38–51. |
| [2] | Grady Jr C P L, Daigger G T, Love N G, et al. 2011. Biological Wastewater Treatment[M]. London: IWA Publishing . |
| [3] | 国家环境保护总局水和废水监测分析方法编委会. 1989. 水和废水监测分析方法[M]. 北京: 中国环境科学出版社 . |
| [4] | Guo J S, Xu Y F, Chen Y P, et al. 2013.Long-term evolution of an activated sludge system under low dissolved oxygen conditions[J]. Journal of Environmental Biology, 34 : 427–436. |
| [5] | Hibiya K, Terada A, Tsuneda S, et al. 2003.Simultaneous nitrification and denitrification by controlling vertical and horizontal microenvironment in a membrane aerated biofilm reactor[J]. Journal of Biotechnology, 100 : 23–32. |
| [6] | 李娜, 林晓珊, 张毅.2010.PCR-DGGE 技术分析倒置 A2/O工艺处理染织废水中的微生物区系[J].环境科学学报, 30 (3):490–496. |
| [7] | Park H D, Noguera D R. 2004.Evaluating the effect of dissolved oxygen on ammonia-oxidizing bacterial communities in activated sludge[J]. Water Research, 38 (14): 3275–3286. |
| [8] | Park H D, Noguera D R. 2008.Nitrospira community composition in nitrifying reactors operated with two different dissolved oxygen levels[J]. Journal of Microbiology and Biotechnology, 18 (8): 1470–1474. |
| [9] | 彭永臻, 郭建华, 王淑莹, 等.2008.低DO污泥微膨胀节能理论与方法的发现,提出及理论基础[J].环境科学, 29 (12):3342–3347. |
| [10] | Liu G, Wang J. 2013.Long-term low DO enriches and shifts nitrifier community in activated sludge[J]. Environmental Science & Technology, 47 (10): 5109–5117. |
| [11] | Liu G Q, Wang J M. 2013.Role of solids retention time on complete nitrification:Mechanistic understanding and modeling[J]. Journal of Environmental Engineering, 140 (1): 48–56. |
| [12] | Liu X, Zhang Y, Yang M, et al. 2007.Analysis of bacterial community structures in two sewage treatment plants with different sludge properties and treatment performance by nested PCR-DGGE method[J]. Journal of Environmental Sciences, 19 (1): 60–66. |
| [13] | Metcalf I N C, Eddy H. 2003. Wastewater Engineering Treatment and Reuse(4nd edtion)[M]. New York: McGraw-Hill . |
| [14] | Miura Y, Hiraiwa M N, Ito T. 2007.Bacterial community structures in MBRs treating municipal wastewater:Relationship between community stability and reactor performance[J]. Water Research, 41 : 627–637. |
| [15] | Muyzer G, Waal E C D, Uitterlinden A G. 1993.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J]. Applied and Environmental Microbiology, 59 : 695–700. |
| [16] | Nicolas B, Peng D C, Jean-Philippe D, et al. 2001.Nitrification at low oxygen concentration in biofilm reactor[J]. Journal of Environmental Engineering, 127 (266): 271. |
| [17] | Satoh H, Ono H, Rulin B, et al. 2004.Macroscale and microscale analyses of nitrification and denitrification in biofilms attached on membrane aerated biofilm reactors[J]. Water Research, 38 : 1633–1641. |
| [18] | Wang X, Wen X, Xia Y, et al. 2012.Ammonia oxidizing bacteria community dynamics in a pilot-scale wastewater treatment plant[J]. PLoS ONE, 7 (4): e36272. |
| [19] | 魏健, 宋永会, 赵乐.2014.MBR处理腈纶废水的效能及微生物群落结构分析[J].环境科学, 35 (12):4610–4617. |
| [20] | Zhou J, Bruns M A, Tiedje J M. 1996.DNA recovery from soils of diverse composition[J]. Applied and Environmental Microbiology, 62 (2): 316–322. |
 2016, Vol. 36
2016, Vol. 36


