吲哚美辛(IDM)是一种常用的非甾体抗炎镇痛药,据报道,2009年仅日本国内对该药物的用量就达到86 t(Edwards et al.,2009).与其他非甾体类(NIMIDs)药物的作用机制相似,IDM主要通过抑制前列腺素的合成来达到抗炎和镇痛效果(雷曙光等,2011).由于IDM的大量使用,未代谢完成和废弃的药物经常排放到天然水体中.2011年中国南部的饮用水中已检出0.53 ng·L-1的IDM,对饮用水的水质造成影响;污水处理厂中检测到的IDM高达0.05 μg·L-1,经处理之后,出水口和进水口浓度基本不变,说明传统的生化工艺对低浓度IDM的去除能力低(Jim et al.,2006).进入自然水环境的IDM可以威胁生态平衡,特别是其母体及副产物的积累会对环境产生潜在的生态风险,能使在环境中占重要作用的微生物群体发生相应变化;微量IDM对人体的副作用表现在抑制相应机体分泌功能,如肾脏、消化道和呼吸道等器官来损害人体健康(Kawabata et al.,2013).
光降解作为一种有效的处理手段常被用来去除水体中痕量污染物(Chen et al.,2015).前人对IDM的光学行为进行了相应的研究,主要集中在对其动力学、降解效果及降解路径等方面.张等(2013)以武汉春季太阳光为光源,考察了不同水质和环境因子对IDM降解作用的影响.Yamamoto等(2009)研究了太阳光下IDM在不同水体和土壤中的降解动力学及量子产率.Temussi等(2011)以中高压汞灯为紫外光源,研究了IDM在水体中的光解产物,结果表明,降解过程中有6个明显的产物,产物为羟基化和酮化产物,证明光解过程中有活性氧物种(ROS)的参与,光解路径以光氧化脱—COOH和光诱导水解脱—CO—N为主.但是,前人缺乏对IDM紫外降解机制的研究,特别是ROS的光化学贡献率及常见环境因子对其紫外光降解行为的促进和抑制作用的深入研究.
因此,本实验对IDM的紫外光解行为进行研究,并分析初始浓度和pH对光解速率常数的影响;通过ROS猝灭实验探讨IDM的紫外光降解机制,通过测定掩蔽系数考察水体中溶解性物质对IDM光解的影响,通过测定IDM和羟基自由基的二级反应速率常数来表明水体中硝酸根的诱导作用.以期为以后自来水厂和污水处理厂出水中痕量IDM的深度处理提供基础数据,本研究对于更好地了解IDM在水环境中的归趋具有重要的意义.
2 材料与方法(Materials and methods) 2.1 试剂IDM(纯度>98.0%)购自TCI试剂公司;腐殖酸(富里酸,SRFA,≥90%)购自Aladdin公司;叠氮化钠(NaN3,纯度>99%)、硝基苯(NB,纯度>99%)均购自美国 Sigma公司;乙腈(色谱纯)购自美国ACS恩科化学;甲酸、氢氧化钠、硫酸、硝酸钠、异丙醇(Isopropanol)等均为分析纯,购自成都科龙化工试剂厂;实验用水均为超纯水.
2.2 实验方法将0.2 g IDM溶于200 mL乙腈中,配制浓度为1 g·L-1的IDM母液.准确移取0.25、0.5、1、2、3 mL母液于250 mL容量瓶中,用高纯氮吹干乙腈.用超纯水定溶(Smart2 Pure超纯水/纯水一体化系统,德国TKA),使容量瓶中IDM的浓度分别为1、2、4、8、12 mg·L-1,并用1% NaOH和H2SO4调溶液pH至中性,摇匀后,移取25 mL溶液至50 mL石英管中,置于XPA-7旋转光化学反应器内(图 1,南京胥江机电厂)进行磁力搅拌,控制反应器温度为25 ℃,用500 W汞灯照射(南京胥江机电厂).实验过程中通过光功率测定仪(北京中教金源科技有限公司,CEL-NF2000)测得平均光功率为1.15 mW·cm-2.每隔30 min取样1次,每个时间点的样品至少设3个重复,取平均值,数值标准偏差小于5%,否则重新试验.样品用HPLC测定浓度.
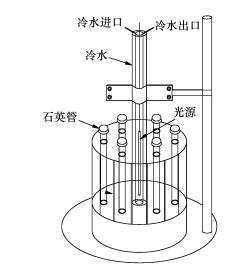 |
| 图 1 旋转光化学反应器 Fig. 1 Rotary photochemical reactor |
色谱仪(LC-20AT,SHIMADZU),色谱条件:流动相是乙腈-0.2%甲酸水(55∶45,体积比);色谱柱(VP-ODS,SHIMADZU);检测器为光电二极管阵列检测器(SPD-M20A),检测波长为268 nm,流速为1 mL·min-1,进样量10 μL,柱温30 ℃.采用紫外分光光度计(UV-2100,Beijing Rayleigh)进行光谱图扫描.
2.4 理论计算方法 2.4.1 ROS猝灭实验ROS猝灭实验是用来阐明IDM的紫外光解机制.异丙醇是羟基自由基(·OH)的猝灭剂(Buxton et al.,1988),NaN3是·OH和1O2的猝灭剂(Buxton et al.,1988;Miolo et al.,2002),它们经常用于光化学机制的研究(Latch et al.,2003;Boreen et al.,2004;And et al.,2006;Ge et al.,2010; Zhang et al.,2011;Li et al.,2015).在IDM溶液中,添加一定量的异丙醇使其浓度分别为0、10、50、100 mmol·L-1以猝灭体系中的·OH;添加一定量的NaN3使其浓度分别为0、10、30、200 mg.L-1以猝灭体系中的·OH和1O2.
2.4.2 ·OH稳态浓度的测定在IDM溶液中加入7.8 μmol·L-1的NB和1 mmol·L-1硝酸根一同光解,隔一定时间取样用HPLC测定NB的浓度以计算NB的光解速率常数. ·OH稳态浓度采用以下公式计算得到:
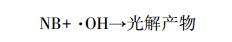
|
(1) |
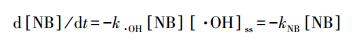
|
(2) |
式中,k·OH为NB与·OH的反应速率常数,取值为3.0×109 L·mol-1·s-1(Zepp et al.,1985);[NB]为NB在t时刻的浓度(mol·L-1);[·OH]ss表示·OH的稳态浓度(mol·L-1);kNB指降解速率常数(s-1).
环境因子对实验的影响测定在进行不同pH影响实验时,配制4 mg·L-1储备液,调节pH分别为5、6、7、8、9.在进行溶解氧影响实验时,样品在实验前先通半小时的高纯氮或高纯氧(8.3 mL·min-1),实验中继续保持稳定的流量通入.在考察硝酸根和溶解性物质的影响实验时,分别在4 mg·L-1 IDM储备液中加入一定量的硝酸盐,使硝酸盐浓度分别为0、0.01、0.1、1.0 mmol·L-1;同理配制0、1、5、10 mg·L-1(以C计)的SRFA,然后进行光解实验,实验和测试方法同上.SRFA对IDM光解的掩蔽系数计算如下(Wals et al., 2004):
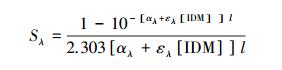
|
(3) |
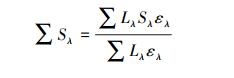
|
(4) |
式中,Sλ代表SRFA在λ波长下对IDM的光掩蔽系数;∑Sλ代表SRFA在IDM紫外吸收波长范围内对IDM的总掩蔽系数;αλ代表SRFA在λ波长下的吸光度(cm-1);ελ代表IDM在λ波长下的摩尔吸光系数;l代表光程(cm);Lλ代表汞灯的光强百分比.
3 结果(Results) 3.1 IDM降解动力学 3.1.1 初始浓度的影响在本研究中,IDM的光降解均符合准一级动力学规律(图 2).在研究不同初始浓度IDM对光降解影响时,进行了暗对照.如图 2所示,IDM浓度没有发生明显的变化,因此,实验过程中可以忽略水解反应对IDM降解的影响. 相反,经过3 h的紫外光照,超过85%的IDM被降解,说明光量子在IDM的降解中起到重要的作用.本实验中,初始IDM浓度为1、2、4、8、12 mg·L-1时,IDM的速率常数分别为0.0148、0.0133、0.00981、0.0077和0.00412 min-1.由此表明,随着初始浓度的增大,IDM的降解速率下降.这可以解释为实验中紫外发射光源稳定,随初始浓度的增大,单位IDM分子获得的光量子减少,因此,在争夺有限的可用于光转换光子中会导致光降解速率下降(Zhang et al.,2011).
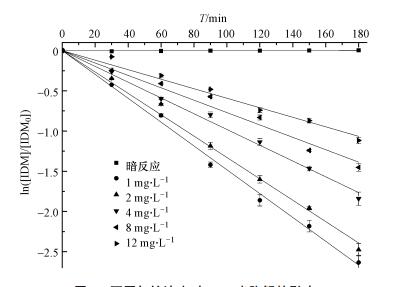 |
| 图 2 不同初始浓度对IDM光降解的影响 Fig. 2 Photodegradation of five different initial IDM concentrations under dark and light conditions |
据报道,有机污染物能通过吸收光子来转化能量和电子,进而产生活性物种(ROS)对本体进行氧化降解,即自敏化降解(Cogan et al., 2008).本研究通过猝灭实验来考察IDM是否有自敏化作用参与降解.从表 1可以看出,添加一定量的异丙醇使其浓度分别为0、10、50、100 mmol·L-1以猝灭体系中的·OH时,IDM的光解速率常数分别为0.00981、0.00931、0.00925和0.00927 min-1;添加一定量的NaN3使其浓度分别为0、10、30、200 mg·L-1以猝灭体系中的·OH和1O2时,IDM的光解速率常数分别为0.00981、0.00755、0.00753和0.00749 min-1.由此可知,在加入异丙醇、NaN3后,都不同程度地抑制IDM的光降解.从实验结果可以得出,自敏化氧化反应参与了IDM在水体中的紫外光降解.比较异丙醇和NaN3的猝灭浓度可知,浓度为50、100 mmol·L-1的异丙醇溶液能够完全猝灭光解过程中产生的·OH,浓度为10、30、200 mg·L-1的NaN3都能够完全猝灭体系中产生的·OH和1O2.
| 表 1 不同条件下IDM(4 mg·L-1)的光解速率常数 Table 1 IDM(4 mg·L-1) photodegradation rate constants under different conditions |
因此,通过实验数据可初步推断IDM在紫外光解过程中发生了直接光解作用(占主导地位)和有·OH及1O2参与的自敏化光解. 由此可以推导出IDM的降解过程,具体如图 3所示.路径一,IDM吸收光子产生激发态IDM,进而直接被降解;路径二,激发态IDM通过转移能量给溶解氧而产生ROS,进而氧化降解IDM(自敏化过程). 以1O2为例,图 3可以表示如下式子:
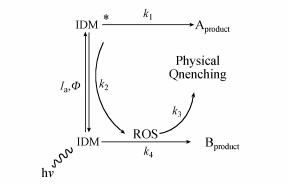 |
| 图 3 IDM的直接光解和自敏化光解路径 Fig. 3 The proposed pathway for photolysis of IDM |
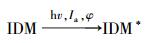
|
(5) |
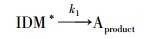
|
(6) |
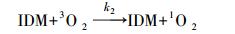
|
(7) |
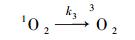
|
(8) |
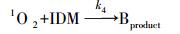
|
(9) |
式中,Ia是IDM的光子吸收率;k1表示IDM的直接光解速率常数(s-1);k2表示IDM*和3O2的二级反应速率常数(L·mol-1·s-1);k3为水体中1O2一级物理猝灭常数(s-1);k4为1O2和IDM的二级反应速率常数(L·mol-1·s-1).式(6)和式(9)分别表示IDM的直接和1O2参加的反应过程.
通过稳态近似法可得:
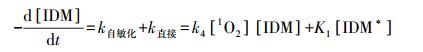
|
(10) |
同理可得[IDM*][1O2]如下:
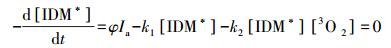
|
(11) |
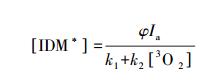
|
(12) |
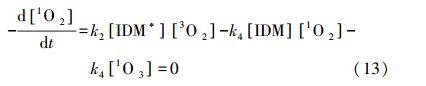
|
(13) |
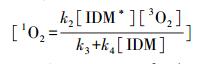
|
(14) |
1O2的猝灭速率为2.5 × 105 s-1(Buxton et al.,1988),因此,k3>>k4,式(14)可以转变为:
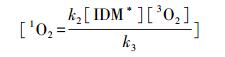
|
(15) |
根据 Beer-Lambert定律可得:
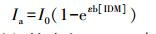
|
(16) |
由于IDM的初始浓度4 mg·L-1,所以εb[IDM]<<1,式(16)可转变为:
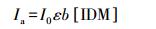
|
(17) |
整合上面式子,初始浓度下对应的光解速率v/C0可用如下式表示:
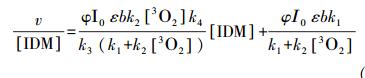
|
(18) |
根据方程式(18)可知,IDM的初始浓度C0及其在各初始浓度下对应的光解速率v/C0成线性关系(图 4),y轴为IDM的直接光解速率常数,初始浓度和光解速率常数成较好的负向线性关系,R2≥0.95. 由如图可得,当C0=0 mg·L-1时IDM的直接光解速率常数为0.0151 min-1,这个速率常数比有自敏化作用参加的速率常数大,说明自敏化光解会抑制IDM的直接降解.这是因为自敏化本身对IDM的降解贡献率比直接降解贡献率低,且在发生自敏化降解反应时会先通过猝灭激发态IDM来形成ROS,这样会抑制IDM的直接光解作用(图 3中k4). 因此,通过动力学模型可知,IDM在紫外光解过程中有直接光解和自敏化光解作用参与.
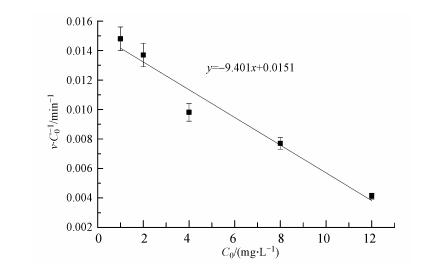 |
| 图 4 IDM的初始浓度C0对应的光解速率v/C0线性图 Fig. 4 Effect of initial concentrations on pseudo-first-order rate constants for photodegradation of IDM |
pH能通过改变有机物的电荷态来影响光转换效率.图 5比较了初始浓度为4 mg·L-1不同pH条件下IDM的降解情况.结果表明,pH为5.0、6.0、7.0、8.0、9.0时IDM的降解速率常数分别为0.00885、0.00924、0.00981、0.0103和0.0111 min-1. 因此能够得出,随pH的增大,IDM的降解速率加快.
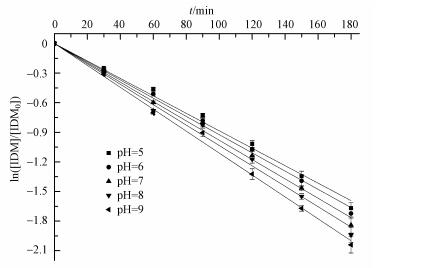 |
| 图 5 pH对IDM光降解的影响 Fig. 5 Effect of pH on IDM photodegradation under ultraviolet light |
一方面,pH值增大致使IDM更多地转变成为离子形态(电离H+),羧基氧原子上的负电子增加了苯环的电子云密度,更容易受到ROS的攻击而使IDM的光化学转化效率增加;另一方面,随pH的增大,IDM的紫外吸收光谱图会发生红移,和光源的发射光谱有更多的重叠,增加了IDM的直接光解作用(Hapeshi et al.,2010).
3.2.2 溶解氧存在对IDM光降解的影响本研究中,通过通入高纯氮和高纯氧来评价溶解氧存在下对IDM光降解的影响.实验过程中进行暗对照,在暗反应中通入高纯氮和高纯氧后IDM的降解没有变化.从表 1可以看出,通入高纯氮时IDM的降解速率加快.前面的动力学模型证实有自敏化参与会减慢IDM的直接降解速率,因此,当实验通入高纯氮来驱除水体中溶解氧时会减少ROS的生成,并促进了IDM的光降解.
相反,通入高纯氧后水体中的溶解氧浓度增大,IDM的光降解速率减慢.从IDM的光解路径可知,溶解氧不仅能过吸收激发态IDM来产生ROS,进而促进IDM的自敏化降解(图 3中k4),而且能够猝灭激发态IDM来抑制IDM的直接光解(图 3中k1).前面的动力学模型证实IDM的直接光解占主导作用,因此,溶解氧实验和这一结果相吻合.
硝酸根的影响天然水体中NO3-的浓度为10-5~10-3 mol·L-1,同时它还是一种光敏剂,在受到光照下能够产生活性氧物种(陈平等,2015),故考察NO3-对IDM降解的影响.模拟环境浓度下NO3-对IDM的影响如图 6所示.硝酸根浓度为0、0.01、0.1、1.0 mmol·L-1时,IDM的光解速率常数分别为0.00981、0.0113、0.0127、0.0230 min-1. 实验表明,水体中NO3-能促进IDM的紫外降解,并随NO3-浓度的增大而增大.
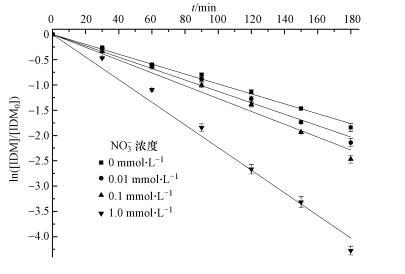 |
| 图 6 不同浓度硝酸根对IDM紫外光降解的影响 Fig. 6 Effect of NO3- concentration on IDM photodegradation under ultraviolet light |
这是因为NO3-可以通过两方面影响IDM的光解:①光掩蔽效应;②通过光解产生·OH和NO2·来促进IDM的降解(式(19)~(21)).有文献报道,由于NO3-会与药物竞争吸收光量子,从而抑制药物在水体中的光解(李超等,2009).从图 7中可以看出,虽然NO3-在紫外可见光谱图内和IDM的谱图有重叠,但两者通过竞争吸光引起的抑制行为在IDM的光降解中并没有起主要作用.相反,由NO3-产生的自由基引起的间接反应在IDM光降解中起主导作用.这一结果和李建(2014)在模拟太阳光下NO3-对IDM光解的影响一致.
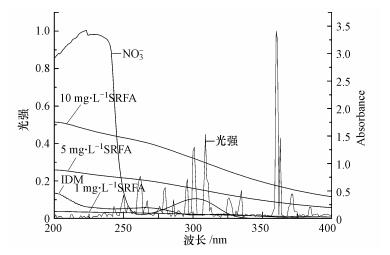 |
| 图 7 4 mg·L-1 IDM、1 mmol·L-1 NO3-和不同浓度SRFA的紫外扫描图及实验中灯源的光强百分比 Fig. 7 Ultraviolet absorption spectra of 4 mg·L-1 IDM,1 mmol·L-1 NO3- and different concentration of SRFA in water and irradiance spectrum of the UV light (relative intensity) |
采用竞争动力学实验,加入了NB作为检测·OH的分子探针来考察体系中是否存在·OH并氧化分解IDM.在稳定光强照射下,·OH的生成及消失速率相等,其浓度达到稳定.由分子探针消失速率计算·OH的稳态浓度[OH]ss(式(2)). 实验测得NB拟一级动力学反应常数kNB=6.3×10-5 s-1,则体系中羟基自由基的浓度[OH]ss=kNB/kP·OH=2.10×10-14 mol·L-1,同时,根据相同光照条件测得IDM的光降解拟一级反应速率常数kIDM=2.07×10-4 s-1,由此计算出IDM与·OH的二级反应速率常数为kIDM·OH=9.86×109 L·mol-1·s-1.得出的kIDM,·OH符合常见非甾体药物与·OH的反应速率(Vione et al.,2011).
SRFA对IDM光降解的影响环境中溶解性物质(DOM)的浓度范围为0.3~30 mg·L-1,其在水环境中扮演的角色复杂,本身是光敏剂又能和其他光敏剂共存产生协同效应,且能猝灭羟基自由基及与目标污染物竞争吸光(Werner et al.,2005).
本研究模拟水体里常见的DOM之一富里酸(SRFA)对IDM紫外光降解的影响. 实验中分别配制0、1、5、10 mg·L-1(以C计)的SRFA来考察其对IDM光解的作用,结果如图 8所示.由图可知,添加不同浓度SRFA会使IDM的光解速率降低,随浓度的增加效果更明显,IDM的速率常数分别为0.00981、0.0080、0.00412、0.00274 min-1.
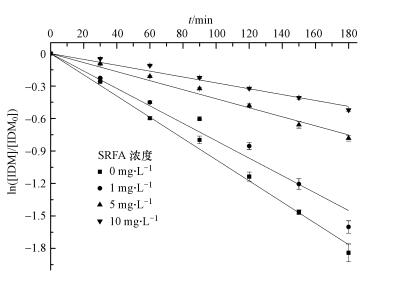 |
| 图 8 不同浓度SRFA对IDM(4 mg·L-1)紫外光降解的影响 Fig. 8 Effect of SRFA concentration on IDM(4 mg·L-1)photodegradation under ultraviolet light |
为了探究SRFA对IDM光降解的影响机制,对实验中3个浓度的SRFA进行紫外光谱图扫描(图 7).从图中可以看出,不同浓度的SRFA的紫外吸收波长都和IDM重叠(200~400 nm),说明屏蔽效应可能成为IDM降解速率降低的重要因素.由此引入屏蔽系数来进一步考察SRFA对IDM光降解的影响.通过式(3)和式(4),算出不同浓度SRFA的总屏蔽系数,由实验结果可知,随着SRFA浓度的增大,屏蔽作用越强(表 2),对IDM的光降解抑制越大.同时,通过总掩蔽系数可算出SRFA对IDM光掩蔽后的理论速率常数k0Sλ,从结果发现,理论速率常数k0Sλ均比实际测得的速率常数ka大.由此可知,SRFA对IDM的光降解除了光屏蔽作用外还存在猝灭ROS的作用.
| 表 2 不同浓度DOM对IDM光降解的影响的屏蔽因子 Table 2 Kinetics parameter of the influence of DOM on the photolysis of 4 mg·L-1 IDM (pH = 7.0) |
1)IDM的紫外光解反应符合准一级动力学规律,其降解速率常数随自身浓度的增大而减小.
2)IDM的紫外降解包括直接光解和ROS参加的自敏化光解.
3)碱性环境有利于IDM的降解,而溶解氧抑制IDM的光解.
4)腐殖酸通过光掩蔽和自由基猝灭两个作用抑制IDM的光解;硝酸根通过接受光量子产生·OH促进IDM的降解.
| [1] | And A T H, Richard C. 2006.Simulated solar light irradiation of mesotrione in natural waters[J]. Environmental Science & Technology, 40 (12): 3842–3847. |
| [2] | Boreen A L, Arnold W A, McNeill K. 2004.Photochemical fate of sulfa drugs in the aquatic environment:sulfa drugs containing five-membered heterocyclic groups[J]. Environmental Science & Technology, 38 (14): 3933–3940. |
| [3] | Buxton G V, Greenstock C L, Helman W P, et al. 1988.Critical review of rate constants for reactions of hydrated electrons,hydrogen atoms and hydroxyl radicals (·OH/·O- in aqueous solution[J]. Journal of Physical and Chemical Reference Data, 17 (2): 513–886. |
| [4] | 陈平, 刘国光, 吕文英, 等.2015.水环境中不同形态氮对甲芬那酸光降解影响机制的研究[J].环境科学学报, 35 (10):3151–3156. |
| [5] | Chen P, Lv W, Chen Z, et al. 2015.Phototransformation of Menamic acid induced by nitrite ions in water:mechanism,toxicity,and degradation pathways[J]. Environmental Science and Pollution Research, 22 (16): 12585–96. |
| [6] | Cogan S, Haas Y. 2008.Self-sensitized photo-oxidation of para-indenylidene-dihydropyridine derivatives[J]. Journal of Photochemistry and Photobiology A:Chemistry, 193 (1): 25–32. |
| [7] | Edwards M, Topp E, Metcalfe C D, et al. 2009.2009.Pharmaceutical and personal care products in tile drainage following surface spreading and injection of dewatered municipal biosolids to an agricultural field[J]. Science of the Total Environment, 407 (14): 4420–4230. |
| [8] | Ge L, Chen J, Wei X, et al. 2010.Aquatic photochemistry of fluoroquinolone antibiotics:kinetics,pathways,and multivariate effects of main water constituents[J]. Environmental Science & Technology, 44 (7): 2400–2405. |
| [9] | Hapeshi E, Achilleos A, Vasquez M I, et al. 2010.Drugs degrading photocatalytically:kinetics and mechanisms of ofloxacin and atenolol removal on titania suspensions[J]. Water Research, 44 (6): 1737–1746. |
| [10] | Jim T Y, Bouwer E J, Coelhan M. 2006.Occurrence and biodegradability studies of selected pharmaceuticals and personal care products in sewage effluent[J]. Agricultural Water Management, 86 (1): 72–80. |
| [11] | Kawabata K, Sugihara K, Sanoh S, et al. 2013.Photodegradation of pharmaceuticals in the aquatic environment by sunlight and UV-A,-B and-C irradiation[J]. The Journal of Toxicological Sciences, 38 (2): 215–223. |
| [12] | Latch D E, Stender B L, Packer J L, et al. 2003.Photochemical fate of pharmaceuticals in the environment:cimetidine and ranitidine[J]. Environmental Science & Technology, 37 (15): 3342–3350. |
| [13] | Li F H, Yao K, Lv W Y, et al. 2015.Photodegradation of Ibuprofen Under UV-Vis Irradiation:Mechanism and Toxicity of Photolysis Products[J]. Bulletin of Environmental Contamination and Toxicology, 94 (4): 479–483. |
| [14] | 雷曙光, 罗永煌, 陈君.2011.吲哚美辛研究概况及其在动物上的应用[J].中国动物保健, 1 :14–17. |
| [15] | 李超, 谢国红, 刘国光, 等.2009.不同形态氮转化对啶虫脒在水溶液中光解的影响[J].环境科学学报, 29 (9):1918–1922. |
| [16] | 李建.2014.吲哚美辛在水溶液中的光化学降解研究[D].广州:广东工业大学.25-27 |
| [17] | Miolo G, Viola G, Vedaldi D, et al. 2002.In vitro phototoxic properties of new 6-desfluoro and 6-fluoro-8-methylquinolones[J]. Toxicology in Vitro, 16 (6): 683–693. |
| [18] | Temussi F, Cermola F, DellaGreca M, et al. 2011.Determination of photostability and photodegradation products of indomethacin in aqueous media[J]. Journal of Pharmaceutical and Biomedical Analysis, 56 (4): 678–683. |
| [19] | Vione D, Maddigapu P R, De Laurentiis E, et al. 2011.Modelling the photochemical fate of ibuprofen in surface waters[J]. Water Research, 45 (20): 6725–6736. |
| [20] | Walse S S, Morgan S L, Kong L, et al. 2004.Role of dissolved organic matter,nitrate,and bicarbonate in the photolysis of aqueous fipronil[J]. Environmental Science & Technology, 38 (14): 3908–3915. |
| [21] | Yamamoto H, Nakamura Y, Moriguchi S, et al. 2009.Persistence and partitioning of eight selected pharmaceuticals in the aquatic environment:laboratory photolysis,biodegradation,and sorption experiments[J]. Water Research, 43 (2): 351–362. |
| [22] | Zepp R G, Schlotzhauer P F, Sink R M. 1985.Photosensitized transformations involving electronic energy transfer in natural waters:role of humic substances[J]. Environmental Science & Technology, 19 (1): 74–81. |
| [23] | Zhang N, Liu G, Liu H, et al. 2011.Diclofenac photodegradation under simulated sunlight:effect of different forms of nitrogen and kinetics[J]. Journal of Hazardous Materials, 192 (1): 411–418. |
| [24] | 张婷, 吴波, 孙娜, 等.2013.吲哚美辛微生物及自然光降解研究[J].湖北大学学报:自然科学版, 35 (4):441–444. |
 2016, Vol. 36
2016, Vol. 36


