2. 武昌首义学院城市建设学院, 武汉 430064
2. Department of Urban Constrution, Wuchang Shouyi University, Wuhan 430064
政府间气候变化专门委员会(IPCC)第五次评估报告第三工作组报告《气候变化2014:减缓气候变化》显示虽然减缓气候变化的政策越来越多,但全球温室气体排放已升至前所未有的水平,只有通过重大体制和技术变革,才能实现全球升温控制在2 ℃以内的目标(IPCC,2014).作为一种主要温室气体,CO2在2010—2014五年间浓度首次超过400 × 10-6(NOAA,2013),以中国为首的发展中国家的CO2排放总量全球占比持续显著上升(邹骥等,2014),同时CO2是一种丰富安全的碳资源(常赵刚等,2013),因此有效捕集及合理利用CO2引起全世界广泛关注.
离子液体(ionic liquids,ILs)作为一种绿色化学的代表溶剂,具有难挥发、结构可调和性质稳定等优点,对CO2有较高的溶解性,能够解决传统醇胺法捕集过程中的易腐蚀设备和吸附效率不高等问题(Sistla et al.,2015; Lu et al.,2014),主要有以咪唑类为主的常规离子液体(Wang et al.,2012)、引入极性基团的功能型离子液体(Sun et al.,2014)、离子液体高聚物(Tang et al.,2005)和支撑离子液体膜(Albo et al.,2012)等.其中,离子液体高聚物聚合的步骤比较复杂,不适合工业应用;支撑离子液体膜较厚(≥150 μm),在高压下从烟道气中分离二氧化碳没有适用性(Scovazzo,2009);而引入胺基基团的功能型离子液体具有更高的稳定性,克服了常规离子液体需要低温和高压下吸收CO2的局限(Aboudi et al.,2015; Sun et al.,2014).其中,课题组胡辉(Hu et al.,2014)和李芳等(2014)研究发现以三乙烯四胺(TETA)为阳离子前驱体合成的多胺基离子液体对CO2展现着优异的吸收性能,但其阴离子的选择有限,具有一定的局限性,需要扩大阴离子范围证明多胺基离子液体的适用性.
本文采用一步合成法合成并纯化了以TETA为阳离子的4种多胺基离子液体([TETAH]+X:X= [Cl]-、[NO3]-、[SO4]2-、[BF4]-),优选出对CO2吸收效果最佳的离子液体,从含水率、气体流量、温度3个单因素方面分析了该离子液体的CO2吸收性能,并结合正交试验进行因素显著性研究,为进一步研究多胺基离子液体吸收CO2工艺提供理论和数据支持.
2 实验部分(Experimental) 2.1 实验试剂三乙烯四胺(TETA,CP)、氟硼酸(HBF4,AR)、乙醚(AR)、无水乙醇(AR),硝酸(HNO3,AR),国药集团化学试剂有限公司.硫酸(H2SO4,AR)、盐酸(HCl,AR),信阳市化学试剂厂.
N2和CO2,纯度≥99.9%,北京普莱克斯实用气体科技有限公司.
2.2 离子液体的合成采用一步合成法(刘植昌等,2011)合成多胺基离子液体:将TETA分别与HCl、HNO3、H2SO4和HBF4按照1:1摩尔比进行酸碱中和反应,并于冰水浴中磁力搅拌6 h,得到离子液体粗产品,再经由乙醚萃取、减压蒸馏和氮气吹扫的方式纯化,最终得到4种目标离子液体([TETAH]+[Cl]-、[TETAH]+[NO3]-、2[TETAH]+[SO4]2-和[TETAH]+[BF4]-),依次编号为1#、2#、3#和4#.
2.3 CO2的吸收采用重量法考察多胺基离子液体对CO2的吸收效果.实验装置如图 1所示,主要由吸收管、恒温水浴锅、气瓶、尾气吸收瓶和缓冲室组成.其中,多余的CO2气体由尾气吸收系统中的NaOH碱液吸收.
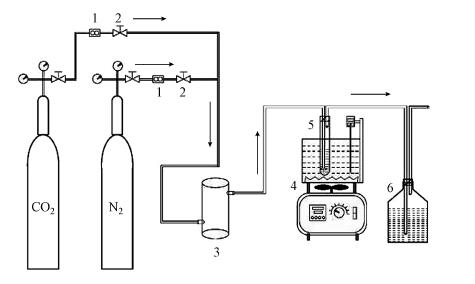 |
| 图 1 多胺基离子液体吸收CO2的装置图(1. 流量计;2. 阀门;3. 缓冲室;4. 恒温水浴锅;5. 吸收管;6. 尾气吸收瓶) Fig. 1 Diagram of CO2 absorption by poly-amino based ionic liquids |
每次实验前,需要在气路中通入N2检查整个气路装置的气密性和排除系统内的空气.主要步骤为:首先在70 ℃下将离子液体置于吸收管内用N2吹扫1 h,再通入CO2(调至所需流量),每间隔一段时间将吸收管移出并密封,用吸水滤纸擦干后,用电子天平称重,并做好记录,直至前后两次重量不变.每次实验装入的离子液体为10 g.
实验条件如表 1所示,首先在Expt.1条件下,对合成的离子液体进行CO2吸收实验,优选出吸收CO2效果最佳的多胺基离子液体;然后通过单因素分析(Expt.2~Expt.4),研究在不同的含水率、气体流量和温度条件下该多胺基离子液体对CO2吸收量的影响.最后通过正交试验探讨含水率、气体流量和温度3个因素对吸收效果的影响,确定因素影响的显著性及最佳吸收条件.
| 表 1 实验条件 Table 1 Experimental conditions |
以X(CO2)和V(CO2)为评价指标,含义如式(1)和(2)所示:
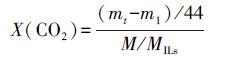
|
(1) |
式中,X(CO2)为CO2摩尔吸收量(mol·mol-1);MILs为多胺基离子液体的分子量(g·mol-1);M为多胺基离子液体的质量(g);m1和mt分别为吸收管在0时刻和t时刻的质量(g).
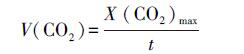
|
(2) |
式中,V(CO2)为平均CO2吸收速率(mol·mol-1·min-1);X(CO2)max为CO2饱和摩尔吸收量(mol·mol-1);t为饱和时间(min).
3 结果与讨论(Results and discussion) 3.1 1#~4#离子液体对CO2的吸收效果研究图 2为1#~4#离子液体在Expt.1条件下对CO2的吸收效果图.由图 2可知,1#~4#离子液体对CO2的摩尔吸收量大小顺序为3#>4#>1#>2#,平均CO2吸收速率的大小依次为1#>3#>4#>2#.虽然3#离子液体的平均吸收速率(9.196 × 10-3 mol·mol-1·min-1)略低于1#离子液体(9.790 × 10-3 mol·mol-1·min-1),但其对CO2的饱和吸收量(1.011 mol·mol-1)约为1#离子液体的2倍(0.489 mol·mol-1),也明显高于其它2种离子液体.综合实验结果可知,3#(2[TETAH]+[SO4]2-)为对CO2吸收效果最佳的离子液体.
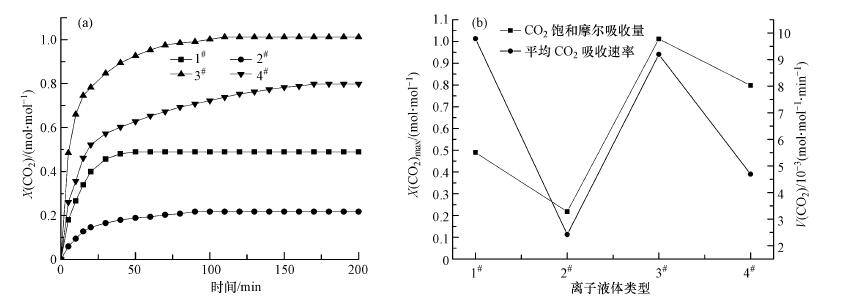 |
| 图 2 1#~4#离子液体对CO2的吸收效果 (a. CO2摩尔吸收量曲线;b. CO2饱和吸收量和平均吸收速率曲线) Fig. 2 Absorption performance of ILs 1#~4# on CO2 |
根据3.1节的分析,以3#(2[TETAH]+[SO4]2-)为研究对象,进一步从含水率、气体流量和温度等因素考察其对CO2吸收量的影响.
3.2.1 不同含水率下3#离子液体对CO2的吸收效果研究图 3为3#离子液体在不同含水率下(Expt.2)对CO2的吸收效果曲线.由图 3可知,随着含水率从0增加到50%,3#离子液体对CO2的摩尔吸收量和平均CO2吸收速率均呈现先增加后降低的趋势,当含水率为40%时,3#离子液体(2[TETAH]+[SO4]2-)对CO2吸收效果最好,其CO2吸收饱和容量和吸收速率分别达到1.184 mol·mol-1和13.150 × 10-3 mol·mol-1·min-1.但当含水率达到50%时,吸收效果下降.这说明在含水率较低时,水的存在会降低离子液体的黏度和离子液体中阴阳离子之间的相互作用(Huddleston et al.,2001; Zhao et al.,2010),增大了离子液体与CO2之间的作用,从而增加传质效果,离子液体与CO2的反应速率也随之加快;但含水率的进一步增大后,极性的水分子基团将占据离子液体的极性位及空穴(Aki et al.,2004),使CO2的溶解度降低,从而影响离子液体与CO2的反应.实验结果说明含水率的增加能促进3#离子液体对CO2吸收效果,但这种促进作用是有限的.
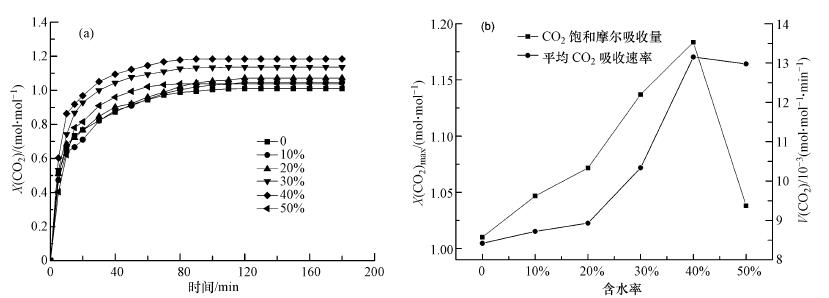 |
| 图 3 不同含水率下3#离子液体对CO2的吸收效果(a. CO2摩尔吸收量曲线;b. CO2饱和吸收量和平均吸收速率曲线) Fig. 3 Absorption of ILs 3# on CO2 under different water contents |
图 4为3#离子液体在不同气体流量下(Expt.3)对CO2的吸收效果曲线.由图 4可知随着流量从50 mL·min-1增加至300 mL·min-1,3#离子液体对CO2吸收饱和量从1.042 mol·mol-1逐渐降低到0.737 mol·mol-1,而CO2平均吸收速率呈上升趋势,从6.950×10-3 mol·mol-1·min-1增加到36.852 × 10-3 mol·mol-1·min-1.
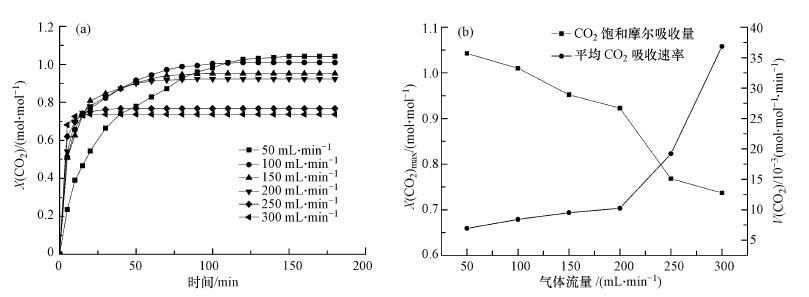 |
| 图 4 不同气体流量下3#离子液体对CO2的吸收效果(a. CO2摩尔吸收量曲线;b. CO2饱和吸收量和平均吸收速率曲线) Fig. 4 Absorption of ILs 3# on CO2 under different gas flow rates |
这是由于一方面增大气体流量会缩短CO2在吸收管内的停留时间,同时也缩短了CO2与3#离子液体的接触反应时间;另一方面进入吸收管内的单位时间的CO2的量随着气体流量的增大而增多,增大了单位时间内的反应气体量.3#离子液体对CO2吸收容量和平均吸收速率受到这两方面作用的共同影响,结合实验结果说明前者的因素影响作用大于后者,使得平均CO2吸收速率随着流量增大而迅速提高,吸收容量小幅度降低.
3.2.3 不同温度下3#离子液体对CO2的吸收效果研究图 5为3#离子液体在不同温度下(Expt.4)对CO2的吸收效果曲线.由图 5可知,随着温度从10 ℃增加至60 ℃,3#离子液体对CO2吸收饱和量从0.991 mol·mol-1逐渐增加到1.107 mol·mol-1,而CO2平均吸收速率呈先上升后下降的趋势,当温度为50 ℃时吸收速率达到最大值18.177 × 10-3 mol·mol-1·min-1,60 ℃时降低至13.838 × 10-3 mol·mol-1·min-1.
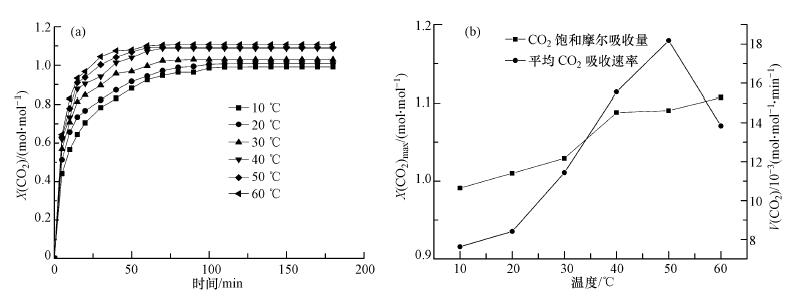 |
| 图 5 不同温度下3#离子液体对CO2的吸收效果(a.CO2摩尔吸收量曲线;b.CO2饱和吸收量和平均吸收速率曲线) Fig. 5 Absorption of ILs 3# on CO2 under different temperature |
| 表 2 正交试验结果 Table 2 Results of orthogonal experiment |
这主要是由于在适宜的温度范围内,离子液体的黏度随着温度的升高而降低,有利于离子液体对CO2的吸收(任树行等,2012),且CO2分子的扩散速度随着温度的升高而加快,使得CO2与离子液体的反应速度也加快,符合热力学和动力学规律.但当温度进一步提高至60 ℃后,由于含有胺基的离子液体对CO2的吸收可逆(Bates et al.,2002),高温将促使反应朝着反方向进行,使得平均CO2吸收速率开始降低.综合实验结果可知温度的增加能促进3#离子液体对CO2吸收效果,但这种促进作用是有限的.
3.3 正交试验分析基于3.1节和3.2节的分析,以X(CO2)为主要评价指标,选取L25(56)正交表进行三因素(A:含水率;B:气体流量;C:温度)五水平(含水率:0%、10%、20%、30%、40%;气体流量:50 mL·min-1、100 mL·min-1、150 mL·min-1、200 mL·min-1、250 mL·min-1;温度:10 ℃、20 ℃、30 ℃、40 ℃、50 ℃)下的正交试验,以进一步了解各因素对3#(2[TETAH]+[SO4]2-)离子液体吸收CO2性能影响的显著性.
表 1为正交试验结果,表中均值1~均值5分别表示各因素各水平下的X(CO2)的均值,其数值越大,表明在该条件下3#离子液体吸收CO2的效果越好,由表 1中均值结果可知3#离子液体吸收CO2的最佳条件是A4B1C1,即含水率30%、气体流量50 mL·min-1、温度10 ℃,此时CO2饱和摩尔吸收量达到1.325 mol·mol-1,是常用混合胺MEA + DETA溶液吸收量的2.2倍(文娟等,2013),也高于新型DBU+甲醇溶液的吸收效果(何都良等,2014),表明在较低的温度和气体流量下3#(2[TETAH]+[SO4]2-)离子液体对CO2具有较高的去除率.
表中极差表示为各因素下最大与最小的均值之差,极差越大表明该因素对CO2吸收效果的影响越大.由表中极差结果可知3#(2[TETAH]+[SO4]2-)离子液体吸收CO2过程中,各因素的影响次序大小为:含水率>气体流量>温度.
4 结论(Conclusions)1)2[TETAH]+[SO4]2-离子液体对CO2吸收效果最优,其CO2的饱和吸收量和平均吸收速率分别达到1.011 mol·mol-1和9.196 × 10-3 mol·mol-1·min-1.
2)2[TETAH]+[SO4]2-离子液体对CO2吸收的单因素影响分析表明:随着含水率的增大,对CO2的摩尔吸收量和平均CO2吸收速率均呈现先增加后降低的趋势,含水率为40%时吸收效果最优;随着流量的增加,对CO2的摩尔吸收量减小,而平均CO2吸收速率增加,流量50 mL·min-1时吸收饱和量最大,流量300 mL·min-1时平均吸收速率最高;随着温度的升高,对CO2吸收饱和量增加,而CO2平均吸收速率呈先上升后下降的趋势,温度50 ℃时吸收速率达到最大值,60 ℃时吸收饱和量最大.
3)正交试验分析表明:2[TETAH]+[SO4]2-离子液体吸收CO2的最佳条件是含水率30%、气体流量50 mL·min-1、温度10 ℃,此时CO2饱和摩尔吸收量达到1.325 mol·mol-1.且各因素对CO2吸收量的影响次序大小为含水率>气体流量>温度.
| [1] | Aboudi J, Vafaeezadeh M. 2015.Efficient and reversible CO2 capture by amine functionalized-silica gel confined task-specific ionic liquid system[J]. Journal of Advanced Research, 6 (4): 571–577. |
| [2] | Aki S N V K, Mellein B R, Saurer E M. 2004.High-pressure phase behavior of carbon dioxide with imidazolium-based ionic liquids[J]. Journal of Physical Chemistry B, 108 : 20355–20365. |
| [3] | Albo J, Santos E, Neves L A, et al. 2012.Separation performance of CO2 through Supported Magnetic Ionic Liquid Membranes (SMILMs)[J]. Separation and Purification Technology, 97 (3): 26–33. |
| [4] | Bates E D, Mayton R D, Ntai L, et al. 2002.CO2 capture by a task-specific ionic liquid[J]. Journal of the American Chemical Society, 120 : 926–927. |
| [5] | 常赵刚, 敖迎春, 杜维, 等.2013.二氧化碳减排及固定的研究进展概述[J].资源节约与环保, 10 (9):114. |
| [6] | 何都良, 常李强, 秦晋凯, 等.2014.DBU 醇溶液对CO2吸收量的影响研究[J].环境科学学报, 35 (10):3316–3322. |
| [7] | Hu H, Li F, Xia Q, et al. 2014.Research on influencing factors and mechanism of CO2 absorption by poly-amino-based ionic liquids[J]. International Journal of Greenhouse Gas Control, 31 : 33–40. |
| [8] | Huddleston J G, Visser A E, Reichert W M, et al. 2001.Characteriation and comparison of hydrophilic and hydrophobic room temperature ionic liquids incorporating the imidazolium cation[J]. Green Chemistry, 3 (4): 156–164. |
| [9] | IPCC. 2014. The Working Group Ⅲ contribution to the IPCC Fifth Assessment Report (WGⅢ AR5) Climate Change 2014:Mitigation of Climate Change[R/OL]. http://mitigation2014.org/report |
| [10] | 李芳.2014.多胺基离子液体吸收CO2的特性实验研究[D].武汉:华中科技大学.25 |
| [11] | 刘植昌,孟祥海,张睿,等.2011.用于吸收酸性气体的含胺基离子液体及其制备方法与应用[P].中国,A,101993378.03-30 |
| [12] | Lu J G, Lu C T, Chen Y, et al. 2014.CO2 capture by membrane absorption coupling process:Application of ionic liquids[J]. Applied Energy, 115 : 573–581. |
| [13] | NOAA.[2014-07-13]. 2013 state of the climate:carbon dioxide tops 400 ppm[R/OL]. http://www.climate.gov/news-features/understanding-climate/2013-state-climate-carbon-dioxide-tops-400-ppm |
| [14] | 任树行.2012.功能化离子液体的定向制备及用于吸收燃煤烟气中SO2和CO2的研究[D].北京:北京化工大学.93 |
| [15] | Scovazzo P. 2009.Determination of the upper limits, benchmarks, and critical properties for gas separations using stabilized room temperature ionic liquid membranes (SILMs) for the purpose of guiding future research[J]. Journal of Membrane Science, 343 (1/2): 199–211. |
| [16] | Sistla Y S, Khanna A. 2015.CO2 absorption studies in amino acid-anion based ionic liquids[J]. Chemical Engineering Journal, 273 : 268–276. |
| [17] | Sun H, Zhou X Q, Xue Z M, et al. 2014. Theoretical investigations on the reaction mechanisms of amine-functionalized ionic liquid[aEMMIM] [BF4] and CO2[J]. International Journal of Greenhouse Gas Control, 20:43-48 |
| [18] | Tang J B, Sun W L, Tang H D. 2005.Enhanced CO2 absorption of poly(ionic liquid)s[J]. Macromolecules, 46 (26): 12460–12467. |
| [19] | Wang M, Zhang L Q., Liu H, et al. 2012.Studies on CO2 absorption performance by imidazole-based ionic liquid mixtures[J]. Journal of Fuel Chemistry and Technology, 40 (10): 1264–1268. |
| [20] | 文娟, 霍春秀, 杨剑, 等.2013.混合胺MEA + DETA 吸收CO2的影响因素[J].环境工程学报, 7 (11):4451–4456. |
| [21] | Zhao W, He G H, Zhang L L, et al. 2010.Effect of water in ionic liquid on the separation performance of supported ionic liquid membrane for CO2/N2[J]. Journal of Membrane Science, 360 : 279–286. |
| [22] | 邹骥, 滕飞, 傅莎.2014.减缓气候变化社会经济评价研究的最新进展一一对IPCC第五次评估报告第三工作组报告的评述[J].气候变化研究进展, 10 (5):313–322. |
 2016, Vol. 36
2016, Vol. 36


