2. 国家环境保护纺织工业污染防治工程技术中心, 上海 201620
2. State Environmental Protection Engineering Center for Pollution Treatment and Control in Textile Industry, Shanghai 201620
MBR是一种应用于水处理领域的新型技术,具有占地面积小、污泥浓度高及出水质量好等优点(Le-Clech et al.,2006),但膜使用寿命和膜污染是阻碍其应用推广的最重要因素(Drews,2010;Meng et al.,2009).膜表面性质,如亲水性、电荷和粗糙度等,在很大程度上决定了膜的水渗透能力和抗污染性能.而膜表面改性技术作为常用的膜表面功能化手段,由于其操作简单、成本低廉,从而受到研究者和工业界的广泛关注,因为表面改性既保持了膜本体材料的优良性能,又赋予了膜其他功能(如抗蛋白质吸附等).
MBR技术是膜在水处理工艺应用的重点.一般认为,MBR膜污染主要是由胞外多聚物(EPS)引起的,而EPS是污水生物处理过程中的微生物分泌于体外的高分子聚合物,如多糖和蛋白质等(Liu et al.,2003).EPS是通过降低菌体表面电荷和大分子间吸附架桥作用,加速微生物在膜表面的附着,由此造成膜表面可逆污染(Ramesh et al.,2007; Yang et al.,2009).有关膜材料的研究发现,通过对微滤(MF)、超滤(UF)和反渗透膜(RO)进行多巴胺涂覆改性,再进行PEG-NH2表面接枝,实验结果表明,接枝改性膜具有较强的抗蛋白质吸附性能;另一方面,由于改性膜的污染阻力得到提高,从而使得膜滤出液水质有所改善(McCloskey et al.,2010; Miller et al.,2014).亲水的聚合多巴胺和PEGs高聚物对蛋白质类物质和微生物的吸附能力较弱(Kang et al.,2007;Van Wagner et al.,2011),因此,如果将此类物质接枝至膜表面,则能够增加膜表面的亲水性,并可以有效抑制污染物质的沉积.
本文对PVDF微滤膜进行聚合多巴胺涂覆改性,以及接枝氨基聚乙二醇(mPEG-NH2),考察微滤膜改性前后纯水通量的变化,研究改性膜在膜生物反应器中短期和长期运行条件下,渗透通量和比膜通量的衰减状况,通过计算过滤阻力和测定膜面滤饼层的胞外多聚物(EPS)含量来分析改性膜的抗污染性能.
2 实验材料和方法(Materials and methods) 2.1 主要试剂与仪器试剂:盐酸多巴胺(Dopamine hydrochloride)、氨基聚乙二醇(mPEG-NH2,M.W.10000)由上海阿拉丁试剂有限公司提供;三羟基氨基甲烷(Tris)、盐酸、异丙醇由中国国药集团上海化学试剂公司提供;无水乙醇由常熟市鸿盛精细化工有限公司提供.
仪器:TS-8型脱色摇床(江苏其林贝尔仪器制造有限公司)、SL-200C型接触角仪(上海梭伦信息科技有限公司)、Nicolet6700傅立叶红外光谱仪(FTIR)(美国Thermo Fisher公司)、S-4800型场发射扫描电镜(日本HITACHI公司)、Nanoscope IV MultiMode原子力扫描电子显微镜(美国Veeco公司)、BT100L型蠕动泵(保定雷弗流体科技有限公司)、JA3-1002型电子天平(上海菁海仪器有限公司).
2.2 PVDF微滤膜表面改性PVDF微滤膜表面改性主要分两个步骤:多巴胺涂覆改性和PEG接枝改性,具体按文献(Li et al.,2014)方法进行.
2.3 膜表征膜在接触角、红外光谱和电镜扫描测试前,需置于真空冷冻干燥箱处理24 h.接触角测定时,每个样品测5次,取其平均值.纯水通量采用死端过滤测试装置(超滤杯)测定(李鑫等,2014),膜片在测试前需经20 min的预压(20 kPa).
2.4 分析方法MLSS和MLVSS采用重量法测定,CODCr采用微波密封消解法测定,NH+4-N采用纳氏试剂法测定;膜表面滤饼层胞外多聚物(EPS)采用热提取方法测定(田禹等,2013);多糖采用苯酚-硫酸法测定,以葡萄糖作为标准物质(DuBois et al.,1956);蛋白质采用修正的Lowry法测定,以牛血清蛋白作为标准物质(Lowry et al.,1951).
2.5 MBR实验装置实验采用PVDF平板微滤膜作为膜改性材料(由中科瑞阳膜技术(北京)有限公司提供),膜孔径为0.1 μm,装配在自制膜组件上,膜组件由两片膜对称放置组成,总装载膜面积为72.6 cm2.由于自制膜组件的膜面积较小,因此,增设原装PVDF平板微滤膜组件(由上海斯纳普膜分离科技有限公司提供),使系统水力停留时间维持在较合理水平,膜孔径为0.1 μm,膜面积为0.1 m2·片-1.
实验采用浸没式膜生物反应器,试验装置如图 1所示.将装配有原膜、多巴胺涂覆改性膜和mPEG-NH2接枝改性膜的3套自制膜组件置于同一MBR中进行平行对比试验,另有一片原装膜组件,因此,总膜面积为0.122 m2.膜生物反应器的有效体积为20 L;缺氧池设置在好氧池前,其有效体积为7 L,污泥回流比为150%;系统温度维持在20 ℃左右.接种污泥取自上海市松江第二污水处理厂二沉池的回流污泥.模拟生活污水配方参考其他研究者成果(Su et al.,2013).MBR主要运行参数见表 1.膜出水依靠蠕动泵抽吸,由无限循环定时器控制,运行8 min,停止2 min;通过连接电脑自动计数的电子天平,来记录一定时间间隔内膜滤出液的质量变化.
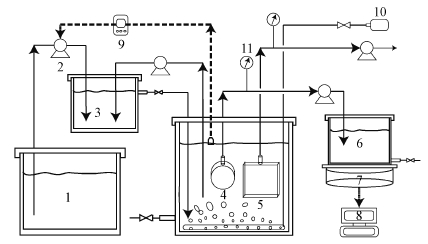 |
| 图 1 MBR系统示意图 (1.模拟生活污水;2.蠕动泵;3.缺氧池;4.自制膜组件;5.原装膜组件;6.滤出液储藏罐;7.电子天平;8.计算机;9.水位控制器;10.曝气泵;11.负压表) Fig. 1 Schematic diagram of the MBR system |
| 表 1 MBR系统的运行条件 Table 1 Operation parameters of the MBR system |
膜过滤阻力是评价膜污染性质的重要指标,根据达西定律,膜过滤阻力可由以下公式求得(Bae et al.,2005):
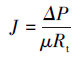
|
(1) |
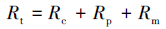
|
(2) |
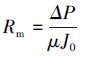
|
(3) |
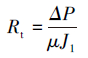
|
(4) |
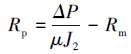
|
(5) |
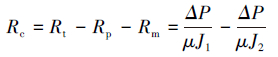
|
(6) |
式中,Rt为膜过滤总阻力(m-1),Rm为膜固有过滤阻力(m-1),Rp为膜孔堵塞引起的不可逆过滤阻力(m-1),Rc为滤饼层和浓差极化形成的可逆过滤阻力(m-1),ΔP为跨膜压差(30 kPa),μ为渗滤液的黏度(CPS),J0为膜初始纯水通量(L·m-2·h-1),J1为膜运行末端的膜通量(L·m-2·h-1),J2为膜去除滤饼层后的纯水通量(L·m-2·h-1).
3 结果与讨论(Results and discussion) 3.1 膜的表征图 2为3种膜片的傅里叶红外光谱图.从图 2可以发现,微滤膜经多巴胺涂覆后,出现1610、1501 cm-1处的N—H弯曲振动峰和CC振动峰,可能分别与聚合多巴胺分子上的—NH2和苯环结构有关(Arena et al.,2011),而接枝mPEG-NH2后,此处峰值变化不大;PEG接枝膜在3367 cm-1处出现的—OH振动峰表现强烈,可能是引入了更多的—OH的缘故(Jiang et al.,2010).表 2是不同改性膜的接触角值.多巴胺涂覆改性膜的接触角明显小于原膜,这是由于聚合多巴胺涂覆层具有强亲水性,一些亲水性基团如—OH、—COOH和—NH2的引入,使膜表面的亲水性大大提高(Arena et al.,2011).PEG接枝后,其接触角从56.2°降低为50.3°,可能是膜表面引入了PEG分子中的—OH,使亲水性得到了进一步提升.图 3表现的是在20 kPa测试条件下,不同改性膜的纯水通量和通量比率.多巴胺涂覆改性膜的纯水通量为217.6 L·m-2·h-1,纯水通量比率(JPDOPA/J0)为0.87,表明多巴胺涂覆使纯水通量略有降低.因为在适当条件下,多巴胺一旦与膜表面接触,便快速地发生自聚合反应,聚合多巴胺粘附在膜表面或者进入膜孔隙内部,积累在膜孔隙;膜孔隙减小引起的水渗透能力下降,可能远远大于膜孔隙润湿性改善对水通量的增益效果(Arena et al.,2014).当接枝mPEG-NH2后,改性膜纯水通量是206.3 L·m-2·h-1,纯水通量比率(JPEG/JPDOPA)为0.95,纯水通量进一步降低,这说明虽然接枝了亲水性更强的PEG分子,但并没有削弱膜孔隙减小对水通量的降低作用.图 4是3种改性膜的场发射扫描电镜(FESEM)照片.通过对比图a、b、c可以发现,经多巴胺涂覆后,膜表面出现较明显的斑驳层状结构,这可能就是聚合多巴胺涂覆层,并且膜孔径有较明显的减小;但在mPEG-NH2接枝前后,膜表面形态变化不大,可能是接枝层厚度远小于涂覆层的缘故.聚合多巴胺和PEG的引入,在一定程度上会减小膜孔径.
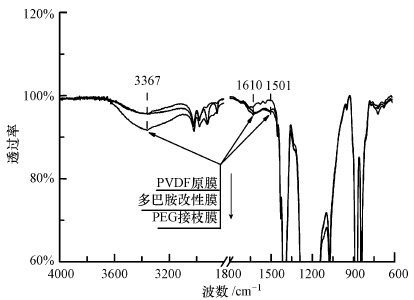 |
| 图 2 3种膜片的红外谱图 Fig. 2 FTIR of three membrane samples |
| 表 2 改性对膜接触角的影响 Table 2 Influence of the modifications on membrane contact angles |
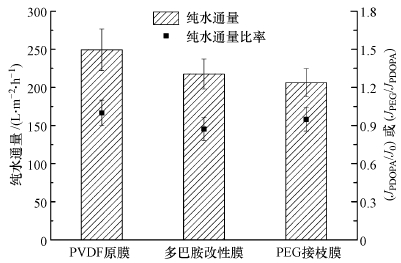 |
| 图 3 改性对膜纯水通量的影响 Fig. 3 Influence of modifications on membrane pure water flux |
 |
| 图 4 原膜(a)、多巴胺改性膜(b)和PEG接枝膜(c)的场发射扫描电镜照片 Fig. 4 FESEM images of unmodified membrane(a), dopamine modified membrane(b), and PEG membrane(c) |
图 5是上述3种改性膜的原子力扫描电镜(AFM)照片,表 3是相对应的最大粗糙度(Rz-range)、均方根粗糙度(Rms)和平均粗糙度(Ra)的数值.与原膜相比,多巴胺涂覆膜表面粗糙度增加显著(Karkhanechi et al.,2014),如平均粗糙度由3.10 nm增至4.52 nm,增加了1.46倍,这表明膜表面存在着聚合多巴胺涂覆层;而在mPEG-NH2接枝前后,改性膜的平均粗糙度变化不大,可能是因为PEG接枝层比聚合多巴胺涂覆层更薄,接枝引起的粗糙度变化太小.
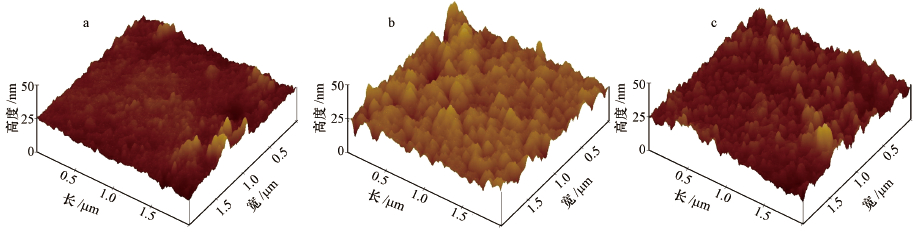 |
| 图 5 原膜(a)、多巴胺改性膜(b)和PEG接枝膜(c)的原子力扫描电镜照片(尺寸大小: 2 μm×2 μm) Fig. 5 AFM images of unmodified membrane(a), dopamine modified membrane(b), and PEG membrane(c) |
| 表 3 不同改性膜的表面粗糙度参数(Rz-range、Rms和Ra) Table 3 Surface roughness parameters (Rz-range, Rms, Ra) of the unmodified and modified membranes |
在本实验中,将原膜、巴胺涂覆改性膜和PEG接枝改性膜都置于同一MBR中进行短期过滤实验,使抽吸压力维持在20 kPa左右,因此,可视为恒压过滤过程.如图 6所示,在最初的100 min内,原膜通量最大,这是因为聚合多巴胺涂覆层和PEG接枝层的存在引起膜孔隙的减小,降低了微滤膜的水渗透能力.随着时间推移,3种微滤膜的通量衰减都非常严重;但在250 min后,改性膜逐渐表现出一定的优势;且当通量衰减变化趋于平缓时,原膜通量为18.9 L·m-2·h-1,而多巴胺涂覆改性膜通量为27.7 L·m-2·h-1,是原膜的146.5%;PEG接枝改性膜通量为30.9 L·m-2·h-1,也就是多巴胺涂覆改性膜的1.1倍.结果表明,聚合多巴胺涂覆层富有的亲水性物质,可能有效抑制了膜表面的微生物吸附和减缓了膜孔堵塞(Miller et al.,2012);另外,PEG接枝可能赋予了膜表面较强的抗蛋白质吸附能力,因此,降低了膜通量的衰减速率.
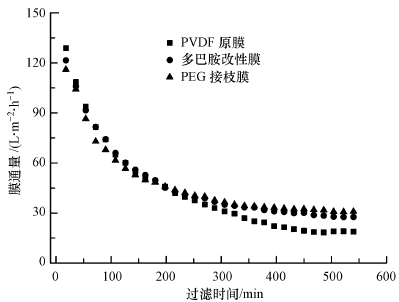 |
| 图 6 短期过滤过程通量随时间变化 Fig. 6 The flux changed with time during a short-term filtration |
图 7a是改性膜在MBR中长期过滤期间跨膜压差随过滤时间增加的递增情况,图 7b是比膜通量随过滤时间增加的衰减情况.膜通量维持在10 L·m-2·h-1左右,当跨膜压差达到30 kPa时,取出该膜片进行人工清洗(使用软质海绵擦拭膜表面)后,再重新启用.图 7表明,从第3天开始,多巴胺涂覆膜的跨膜压差增速逐渐低于原膜(Semião et al.,2013),在第一个过滤周期末的比膜通量为0.455 L·m-2·h-1·kPa-1,而原膜是0.333 L·m-2·h-1·kPa-1;PEG接枝改性膜的比膜通量比多巴胺涂覆膜多37.4%.在第2个过滤周期内,可能是由于膜孔隙被污染物质堵塞,部分孔径减小,所有膜的比膜通量衰减趋势明显快于上一周期.但PEG接枝改性膜仍旧表现出更明显的抗污染能力,在第27天的比膜通量仍比原膜高25%.
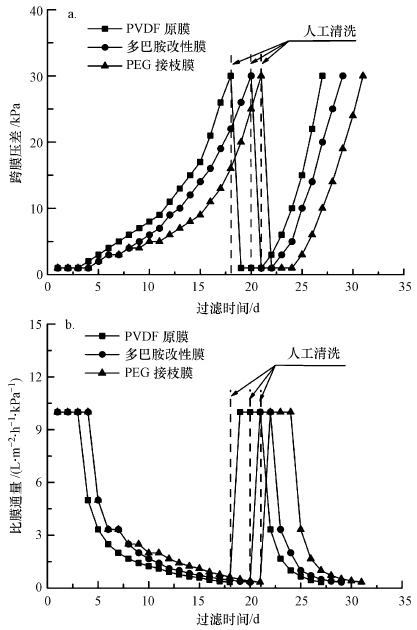 |
| 图 7 长期过滤过程跨膜压差(a)和比膜通量(b)随时间变化 Fig. 7 The changes of trans-membrane pressure(a) and special flux(b) with time during a long-term filtration |
原膜和改性膜在MBR中长期过滤期间,滤出液中COD和NH+4-N的变化及去除率如图 8所示.3种膜对COD和NH+4-N的去除率分别达94%及95%以上,多巴胺涂覆膜表面及内部孔隙小于原膜,其物理截留作用更明显,对污染物的截留能力更强;经PEG接枝改性后,可能进一步减小了膜表面及内部的孔隙,从而提高了对污染物的去除率.
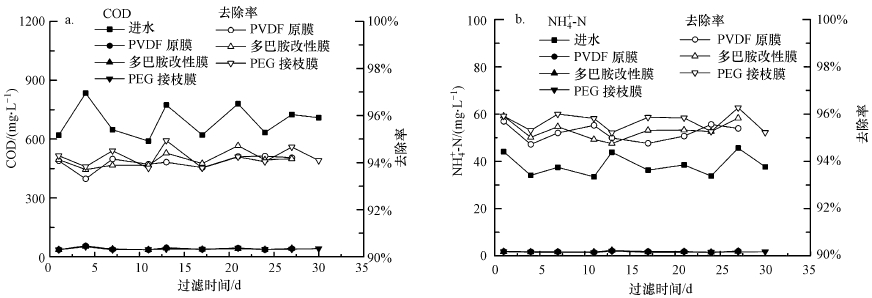 |
| 图 8 MBR进出水COD(a)和NH+4-N(b)及其去除率随时间变化 Fig. 8 Removals and concentration of COD(a) and NH+4-N(b) with running time during a long-term filtration test |
在第一个过滤周期终止后,本文测定了不同改性膜的过滤阻力,结果如表 4所示.改性膜的膜过滤总阻力(Rt)明显低于原膜,多巴胺涂覆改性膜和PEG接枝改性膜的总膜阻力分别为原膜的87.60%、80.70%;且泥饼层阻力(Rc)在膜过滤总阻力中占有了最大比例,主要是MBR中的较高污泥浓度所致;改性膜的不可逆过滤阻力(Rp)明显小于原膜,原膜的值在总膜阻中的占比为1.22%,多巴胺涂覆膜和PEG接枝膜分别为0.99%和0.65%,这说明涂覆和接枝物质可能有效抑制了难清洗的污染物质在膜孔隙中的积累和吸附,这种抑制作用可能和膜表面孔径的缩小和亲水性增强有关(Liu et al.,2013).
| 表 4 原膜与改性膜在MBR长期运行过程中的膜阻力分析 Table 4 Analysis on the resistance of unmodified and modified membranes during a long-term filtration in MBR |
根据主流观点,多糖和蛋白质是膜污染的主要有机物,多糖类物质通过氢键与膜表面发生结合,而蛋白质由于其两性特征通过偶极作用或以胶体形成凝胶的形式与膜面结合(Amy et al.,2008).本实验中,用橡胶棒刮取膜表面滤饼层测定胞外多聚物(EPS)中蛋白质和多糖的含量.从表 5可以看出,原膜表面滤饼层中蛋白质和多糖含量最多,为175.45 mg·g-1(以VSS计),分别是多巴胺涂覆膜和PEG接枝改性膜的1.10倍和1.15倍.膜表面积累的蛋白质占比更大,如原膜的蛋白质占比为79.56%;但经PD涂覆改性后,蛋白质占比降低为73.30%;可能由于抗蛋白吸附分子的引入,PEG接枝改性膜表面蛋白质占比又低于多巴胺涂覆膜4.6%.实验结果与设想相符,由于PD涂覆层和PEG接枝层上大量羟基的存在,增加了多糖类物质的吸附而减少了蛋白质类物质的吸附,而在滤饼层阻力中蛋白质的作用要比多糖占优势(Anja et al.,2006),因此,PD涂覆和PEG接枝降低了膜污染的总阻力.
| 表 5 原膜与改性膜长期过滤后的膜面蛋白质和多糖分析 Table 5 Analysis on the protein and polysaccharide to the unmodified and modified membrane surface during a long-term filtration |
从图 9可以看到不同改性膜在膜生物反应器运行两个周期后膜表面的污染状况.原膜表面存在着较大面积的块状污染物粘附层,膜孔几乎都被污染物覆盖(图 9a);而聚合多巴胺涂覆改性膜表面受污染状况较轻,污染物粘附层较松散,部分膜孔表面未被污染物堵塞(图 9b),是由于膜表面聚合多巴胺涂覆层的亲水性和荷电性,降低了蛋白质类污染物的吸附;PEG接枝改性膜表面受污染程度(图 9c)与前者很接近,可能是由于接枝的PEG会进一步提高膜表面对蛋白质类污染物的抗吸附能力.
 |
| 图 9 原膜(a)、多巴胺改性膜(b)和PEG接枝膜(c)长期过滤后的场发射扫描电镜照片 Fig. 9 FESEM images of unmodified membrane(a), dopamine modified membrane(b), and PEG membrane(c) after long-term filtration |
图 10为不同改性膜在长期恒流过滤后的傅里叶红外光谱图.在1647 cm-1处的酰胺基团(肽键),以及1548 cm-1处的N—H弯曲振动峰与C—N伸缩振动峰的叠加,都可能与膜面蛋白质分子上的—NH2有关,而原膜比改性膜表现得更为强烈,说明原膜吸附了更多的蛋白质类有机物;PEG接枝膜在1039 cm-1处的吸收峰最明显,可能与多糖类物质中的C—O有关(Nguyen et al.,2015).
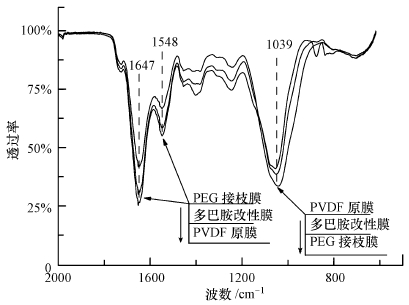 |
| 图 10 3种膜片长期过滤后的红外图谱分析 Fig. 10 FTIR of three membranes after a long-term filtration |
将原膜、多巴胺改性膜和PEG接枝膜置于MBR反应器中运行15 d后,对污染膜进行清洗.首先进行120 min的水力清洗,使用磁力搅拌器使超滤饼内的转子转动,从而在膜表面形成强大的水力剪切力,转子转动速度为1000 r·min-1,水力清洗和化学试剂清洗均施加0.02 MPa的压力,再先后进行下列步骤(杨林明等,2014):①采用pH=3的柠檬酸溶液进行60 min的化学试剂清洗;②利用50 ℃、1%的表面活性剂(主要成分为十二烷基磺酸钠)中性溶液进行60 min的化学试剂清洗.两种清洗完成后,通量恢复情况如图 11所示,多巴胺改性膜和PEG接枝膜的通量恢复率均有明显提高,经50 ℃、1%的表面活性剂的清洗,改性膜表面粘附的蛋白质或脂类污染物更易被洗脱,PEG接枝膜通量恢复率达81%.
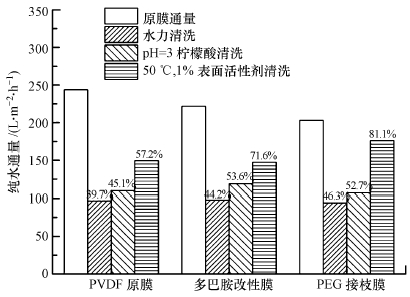 |
| 图 11 膜清洗通量恢复情况 (图中百分数为通量恢复率) Fig. 11 Flux recovery of the membranes with membrane washing |
1) 利用PD改性在PVDF微滤膜表面形成PD层,在此基础上接枝mPEG-NH2,引入了功能性基团.多巴胺涂覆改性使膜表面粗糙度增大,接触角减小,且亲水性提高;接枝mPEG-NH2后,膜表面粗糙度变化不明显,但亲水性得到进一步提高.
2) 多巴胺涂覆改性膜进行短期恒压过滤实验后,通量衰减速率减缓,其稳定通量是原膜的1.47倍,mPEG-NH2接枝改性膜的抗污染能力有进一步提升.在长期恒流过滤实验中,多巴胺改性膜的跨膜压差增速降低,即比膜通量衰减趋势更平缓;经多巴胺涂覆后,膜面滤饼层EPS含量较原膜有9.23%的降低,且蛋白质占比由79.56%降至73.30%,接枝mPEG-NH2后,改性膜抗污染能力进一步增强.
| [1] | Amy G. 2008.Fundamental understanding of organic matter fouling of membranes[J]. Desalination, 231 (1/3): 44–51. |
| [2] | Anja D, Lee C H, Kraume M. 2006.Membrane fouling-a review on the role of EPS[J]. Desalination, 200 (1/3): 186–188. |
| [3] | Arena J T, McCloskey B, Freeman B D, et al. 2011.Surface modification of thin film composite membrane support layers with polydopamine:Enabling use of reverse osmosis membranes in pressure retarded osmosis[J]. Journal of Membrane Science, 375 (1/2): 55–62. |
| [4] | Arena J T, Manickam S S, Reimund K K, et al. 2014.Solute and water transport in forward osmosis using polydopamine modified thin film composite membranes[J]. Desalination, 343 : 8–16. |
| [5] | Bae T H, Tak T M. 2005.Interpretation of fouling characteristics of ultrafiltration membranes during the filtration of membrane bioreactor mixed liquor[J]. Journal of Membrane Science, 264 (1/2): 151–160. |
| [6] | Drews A. 2010.Membrane fouling in membrane bioreactors-Characterisation,contradictions,cause and cures[J]. Journal of Membrane Science, 363 (1/2): 1–28. |
| [7] | DuBois M, Gilles K A, Hamilton J K, et al. 1956.Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry, 28 (3): 350–356. |
| [8] | Jiang J H, Zhu L P, Li X L, et al. 2010.Surface modification of PE porous membranes based on the strong adhesion of polydopamine and covalent immobilization of heparin[J]. Journal of Membrane Science, 364 (1/2): 194–202. |
| [9] | Kang G D, Liu M, Cao Y M. 2007.A novel method of surface modification on thin-film composite reverse osmosis membrane by grafting poly (ethylene glycol)[J]. Polymer, 48 (5): 1165–1170. |
| [10] | Karkhanechi H, Takagi R, Matsuyama H. 2014.Biofouling resistance of reverse osmosis membrane modified with polydopamine[J]. Desalination, 336 : 87–96. |
| [11] | Le-Clech P, Chen V, Fane T A G. 2006.Fouling in membrane bioreactors used in wastewater treatment[J]. Journal of Membrane Science, 284 (1/2): 17–53. |
| [12] | Li F, Meng J Q, Ye J F, et al. 2014.Surface modification of PES ultrafiltration membrane by polydopamine coating and poly(ethylene glycol) grafting:Morphology,stability,and anti-fouling[J]. Desalination, 344 : 422–430. |
| [13] | 李鑫, 方小峰, 李健生, 等.2014.纳米Ag粒子原位杂化PVDF超滤膜的抗污染性能[J].环境科学学报, 34 (3):638–644. |
| [14] | Liu L F, Bing S, Yang F L. 2013.Polydopamine coating-Surface modification of polyester filter and fouling reduction[J]. Separation and Purification Technology, 118 : 226–233. |
| [15] | Liu Y, Fang H H P. 2003.Influences of extracellular polymeric substances (EPS) on flocculation,settling,and dewatering of activated sludge[J]. Critical Reviews in Environmental Science and Technology, 33 (3): 237–273. |
| [16] | Lowry O H, Rosebrough N J, Farr A L, et al. 1951.Protein measurement with the Folin phenol reagent[J]. Journal of Biological Chemistry, 193 : 265–275. |
| [17] | McCloskey B D, Park H B, Hao J, et al. 2010.Influence of polydopamine deposition conditions on pure water flux and foulant adhesion resistance of reverse osmosis,ultrafiltration,and microfiltration membranes[J]. Polymer, 51 (15): 3472–3485. |
| [18] | Meng F G, Chae S R, Drews A, et al. 2009.Recent advances in membrane bioreactors (MBRs):Membrane fouling and membrane material[J]. Water Research, 43 (6): 1489–1512. |
| [19] | Miller D J, Araújo P A, Correia P B, et al. 2012.Short-term adhesion and long-term biofouling testing of polydopamine and poly (ethylene glycol) surface modifications of membranes and feed spacers for biofouling control[J]. Water Research, 46 (12): 3737–3753. |
| [20] | Miller D J, Kasemset S, Wang L, et al. 2014.Constant flux crossflow filtration evaluation of surface-modified fouling-resistant membranes[J]. Journal of Membrane Science, 452 : 171–183. |
| [21] | Nguyen N C, Chen S S, Nguyen H T, et al. 2015.Applicability of a novel osmotic membrane bioreactor using a specific draw solution in wastewater treatment[J]. Science of the Total Environment, 518-519 : 586–594. |
| [22] | Ramesh A, Lee D J, Lai J Y. 2007.Membrane biofouling by extracellular polymeric substances or soluble microbial products from membrane bioreactor sludge[J]. Applied Microbiology and Biotechnology, 74 (3): 699–707. |
| [23] | Semião A J C, Habimana O, Cao H, et al. 2013.The importance of laboratory water quality for studying initial bacterial adhesion during NF filtration processes[J]. Water Research, 47 (8): 2909–2920. |
| [24] | Su X Y, Tian Y, Sun Z C, et al. 2013.Performance of a combined system of microbial fuel cell and membrane bioreactor:Wastewater treatment,sludge reduction,energy recovery and membrane fouling[J]. Biosensors and Bioelectronics, 49 : 92–98. |
| [25] | 田禹, 李志能, 陈琳.2013.正常污泥和膨胀污泥中EPS膜污染特性及其与膜表面作用能分析[J].环境科学学报, 33 (5):1224–1230. |
| [26] | Van Wagner E M, Sagle A C, Sharma M M, et al. 2011.Surface modification of commercial polyamide desalination membranes using poly(ethylene glycol) diglycidyl ether to enhance membrane fouling resistance[J]. Journal of Membrane Science, 367 (1/2): 273–287. |
| [27] | 杨林明, 李方, 杜春慧, 等.2014.利用聚合多巴胺及PEG对PVDF中空纤维膜进行表面功能化的研究[J].膜科学与技术, 34 (3):23–29. |
| [28] | Yang S F, Li X Y. 2009.Influences of extracellular polymeric substances (EPS) on the characteristics of activated sludge under non-steady-state conditions[J]. Process Biochemistry, 44 (1): 91–96. |
 2016, Vol. 36
2016, Vol. 36


