2. 浙江省植物进化生态学与保护重点实验室, 台州 318000
2. Zhejiang Provincial Key Laboratory of Plant Evolutionary Ecology and Conservation, Taizhou 318000
镉(Cd)是一种对人类和其它动植物均有毒害作用的重金属(Shute et al.,2006;Nagajyoti et al.,2010;Dias et al.,2013).我国环境保护部和国土资源部于2014年4月公布的《全国土壤污染状况调查公报》显示,Cd已成为我国受污染土壤中最主要的无机污染物之一.研究发现,Cd较易被植物尤其是一些农作物吸收并富集,造成生长抑制、株型矮小、叶片失绿和光合作用降低(Ivanova et al.,2008;高芳等,2011;陈虎等,2013).通过食物链,Cd还会在动物体(包括人体)肝、肾等器官大量积累,最终抑制器官酶系统,影响生理代谢,并对身体各大系统产生不同程度的损害(Jin et al.,2002;魏筱红等,2007;Hartwig,2013).
针对土壤重金属污染,生物修复法较多且效果较好(Ali et al.,2013).但目前通过植物修复重金属污染土壤的研究大多集中于污染土壤中自然生长的不同植物重金属特征比较或单物种对重金属的富集(高洁等,2012;曹福亮等,2012;孙晓灿等,2012).有关植物物种多样性与生态系统功能的研究发现,植物物种多样性的增加会通过“选择效应”(随着物种数增加,随机带入高产物种的可能性随之增加,最终使整个群落的均产值提高)或“互补效应”(群落中各物种通过互补利用资源,或者种间促进作用来提高产值)提高生态系统生产力(Yachi et al.,1999;Loreau et al.,2001;Hooper et al.,2005),增加入侵抵抗力(Fargione et al.,2005)和凋落物分解能力(Hättenschwiler et al.,2005).近期,利用微藻修复水体Cd污染的研究发现,种间促进作用可显著提高微藻对Cd的吸收(Li et al.,2012).对陆生植物的研究也发现,植物物种多样性可通过互补效应增强其对复合重金属污染的修复能力(Wang et al.,2014).此外,植物混种比例不同还会影响其对重金属Cd和Zn的富集量、富集系数和转运系数(杨远祥等,2014).但不同重金属会通过相加作用、联合作用或单独作用对植物产生影响.目前,有关植物物种多样性的增加是否能提高土壤重金属单污染的修复能力并不清楚.
因此,本研究选取对环境条件要求不高、生长周期短的本地草本植物,通过模拟Cd污染土壤,研究植物物种多样性对土壤Cd污染修复的影响,探讨植物物种多样性对土壤Cd污染修复的作用机理,以期为利用本地常见短世代周期植物进行土壤重金属污染修复提供理论依据.
2 材料与方法(Materials and methods) 2.1 实验材料采集数种处于同一生长期的本地常见草本植物,分别栽种于Cd处理土壤中,3周后挑选存活率较高(至少大于60%)、生长情况良好的6种本地常见草本植物:荆芥(Nepeta cataria)、鸡眼草(Kummerowia striata)、短叶水蜈蚣(Kyllinga brevifolia)、牛筋草(Eleusine indica)、鸭跖草(Commelina communis)和细风轮菜(Clinopodium gracile)为实验材料.剔除掉爵床(Rostellularia procumbens)、酢酱草(Oxalis corniculata)、破铜钱(Hydrocotyle sibthorpioides)、鬼针草(Bidens pilosa)和白车轴草(Trifolium repens)5种.于2014年7月19日野外收集健康且处于同一生长期的植株,栽种于长56 cm、宽38 cm的塑料培养箱中备用.
实验所用土壤为本地农田土(浙江省台州学院椒江校区后山脚,附近无Cd污染源),风干,过筛(孔径1 cm)后备用.根据浙江省台州市路桥区土壤Cd污染平均水平(王世纪等,2006),用CdSO4·5H2O分析纯将实验土壤配制成Cd含量为250 mg·kg-1的模拟Cd污染土壤.土壤中添加的CdSO4·5H2O的质量(g)根据公式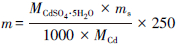
实验根据有条件的随机分割物种库的方法(Bell et al.,2009),共设置4个物种丰富度水平(R= 1、2、3、6).单物种水平:每个物种12个重复;2-物种水平:6个组合,每个重复6次;3-物种水平:4个组合,每个重复6次;6-物种水平:重复12次;一共144(24×6)个样方.
每个样方用长23 cm、宽18.5 cm、高13 cm的花盆构建,2014年8月4日每个花盆中种植6株,单物种处理种植6株相同物种,多物种处理不同物种等比例混合.样方建立后2周内,对死亡植株进行替换.2014年9月1日开始对植物进行指标测定和收获.
2.3 指标测定方法株高用直尺测量;叶绿素相对含量用CCM-200plus 叶绿素含量测定仪(OPTI-SCIENCES,USA)测定,每个存活植株选择3片叶位一致(植株顶部向下第3~5片)的叶片测定;叶绿素荧光参数用OS30P便携式叶绿素荧光仪(OPTI-SCIENCES,USA)测定,所取叶片与测定叶绿素相对含量时所取一致,于叶绿素相对含量测定之后对叶片用不同颜色的荧光染料标记,夜间暗适应至少30 min后测定.之后对各样方中不同物种分开收集,用WinRHIZO根系分析系统(Regent Instruments Inc.,Quebec,Canada)及扫描仪(Epson 1680)对根总长、根总表面积、根总体积、根平均直径和根尖总数进行测定.各物种植株地上部分和地下部分于105 ℃杀青后70 ℃分别烘干后称重.样方土壤风干后备用.
烘干的植物地上部分、地下部分及风干土壤研磨后过1 mm筛,植物用MARS 240/50微波消解仪(CEM,Matthews,NC,USA;HNO3:H2O2= 3:1,体积比)进行消化,土壤用高氯酸-硝酸-盐酸法进行消化,消化后用电感耦合等离子体发射光谱仪(ICP/OES,Optima 2100DV,Perkin Elemer,USA)测定Cd含量.通过计算获得富集系数(BCF)和迁移系数(TF):
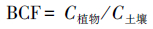
|
(1) |

|
(2) |
式中,C植物、C土壤、C地上、C地下分别表示植物重金属含量、土壤重金属含量、植物地上部分重金属含量、植物地下部分重金属含量.
2.4 数据分析通过如下公式对植物物种多样性净效应进行计算,并对净效应分割求出选择效应和互补效应(Loreau et al.,2001):
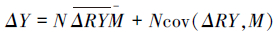
|
(3) |
式中,ΔY为净效应,NΔRYM为互补效应;Ncov(ΔRY,M)为选择效应;N为混种样方的物种数;ΔRY为物种在混种时相对观察值与期望值间的偏差;M为单种平均值;cov(ΔRY,M)为观察值和期望值偏差与单种观察值的协方差.
实验数据用SPSS 16.0软件进行统计分析,采用单因素方差分析(One-way ANOVA)对不同植物物种多样性间各指标进行差异显著性检验,并对各指标随植物物种多样性变化的线性回归显著性进行检验.另外,用Pearson相关性检验分析不同指标间的相关性.
3 结果(Results) 3.1 植物物种多样性对植物生长和根系形态的影响及其多样性效应 3.1.1 植物生长收获期对样方植株统计发现,6-物种、3-物种、2-物种和单物种处理的植株存活率分别为71.21%、51.39%、49.07%和48.15%.由表 1可知,在Cd处理条件下,植物物种多样性的增加促进了地下生物量和总生物量的积累.6-物种处理的地下生物量和总生物量均高于单物种、2-物种和3-物种处理,且6-物种处理与2-物种和3-物种处理的地下生物量具有显著差异,6-物种与3-物种处理的总生物量具有显著差异.同时,6-物种处理的根冠比和地上生物量也高于其它处理,但差异不显著.
| 表 1 植物物种多样性对植物生长的影响 Table 1 Effects of plant species diversity on plant growth |
对植物生长指标的多样性效应分析表明,6-物种处理条件下,植株平均株高、地上生物量和总生物量的净效应显著高于2-物种和3-物种处理(图 1).对净效应分割发现,6-物种处理的互补效应与净效应变化情况一致,而选择效应不随植物物种多样性的变化而变化.因此,植物物种多样性对生长指标的净效应主要由互补效应引起.
 |
| 图 1 植株生长指标的多样性效应 a.株高;b.根冠比;c.地上生物量;d.地下生物量;e.总生物量 Fig. 1 Diversity effect on plants growth indices a. Plant height; b. Root shoot ratio; c. Above-ground biomass; d. Underground biomass; e. Total biomass |
对植物根系形态指标随植物物种多样性的增加进行线性回归后发现(图 2),植物根总长、根总表面积、根尖总数和根平均直径随物种多样性的升高而显著增加.
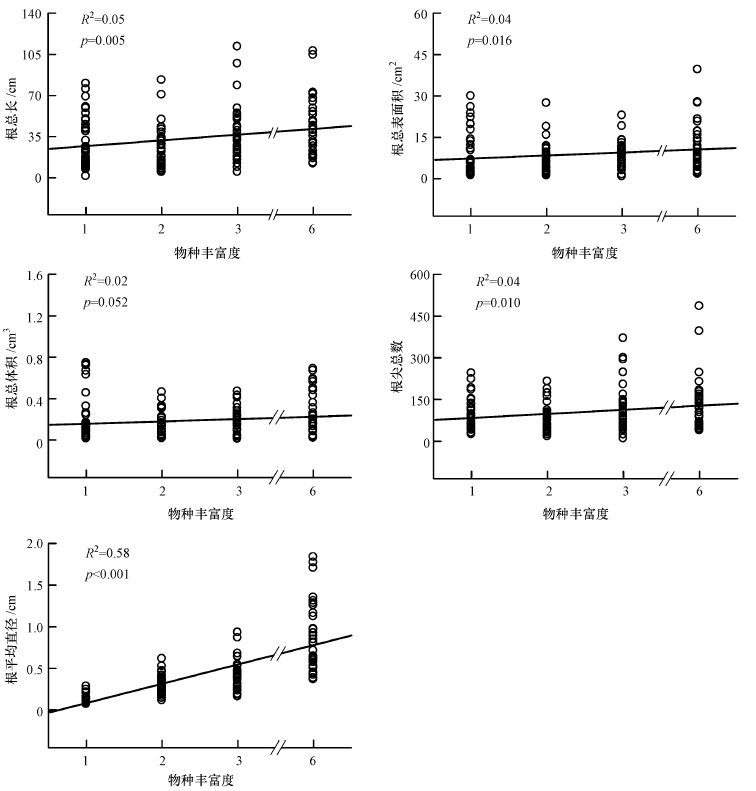 |
| 图 2 植物物种多样性对植物根系形态的影响 R2表示调整后的决定系数,p为回归显著性(p≥0.05,不显著; 0.01≤p < 0.05,显著; p < 0.01,极显著;下同);圆圈为样方数据点 Fig. 2 Effects of plant species diversity on root morphology |
对植株根系形态的多样性效应分析发现(图 3),6-物种处理下植物根总长、根总表面积、根总体积和根平均直径的净效应显著高于2-物种和3-物种处理;6-物种和3-物种处理对植物根尖总数的净效应显著高于2-物种处理.对净效应分割发现,互补效应和负选择效应均随植物物种多样性的增加而增加.因此,植物物种多样性对植物根系的促进作用也是由互补效应引起.
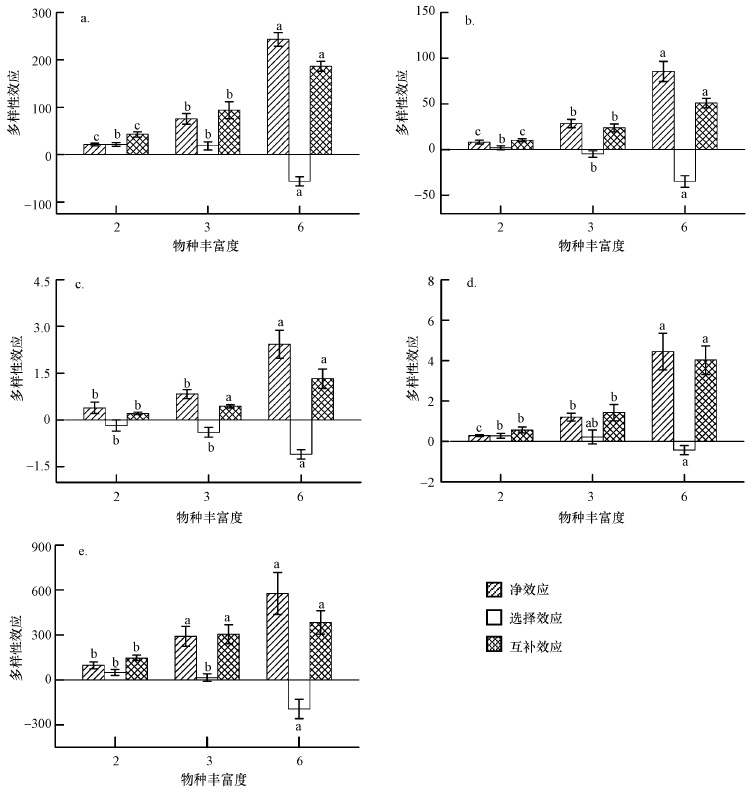 |
| 图 3 植株根系形态的多样性效应 a.根总长;b.根总表面积;c.根总体积;d.根平均直径;e.根尖总数 Fig. 3 Diversity effect on root morphology a. Root length; b. Root surface area; c. Root volume; d. Root average diameter; e. Number of root tip |
由表 2可知,在Cd处理条件下,随着物种数增加,植物PSII原初光能转化效率(Fv/Fm)、PSII潜在活性(Fv/F0)显著提高,而6-物种处理下植物初始荧光(F0)显著低于其它处理.相关性分析表明,植株F0与植株总Cd含量(p=0.002)及植株地下部分Cd含量(p=0.009)呈显著负相关.但不同植物物种多样性处理间的植物叶绿素相对含量和最大荧光产量(Fm)无显著差异.相关性分析表明,叶绿素相对含量与植物地上生物量、地下生物量及地上Cd含量和总Cd含量呈显著正相关.
| 表 2 植物物种多样性对植物光合生理指标的影响 Table 2 Influence of plant species diversity on plants photosynthetic physiology indices |
多样性效应分析表明(图 4),Cd污染条件下植物物种多样性的增加对植株叶绿素相对含量、Fm、F0及Fv/F0具有显著的净效应;其中,6-物种处理的互补效应均高于2-物种和3-物种处理.物种数的增加对Fv/Fm的多样性效应无显著影响.
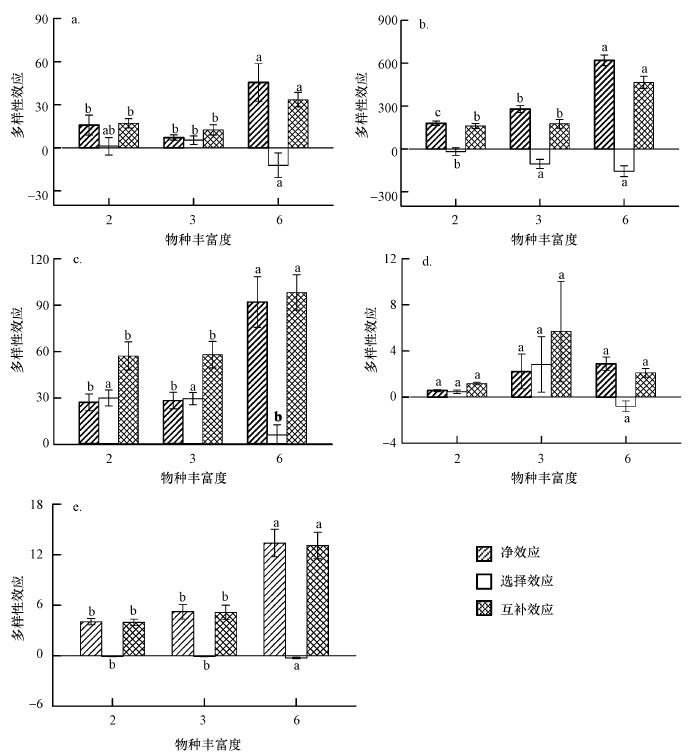 |
| 图 4 植物叶绿素相对含量及叶绿素荧光参数的多样性效应 a.叶绿素相对含量;b.最大荧光产量;c.初始荧光;d.PSII原初光能转化效率;e. PSII潜在活性 Fig. 4 Diversity effect of chlorophyll content and fluorescence parameters a. Chlorophyll relative content; b. Fm; c. F0; d. Fv/Fm; e. Fv/F0 |
随处理物种数的增加,植物地上、地下Cd含量(积累量)及总Cd含量(积累量)呈显著的线性增长趋势.单因素方差分析显示,不同处理间,植株地下部分Cd含量差异显著(6-物种处理显著高于其它处理,p≤0.001;3-物种处理显著高于单物种处理,p=0.002);植株总Cd含量亦是如此(6-物种处理显著高于其它处理,p≤0.006;3-物种处理显著高于单物种处理,p=0.002);对于植株地上部分Cd含量,6-物种处理显著高于其它处理(p≤0.01).
植株Cd积累量变化趋势与Cd含量类似.对于地上Cd积累量,单物种与其它3种多样性处理之间存在显著差异(2-物种、6-物种处理显著高于单物种处理,p≤0.005);对于地下Cd积累量,在6-物种处理与其它处理之间存在显著差异(p < 0.05);总Cd积累量在6-物种与其它多样性处理之间存在显著差异(p < 0.03).
相关性分析表明,地上Cd积累量和地下Cd积累量分别与地上生物量和地下生物量呈现显著正相关(p < 0.001).因此,植物对Cd吸收的增加可能与生物量的增加密切相关.此外,植株地上Cd积累量和总Cd积累量与根系形态指标(根总长、根总表面积、根体积和根平均直径)均呈现显著正相关,但地下Cd积累量却与根系形态指标均无显著相关性.植株F0与植株总Cd含量(p=0.002)及植株地下部分Cd积累量(p= 0.009)呈显著负相关,在不同处理植株间Cd含量(积累量)之间的显著差异体现出植物物种多样性的提高可在一定程度上提高植物对Cd的吸收,这一点在植株富集系数上有明显体现:随物种数增加,富集系数呈显著线性增长趋势;但植物物种数的提高对迁移系数的影响不甚明显(图 5).
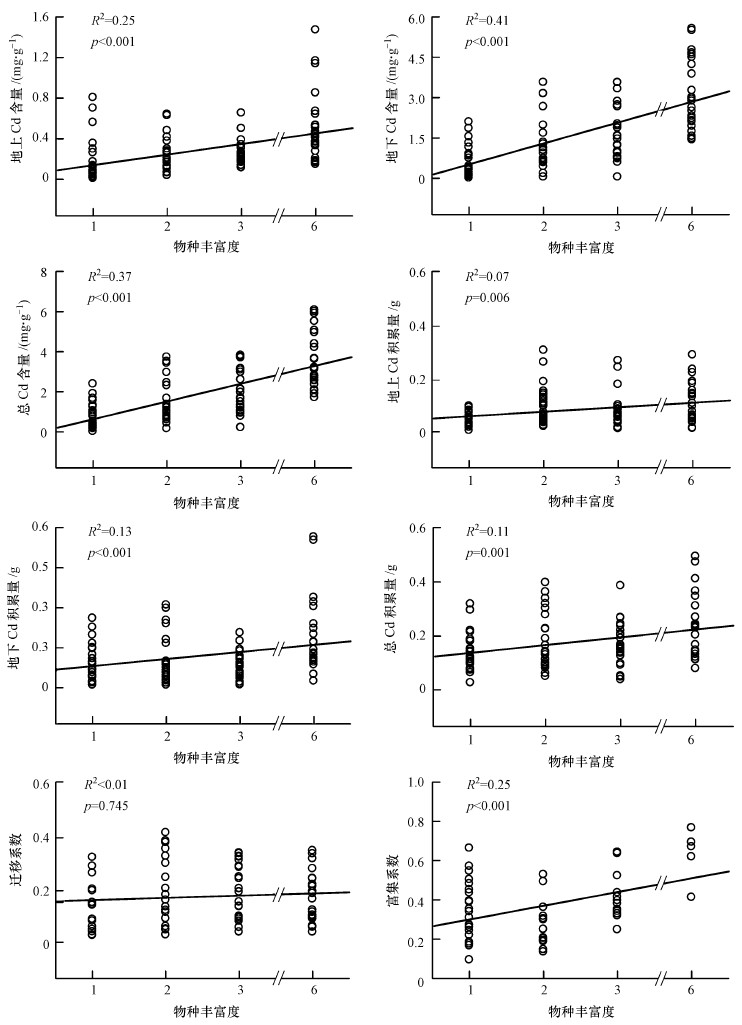 |
| 图 5 植物物种多样性对土壤Cd修复的影响 Fig. 5 Effects of plant species diversity on soil Cd removal |
多样性效应分析表明(图 6),6-物种对地上Cd含量、地上Cd积累量和地下Cd积累量的净效应显著高于2-物种和3-物种处理,但其中只有地上Cd含量的净效应主要由互补效应引起.地下Cd含量和总多样性效应计算结果显示,随着植物物种多样性增加,互补效应显著增强,如6-物种处理下,植株地上部分Cd含量、地下部分Cd含量(积累量)、总Cd含量(积累量)及富集系数与2-物种、3-物种处理间存在显著差异(p≤0.037).在某些指标中,选择效应强度与互补效应接近,但总体变化趋势无显著规律性.净效应主要由互补效应引起,物种数的增多同样可引起净效应的增强:6-物种处理下,植株地上部分Cd含量(积累量)、地下部分Cd含量及总Cd含量与2-物种、3-物种处理间存在显著差异(p≤0.03).而物种数的变化对迁移系数多样性效应无显著影响.
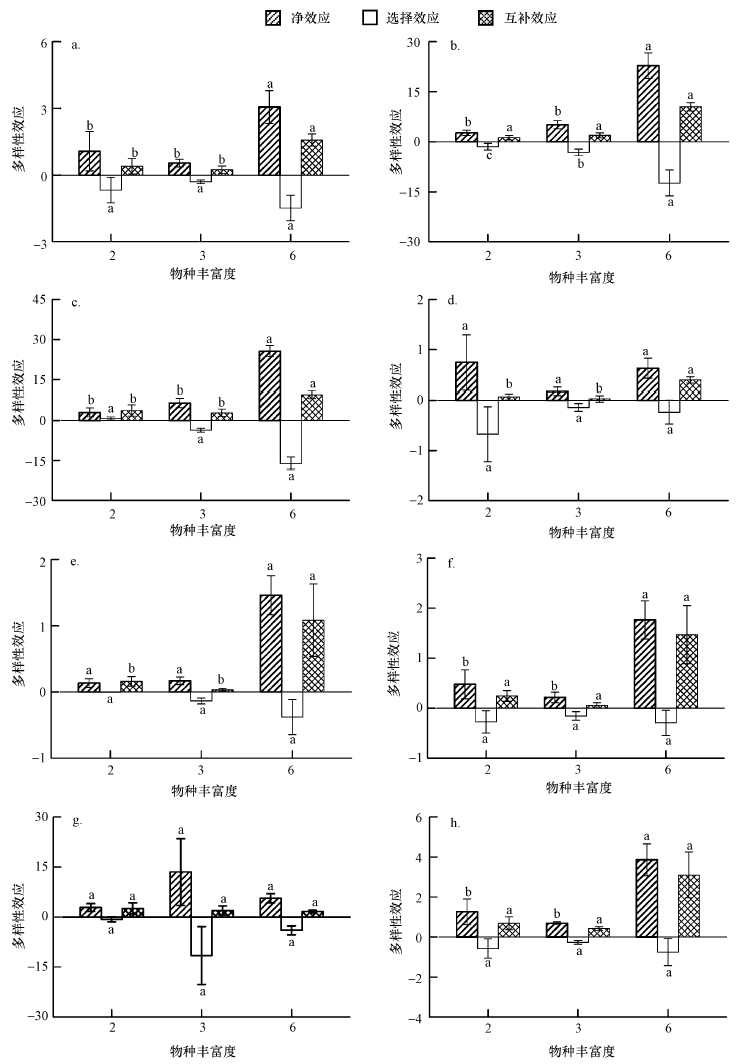 |
| 图 6 土壤Cd修复的多样性效应 a.地上Cd含量;b.地下Cd含量;c.总Cd含量;d.地上Cd积累量;e.地下Cd积累量;f.总Cd积累量;g.迁移系数;h.富集系数 Fig. 6 Diversity effects on soil Cd removal a.Above-ground Cd concentration; b.Underground Cd concentration; c.Total Cd concentration; d. Above-ground Cd content; e.Underground Cd content; f.Total Cd content; g.Migration coefficient; h. Concentration coefficient |
通过控制实验发现,在添加重金属Cd的土壤中,植物物种多样性的增加显著促进了植物生长和对Cd的富集能力.植物地下部分及总Cd积累量随植物物种多样性的增加显著升高,植物对Cd的富集系数也随植物物种多样性增加显著提高.说明植物物种多样性对土壤中Cd的富集具有显著的促进作用.对矿区不同污染程度土壤重金属调查也发现,植被覆盖较多的地方土壤重金属污染较少(付兰等,2012).
植物物种多样性对土壤Cd富集的促进作用与植物物种多样性对生物量的提高密切相关.大量研究表明,高物种多样性处理条件下,物种间通过互补效应(生态位不同或互利作用)或选择效应提高群落生产力.本研究也发现,在Cd处理土壤中,6-物种处理的植物总生物量显著高于其它处理,并且植物地上与地下Cd积累量分别与地上和地下生物量呈显著正相关.植物物种多样性对植物生物量的效应分析也表明,6-物种处理的净效应和互补效应显著高于2-物种和3-物种处理.Li等(2012)对单细胞绿藻多样性与水体Cd污染清除的研究也发现,绿藻多样性对水体中Cd污染的清除很大程度上是由物种多样性对生物量的正效应引起的.Wang等(2014)对重金属复合污染土壤的研究也发现,在重金属污染土壤中,植物物种多样性对生物量也具有明显的正效应.
Cd添加土壤中6-物种样方植物生物量的增加与净效应主要由互补效应引起.本研究中植物物种多样性的增加对植物根系形态具有显著的促进作用,根系长度、表面积、根尖数及根平均直径均随植物物种多样性的增加而显著升高.这是由于植物物种多样性高的群落会由于不同物种的根系生长格局不同而占据不同的土壤空间(Meinen et al.,2009;Brassard et al.,2013).本研究所选物种分属5个不同的科.亲缘关系较远可能使得植物生长特性不同,使得根系占据土壤不同深度和利用不同养分资源,从而能更有效地利用土壤水分和养分资源(Silvertown,2004)及进一步促进根系生长.研究表明,高浓度的Cd会抑制植物根系生长,使根长、根体积等显著减少从而影响植物生长(Dixit et al.,2001).本研究发现,随着植物物种多样性的增加,对Cd的富集也显著增加.此外,根总表面积、总体积及根平均直径与地上Cd积累量与总Cd积累量呈显著的正相关,表明植物根系的增加不仅会提高对矿质养分的吸收,还会促进对重金属的富集.这可能是由于根系是植物与重金属的直接接触面,是植物最主要的吸收器官,植物物种多样性的增加一方面通过增加重金属与植物根系接触面来提高对Cd的吸收;另一方面,植物物种多样性的增加使根系分泌物数量和种类增加,从而刺激来源于根的酶活性和根际微生物数量,进而加快污染物的分解与吸收(Kozdrój et al.,2000).
其次,植物对矿质养分吸收的增加可以间接地通过提高植物光合作用和对不良环境的抵抗力来促进植物生长与对Cd的吸收.在Cd处理条件下,植物会受到一定程度的毒害作用.大量实验证实,植物积累一定量的重金属后会引起生长缓慢,新陈代谢受抑制等生理生化变化,具体表现为株型矮小、光合作用效率下降(Ivanova et al.,2008;高芳等,2011;陈虎等,2013).本研究中,6-物种样方中,植物物种多样性对植物叶绿素相对含量的净效应和互补效应显著高于2-物种和3-物种处理,且叶绿素相对含量与植物生物量和Cd积累量呈显著正相关,说明叶绿素相对含量的增加对于植物生长与Cd的吸收具有正效应.研究表明,Cd污染能降低植物光合作用和PSⅡ最大光化学效率Fv/Fm(曹玲等,2006;Hu et al., 2014).本实验对植物叶绿素荧光参数的分析发现,在Cd处理条件下,植物物种多样性对初始荧光F0有显著的抑制作用,而对PSⅡ最大光化学效率Fv/Fm和PSII潜在活性Fv/F0有显著促进作用.说明植物物种多样性能提高PSⅡ反应中心内的光能转化效率.植株F0与植株总Cd含量及植株地下部分Cd积累量呈显著负相关,这可能与Cd胁迫下植物物种多样性单一环境中,植株更易受Cd毒害,光合系统更易被破坏,从而导致F0值增大有关.这说明植物物种多样性的增加在促进植物生长的同时,也提高了其对Cd的耐受力.保险假说认为,在多变环境中物种间生态位差异可以使不同物种“风险分摊”,因而物种丰富的系统面临环境波动时会表现出“缓冲效应”(Yachi et al.,1999;Loreau et al.,2000;张全国等,2002).多样性效应分析显示,本实验中多物种处理植物间存在显著的互补效应,因此可以推测,可能是试验植物在种间存在资源利用上的差异,或者存在物种之间的正相互关系,从而产生了生态位互补,在一定程度上分摊了Cd带来的不利影响,毒害作用得以被“缓冲”.
5 结论(Conclusions)1) 在Cd处理条件下,植物物种多样性的提高对植物生长有着较大程度的促进作用,主要表现在植物生物量的显著提高,对植物根系形态显著的正效应以及植物光合能力的显著增强.
2) 在Cd处理条件下,植物物种多样性的提高对实验植物群落生态系统功能产生的净效应,均由植物物种之间的互补效应引起.
3) 从生态系统或群落尺度研究土壤Cd污染治理问题具有一定潜力:实验植物群落中,植物物种多样性的提高不仅能够削弱Cd对植物的毒害作用,还能通过改变植物根系形态和生物量来提高对土壤Cd污染的修复,但产生这一结果的内在生理生态机制仍待进一步研究.
| [1] | Ali H, Khan E, Sajad M A. 2013.Phytoremediation of heavy metals-Concepts and applications[J]. Chemosphere, 91 (7): 869–881. |
| [2] | Bell T, Lilley A, Hector A, et al. 2009.A linear model method for biodiversity-ecosystem functioning experiments[J]. The American Naturalist, 174 (6): 836–849. |
| [3] | Brassard B W, Chen H Y H, Cavard X, et al. 2013.Tree species diversity increases fine root productivity through increased soil volume filling[J]. Journal of Ecology, 101 (1): 210–219. |
| [4] | 曹福亮, 郁万文, 朱宇林.2012.银杏幼苗修复Pb和Cd重金属污染土壤特性[J].林业科学, 48 (4):8–13. |
| [5] | 曹玲, 王庆成, 崔东海.2006.土壤镉污染对四种阔叶树苗木叶绿素荧光特性和生长的影响[J].应用生态学报, 17 (5):769–772. |
| [6] | 陈虎, 郭笃发, 郭峰, 等.2013.作物吸收富集镉研究进展[J].中国农学通报, 29 (3):6–11. |
| [7] | Dias M C, Monteiro C, Moutinho-Pereira J, et al. 2013.Cadmium toxicity affects photosynthesis and plant growth at different levels[J]. Acta Physiologiae Plantarum, 35 (4): 1281–1289. |
| [8] | Dixit V,Pandey V,Shyam R.2001.Differential antioxidative responses to cadmium in roots and leaves of pea (Pisum sativum L.cv.Azad)[J].Journal of Experimental Botany,52(358):1101-1109 |
| [9] | Fargione J E, Tilman D. 2005.Diversity decreases invasion via both sampling and complementarity effects[J]. Ecology Letters, 8 (6): 604–611. |
| [10] | 付兰, 张朝晖.2012.贵州省新路卡林型金矿区苔藓植物多样性及重金属污染监测[J].植物研究, 32 (5):636–640. |
| [11] | 高芳, 林英杰, 张佳蕾, 等.2011.镉胁迫对花生生理特性,产量和品质的影响[J].作物学报, 37 (12):2269–2276. |
| [12] | 高洁, 刘文英, 陈卫军.2012.电镀污染区植物对复合重金属的富集、转移和对污染土壤的修复潜力[J].生态与农村环境学报, 28 (4):468–472. |
| [13] | Hättenschwiler S, Tiunov AV, Scheu S. 2005.Biodiversity and litter decomposition in terrestrial ecosystems[J]. Annual Review of Ecology,Evolution,and Systematics, 36 : 191–218. |
| [14] | Hartwig A. 2013. Cadmium and Cancer//Cadmium:From Toxicity to Essentiality[M]. Netherlands: Springer: 491 -507. |
| [15] | Hooper D U, Chapin Iii F S, Ewel J J, et al. 2005.Effects of biodiversity on ecosystem functioning:a consensus of current knowledge[J]. Ecological Monographs, 75 (1): 3–35. |
| [16] | Hu H, Wang L, Wang Q, et al. 2014.Photosynthesis,chlorophyll fluorescence characteristics,and chlorophyll content of soybean seedlings under combined stress of bisphenol A and cadmium[J]. Environmental Toxicology and Chemistry, 33 (11): 2455–2462. |
| [17] | Ivanova A, Krantev A, Stoynova Z, et al. 2008.Cadmium induced changes in maize leaves and the protective role of salicylic acid[J]. General and Applied Plant Physiology, 34 : 149–158. |
| [18] | Jin T, Nordberg V, Frech W, et al. 2002.Cadmium biomonitoring and renal dysfunction among population environmentally exposed to cadmium from smelting in China[J]. Biometals, 15 : 397–410. |
| [19] | Kozdrój J, van Elsas J D. 2000.Response of the bacterial community to root exudates in soil polluted with heavy metals assessed by molecular and cultural approaches[J]. Soil Biology and Biochemistry, 32 (10): 1405–1417. |
| [20] | Li S P, Li J T, Kuang J L, et al. 2012.Effects of species richness on cadmium removal efficiencies of algal microcosms[J]. Journal of Applied Ecology, 49 (1): 261–267. |
| [21] | Loreau M. 2000.Biodiversity and ecosystem functioning:recent theoretical advances[J]. Oikos, 91 : 3–17. |
| [22] | Loreau M, Hector A. 2001.Partitioning selection and complementarity in biodiversity experiments[J]. Nature, 412 (6842): 72–76. |
| [23] | Loreau M, Naeem S, Inchausti P, et al. 2001.Biodiversity and ecosystem functioning:current knowledge and future challenges[J]. Science, 294 (5543): 804–808. |
| [24] | Meinen C, Hertel D, Leuschner C. 2009.Biomass and morphology of fine roots in temperate broad-leaved forests differing in tree species diversity:is there evidence of below-ground overyielding?[J]. Oecologia, 161 (1): 99–111. |
| [25] | Nagajyoti P C, Lee K D, Sreekanth T V M. 2010.Heavy metals occurrence and toxicity for plants:a review[J]. Environmental Chemistry Letters, 8 (3): 199–216. |
| [26] | 孙晓灿, 魏虹, 谢小红, 等.2012.水培条件下秋华柳对重金属Cd的富集特性及光合响应[J].环境科学研究, 25 (2):220–225. |
| [27] | Shute T, Macfie S M. 2006.Cadmium and zinc accumulation in soybean:A threat to food safety?[J]. Science of The Total Environment, 371 (1/3): 63–73. |
| [28] | Silvertown J. 2004.Plant coexistence and the niche[J]. Trends in Ecology & Evolution, 19 (11): 605–611. |
| [29] | Wang J, Ge Y, Chen T, et al. 2014.Facilitation drives the positive effects of plant richness on trace metal removal in a biodiversity experiment[J]. PloS One, 9 (4): e93733. |
| [30] | 王世纪, 简中华, 罗杰.2006.浙江省台州市路桥区土壤重金属污染特征及防治对策[J].地球与环境, 34 (1):35–43. |
| [31] | 魏筱红, 魏泽义.2007.镉的毒性及其危害[J].公共卫生与预防医学, 18 (4):44–46. |
| [32] | Yachi S, Loreau M. 1999.Biodiversity and ecosystem productivity in a fluctuating environment:the insurance hypothesis[J]. Proceedings of the National Academy of Sciences, 96 (4): 1463–1468. |
| [33] | 杨远祥, 朱雪梅, 邵继荣, 等.2014.不同混种比例对白三叶和香根草锌镉富集的影响[J].水土保持学报, 28 (1):266–269. |
| [34] | 张全国, 张大勇.2002.生物多样性与生态系统功能:进展与争论[J].生物多样性, 10 (1):49–60. |
 2016, Vol. 36
2016, Vol. 36


