2. 重庆市农业科学院, 重庆 401329
2. Chongqing Academy of Agricultural Sciences, Chongqing 401329
环境污染对农业生态的影响日益严重和突出,受到人们的关注.随着工业化发展,铅、汞、镉、钴等重金属大量被排放到大气、水体和土壤中,严重污染环境,进而影响到人类健康(Hsu et al.,2006;Beyer et al.,2007;Guo et al.,2015),引起一系列的重金属超标、重金属中毒事件(Luigi et al.,2006).其中铅是已知毒性最大的重金属污染物之一,具有极强的积累性和不可逆性,一旦进入人体将很难排除(Ouyang et al.,1998).铅在人体血液中正常含量应该在0~99 μg·L-1,如果超标将易引发不同程度的中毒,会对人体很多脏器产生影响,尤其对幼儿的智力发育造成严重障碍(Tabaldi et al.,2007;万双秀等,2005;刘茂生等,2004).由于铅中毒事件的不断发生,有关土壤铅污染及治理的研究越来越受到重视(Perić et al.,2004;Goel et al.,2005)
治理铅污染的传统方法包括化学沉淀、化学氧化还原、离子交换、过滤、电化学处理等,但这些方法都有一些较大的缺点,比如成本较高、去除不完全、能量要求较高、会产生需要进一步处理的毒性淤泥及废弃物等(Harrison,2012).近年来迅速兴起的生物修复技术,以其实施简便、投资少、对环境破坏小、造成二次污染的机会少且专一性较高等优点,成为绿色环保领域科学研究热点之一(Ghosh et al.,2015).
据研究,一些细菌(Banerjee et al.,2015)、真菌(Zheng et al.,2015)、藻类(Ye et al.,2015)可吸收土壤和水体中的重金属,用于重金属污染的生物修复(Khan et al.,2000).一些大型真菌不仅可以富集和积累外部环境中的镉、铅、铜、锌等多种阳离子(García-Delgado et al.,2015),还可以通过分泌有机酸、氨基酸、以及其他代谢产物络合重金属及含重金属的矿物,从而减小重金属的毒性(Chanmugathas et al.,1988).此外,由于大型真菌能形成子实体,通过对子实体的后处理可将重金属从污染场地移出,并进行重金属回收,同时回收的重金属还能在工业发展中加以利用(安鑫龙等,2007).在真菌中,腐生真菌被证明是最有效的重金属污染的生物修复生物,其中大孢蘑菇(Agaricus macrosporus)对重金属的富集作用被深入研究(Garcia et al.,2005),研究发现在碱性pH条件下,大孢蘑菇对重金属铜、铅与镉离子的最高吸收率分别为96%、89%与96%(Melgar et al.,2007).墨汁鬼伞作为一种大型腐生真菌,不仅能耐受粗放种植,还对周围环境中的重金属离子有很好的富集作用,且成本较低(周启星等,2008).尤其是我国集约规模化养殖业,经过生物富集,畜禽粪便重金属超标,当粪便被当做有机肥用于农作物必定再次造成土壤和农作物的重金属超标,因此降低畜禽粪便重金属的含量是一个较为关键的环节(刘剑飞等,2010).而墨汁鬼伞能够在畜禽粪便上很好的生长,通过人工种植墨汁鬼伞可达到消除畜禽粪便重金属污染的目的,并通过分离纯化等流程,提炼出子实体中的重金属盐或含有机态重金属的残渣作为工业原料进行再次利用(刘剑飞等,2007).本文主要从分析墨汁鬼伞对环境重金属铅的耐受性和富集力两个方面初步分析了墨汁鬼伞修复环境重金属污染的能力,为墨汁鬼伞应用于环境重金属生物修复奠定基础,同时分析可能参与墨汁鬼伞吸附重金属Pb2+的蛋白,为墨汁鬼伞吸附重金属离子的分子机理研究奠定基础.同时该结果也为重金属环境污染后墨汁鬼伞的生物修复提供理论依据.
2 材料与方法(Materials and methods) 2.1 实验菌种实验所使用的墨汁鬼伞菌种来自重庆市农科院,由研究员廖敦秀提供.
2.2 试验方法墨汁鬼伞的培养基是在PDA+玉米粉培养基的基础上参考孙悦迎及毕华兰等的方法加以改进(孙悦迎等,2003;毕华南等,2008),液体培养基成分为:马铃薯200 g,葡萄糖20 g,玉米淀粉20 g,MgSO4 0.5 g,KH2PO4 1 g,蛋白胨2 g,ddH2O定容至1000 mL,调pH到7.0~7.5.(固体培养基在液体培养基的基础上加入琼脂20 g).接种时用5 mm打孔器在培养5~7 d的墨汁鬼伞平板的菌丝边缘打孔,接种于液体培养基中或固体平板中央.
2.3 重金属Pb2+对墨汁鬼伞生长的影响首先配制45.77 g·L-1的Pb(CH3COO)2·3H2O溶液100 mL母液,分别向100 mL不同量Pb(CH3COO)2·3H2O母液,使培养基中Pb2+的浓度为0、5、10、20、50、100、200、300、400、500、600、800 mg·L-1.灭菌后,接种墨汁鬼伞,每个浓度梯度做3个重复,于25 ℃下培养9 d,每天观察其长势并测量菌落直径,绘制生长速率曲线,每个浓度设3个重复.
2.4 墨汁鬼伞对Pb2+富集效应的测定分别向100 mL液体培养基中加入Pb(CH3COO)2·3H2O母液,使培养基中Pb2+的浓度为5、100、800 mg·L-1.灭菌后,接种墨汁鬼伞,于25 ℃、180 r·min-1下培养9 d.每隔1 d取7~8 mL菌液,10000 r·min-1、4 ℃离心10 min.吸取上清液5 mL,用原子分光光度法测定上清液中Pb2+浓度(陶锐等,1985).
2.5 总蛋白的提取与SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)为了分析Pb2+胁迫下墨汁鬼伞的差异表达蛋白,用液体培养基培养墨汁鬼伞,于25 ℃,180 r·min-1下培养5 d.通过0.22 μm的微孔滤膜分离菌丝与上清.菌丝液氮充分研磨后,加入3 mL提取液(0.05 mol·L-1 pH=7.0 Tris-HCl 50 mL,甘油0.5 mL,10% SDS 0.05 mL,0.5 mol·L-1 EDTA标准溶液0.2 mL),匀浆后于4 ℃、10000 r·min-1离心15 min;而上清使用冻干机冻干后,溶解在SDS-PAGE电泳缓冲液中.
根据朱广廉等(1982)的方法,配制12% SDS-PAGE分离胶10 mL,以及5% SDS-PAGE浓缩胶5 mL(分离胶和浓缩胶配方均来自TaKaRa商品目录),并灌胶两块.按照20 μg每孔上样,于100~120 V下电泳约1~2 h.电泳后,取出凝胶,切角标记,分别用银染和考马斯亮蓝R250染色.
2.6 蛋白质谱分析与Mascot比对上步中考马斯亮蓝R250染色的凝胶脱色后,用洁净的刀片切下条带,转入微量离心管;用去离子水和50 μL含50 mmol·L-1 NH4HCO3/CH3CN(1:1)的脱色液洗涤2次,于37 ℃下涡旋20 min,重复洗涤步骤至胶条变为无色;加入50 μL乙腈,于真空离心机中干燥10 min,加入20 μL喊10 mmol·L-1 DTT的25 mmol·L-1 NH4HCO3溶液,于56 ℃下还原1 h;真空离心机干燥30 min,加入20 μL烷化剂(含50 mmol·L-1碘乙酰胺的25 mmol·L-1 NH4HCO3)暗置45 min;分步洗涤:25 mmol·L-1 NH4HCO3洗涤2次,每次10 min,含25 mmol·L-1 NH4HCO3的50%CH3CN洗涤2次,每次10 min,CH3CN洗涤10 min;胶条于真空离心机中干燥10 min,用10 ng·mL-1胰蛋白酶于37 ℃下酶解过夜;用含0.1% TFA的50% CH3CN萃取片段,用质谱Ultraflex TOF/TOF(Bruker,Germany);用flexanalysis 2.0软件处理收集到的指纹图谱,并将结果与Mascot数据库进行比对(http://www.matrixscience.com).(以上步骤除切胶外,均由江苏大学生命科学学院完成)
3 结果与讨论(Results and discussion) 3.1 重金属Pb2+对墨汁鬼伞生长的影响测量墨汁鬼伞在不同重金属离子Pb2+浓度梯度下生长的菌落平均直径,从而计算出墨汁鬼伞在不同重金属Pb2+浓度梯度下的平均生长速率(图 1),不同Pb2+浓度下墨汁鬼伞的生长速率如图 1所示.在Pb2+浓度较低(≤50 mg·L-1)时,,墨汁鬼伞的生长并未受到明显抑制(图 1,0~50 mg·L-1),菌落形态、颜色与无Pb2+状态下的生长一致(图 2 Pb5);随着Pb2+浓度的升高,其浓度在100~400 mg·L-1时,生长速率明显下降,与低浓度铅离子培养条件相比具有明显差异(p<0.05),墨汁鬼伞生长速率<8.6 mm·d-1,与无Pb2+培养的墨汁鬼伞相比,生长速率下降16%(图 1,100~400 mg·L-1),菌丝更加稀疏(图 2,Pb100);在高浓度铅离子浓度培养条件下(500~800 mg·L-1),墨汁鬼伞的生长被严重抑制,墨汁鬼伞的平均生长速率为<6.1 mm·d-1,与无Pb2+培养的墨汁鬼伞相比,生长速率下降近43%,与中浓度Pb2+(100~400 mg·L-1)培养条件相比也具有极显著差异(p<0.01)(图 1,500~800 mg·L-1);同时墨汁鬼伞还表现为菌丝稀疏,菌落形状不规则,且培养基中心变黑,周围变黄(图 2,Pb800).从实验结果来看,即使随着Pb2+浓度的升高,墨汁鬼伞的平均生长速率随之下降,但即使在Pb2+浓度高达800 mg·L-1的情况下,墨汁鬼伞的生长也并未被完全抑制.这为墨汁鬼伞修复环境重度铅污染的应用提供了可能性.
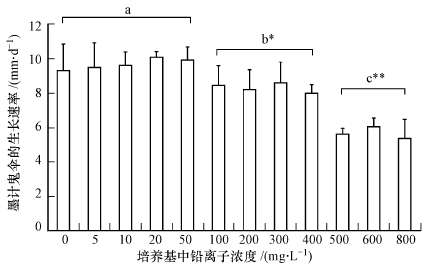 |
| 图 1 不同Pb2+浓度下,墨汁鬼伞的生长速率 (每个浓度设3个重复,每个点上的误差棒代表3次重复的标准误差;a、b、c表示无显著差异处理组;*表示显著性差异;**表示极显著性差异) Fig. 1 Growth rate of Coprinus atramentarius on the different Pb2+ concentrations (Error bars represents the standard deviation of three repetitions; a, b, c means no obvious difference between these concentrations; *means the difference is significant at the 0.05 level; **means the difference is significant at the 0.01 level) |
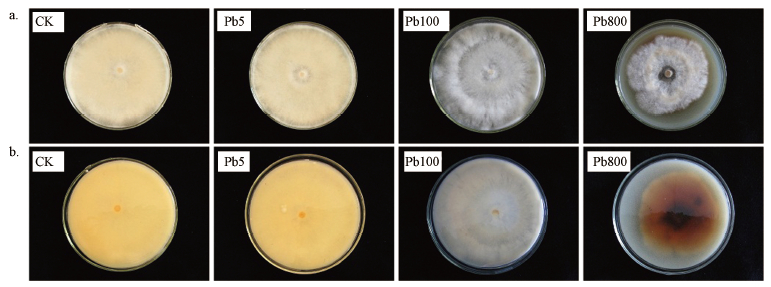 |
| 图 2 墨汁鬼伞在不同Pb2+浓度下的菌落形态(a. 正面;b. 反面)(CK、Pb5、Pb100与Pb800分别表示培养基中Pb2+浓度为0、5、100 mg·L-1和800 mg·L-1) Fig. 2 Colonial morphology of Coprinus atramentarius in different Pb2+ concentrations (a. front; b. reversal)(CK, Pb5, Pb100 and Pb800 represent the culture media contain 0 mg·L-1, 5 mg·L-1, 100 mg·L-1 and 800 mg·L-1 Pb2+, respectively) |
由于不同浓度的Pb2+对墨汁鬼伞的生长影响不同,因此我们想分析不同Pb2+浓度下,墨汁鬼伞对Pb2+的富集效率.根据不同Pb2+浓度对墨子鬼伞抑制效应的结果(图 1),我们选择低浓度Pb2+、中浓度Pb2+以及生长速率最慢时的Pb2+浓度(分别为5、100、800 mg·L-1)作为墨汁鬼伞Pb2+富集效应的实验条件.4个初始浓度下,墨汁鬼伞对Pb2+的富集效应见表 1.
由表 1可以看出,墨汁鬼伞对Pb2+的富集作用较强,在培养的前两天,墨汁鬼伞对Pb2+就已经完成明显的富集作用,延长培养时间并没有明显增加墨汁鬼伞对Pb2+的富集效应.以第10 d的结果来计算富集效率,在Pb2+起始浓度分别为5、100、800 mg·L-1时,能到达的富集效率分别为84.7%、98.9%和94.7%.其最佳吸附效率甚至超过大孢蘑菇对Pb2+的最高富集率89%(Melgar et al.,2007).从富集效率结果来看,在100 mg·L-1起始Pb2+浓度情况下,最后培养基中残留的Pb2+浓度基本与5 mg·L-1起始Pb2+浓度残留相同,可见墨汁鬼伞并不能完全富集培养液中Pb2+,有一个可富集浓度最低值;同时在起始Pb2+浓度高达800 mg·L-1时,培养基中Pb2+残留浓度明显升高(41.8 mg·L-1),但最终也能达到94.7%的富集效率,这可能是墨子鬼伞在高浓度的Pb2+浓度下,生长受到抑制后影响了其对Pb2+的富集,或者是墨汁鬼伞对Pb2+的富集效应已经达到极限,但也从另外一个角度说明墨子鬼伞即使在Pb2+浓度很高的情况下依然能很好的富集Pb2+.本研究项目的合作者通过模拟猪粪,分析在人工模拟培养基中添加Pb2+分析重金属离子对墨汁鬼伞生长的抑制以及墨汁鬼伞富集培养基中Pb2+的能力,研究结果显示即使在猪粪存在的情况下,墨汁鬼伞在添加Pb2+的培养基中仍然具有较好的生长能力,添加的猪粪对Pb2+的富集能力也没有明显影响(朱金山等,2015).Wu等(2015)研究发现毛头鬼伞(Coprinus comatus)对土壤中的Cu2+能够达到96.00%的清除效率.Taştan等(2010)研究发现曲霉(Aspergillus versicolor)在合适pH条件下对50 mg·L-1浓度的 Cr5+、Ni2+、Cu2+等离子分别具有99.89%、30.05%和29.06%的清除效率;此外Ramasamy et al.,(2011)研究发现曲霉(Aspergillus fumigates)对水溶液中Pb2+的清除效率能够达到85.41%.以上的研究表明真菌是一种较好的环境修复生物,可以用于土壤、水体等环境的重金属污染,然而不同的真菌对不同的重金属离子吸附效率不同,同时也会受培养环境的影响;与其它真菌相比,墨汁鬼伞有更好的环境适应性,可以培养在动物粪便上,也可以通过培养墨汁鬼伞液体培养物用于水体的Pb2+污染修复.我们的研究也表明即使在培养基中添加高浓度的Pb2+后,墨汁鬼伞对Pb2+仍然具有较高的清除效率,可以预期墨汁鬼伞应用于重度Pb2+污染环境的生物修复.
| 表 1 培养基中Pb2+浓度变化及富集效率 Table 1 Temporal variation of Pb2+ concentration and accumulation efficiency |
研究发现真菌对重金属离子的富集效应主要包括两步,真菌首先把重金属离子富集(bioaccumulation)到细胞内,然后通过细胞内化合物吸附或者螯合重金属离子(biosorption)(Plaza et al.,1996).一些细胞内分子会参与到这个螯合过程中,如蛋白质,氨基酸,脂类多糖等,但具体的分子机理目前并不十分清楚(Mar'in et al.,1997).为探究墨汁鬼伞富集Pb2+的分子机理,我们添加不同浓度Pb2+到培养基中,分别分析了墨汁鬼伞的菌丝与胞外蛋白质的表达差异.菌丝与胞外蛋白SDS-PAGE电泳后的银染结果如图 3a和3b所示.由图 3a可以看出,从菌丝中提取的蛋白在SDS-PAGE后能通过银染染出一条明显诱导表达的条带,而培养液并没有检测到明显的差异条带(图 3b);当Pb2+浓度为100 mg·L-1时差异条带最明显,表明Pb2+离子浓度为100 mg·L-1时,该差异蛋白的诱导效率最高.为了鉴定该差异表达蛋白,我们采用Pb2+ 浓度100 mg·L-1作为诱导条件,增加上样量后进行SDS-PAGE电泳与考马斯亮蓝染色,以便于兼容质谱分析,质谱结果通过在Mascot数据库比对,鉴定差异蛋白为14-3-3类蛋白(Mr/pI,29075/4.57)(图 3c),该蛋白的表达与Pb2+的浓度呈正相关性.对墨角藻(Fucus vesiculosus)的研究也发现重金属Cu2+能够诱导墨角藻14-3-3基因的表达,研究结果表明在较低浓度(3~30 μg·L-1)条件下,14-3-3基因的表达与Cu2+的浓度成正相关性,而高浓度(>150 μg·L-1)反而不能诱导14-3-3基因表达(Jennifer et al.,2012).14-3-3蛋白在真核生物中及其保守,在真核生物基本代谢、酶活性、基因表达、生物的抗病、抗氧化和耐盐等过程中多发挥重要功能(Chang et al.,2012).大量的研究已经证明14-3-3蛋白连接到转录因子(transcription factors)和通道蛋白(transporters)后参与离子的转运与压力调控(Roberts et al.,2003;Cheng et al.,2002),其启动子能够被重金属离子的激活(Aksamit et al.,2005),另外,有研究表明14-3-3蛋白参与植物柠檬酸(Citrate)的排出机制中,是植物耐铝Al3+毒害的重要调节蛋白(Chen et al.,2015).我们的研究说明墨汁墨汁鬼伞的14-3-3蛋白与Pb2+的胁迫相关,但其所发挥的功能需要进一步研究.
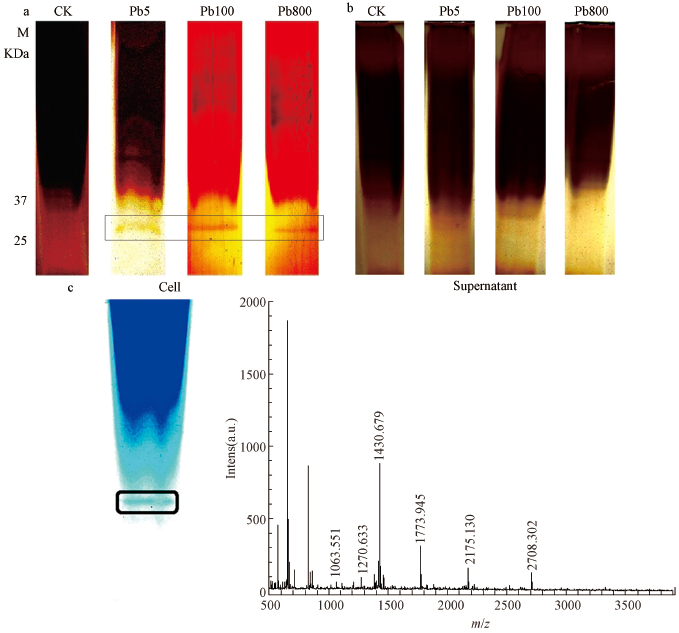 |
| 图 3 Pb2+对墨汁鬼伞细胞与上清液蛋白质诱导分析(CK、Pb5、Pb100与Pb800分别表示培养基中Pb2+浓度为0、5、100、800 mg·L-1; a. 一个分子量约为30 kDa的墨汁鬼伞细胞被诱导; b. 培养液上清中无明显被诱导的蛋白;c. 以最佳诱导条件(Pb2+浓度为100 mg·L-1)诱导细胞蛋白,考马斯亮蓝染色后进行质谱分析) Fig. 3 Pb2+ induce proteins expression of cells and supernatant(CK, Pb5, Pb100 and Pb800 represent the culture media containing 0 mg·L-1, 5 mg·L-1, 100 mg·L-1 and 800 mg·L-1 Pb2+, respectively; a. one protein (MW, 30 kDa) was identified in the cells of Coprinus atramentarius. b. no protein was identified in the supernatant;c. the most effective inducing condition (100 mg·L-1) induce proteins expression, and conduct mass spectrometric analysis after Coomassie blue staining) |
研究Pb2+对墨汁鬼伞生长抑制效应时,我们发现Pb2+浓度较低时对墨汁鬼伞正常生长影响较小;随Pb2+浓度的升高,Pb2+对墨汁鬼伞的生长抑制增大,抑制效应主要表现为导致菌落形状不规则、菌丝生长稀疏以及培养基色素积累等方面.我们的研究也表明墨汁鬼伞对不同浓度Pb2+(5、100、800 mg·L-1)都具有较高的富集效率,但并不能完全清除培养基中的Pb2+;但在Pb2+浓度高达800 mg·L-1时,尽管墨汁鬼伞对Pb2+的富集效率较高,但是培养基中残余的Pb2+较多.从以上结果我们可以看到,即使在Pb2+浓度较高(800 mg·L-1)的情况下,墨汁鬼伞也能够运用于环境中Pb2+的清除,吸附Pb2+后的墨汁鬼伞可以用于对重金属Pb2+的回收再利用.同时我们也鉴定到了一个受Pb2+诱导的14-3-3蛋白,该蛋白可以作为环境Pb2+污染的指示蛋白.
| [1] | Aksamit A, Korobczak A, Skala J, et al. 2005.The 14-3-3 gene expression specificity in response to stress is promoter-dependent[J]. Plant Cell Physiol, 46 (10): 1635–1645. |
| [2] | 安鑫龙, 周启星.2007.大型真菌对重金属的生物富集作用及生态修复[J].应用生态学报, 18 (8):1897–1902. |
| [3] | Banerjee G, Pandey S, Ray A, et al. 2015.Bioremediation of heavy metals by a novel bacterial strain and its antioxidant enzyme activity, Flocculant Production, and Protein Expression in Presence of Lead, Cadmium, and Nickel[J]. Water, Air, and Soil Pollution, 4 (226): 1–9. |
| [4] | Beyer N, Pattee W, Oliver H, et al. 1985.Metal contamination in wildlife living near two zinc smelters[J]. Environmental Pollution Series A, Ecological and Biological, 38 (1): 63–86. |
| [5] | 毕华南. 2008. 墨汁鬼伞液体发酵培养条件及生物活性研究[D]. 无锡:江南大学 |
| [6] | Chang M J, Tao X, Gu Y H, et al. 2012.Cloning and characterization of the 14-3-3 protein gene from Ipomoea batatas (L.) Lam[J]. African Journal of Microbiology Research, 6 (9): 1990–1999. |
| [7] | Chanmugathas P, Bollag J M. 1988.Microbial role in immobilization and subsequent mobilization of cadmium in soil suspensions[J]. Soil Science Society of America Journal, 51 (5): 1184–1191. |
| [8] | Chen Q, Kan Q, Wang P, et al. 2015.Phosphorylation and interaction with the 14-3-3 protein of the plasma membrane H+-ATPase are involved in the regulation of Magnesium-mediated increases in Aluminum-induced citrate exudation in broad bean (Vicia faba. L)[J]. Plant Cell Physiol, 56 (7): 1144–1153. |
| [9] | Cheng S H, Willmann M R, Chen H C, et al. 2002.Calcium signaling through protein kinases. The Arabidopsis calcium-dependent protein kinase gene family[J]. Plant Physiol, 129 (2): 469–485. |
| [10] | Ebbs S D, Lasat M M, Brady D J, et al. 1997.Phytoextraction of cadmium and zinc from a contaminated soil[J]. Environmental Quality, 26 (6): 1424–1430. |
| [11] | Gadd G M, Fry J C. 1992. Microbial control of pollution[M]. Cambridge: Cambridge University Press . |
| [12] | García-Delgado C, Yunta F, Eymar E. 2015.Bioremediation of multi-polluted soil by spent mushroom (Agaricus bisporus) substrate:Polycyclic aromatic hydrocarbons degradation and Pb availability[J]. Journal of Hazardous Materials, 300 : 281–288. |
| [13] | Garcia M A, Alonso J, Melgar M J. 2005.Agaricus macrosporus as a potential bioremediation agent for substrates contaminated with heavy metals[J]. Journal of Chemical Technology and Biotechnology, 80 (3): 325–330. |
| [14] | Ghosh A, Ghosh Dastidar M, Sreekrishnan T. 2015.Recent Advances in Bioremediation of Heavy Metals and Metal Complex Dyes:Review[J]. Journal of Environmental Engineering:C4015003, : . |
| [15] | Goel J, Kadirvelu K, Rajagopal, et al. 2005.Removal of lead(Ⅱ) by adsorption using treated granular activated carbon:Batch and column studies[J]. Journal of Hazardous Materials, 125 (1/3): 211–220. |
| [16] | Guo W, Huo S, Ding W. 2015.Historical record of human impact in a lake of northern China:Magnetic susceptibility, nutrients, heavy metals and OCPs[J]. Ecological Indicators, 57 : 74–81. |
| [17] | Harrison R, Laxen D P H. 1981. Lead pollution:causes and control[M]. Springer Nether lands. Springer Science & Business Media: : 55 -69. |
| [18] | Hsu M J, Selvaraj K, Agoramoorthy G. 2006.Taiwan's industrial heavy metal pollution threatens terrestrial biota[J]. Environmental Pollution, 143 (2): 327–334. |
| [19] | Jennifer R O, Ceri A M, Beate N, et al. 2012.Induction of expression of a 14-3-3 gene in response to copper exposure in the marine alga, Fucus vesiculosus[J]. Ecotoxicology, 21 (1): 124–138. |
| [20] | Khan A, Kuek C, Chaudhry T, et al. 2000.Role of plants, mycorrhizae and phytochelators in heavy metal contaminated land remediation[J]. Chemosphere, 41 (1): 197–207. |
| [21] | 刘茂生, 宋继军.2004.有害元素铅与人体健康[J].微量元素与健康研究, 21 (4):62–63. |
| [22] | 刘剑飞, 黄道友, 胡留杰, 等.2010.大型墨汁鬼伞修复重金属污染的前景分析[J].南方农业, (7):81–84. |
| [23] | Luigi C, Luciano V, Liliane E P, et al. 2006.Heavy metals in edible mushrooms in Italy[J]. Food Chemistry, 98 (2): 277–284. |
| [24] | Mar'in A, Conti C, Gobbi G. 1997.Sorption of lead and caesium by mushrooms grown in natural conditions[J]. Resource and Environmental Biotechnology, 2 (1): 25–49. |
| [25] | Melgar M, Alonso J, García M. 2007.Removal of toxic metals from aqueous solutions by fungal biomass of Agaricus macrosporus[J]. Science of the Total Environment, 385 (1): 12–19. |
| [26] | Ouyang H, Vogel H J. 1998.Metal ion binding to calmodulin:NMR and fluorescence studies[J]. Biometals, 11 (3): 213–222. |
| [27] | Page M R A, Swires-Hennessy M E. 1986. Contaminated Soil[M]. Dordrecht: Martinus Nijhoff Publishers: 233 -246. |
| [28] | Perić J, Trgo M, Vukojević Medvidović N. 2004.Removal of zinc, copper and lead by natural zeolite-a comparison of adsorption isotherms[J]. Water Research, 38 (7): 1893–1899. |
| [29] | Plaza G, Lukasik W, Ulfig K. 1996.Sorption of cadmium by filamentous soil fungi[J]. Acta Microbiol Pol, 45 (2): 193–201. |
| [30] | Ramasamy K R, Congeevaram S, Thamaraiselvi K. 2003.Evaluation of Isolated Fungal Strain from e-waste Recycling Facility for Effective Sorption of Toxic Heavy Metal Pb (Ⅱ) Ions and Fungal Protein Molecular Characterization-a Mycoremediation Approach[J]. Asian J Exp Biol Sci, 2 (2): 342–347. |
| [31] | Roberts M R. 2003.14-3-3 proteins find new partners in plant cell signalling[J]. Trends Plant Sci, 8 (5): 218–223. |
| [32] | 孙悦迎, 卫丞友, 雷萍, 等.2003.墨汁鬼伞生物学特性研究[J].食用菌学报, 10 (4):16–19. |
| [33] | Tabaldi L A, Ruppenthal R, Cargnelutti D, et al. 2007.Effects of metal elements on acid phosphatase actiivty in cucumber (Cueumis sativus L.) seedlings[J]. Environmental and Experimental Botany, 59 (1): 43–48. |
| [34] | Taştan B E, Ertuğrul S, Dönmez G. 2010.Effective bioremoval of reactive dye and heavy metals by Aspergillus versicolor[J]. Bioresource Technology, 101 (3): 870–876. |
| [35] | 陶锐, 周宏刚.1985.氢化物发生-原子吸收分光光度法测定食品中铅[J].分析化学, 13 (4):283–285. |
| [36] | 万双秀, 王俊东.2005.铅污染的危害及防治[J].微量元素与健康研究, 22 (1):63–65. |
| [37] | Weon B, Rajesh K M, Ashok M, et al. 2001.Genetic engineering of Escherichia coli for enhanced uptake and bioaccumulation of mercury[J]. Applied and Environmental Microbiology, 67 (11): 5335–5338. |
| [38] | Wu B, Chen R, Y ao, Y, et al. 2015.Mycoremediation potential of Coprinus comatus in soil co-contaminated with copper and naphthalene[J]. RSC Advances, 5 (83): 67524–67531. |
| [39] | |
| [40] | Zheng S, Wang C, Shen Z, et al. 2015.Role of extrinsic Arbuscular Mycorrhizal fungi in heavy metal-contaminated wetlands with various soil moisture levels[J]. International Journal of Phytoremediation, 17 (3): 208–214. |
| [41] | 周启星, 安鑫龙, 魏树和.2008.大型真菌重金属污染生态学研究进展与展望[J].应用生态学报, (8):1848–1853. |
| [42] | 朱广廉, 杨中汉.1982.SDS-聚丙烯酰胺凝胶电泳法测定蛋白质的分子量[J].植物生理学通讯, 2 :43–47. |
| [43] | 朱金山, 胡留杰, 刘剑飞, 等.2015.墨汁鬼伞对猪粪中铅的富集特性研究[J].西南农业学报, 28 :1197–1200. |
 2016, Vol. 36
2016, Vol. 36


