2. 江西师范大学, 鄱阳湖湿地与流域研究教育部重点实验室, 南昌 330022
2. Key Laboratory of Poyang Lake Wetland and Watershed Research, Ministry of Education, Jiangxi Normal University, Nanchang 330022
生物质炭化技术是近年来发展起来的农林废弃物资源化利用新技术.生物炭具有含碳量高、稳定性高、表面官能团丰富等特性,且孔隙发达,具有较高的比表面积和阳离子交换量,可充当吸附剂用来吸附水体和土壤中重金属(Uchimiya et al., 2011; Cao et al., 2009; 陈再明等,2012)和有机污染物(Accardi-Dey and Gschwend, 2002; Yang and Sheng, 2003),具有固定土壤中重金属和有机污染物的潜在能力(Beesley and Marmiroli, 2011; Beesley et al., 2011),应用方向广泛如固碳减排(陈温福等,2013)、减缓土壤温室气体排放(Yanai et al., 2007; Van Zwieten et al., 2009),炭化还田改良土壤(孟军,2011)、促进作物生长(Chan et al., 2007; Chan et al., 2008; 李冬等,2014)等,在改善土壤环境,提高粮食产量,修复环境污染,消减环境风险等方面具有广阔的应用潜力,显示出多重的环境效益.
目前,国内外对生物炭的研究发展比较迅速,对不同原材料的生物炭及其制备方法、制备条件以及不同理化特性、生物炭的应用等方面均有不同程度的研究.主要原材料有农作物秸秆、农业残渣(吴诗雪等,2015;Mulligan,2010)、动物粪便(王章鸿等, 2012,Agblevo et al., 2010; Cao et al., 2011)、污泥(王定美等,2014)等.其中农业秸秆是制备生物炭最主要的原材料之一,以玉米秸秆、小麦秸秆、高粱秸秆、水稻秸秆等为主(潘根兴等,2011;崔丽,2014).与其他农业秸秆相比,水稻秸秆是农业生态系统中最普遍的生物质原材料,水稻秸秆极其柔软,易于预处理,便于压缩成形,已有研究认为,水稻等草本秸秆炭的输入可以增加塿土等的微生物数量和生物量水平(陈心想等,2014;Kolb et al., 2009);但木质生物炭的添加会降低土壤微生物生物量碳的含量(Dempster et al., 2012),这可能是由于草本秸秆炭较木质炭含有更为丰富的微生物可利用组分以及栖息环境造成(李明等,2015).不同来源的生物炭因结构特性及组分差异,往往会被不同的微生物群体所利用(Steinbeiss et al., 2009).
我国水稻等农业秸秆类物质的产量约6 × 108 t·a-1,其中大于50%的秸秆因缺乏有效的处理途径而闲置或就地焚毁,不仅污染环境而且存在极大的浪费(Yang et al., 2003).因此,将水稻秸秆制备成生物炭进行开发利用等方面的研究已成为相关热点.安增莉等(2011)利用红外(FTIR)光谱、Boehm 滴定、比表面积及微孔分析等方法分别对300 ℃、400 ℃、500 ℃、600 ℃下制备的水稻秸秆生物炭进行表征并研究了水稻秸秆生物炭对Pb(Ⅱ)的吸附特性;李明遥等(2013)利用不同裂解温度水稻秸秆生物炭对土壤Cd形态的影响进行过相关研究;肖洋等(2014)利用水稻秸秆生物炭对水体中DDE 的吸附性能进行过研究;柯跃进等(2014)研究过500 ℃和700 ℃裂解的水稻秸秆生物炭对耕地土壤有机碳及其CO2释放的影响;李明等(2015)也利用水稻和玉米等不同秸秆生物炭对红壤性水稻土养分及微生物群落结构的影响进行过研究,高瑞丽等(2015)采用水稻秸秆生物炭对镉、铅复合污染土壤中重金属形态转化的短期影响进行过相关研究.以上研究多为水稻秸秆生物炭对水、土环境中不同污染物的吸附特性等方面,对水稻秸秆生物炭的制备条件或结构特性等方面的研究相对较少些.
本文在前人研究工作的基础上,利用南方最典型普遍的农业秸秆--水稻秸秆作为原材料,采用限氧控温炭化法(Glaser et al., 2002),在马弗炉内经历不同裂解温度条件(300 ℃、400 ℃、500 ℃、600 ℃、700 ℃)和不同保温时间制备生物炭.采用SEM扫描电镜,比表面测定仪,红外光谱,元素分析等现代分析手段对生物炭的结构形貌、比表面积和孔径、表面官能团和元素含量等性质进行全面表征分析,并将生物炭结构与特性相联系、物理性质与化学性质相结合,试图全面探讨水稻秸秆生物炭的各种制备条件,分析不同裂解温度条件对生物炭特性的影响,为稻秆生物炭的制备生产条件提供一定的补充依据和合理的技术支持,并探索生物炭的其他应用领域,为水稻稻秆等各种农业废弃物的资源化利用寻求新的途径,对于促进农业低碳、循环、可持续发展具有重要意义.
2 材料与方法(Materials and methods) 2.1 实验原料本研究所用水稻秸秆采自江西省南昌市新建县郊区,水稻收割后取剩余秸秆.将稻秆洗净,自然风干2 d后于70 ℃左右烘12 h,用粉碎机将稻秆粉碎,过50目筛装密封袋备用.
2.2 生物炭的制备方法将备用稻秆置于100 mL陶瓷坩埚,压实盖上盖,在马弗炉内热解炭化.设置热解升温速率为15 ℃·min-1.最高热处理温度(HTT)分为300 ℃、400 ℃、500 ℃、600 ℃、700 ℃,保温时间为3 h,冷却30 min至室温后,研磨,过100 目筛后分别密封保存,做好标记备用.
2.3 生物炭特性表征与分析方法 2.3.1 产率称取一定量的备用稻秆于马弗炉中缺氧炭化,冷却至室温后取出,称量.前后质量比即为产率.
2.3.2 灰分生物炭灰分的测定参照《木炭和木炭实验方法》GB/T17664-1999.将30 mL瓷坩埚置于高温电炉中,于650 ℃下灼烧至恒重,冷却30 min称量.称取1 g生物炭,置于已灼烧至恒重的瓷坩埚中.将坩埚送入高温电炉中,打开坩埚盖,逐渐升高温度,在800 ℃灰化4 h,冷却取出称量.依据公式(1)计算灰分含量:

式中,A1为灰分含量(%);G2为灼烧后灰分和坩埚总重(g);G1为空坩埚质量(g);G为灼烧前生物炭的含量(g).
2.3.3 挥发分挥发分含量的测定参照《GB/T 2001-91焦炭工业分析测定方法挥发分含量的测定》方法,具体步骤为准确称取1 g生物炭,放入用预先灼烧至恒重的带盖瓷坩埚,盖上盖,放在坩埚架上.打开预先升温至(900±10)℃的炉门,迅速将装有瓷坩埚的架子送入炉中的恒温区内,立即开动秒表计时,并关好炉门,使坩埚连续加热7 min后立即从炉内取出坩埚,放在空气中冷却约5 min,移入干燥器中冷却至室温,称量.依据公式(2)计算挥发分含量:
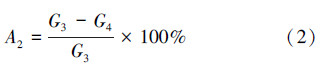
式中,A2为灰分含量(%);G3为灼烧前试样质量(g);G4为灼烧后试样质量(g).
2.3.4 pH值按照《GB/T 12496.7-1999木质活性炭试验方法pH值的测定》方法,称取干燥的式样2.50 g(称准至0.01 g),置于100 mL 的锥形瓶中,加入不含二氧化碳的水50 mL,加热,缓和煮沸5 min,补充蒸发的水,过滤,弃去初滤液5 mL,余液冷却至室温后用pH计测定pH值.
2.3.5 样品形状和表面特征的测定采用扫描电子显微镜(S-3400 N,日本日立)观测生物炭样品形状及表面特征.随机选取生物炭样品外表面部位,放置在黑色背景胶板上,调整视野清晰度,选择结构完整的部位拍照,分析并保存.
2.3.6 生物炭的元素分析采用元素分析仪(NCHS-O,意大利欧维特)测定生物炭中 C、H、N等元素的百分含量.测试条件:炉温1150 ℃,氮氢混合气95%氮,5%氢,压力0.2 MPa样品平行测定2次,用平均值计算各种生物炭中有机质组分的 H/C、O/C和(O+N)/C的原子比.
2.3.7 生物炭的红外光谱分析用傅立叶变换红外光谱仪(Nicolet 6700,美国尼高利)测定生物炭的红外光谱.将生物炭磨碎过100目筛子,烘干,按比例1:2000与 KBr混合,在玛瑙研钵中磨匀,压片后测试.
2.3.8 生物炭的比表面积及孔径分析采用GB/T19587-2004气体吸附BET法,进样前,所有的样品均在150 ℃、真空条件下脱气2 h,以清除试样表面已经吸附的物质,99.999% N2为吸附质,液氮温度77 K,在饱和蒸汽压为1.0360×105 Pa.P/P0取点在0.05~0.35范围.
3 结果与讨论(Results and discussion) 3.1 产率分析不同热解温度下稻秆生物炭的产率结果见图 1.从图 1可以看出温度对稻秆生物炭产率影响显著,具体表现为随着裂解温度的升高而减小.裂解温度从300 ℃升至700 ℃,生物炭产率从38.24%下降到17.11%.其中300~500 ℃温度区间内,生物炭质量损失最大,产率急剧下降,降幅达到67.96%,500~700 ℃产率下降变缓,600~700 ℃产率变化较小,产率较为稳定.李飞跃等用核桃壳制备不同温度(200~700 ℃)的生物炭,结果也表明在200~500 ℃阶段产率下降剧烈,降幅达52.6个百分点,500 ℃以上阶段产率变化趋缓(李飞跃等,2015).
 |
| 图 1 不同裂解温度下生物炭产率的比较(注:图中不同小写字母为0.05 水平上差异显著) Fig. 1 Comparisons of yields between biochars at different temperatures |
生物质中的不同组成成分(纤维素、半纤维素、木质素等)具有不同的分解温度(罗烨,2012).在较低的热解温度下,稻秆中半纤维素和纤维素开始大量分解,生物炭质量急剧下降,产率变化较大,木质素主要在高温阶段分解;随着热解温度的升高,原材料热解趋于完全,所以产率变化逐渐稳定,变化较平缓.
3.2 不同温度对稻秆生物炭灰分、挥发分和pH的影响不同裂解温度下稻秆生物炭的物理性质见表 1.稻秆生物炭均大于7,呈碱性,随着裂解温度升高,pH值有增大的趋势.稻秆生物炭pH值在300~500 ℃变化最显著,由8.45增加到10.30,500~700 ℃区间pH值差异较小.一方面,生物炭热解过程中形成的一些酸性物质会部分残留在生物炭中,但是随着热解温度的增加,这些物质会逐渐的挥发,因而高温生物炭中的酸性物质含量较少,pH值相应就会有所增加(罗烨,2012).将生物炭灰分和pH进行相关性分析发现两者之间有着极显著的正相关关系(p<0.01),相关性系数r为0.897.这说明生物炭灰分含量对生物炭pH具有重要影响.这可能是因为随着温度升高,生物炭中的无机离子会熔结形成碱性物质,主要为灰分中无机碳酸盐,从而生物炭pH值增加(Yuan et al., 2011).
| 表 1 不同裂解温度下稻秆生物炭物理性质比较 Table 1 Comparisons of physical properties between biochars at different temperatures |
稻秆生物炭挥发分在300 ℃最高为36.53%,在700 ℃时挥发分最小为12.85%.稻秆含有纤维素、木质素、半纤维素等多种化学成分,且纤维素含量较高(郝蓉等,2010; 王金主等,2010).低温时稻秆热解不完全,挥发分尚未完全析出,温度升高,纤维素和木质素的降解,挥发分开始大量析出,残留在生物炭内的挥发分减少,600 ℃以后挥发分含量变化不大,说明挥发分已几乎全部析出.
灰分是生物炭在充分的氧环境中高温燃烧产生的白色或浅红色的无机物质.当裂解温度由300 ℃升至700 ℃时,稻秆生物炭的灰分含量从 20.63%升高到 35.27%.原材料稻秆灰分质量分数为108.3 g·kg-1,不同温度生物炭灰分(300~700 ℃)占稻秆初始灰分的质量百分含量分别为73.23%、70.79%、60.14%、57.33%和55.96%.随着温度升高,剩余的灰分占生物质初始灰分的质量百分数下降.这说明稻秆在炭化过程中析出了碱金属,且碱金属的析出量随温度升高而增加.这一点已有研究证明(Yuan et al., 2011),Yuan等用作物残渣制备不同温度下的生物炭研究生物炭中的碱金属形态,结果发现,随裂解温度升高,碱金属析出量增加.稻秆在热解过程中有机物减少,随着制备温度升高,Si 、Ca、Mg、Cl等无机离子烧结、融合,形成了无机矿物质,碱金属析出量增加,因此导致灰分含量增加.
3.3 稻秆生物炭扫描电镜分析稻秆原材料和不同温度下的稻秆生物炭扫描电镜图见图 2.从图 2可以看出,生物炭均具有明显的孔隙结构,不同温度孔隙数量和大小均有一定的差异.原材料稻秆的结构散乱无序,通过裂解后,稻秆表面形态发生很大的变化,结构更加规则,孔隙更加致密.不同热解温度下制备的稻秆生物炭均具有多孔结构,且孔的形状规则.300 ℃稻秆生物炭出现了明显的管状结构和少量的孔状结构,孔壁表面光滑但是孔数量较少;温度升至400 ℃时,稻秆生物炭孔隙结构更加致密规则,孔数量明显增加;随着裂解温度继续增加,微孔有所发展,孔数量增加.通过对比发现,在相同的放大倍数下(5000倍),高温炭比低温炭孔隙结构更加发达,这说明适当增加裂解温度有利于生物炭孔隙结构的形成.
 |
| 图 2 不同温度生物炭及稻秆扫描电镜图(5000倍) Fig. 2 SEM images of rice straw and biochars at different temperatures |
不同温度下稻秆生物炭的元素分析结果见表 2.不同温度下稻秆生物炭中元素含量大小顺序均为C含量>O含量>H含量>N含量.随着温度的升高,生物炭中不同元素的含量均发生了一定变化,具体表现为含碳量增加,H、O、N元素含量均减小.这与许多研究结果一致(Sinha et al., 2013; Tsai et al., 2015).
| 表 2 不同温度下制备的生物炭元素分析结果 Table 2 Elemental compositions of biochars at different temperatures |
H/C可以表征生物炭的芳香性,H/C比值越小表示芳香性越强,生物炭结构越稳定.O/C和(O+N)/C可以代表生物炭的亲水性和极性,O/C和(O+N)/C值越高说明亲水性和极性越强.随着制备温度升高,H/C 、O/C和(O+N)/C均下降,这说明温度升高,生物炭芳香性增强,亲水性和极性减弱.稻秆生物炭中元素随温度变化规律与一些研究结果一致(郝蓉等,2010; 孙克静等,2014).
稻秆在裂解过程中,原料中的纤维素、半纤维素和木质素发生脱水反应、脱羧反应和脱羟基反应等,因而失去了大量的C、H、O元素.H元素和N元素的减少与高温时生物炭中的较弱的化学键的断裂有关(郝蓉等,2010).
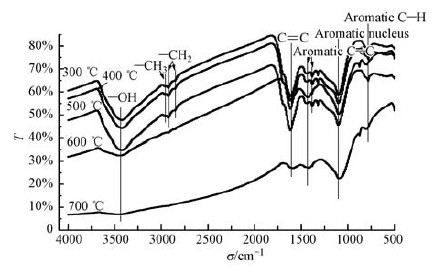
3.5 不同温度下稻秆生物炭红外分析以波数σ(σ范围4000~500 cm-1)为横坐标,透光率T(%)为纵坐标,绘制不同温度(300 ℃、400 ℃、500 ℃、600 ℃、700 ℃)下稻秆生物炭(样品重复量n=5)的FTIR图谱,如图 3所示.不同温度稻秆生物炭在不同波数3422、2966、2922、2854、1602、1433、1098、880、785、472cm-1等处有较明显的吸收峰.这表明稻秆生物炭表面含有羟基、羧基、酯羰基、吡啶等官能团,不同温度制备的生物炭其表面官能团存在一定的差异,随着温度的升高,生物炭表面官能团总含量减少,这与相关的研究结果呈一致性(朱庆祥,2011).
 |
| 图 3 不同裂解温度稻秆生物炭的红外光谱图 Fig. 3 FTIR spectrum of the bio-chars made from rice straw at different temperatures |
波数472 cm-1处为无机矿物Si-O-Si的Si-O对称伸缩振动峰(陈和生等,2011; 徐义亮,2013),随温度升高逐渐增强,说明随裂解温度升高SiO2相对含量升高.这与灰分含量变化结果一致.3422 cm-1附近的宽峰为羟基(-OH)的伸缩振动(潘萌娇等,2014;徐义亮,2013),随着裂解温度的升高而逐渐减弱,这说明温度升高羟基数量减少.这是由于随着温度升高结合水的脱离和氢键结合的羟基逐渐断裂.稻秆生物炭在1200~1010 cm-1吸收峰宽而强,1200~1000 cm-1为典型的取代芳环C-H吸收峰,在1602 cm-1处为芳环C=C的伸缩振动(徐义亮,2013;潘萌娇等,2014),1433 cm-1为芳环C-C的伸缩振动(罗亭,2014),均随着温度升高而减弱,说明温度升高木质素大量分解,芳环结构中的键在逐步发生断裂.
785和880 cm-1 处的吸收峰为芳环C-H弯曲振动(潘萌娇等,2014),随裂解温度升高吸收峰增强,说明稻秆生物炭在热解过程中形成了芳香环且芳香化程度增加.2966、2922和2854 cm-1是由烷烃中的C-H(甲基-CH3和亚甲基-CH2)伸缩振动产生(潘萌娇等,2014;徐义亮,2013),300 ℃、400 ℃ 生物炭存在烷烃C-H吸收峰,而500 ℃、600 ℃、700 ℃生物炭没有出现该吸收峰,说明随着裂解温度升高,烷烃基团缺失,甲基-CH3和亚甲基-CH2逐渐消失,生物炭芳香性增强.
3.6 比表面积及孔径分析采用比表面积及孔径分布仪测定生物炭的比表面积和孔径分布,比表面积测定选择BET模型,孔径分析采用BJH模型.由3.3节扫描电镜图可以看出生物炭具有丰富的孔隙结构,根据孔径的大小,固体表面的细孔可以分成3类:微孔﹤2 nm;中孔 2~50 nm,大孔孔径﹥50 nm(罗亭,2014).300~700 ℃生物炭平均孔径分别为11.63 nm、6.93 nm、4.73 nm、2.33 nm和2.63 nm,这说明稻秆生物炭孔结构主要为中孔,且平均孔径随着温度升高而减小但在600 ℃升温时平均孔径略微有所增加.
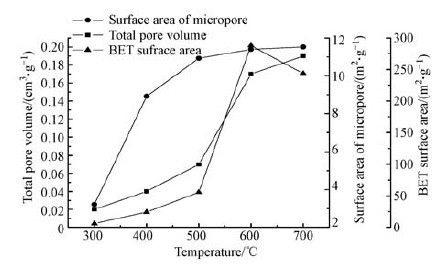
不同温度的生物炭表面特性结果见图 4.由图 4可知,稻秆生物炭比表面积、总孔容和微孔表面积随裂解温度增加呈规律性变化.稻秆裂解后,比表面积发生了巨大变化,原材料稻秆比表面积为0.28 m2·g-1,600 ℃时生物炭比表面积达到最大为288.10 m2·g-1,比表面积为原材料的1029倍.稻秆生物炭在300 ℃到500 ℃比表面积缓慢增加,500 ℃到600 ℃时纤维素、半纤维素、木质素大量分解,挥发性物质的快速释放和气体产物的析出引起小孔的大量开放,比表面积急剧增加.
 |
| 图 4 不同温度下生物炭的表面特性 Fig. 4 Surface structural characteristics of bio-chars made from rice straw at different temperatures |
温度由300 ℃升至600 ℃,生物炭比表面积从 6.11 m2·g-1增加至288.10 m2·g-1,约增加了46倍,生物炭制备温度升至700 ℃时比表面积有所下降.当温度上升到600 ℃,微孔的数量随着挥发分物质的析出而显著增加,导致孔体积和比表面积的增加,而由于挥发分气泡的演变导致的结构次序以及微孔数量的减少和大孔数量的增加被认为是导致700 ℃时比表面积减少的原因(Glatzel et al., 2008).
潘萌娇等用棉秆制备生物炭研究热解温度对其特性的影响(潘萌娇等,2014),本文BET比表面积变化规律与其研究结果相似.李力等用玉米秸秆制备两种温度的生物炭也证明温度更高比表面积更大(李力等,2012).这说明较高的温度有利于制备高比表面积生物炭,600 ℃是制备稻秆生物炭高比表面积的最佳温度.本研究与何秋香等(2014)用柚子皮在600 ℃时制备的生物炭相比,相同温度下制备的稻秆生物炭比表面积更大.除了温度对生物炭比表面积有影响之外,不同原材料的比表面积也有一定差异.与朱庆祥用松木在700 ℃时条件下制备的生物炭比表面积453.19 m2·g-1(朱庆祥,2011)相比,同等条件下稻秆制备生物炭的比表面积更小,而张鹏等(2012)人700 ℃时用猪粪制备的生物炭比表面积仅32.6 m2·g-1,远小于稻秆制备生物炭的比表面积.这可能是由于不同原材料的结构不同,松木孔隙较稻杆更发达,稻杆孔隙结构较猪粪更发达,因此比表面积大小也存在较大差异.说明孔隙丰富的原材料制备出的生物炭比表面积更大.因此,要获得比表面积大的生物炭,除了适当提高裂解温度外,还应考虑原材料的影响.
总孔容随裂解温度升高而增加,说明温度升高,稻秆生物炭孔隙发育更完全,孔隙结构更发达.微孔表面积变化规律与总孔容相似,也随裂解温度升高而增加.微孔表面积在300 ℃到600 ℃下变化最大,升至600 ℃后,继续升温后变化也不大,说明稻秆在裂解过程中微孔数量逐渐增多,这与扫描电镜结果一致,温度对微孔表面积有一定影响,随着温度升高生物炭中微孔数量也有所增加.
3.7 制备温度与生物炭基本特性的相关性分析采用SPSS 20.0软件对生物炭制备温度和特性进行相关性分析,结果如表 3所示,其中p为显著性值,当p<0.01为极显著相关,**代表极显著相关.结果表明,稻秆生物炭的产率和裂解温度之间有极显著负相关关系(p<0.01),相关系数r为-0.947.这也说明了裂解温度对生物炭产率具有显著的影响.灰分和pH值与裂解温度之间有着极显著的正相关关系(p<0.01),相关系数r分别为0.958和0.891;相反,挥发分和裂解温度之间有着极显著的负相关关系(p<0.01),相关系数r为-0.948,这说明裂解温度对生物炭灰分、挥发分和pH值的影响显著.C含量和裂解温度有着极显著的正相关关系(p<0.01),相关系数r为0.97;相反,O、H和N含量与裂解温度之间有着极显著的负相关关系(p<0.01),相关系数r分别为-0.974、-0.964和-0.964.H/C 、O/C和(O+N)/C比值和裂解温度之间有着极显著的负相关关系(p<0.01),相关系数r分别为-0.94、-0.96和-0.956.相比其他特性(均在0.9以上),pH值与制备温度相关系数r值偏小,可能因为生物炭pH值主要与灰分有关,低温时灰分pH值的碱性大小主要由无机阴离子形成了碱性官能团所决定,高温时pH值的碱性大小主要由于制备生物炭过程中形成的无机盐如碳酸盐所决定(Yuan et al., 2011).本研究中温度在700 ℃以下,碱金属析出较少,所以导致pH值和温度因素的相关性相对较小.
| 表 3 生物炭特性和裂解温度的相关性分析 Table 3 The correlation analysis of biochars and pyrolysis temperatures |
1)温度对稻秆生物炭产率影响最显著,温度升高产率减小.不同温度下的稻秆生物炭均为碱性,随着温度升高,pH值增大,灰分含量增加,挥发分含量减少.其中300~500 ℃区间,稻秆生物炭理化性质变化最大.
2)扫描电镜结果显示稻秆生物炭相比原材料结构更规则,孔结构丰富,温度升高,孔隙数量增加,孔结构发育更完整.比表面积及孔径分析结果表明温度对稻秆生物炭表面结构特性具有显著影响,裂解温度升高,生物炭BET比表面积、微孔表面积和总孔容均有所增加.裂解温度的增加有利于生物炭空隙结构的发育和微孔的形成.
3)元素分析表明随着温度的升高,稻秆生物炭含碳量增加,H、O、N元素含量减小,H/C 、O/C、(O+N)/C下降,生物炭芳香性增强,亲水性和极性减弱.傅里叶红外分析表明稻秆生物炭表面含有丰富的官能团如羟基、羧基、酯羰基、吡啶等,不同温度生物炭表面官能团会有一定的差异,主要表现为随裂解温度升高,烷烃基缺失,甲基-CH3和亚甲基-CH2逐渐消失,形成了芳香环且芳香化程度增加.
4)综上所述裂解温度对生物炭表面特性有显著的影响,可以适当提高裂解温度来改良生物炭表面特性,制备符合需求的生物炭.稻秆生物炭呈碱性,稳定性高,可以应用到酸性土壤中改善土壤酸性环境;具有较高的比表面积,表面还有丰富的官能团,可以用来吸附重金属和有机污染物.
| [1] | 安增莉, 侯艳伟, 蔡超, 等. 2011. 水稻秸秆生物炭对Pb(Ⅱ) 的吸附特性[J]. 环境化学, 30(11):1851-1857 |
| [2] | Accardi-Dey A, Gschwend PM. 2002. Assessing the combined roles of natural organic matter and black carbon as sorbents in sediments[J]. Environmental Science and Technology, 36(1):21-29 |
| [3] | Agblevor F A, Beis S, Kim S S, et al. 2010. Biocrude oils from the fast pyrolysis of poultry litter and hardwood[J]. Waste Management, 30(2), 298-307 |
| [4] | Beesley L, Marmiroli M. 2011. The immobilisation and retention of soluble arsenic, cadmium and zinc by biochar[J]. Environmental Pollution, 159(2):474-480 |
| [5] | Beesley L, Moreno-Jimenez E, Gomez-Eyles J L, et al. 2011. A review of biochars' potential role in the remediation, revegetation and restoration of contaminated soils[J]. Environmental Pollution, 159(12):3269-3282 |
| [6] | Cao X D, Ma L N, Gao B, et al. 2009. Dairy-manure derived biochar effectively sorbs lead and atrazine[J]. Environmental Science and Technology, 43(9):3285-3291 |
| [7] | Cao X Y, Ro K S, Chappell M, et al. 2011. Chemical structures of swine-manure chars produced under different carbonization conditions investigated by advanced solid-state C-13Nuclear magnetic resonance (NMR) spectroscopy[J]. Energy and Fuels, 25:388-397 |
| [8] | Chan K Y, Van Zwieten L, Meszaros I, et al. 2007. Agronomic values of greenwaste biochar as a soil amendment[J]. Australian Journal of Soil Research, 45(8):629-634 |
| [9] | Chan K Y, Van Zwieten L, Meszaros I, et al.2008.Using poultry litter biochars as soil amendments[J]. Australian Journal of Soil Research, 46(5):437-444 |
| [10] | 陈和生, 孙振亚, 邵景昌. 2011. 八种不同来源二氧化硅的红外光谱特征研究[J]. 硅酸盐通报, 30(4):934-937 |
| [11] | 陈温福, 张伟明, 孟军. 2013. 农用生物炭研究进展与前景[J].中国农业科学, 46(16):3324-3333 |
| [12] | 陈心想, 耿增超, 王森, 等. 2014. 施用生物炭后塿土土壤微生物及酶活性变化特征[J]. 农业环境科学学报, 33(4):751-758 |
| [13] | 陈再明, 方远, 徐义亮, 等. 2012. 水稻秸秆生物碳对重金属Pb2+的吸附作用及影响因素[J]. 环境科学学报, 32(4):769-776 |
| [14] | 崔丽. 2014. 农作物秸轩热裂解制取生物燃料的研究[D]. 杭州:浙江工业大学 |
| [15] | Dempster D N, Gleeson D B, Solaiman Z M, et al. 2012. Decreased soil microbial biomass and nitrogen mineral isation with eucalyptus biochar addition to a coarse textured soil[J]. Plant and Soil, 354 (1/2):311-324 |
| [16] | 高瑞丽, 朱俊, 汤帆, 等. 2015. 水稻秸秆生物炭对镉、铅复合污染土壤中重金属形态转化的短期影响[J]. 环境科学学报, 36(1):251-256 |
| [17] | Glaser B, Lehmann J, Zech W. 2002. Ameliorating physical and chemical properties of highly weathered soils in the tropics with charcoal-a review[J]. Biology and Fertility of Soils, 35(4):219-230 |
| [18] | Glatzel T, Litterst C, Cupelli C, et al. 2008. Computational fluid dynamics (CFD)software tools for microfluidic applications-A case study[J]. Computers and Fluids, 37(3):218-235 |
| [19] | 郝蓉, 彭少麟, 宋艳暾, 等. 2010. 不同温度对黑碳表面官能团的影响[J]. 生态环境学报, 19(3):528-531 |
| [20] | 何秋香, 陈祖亮. 2014. 柚子皮制备生物炭吸附苯酚的特性和动力学[J]. 环境工程学报, 8(9):3853-3859 |
| [21] | 柯跃进, 胡学玉, 易卿, 等. 2014. 水稻秸秆生物炭对耕地土壤有机碳及其CO2释放的影响[J]. 环境科学, 35(1):94-100 |
| [22] | Kolb S E, Fermanich K J, Dornbush M E. 2009. Effect of charcoal quantity on microbial biomass and activity in temperate soils[J]. Soil Science Society of America Journal, 73(4):1173-1181 |
| [23] | 李冬, 陈蕾, 夏阳, 等. 2014. 生物炭改良剂对小白菜生长及低质土壤氮磷利用的影响[J]. 环境科学学报, 34(9):2384-2391 |
| [24] | 李飞跃, 汪建飞, 谢越, 等. 2015. 热解温度对生物质炭碳保留量及稳定性的影响[J]. 农业工程学报, 31(4):266-271 |
| [25] | 李力, 梁宇超, 刘娅, 等. 2012. 玉米秸秆生物炭对Cd(Ⅱ)的吸附机理研究[J]. 农业环境科学学报, 31(11):2277-2283 |
| [26] | 李明, 李忠佩, 刘明. 等. 2015. 不同秸秆生物炭对红壤性水稻土养分及微生物群落结构的影响[J]. 中国农业科学, 48(7):1361-1369 |
| [27] | 李明遥, 杜立宇, 张妍, 等. 2013. 不同裂解温度水稻秸秆生物炭对土壤Cd形态的影响[J]. 水土保持学报, 27(6):261-264 |
| [28] | 罗亭. 2014. 城镇有机垃圾热解生物炭理化性质研究[D].重庆:重庆大学 |
| [29] | 罗烨. 2012. 芦竹制备生物炭的特性表征及对土壤N2O排放的抑制[D].青岛:中国海洋大学 |
| [30] | 孟军, 张伟明, 王绍斌, 等. 2011. 农林废弃物炭化还田技术的应用与前景[J].沈阳农业大学学报, 42(4):387-392 |
| [31] | Mulligan CJ, Strezov L, Strezov V. 2010. Thermal decomposition of wheat straw and mallee residue under pyrolysis conditions[J]. Energy and Fuels, 24:46-52 |
| [32] | 潘根兴, 林振衡, 李恋卿, 等. 2011. 试论我国农业和农村有机废弃物生物质碳产业化[J].中国农业科技导报, 13(1):75-82 |
| [33] | 潘萌娇, 孙姣, 贺强, 等. 2014. 热解终温和加热速率对棉秆热解生物炭的影响研究[J].河北工业大学学报, 43(5):60-66 |
| [34] | Sinha R, Kumar S, Singh R K. 2013. Production of biofuel and biochar by thermal pyrolysis of linseed seed[J]. Biomass Conversion and Biorefinery, 3(2):327-335 |
| [35] | Steinbeiss S, Gleixner G, Antonietti M. 2009. Effect of biochar amendment on soil carbon balance and soil microbial activity[J]. Soil Biology and Biochemistry, 41(6):1301-1310 |
| [36] | 孙克静, 张海荣, 唐景春. 2014. 不同生物质原料水热生物炭特性的研究[J]. 农业环境科学学报, 33(11):2260-2265 |
| [37] | Tsai W T, Huang C N, Chen H R, et al. 2015. Pyrolytic conversion of horse manure into biochar and its thermochemical and physical properties[J]. Waste and Biomass Valorization, DOI:10.1007/s12649-015-9376-1 |
| [38] | Uchimiya M, Chang S, Klasson K T.2011. Screening biochars for heavy metal retention in soil:Role of oxygen functional groups[J]. Journal of Hazardous Materials, 190(1/3):432-441 |
| [39] | Van Zwieten L, Bhupinderpal-Singh, Joseph S, et al. 2009. Biochar reduces emissions of non-CO2 GHG from soil. In:Lehmann, Joseph S (eds) Biochar for environmental management[M]. Earthscan Publications Ltd. ISBN:9781844076581, 227-249 |
| [40] | 王定美, 王跃强, 余震, 等.2015.污泥与稻秆共热解对生物炭中碳氮固定的协同作用[J]. 环境科学学报, 35(7):2202-2209 |
| [41] | 王金主, 王元秀, 李峰, 等. 2010. 玉米秸秆中纤维素、半纤维素和木质素的测定[J]. 山东食品发酵, 158(3):44-47 |
| [42] | 王章鸿, 郭海艳, 沈飞, 等. 2015. 蚯蚓粪便制备生物炭及其对罗丹明B吸附的研究[J]. 环境科学学报, 35(10):3170-3177 |
| [43] | 吴诗雪, 王欣, 陈灿, 等. 2015. 凤眼莲, 稻草和污泥制备生物炭的特性表征与环境影响解析[J]. 环境科学学报, 35(12):4021-4032 |
| [44] | 肖洋, 张乃明. 2014.水稻秸秆生物炭对水体中DDE的吸附性能研究[J].环保科技, 20(4):7-9 |
| [45] | 徐义亮. 2013.生物碳的制备热动力学特性及其对镉的吸附性能和机理[D].杭州:浙江大学 |
| [46] | Yanai Y, Toyota K, Okazaki M. 2007. Effects of charcoal addition on N2O emissions from soil resulting from rewetting air-dried soil in short-term laboratory experiments[J]. Soil Science and Plant Nutrition, 53(2):181-188 |
| [47] | Yang Y N, Sheng G Y. 2003. Enhanced pesticide sorption by soils containing particulate matter from crop residue burns[J]. Environmental Science and Technology, 37(16):3635-3639 |
| [48] | Yuan H R, Lu T, Zhao D D, et al. 2013. Influence of temperature on product distribution and biochar properties by municipal sludge pyrolysis[J]. Journal of Material Cycles and Waste Management, 15(3):357-361 |
| [49] | Yuan J H, Xu R K, Zhang H. 2011. The forms of alkalis in the biochar produced from crop residues at different temperatures[J]. Bioresource Technology, 102(3):3488-3497 |
| [50] | 张鹏, 武健羽, 李力, 等. 2012. 猪粪制备的生物炭对西维因的吸附与催化水解作用[J].农业环境科学学报, 31(2):416-421 |
| [51] | 朱庆祥. 2011. 生物炭对Pb、Cd污染土壤的修复试验研究[D]. 重庆:重庆大学 |
 2016, Vol. 36
2016, Vol. 36


