2. 华南理工大学亚热带建筑科学国家重点实验室, 广州 510641
2. State Key Laboratory of Subtropical Building Science, South China Univerisity of Technology, Guangzhou 510641
氮和磷是生命体组织不可或缺的重要元素,但其广泛存在于农业生产废水和生活废水中,导致水体富营养化问题日益严重.为了确保饮用水安全,废水处理的成本也一直呈增长趋势,因此,急需研究一种新的、更环保的、更节约成本的废水处理工艺.据报道(Cordell et al.,2009),现代农业肥料中的磷肥主要来源于不可再生的磷酸盐矿石,预计在未来的50~100年内,该资源将面临枯竭.一份关于从废水中回收磷元素的经济评估报告(Shu et al.,2006)认为,每100 m3的废水中大约能够回收1 kg的磷酸铵镁结晶,那么每年可得到6.3万t P2O5.因此,如果能从废水中回收磷元素,将能在极大程度上缓解这种资源危机.
微生物燃料电池(MFC)是一种集产电和污染物去除于一体的新型技术,其利用微生物作催化剂,将化学能转化为电能,同时,降解有机物及其他污染物质.常见的微生物燃料电池有两种类型(杨颖等,2013):一种是双室MFC,其氧化与还原反应分别在由交换膜分开的2个反应室中进行,阴极主要为生物阴极和高性能的阴极电子受体;另一种是单室型MFC,其阴极一面暴露在空气中,电子受体为空气中的氧气.为探究MFC产电和处理废水效果,杨金萍等(2013)研究了生物阴极双室MFC的产电性能及其对硝酸盐污染物的去除效果,发现最大输出电压为119.6 mV,阳极室中COD的去除率为82.4%,MFC运行40 d后阴极室中硝态氮的降解率可达85%以上,但其双室MFC的内阻较大,电池输出电压较低.冉春秋等(2013)以厌氧消化菌和反硝化菌为接种物,构建单室无膜的微生物燃料电池体系,电池最大输出电压为182.5 mV,体系运行10 d后,COD的去除率可达96.5%,16 d后,氨氮和硝态氮的去除率分别可达93.5%和96.7%,但其MFC运行周期过长,输出电压较低,不利于实际应用.Ichihashi等(2012)利用单室MFC处理养猪废水,发现电池的电化学性能较好,但COD的去除率并不高.关于氮磷回收的研究,Zang等(2012)利用单室MFC处理尿素废水,发现废水中的氮和磷主要是因为形成了磷酸氨镁沉淀,从而得以去除.然而,关于利用单室MFC技术产电和对废水实现同步脱氮除磷处理的研究并不多见.因此,本实验采用单室无膜微生物燃料电池处理实验室合成废水,研究该MFC的产电性能及其对N、P和COD的降解效果,从不同的运行时间、不同的进水NH4Cl浓度及对MFC阳极出水进行曝气处理等方面探讨MFC产电情况与污染物降解效率.
2 材料与方法(Materials and methods) 2.1 MFC实验装置和曝气处理体系空气阴极单室型MFC装置参考Liu等(2004)的经典电池模型,具体如图 1a所示,即采用管式的有机玻璃反应器,其内腔直径为3 cm,长度为4 cm,总有效体积为28 mL.MFC电极所用碳布(上海河森电气有限公司)在使用前先沸水浴2 h,以去除表面的杂质.MFC有效面积约7 cm2,阳极和阴极均为碳布,其中,阴极碳布用30% PTFE溶液做疏水处理,且朝向空气的一面涂有碳基层和4层60% PTFE的扩散层,碳布朝向溶液的一面涂有0.5 mg·cm-2铂碳的催化层.通过钛丝将电池两极连接至电压采集器,外电路接有1000 Ω电阻.
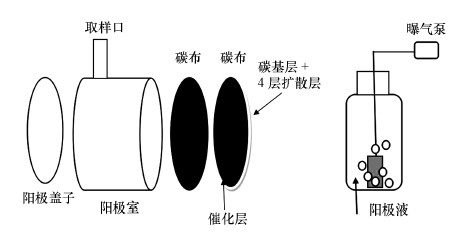 |
| 图 1 单室无膜微生物燃料电池结构简图(a)与曝气瓶装置图(b) Fig. 1 Schematic of single chamber MFC(a) and aeration device(b) |
当MFC运行完一个周期后,将其出水取出做曝气处理,进一步降解废水中的污染物质,具体曝气装置如图 1b所示.
2.2 接种与营养液本实验采用广州市石井污水处理厂的好氧池污泥与缺氧池的污泥混合接种.反应器启动时,接种污泥与实验室配水体积比为1:1.实验所用配水主要成分为5.96 g·L-1 NaHCO3、1.00 g·L-1 NaC2H3O2、0.54 g·L-1 KH2PO4和0.21 g·L-1 NH4Cl及金属微量元素与维生素,其pH值为7.0左右.整个实验中反应器置于(30±1)℃的恒温培养箱内.
2.3 分析与测试方法实验中MFC电压值由数据采集器(美国Keithley M2700)记录,实验中主要测定的指标及方法(魏复盛,2002):pH用pH计(PHS-25上海精科雷兹)测定,COD值采用重铬酸钾法测定,TP采用钼锑抗分光光度法测定,硝态氮(NO3--N)、亚硝态氮(NO2--N)和氨氮(NH4+-N)分别采用紫外分光光度法、N-(1-萘基)-乙二胺光度法和纳氏试剂光度法测定(本文中总氮含量特指这3种氮素含量总和).实验中所用紫外分光光度计型号为UV2800(上海尤尼柯),扫描电子显微镜型号为Merlin(德国蔡司公司生产的场发射扫描电子显微镜).
3 结果与分析(Results and analysis) 3.1 MFC运行稳定后的电学性质经过为期10 d左右的驯化,MFC输出电压值趋于稳定,持续运行72 h后,电压值迅速降为50 mV以下,最高输出电压可达371 mV.为研究MFC电学性能,采用变外电阻法绘制功率密度曲线和极化曲线,即由电阻箱(0~9999 Ω)改变外接电阻的大小,依次从50~5000 Ω变化,记录不同外阻对应的输出电压.电流I由欧姆公式I=U/R计算,功率密度P由公式P=U×I/A计算,其中,U为路端电压(V),R为外接电阻(Ω),A为电极的有效面积(m2).图 2为MFC稳定放电时的电压变化图及极化曲线图与功率密度图.由功率密度图和极化曲线图可得出最大电功率密度为301.6 mW·m-2,MFC内阻为200 Ω.
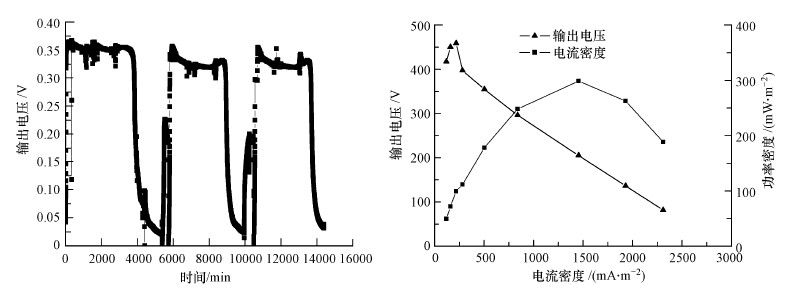 |
| 图 2 MFC输出电压图、极化曲线和功率密度曲线图 Fig. 2 Schematic of electricity production, cell polarization curves and power density curves of the MFC |
取电池运行稳定期间的出水,离心处理后,对MFC出水底部的沉积物做扫描电镜测试.从电镜图(图 3a、3b)可以看出,反应器中微生物形态大多是球形,表明产电菌落很可能由球形菌组成.将MFC出水曝气6 h后(图 3c、3d),可以观察到棒状菌的出现和一些块状的沉淀物质,由此可见,曝气前后MFC出水中的微生物种类发生了变化并有沉淀生成.拆除反应器后,取其阴、阳两极碳布电极,在电镜下可以看到,在阳极碳布上附着较多的微生物群落(图 3e),阴极碳布上可观察到针状的结晶物质(图 3f).
 |
| 图 3 扫描电镜图与能谱图 Fig. 3 SEM-EDS images |
由Mg2++NH4++PO43-+6H2O=MgNH4PO4·6H2O这一反应过程,可生成磷酸铵镁结晶.碳布电极的电镜图上观察到针状晶体的物质,初步猜想可能是形成了鸟粪石等结晶物质.Doyle等(2002)研究发现,影响鸟粪石形成结晶的主要因素为pH值的大小,随着溶液pH的升高,MgNH4PO4·6H2O的溶解度降低,当pH大于8时,可以明显地观察到鸟粪石的结晶.如上所述,实验中的阴极碳布表面针状物质的能谱图(图 3g)与Cusick等(2012)的鸟粪石的标准能谱图相比较,图 3g中出现了一些其他金属元素的杂峰,可能是由于处理过程中样品没能清洗干净,含有其他物质,但Mg、P和N等元素的出峰情况与标准图十分接近,由此判断,实验中碳布上的针状结晶为MgNH4PO4·6H2O.
3.3 不同氨氮浓度对MFC电化学性质和脱氮除磷的影响实验中的配水最初采用4 mmol·L-1的NH4Cl作为微生物的氮源,因为氮源是微生物组织结构的重要元素,因此,有必要探究一下不同氮源浓度对微生物产电性能的影响.本研究分别采用1、2、4和8 mmol·L-1的NH4Cl作为氮源,观察MFC的输出电压,每个浓度下,MFC运行3个周期(约10 d),确保其在不同浓度下运行稳定,结果如图 4所示.由图 4可知,NH4Cl浓度对MFC输出电压有影响,不同NH4Cl浓度下的最大电压分别为326、350、371和307 mV.随着NH4Cl浓度的增加,MFC输出电压先增加后下降,这可能是由于以NH4Cl为氮源的微生物群落数量增大,逐渐成为优势菌群(徐少娟等,2011),产电菌数目增大,造成电池产电量持续变大.当NH4Cl浓度为4 mmol·L-1时,电压达到最大即371 mV. 王庆等(2012)研究了氨氮对有机物降解菌活性的影响,当氨氮浓度远远大于50 mg·L-1时,降解菌活性明显受到抑制. 实验中进水NH4Cl浓度继续增加至8 mmol·L-1(即112 mg·L-1左右)时,MFC输出电压降低,最大电压值仅为307 mV.
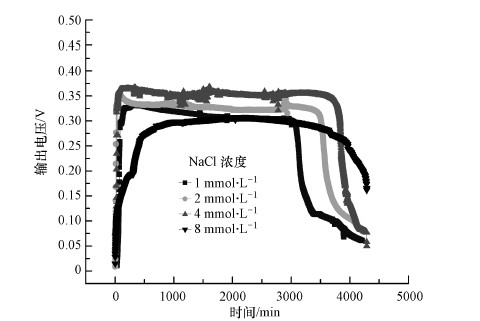 |
| 图 4 不同NH4Cl浓度下电池电压值 Fig. 4 Effect on power generation with different NH4Cl concentration |
在30 ℃的恒温培养箱中,MFC经过连续6 d的运行,每天取样测定一次COD值,探究该系统对COD的去除效果,结果如图 5所示.由于最初阶段营养物质充沛,微生物增长速度快,大量繁殖,MFC输出电压值也较高,开始的72 h内COD降解速率较快,去除率为79.9%.之后的时间段中MFC输出电压值持续降低至50 mV以内,表明阳极室内产电菌的活性也降低,环境中的营养物质较匮乏,COD最终降解为66 mg·L-1,MFC输出电压也低至7 mV左右,COD的总去除率高达93.3%,比张立成等(2014)研究的单室MFC出水COD(100 mg·L-1)要低.
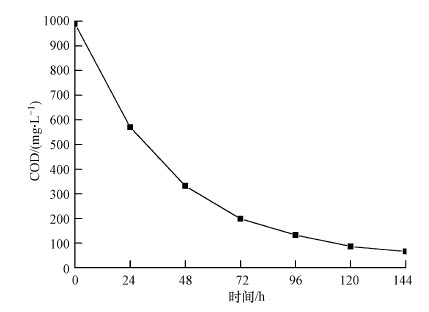 |
| 图 5 MFC工作时间与COD的变化关系 Fig. 5 Schematic of the concentration of COD along with the operation time of the MFC |
投加4 mmol·L-1 NH4Cl作氮源时,反应器稳定运行的时间段内,每隔1天取1次水样测定TP、NO3--N、NO2--N和NH4+-N的浓度.由表 1可以看出,在96 h内,TN的去除率维持在20%以内,去除率较低,表明该MFC对NH4+-N的降解效果不明显. TP的去除率随停留时间依次增大,72 h后约有45%的去除率,而96 h后,微生物产电量只有20 mV左右,TP的去除率降低为35.4%.原因可能是后期的反应器中微生物的营养液消耗殆尽,微生物对营养物质的需求竞争增大,导致一部分微生物因缺乏必要营养而衰亡,释放出微生物体内的磷元素;另一方面,在阳极室的缺氧环境中,微生物菌落中的聚磷菌也会释放体内部分磷元素,这些影响因素均可能导致溶液中磷元素浓度增大.
| 表 1 不同的运行时间对MFC脱氮除磷的影响 Table 1 Effect on the removal of nitrogen and phosphorus with different operation time |
实验发现,MFC稳定放电72 h后,其输出电压值降为50 mV以下,MFC出水pH约为7.3,微生物对TN的去除效果不明显,对TP的去除率不足50%.为了进一步去除TN和TP,将单室MFC出水进行曝气处理,曝气时测得溶液中DO约在2.8~3.5 mg·L-1范围内,曝气时间段为8 h,每1 h取样测定三氮和TP浓度及溶液的pH值,实验结果见图 6.
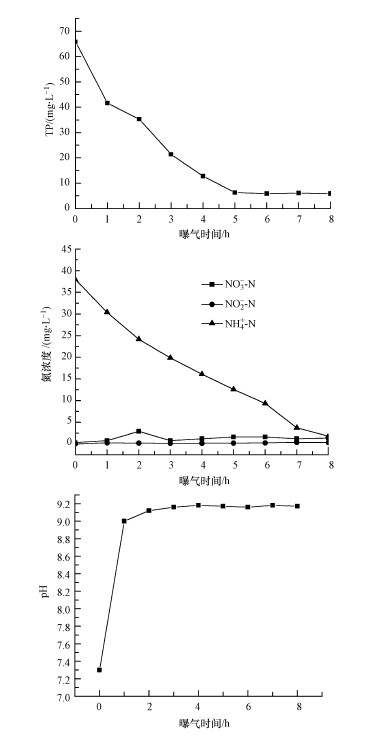 |
| 图 6 TP和三氮的降解情况及pH的变化 Fig. 6 Diagram of the change of TP, nitrogen and pH |
曝气6 h后,相对于实验室配水,TN的去除率高达79.6%,TP的去除率达95.2%. 由图 6可以看出,pH值最后维持在9.17左右. NO3--N浓度在曝气过程中有小幅度的增长趋势,NO2--N维持在一个很小的浓度范围内,变化最大的是NH4+-N浓度,从最初的38 mg·L-1左右下降到2 mg·L-1左右,TP浓度从65.8 mg·L-1降至5.9 mg·L-1左右.曝气6 h后,TP浓度达到最低,之后又有稍微上升的趋势.由于曝气使溶液中DO浓度升高,微生物菌群中可能存在聚磷菌,其吸收磷元素的能力增强,但曝气后期,溶液中乙酸钠等碳源早已消耗完,微生物活性渐渐变弱,吸磷反应减弱,过度曝气导致除磷效果降低(彭赵旭等,2011).同时,曝气阶段水中硝化菌和亚硝化菌将部分氨氮转化为硝酸盐氮及亚硝态氮,因此,这两种氮元素浓度在曝气过程中有小幅度的升高,氨氮的这一转化途径也使得氨氮的浓度降低.另外,曝气时空气对NH4+-N也有一定的吹脱作用(覃彪等,2012),从而进一步降低溶液中NH4+-N的浓度.但曝气时间过长的话(超过6 h),微生物存活所需的营养物质严重缺乏,细胞裂解死亡,释放出体内的氮元素和磷元素,去除率会开始降低. 综上所述,MFC出水的最佳曝气时间为6 h时,脱氮除磷效果最佳.
4 结论(Conclusions)当MFC进水氨氮浓度为4 mmol·L-1时,电池运行状态最佳.MFC系统运行72 h后,产电及物质消耗能力降低.单室MFC对模拟废水中COD的去除效果最明显,对氮素的去除效果一般,只有19.7%左右,并且只能去除小部分的磷酸盐.对其出水进行曝气处理后,磷酸盐去除率高达95.2%,总氮去除率高达79.6%.同时,还发现MFC阴极电极上生成了很多针状的鸟粪石结晶,说明可以实现磷元素的回收利用.
| [1] | Cordell D, Drangert J O, White S. 2009.The story of phosphorus:Global food security and food for thought[J]. Global Environmental Change, 19 (2): 292–305. |
| [2] | Cusick R D, Logan B E. 2012.Phosphate recovery as struvite within a single chamber microbial electrolysis cell[J]. Bioresource Technology, 107 (2): 110–115. |
| [3] | Doyle J D, Parsons S A. 2002.Struvite formation,control and recovery[J]. Water Research, 36 (16): 3925–3940. |
| [4] | Ichihashi O, Hirooka K. 2012.Removal and recovery of phosphorus as struvite from swine wastewater using microbial fuel cell[J]. Bioresource Technology, 114 : 303–307. |
| [5] | Liu H, Logan B E. 2004.Electricity generation using an air-cathode single chamber microbial fuel cell in the presence and absence of a proton exchange membrane[J]. Environmental Science & Technology, 38 (14): 4040–4046. |
| [6] | 彭赵旭, 霍明昕, 彭永臻, 等.2011.DO对除磷过程的长期影响[J].哈尔滨工业大学学报, 43 (4):42–46. |
| [7] | 覃彪, 支银芳, 周华, 等.2012.微生物燃料电池在脱氮方面的研究进展[J].环境科学与技术, 35 (1):111–114. |
| [8] | 冉春秋, 崔玉波, 李海燕, 等.2013.单室型无质子膜微生物燃料电池协同去除 COD 和含氮污染物[J].高校化学工程学报, 27 (2):316–321. |
| [9] | Shu L, Schneider P, Jegatheesan V, et al. 2006.An economic evaluation of phosphorus recovery as struvite from digester supernatant[J]. Bioresource Technology, 97 (17): 2211–2216. |
| [10] | 王庆, 丁原红, 任洪强, 等.2012.高浓度氨氮对活性污泥性能的影响[J].工业用水与废水, 43 (2):13–16. |
| [11] | 魏复盛. 2002. 水和废水监测分析方法(第4版)[M]. 北京: 中国环境科学出版社: 211 -268. |
| [12] | 徐少娟, 蒋涛, 殷峻, 等.2011.进水氨氮浓度对强化生物除磷(EBPR)系统除磷特性及微生物群落结构的影响[J].环境科学学报, 31 (4):745–751. |
| [13] | 杨颖, 江和龙.2013.微生物燃料电池研究进展[J].环境科学与技术, 36 (2):104–109. |
| [14] | 杨金萍, 汪家权, 陈少华, 等.2013.双室微生物燃料电池处理硝酸盐废水[J].环境工程学报, 7 (5):1837–1842. |
| [15] | Zang G L, Sheng G P, Li W W, et al. 2012.Nutrient removal and energy production in a urine treatment process using magnesium ammonium phosphate precipitation and a microbial fuel cell technique[J]. Physical Chemistry Chemical Physics(PCCP), 14 (6): 1978–1984. |
| [16] | 张立成, 常继勇, 程亚楠, 等.2014.单室微生物燃料电池处理生活污水特性研究[J].沈阳建筑大学学报(自然科学版), 30 (5):931–937. |
 2016, Vol. 36
2016, Vol. 36


