2. 新型肥料湖北省工程实验室, 武汉 430070;
3. 通辽市农业科学研究院蔬菜研究所, 通辽 028015;
4. 华中农业大学生命科学技术学院, 农业微生物学国家重点实验室, 武汉 430070
2. Hubei Provincial Engineering Laboratory for New-Type Fertilizer, Wuhan 430070;
3. Vegetable Research Institute, Tongliao Academy of Agricultural Sciences, Tongliao 028015;
4. State Key Laboratory of Agricultural Microbiology, College of Life Science and Technology, Huazhong Agricultural University, Wuhan 430070
我国城郊土壤重金属污染问题越来越受到人们的重视,大量研究结果表明,城郊农用土壤总体上均出现了不同程度的重金属超标现象,其中以Cd超标最为普遍.长春、南京、长沙、杭州、广州、香港等城郊土壤Cd含量高达1.35~3.6 mg·kg-1,超过国家土壤二级标准4.5~12倍(李仁英等,2010;刘乃瑜等,2004;廖金凤,2001;黄凤球等,2014);沈阳市菜地土壤Cd、Pb、Zn的平均值分别为土壤背景值的7.06、3.96和3.87倍(宋菲等,1996),上海市宝山区菜区土壤受到不同程度的重金属污染,Cd和Hg为主要污染元素(冯恭衍等,1993);广州市约有9.5%的菜区土壤受重金属污染,其中Cd、Pb和As的含量分别为广东省土壤背景值的2.77、2.97和1.40倍(戴军等,1995).
重金属污染土壤的修复方法主要有物理、化学和生物修复技术,其中微生物修复以污染小、成本低等特点成为热门的重金属土地污染修复技术,越来越受到关注(徐慧和陈明,2015;Morgan et al.,2005;赵庆龄等,2010).微生物可以改变重金属离子在土壤中的化学行为,通过对土壤中重金属进行转化、移动或固定,降解有毒物质,从而达到微生物修复的目的(吴敏等,2014),郭军康等(2013)在番茄上的研究表明接种耐镉微生物能显著促进镉污染土壤上番茄的生长.不同类型微生物对重金属污染的耐性不同,通常认为:真菌>细菌>放线菌(Hiroki et al.,1992).目前,研究较多的真菌种类主要有酿酒酵母(Saccharomyces cerevisia)、黑曲霉(Aspergillus Niger)、青霉菌(Penicillium sp)等(薛高尚等,2012;Chen et al.,2011; Shaili et al.,2006;).目前关于耐重金属微生物的研究主要集中在对微生物筛选和鉴定上(Zhu et al.,2012; Kamala et al.,2012),而关于利用微生物修复重金属污染的报道还不多(曹德菊,2004;李梦杰等,2013),其中对Pb、Cd污染土壤修复的报道更少见报道(刘灵芝等,2012; Zhang et al.,2013),他们的主要研究成果表明在重金属污染土壤中接种微生物可以降低土壤重金属活性.本文利用从铅镉污染土壤筛选得到的耐铅镉污染两株真菌(产黄头孢霉Cephalosporium chrysogenum和头孢霉Cephalosporium SP),通过分析其对Pb、Cd污染土壤的Pb、Cd含量、形态及小白菜生长的影响,以研究其对土壤Pb、Cd生物有效性的影响,为铅镉污染土壤微生物修复的应用提供理论依据.
2 材料与方法(Materials and methods) 2.1 试验材料试验所用土壤取自湖南株洲,土壤Pb、Cd含量分别为132.5 mg·kg-1,4.56 mg·kg-1,pH4.85,有机质21.88 g·kg-1,碱解氮38.5 mg·kg-1,速效磷 2.11 mg·kg-1,速效钾75.36 mg·kg-1;试验种植作物为小白菜(上海五月慢);试验所用耐铅镉真菌筛选自湖南株洲铅镉污染土壤,分别为产黄头孢霉(Cephalosporium chrysogenum,简称CC)和头孢霉(Cephalosporium SP.,简称SP),两种真菌的基本性状见表 1.
| 表 1 供试菌株菌落的形态及棉兰染色 Table 1 The morphology of colony and Medan staining of fungi |
采用土培试验,分土壤灭菌(灭菌采用巴氏灭菌法)、不灭菌及10 mL和20 mL两个菌液接种水平,共10个处理(表 2).
| 表 2 不同处理接菌与灭菌状况 Table 2 Fungus inoculation and sterilization condition in different treatments |
每个处理设3次重复,每盆装土350 g,施肥量N、P2O5、K2O分别为0.2 g·kg-1土、0.15 g·kg-1土、0.15 g·kg-1土,肥源为分析纯的尿素、磷酸二氢钾及氯化钾.
2008年5月24日种植,7月6号收获;生育期浇无菌水,期间追施尿素0.3 g·盆-1.
2.3 测定指标及方法土壤Pb、Cd化学形态的测定采用1989年修改后的Tessier连续提取法(朱燕婉等,1989),石墨炉原子吸收分光光度计测定;
植物Pb、Cd的测定采用HNO3+HClO4(GB/T 5009—1996)消解,石墨炉原子吸收分光光度计测定.
2.4 数据处理采用Excel 2003和SPSS18.0进行数据处理与分析,LSR法进行多重比较.
3 结果与分析(Result and analysis) 3.1 耐Pb、Cd真菌对小白菜生长的影响 3.1.1 耐Pb、Cd真菌对小白菜株高及鲜重的影响由表 3可知,和对照相比,灭菌和不灭菌接种两株菌都能通过增加株高和鲜重从而促进小白菜生长,其中灭菌时接种CC能显著增加小白菜株高及鲜重,说明接种两株真菌均能促进小白菜的生长,且CC促进小白菜生长的效果更好;两株菌均是灭菌处理较不灭菌处理时小白菜株高及鲜重增加更显著,两株菌均为接种10 mL较20 mL时小白菜生长好,说明灭菌有利于两株菌种促进重金属污染土壤上小白菜生长,且菌株的接种量不一定是越多越好,接种量太大,可能影响土著微生物的生长,从而影响小白菜的生长.试验结果显示灭菌处理和未灭菌土壤上接种两株真菌对小白菜生长的影响不同,在未灭菌土壤上接种不同真菌处理上株高和鲜重没有显著差异,而在灭菌土壤上接种CC小白菜株高和鲜重显著大于接种SP,说明接菌和灭菌对小白菜生长的影响有交互作用.
| 表 3 接种供试菌菌悬液不同处理对小白菜株高和鲜重的影响 Table 3 Effect of different strains liquor on the height and fresh weight of Chinese cabbage |
由表 4可知,接种CC和SP均能降低或显著降低小白菜植株内Pb、Cd含量及累积量.在未灭菌土壤上接种CC和SP能显著降低小白菜Pb、Cd含量和累积量;灭菌土壤上,接种CC对小白菜体内Pb含量及累积量的降低效果较Cd显著,而接种SP对白菜体内Cd含量及累积量的降低效果较Pb好,说明两株菌种在降低小白菜吸收Pb和Cd上的能力是不同的;两株菌接种10 mL都较接种20 mL效果好,说明接种量并不是越多越有利于降低小白菜对Pb、Cd的吸收,这与接菌量对小白菜生长影响的结论是一致的.灭菌和未灭菌土壤上接种真菌对小白菜体内重金属含量和累积量的影响不同,未灭菌土壤上接种CC和SP可以显著降低植物Pb、Cd含量和累积量,但在灭菌土壤上接种CC和SP不能显著降低小白菜Pb、Cd含量和累积量,说明接菌和灭菌在影响小白菜吸收重金属上有交互作用.
| 表 4 接种菌悬液不同处理对小白菜植株内重金属Pb、Cd含量及累积量的影响 Table 4 Effects of different strains liquor on the concentration and accumulation of Pb, Cd in Chinese cabbage |
土壤重金属污染的危害不仅取决于其在土壤中的含量,还取决于其在土壤中的赋存形态(Impellitteri et al.,2003; Fernandez et al.,2000;Sastre et al.,2004).目前,通常将土壤重金属的赋存形态划分为5种,即可交换态、碳酸盐结合态、铁锰氧化结合态、有机结合态和残渣态,其中可交换态、碳酸盐结合态和铁锰氧化物结合态为不稳定态,其生物有效性高,有机质及硫化物结合态和残渣态为稳定态,生物有效性低(靳治国,2010).
3.2.1 耐Pb、Cd真菌对土壤交换态Pb、Cd含量的影响由图 1可知,灭菌能显著降低土壤交换态Pb、Cd含量,对成熟期土壤的降低效果更显著,说明灭菌对土壤交换态Pb、Cd含量的降低随作物生育时期增加降低效果更为显著;灭菌与不灭菌土壤交换态Pb、Cd含量均随着生育期增长而降低,可能是小白菜吸收的原因.
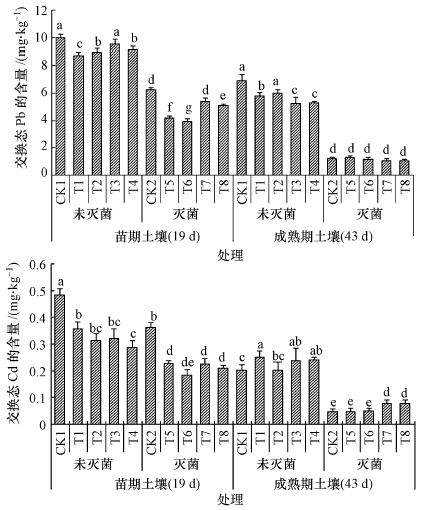 |
| 图 1 接种真菌对土壤交换态Pb、Cd含量的影响 注: 图中不同字母表示同一时期处理间差异显著性达5%水平 Fig. 1 Effect of fungi on the exchangeable Pb and Cd concentration in soil Note: Different letters in the same period are significantly different at P < 0.05. |
灭菌与不灭菌土壤接种两株菌均能显著降低苗期土壤交换态Pb、Cd含量,并且随着生育期增加,接种两株菌仍对未灭菌土壤交换态Pb、Cd含量有降低或显著降低效果,其中SP菌株的效果更为显著,但对灭菌土壤交换态Pb、Cd含量影响不再明显.这些结果说明这两株菌均能降低土壤交换态Pb、Cd含量.
CC对未灭菌土壤交换态Pb、Cd含量的降低主要在苗期,而SP则主要在于成熟期,CC和SP对灭菌土壤交换态Pb、Cd含量的降低都只限于苗期,由此可以说明SP可能较CC对土壤土著微生物的适应性强,而在没有土著微生物的情况下,CC对交换态Pb、Cd含量降低的效果较SP好,且对小白菜株高及鲜重的促进作用也较SP好(表 3).
3.2.2 耐Pb、Cd真菌对土壤碳酸盐结合态Pb、Cd含量的影响由图 2可知,灭菌处理能显著降低苗期土壤碳酸盐结合态Pb含量,但对苗期土壤碳酸盐结合态Cd含量没有影响.随着作物生长时间增加,灭菌土壤中碳酸盐结合态Pb含量显著增加,其原因可能是后期耐性菌株死亡,菌株释放出的Pb和土壤中的碳酸盐结合;灭菌显著增加了成熟期土壤中碳酸盐结合态Cd含量.这些结果说明灭菌对土壤中碳酸盐结合态Pb含量初期起降低作用,后期起增加作用,而对土壤碳酸盐结合态Cd含量初期没有影响,后期起增加作用.
 |
| 图 2 接种真菌对土壤碳酸盐Pb、Cd含量的影响 注: 图中不同字母表示同一时期处理间差异显著性达5%水平 Fig. 2 Effect of fungi on the carbonate bound Pb and Cd concentration in soil Note:Different letters in the same period are significantly different at P < 0.05. |
灭菌与不灭菌接种CC和SP对苗期土壤碳酸盐结合态Pb含量没有影响,但接种CC和SP可以显著降低未灭菌苗期土壤中碳酸盐结合态Cd含量,说明接种SP和CC苗期时只影响未灭菌土壤上碳酸盐结合态Cd含量.成熟期时,接种两种真菌均不能降低未灭菌土壤中碳酸盐结合态Pb、Cd含量,说明接种SP和CC对碳酸盐结合态Cd含量的影响主要是在苗期.
在成熟期灭菌土壤中两株真菌均是接种10 mL处理的碳酸盐结合态Cd含量显著低于接种20 mL处理,说明并不是接种菌株越多越有有利于降低土壤中碳酸盐结合态Cd含量.
3.2.3 耐Pb、Cd真菌对土壤铁锰氧化物结合态Pb、Cd的影响由图 3可知,灭菌对苗期土壤铁锰结合态Pb含量没有显著影响,但灭菌显著增加苗期土壤铁锰结合态Cd含量,随着小白菜生长时间增加,灭菌显著降低了成熟期土壤上铁锰结合态Pb含量,但是对土壤中铁锰结合态Cd含量的影响不再显著.说明灭菌对铁锰结合态Cd含量影响主要在苗期,对铁锰结合态Pb含量的影响主要在成熟期.
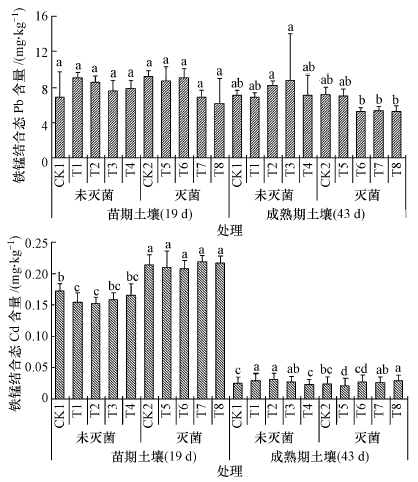 |
| 图 3 接种真菌对土壤铁锰氧化物结合态Pb、Cd含量的影响 注: 图中不同字母表示同一时期处理间差异显著性达5%水平 Fig. 3 Effect of fungi on the Iron-manganese oxide bound Pb and Cd concentration in soil Note:Different letters in the same period are significantly different at P < 0.05. |
接种CC和SP两株菌种对苗期土壤中铁锰结合态Pb含量没有显著影响,且接种CC和SP对苗期灭菌土壤上铁锰结合态Cd没有影响,但接种CC显著降低了未灭菌苗期土壤中铁锰结合态Cd含量.成熟期时,接种CC和SP均未显著降低灭菌与未灭菌土壤中铁锰结合态Pb、Cd含量(T5处理铁锰结合态Cd除外).说明接种SP对铁锰结合态Pb、Cd含量没有显著影响,而接种CC仅对土壤中铁锰结合态Cd含量有降低作用.
3.2.4 耐Pb、Cd真菌对土壤有机结合态Pb、Cd含量的影响由图 4可以看出,灭菌显著降低了苗期土壤有机结合态Pb含量,但显著增加了苗期土壤有机结合态Cd含量;成熟期时,灭菌未能显著影响土壤中有机结合态Pb含量,但灭菌显著增加土壤中有机结合态Cd含量.说明灭菌对土壤有机结合态Pb含量的影响主要在苗期,但能影响小白菜整个生长期土壤有机结合态Cd含量.
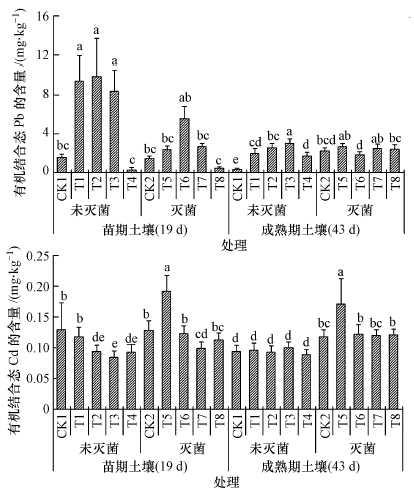 |
| 图 4 接种真菌对土壤有机结合态Pb、Cd含量的影响 注: 图中不同字母表示同一时期处理间差异显著性达5%水平 Fig. 4 Effect of fungi on the organic bound Pb and Cd concentration in soil Note:Different letters in the same period are significantly different at P < 0.05. |
接种CC和SP均能显著增加灭菌与未灭菌苗期土壤中有机结合态Pb含量,且能显著降低未灭菌苗期土壤中有机结合态Cd含量.成熟期时,接种SP和CC能显著增加未灭菌土壤中有机结合态Pb含量,但对灭菌土壤上有机结合态Pb含量没有影响;接种SP和CC对成熟期未灭菌土壤中有机结合态Cd含量没有显著影响.这些说明接种SP和CC能显著增加土壤中有机结合态Pb含量且显著降低苗期未灭菌土壤上有机结合态Cd含量.
接种CC显著增加了灭菌苗期土壤有机结合态Cd含量,但接种SP显著降低了灭菌苗期土壤有机结合态Cd含量,说明接种CC对降低土壤Cd活性有更好的作用.
3.2.5 耐Pb、Cd真菌对土壤残渣态Pb、Cd含量的影响由图 5可知,灭菌能降低或显著降低苗期土壤中残渣态Pb、Cd含量,随着小白菜生长时间增加,灭菌降低了成熟期土壤中残渣态Pb含量,但没有降低成熟期土壤残渣态Cd含量.说明灭菌能降低小白菜整个生育期土壤中残渣态Pb含量,但对土壤残渣态Cd含量的降低作用主要在苗期.
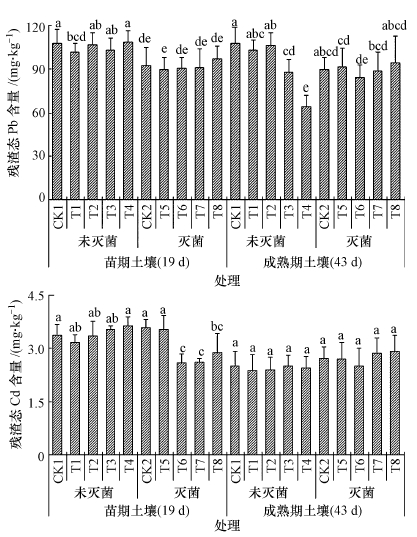 |
| 图 5 接种真菌对土壤残渣态Pb、Cd含量的影响 注: 图中不同字母表示同一时期处理间差异显著性达5%水平 Fig. 5 Effect of fungi on the concentration of residual java state Pb and Cd in soil Note:Different letters in the same period are significantly different at P < 0.05. |
接种CC和SP对苗期未灭菌土壤残渣态Pb、Cd含量均没有显著影响,但能显著降低灭菌苗期土壤中残渣态Cd含量;成熟期时,接种CC和SP能显著降低未灭菌土壤中残渣态Pb含量,对灭菌土壤上残渣态Pb含量及灭菌与未灭菌土壤上残渣态Cd没有显著影响,说明接种CC和SP对残渣态Pb的影响主要在成熟期,而对残渣态Cd含量的影响主要在苗期,这可能是因为不同真菌对不同重金属的修复效果及机理不同.
4 讨论(Discussion)试验结果表明灭菌与未灭菌土壤接种CC和SP均能增加或显著增加小白菜的株高和鲜重,说明接种耐Pb、Cd真菌CC和SP能显著促进重金属污染土壤上小白菜的生长,这与研究报道在重金属污染的土壤上添加耐镉微生物可以显著促进番茄的生长(盛下放等,2003)的结果一致.灭菌土壤接种CC可以显著增加小白菜的株高和生物量,且接种10 mL CC的增加效果更好,说明菌种的接种量并不是越大越有利于促进重金属污染土壤上作物的生长,这可能是因为接菌量过多会影响土著微生物的生长,从而破坏土壤中原有的微生物种群结构,因而不利于小白菜的生长.
接种耐Pb、Cd真菌CC和SP显著降低了小白菜植株内Pb、Cd含量及累积量.试验数据表明接种两株真菌均显著降低了土壤中交换态Pb、Cd和碳酸盐结合态Pb、Cd的含量,而植物吸收重金属的数量与土壤交换态和碳酸盐态含量更为密切(Xian,1989),本试验接种的CC和SP通过降低土壤Pb、Cd的生物有效性(包括交换态和碳酸盐结合态),减少小白菜对Pb、Cd的吸收和累积,从而减缓Pb、Cd对小白菜的毒害,促进小白菜生长,增加小白菜产量.同时,接种两株真菌显著增加土壤有机结合态Pb、Cd含量,这可能是因为真菌分泌的有机物质与土壤中重金属结合,而有机结合态重金属不易被植物吸收(靳治国,2010),因而降低了重金属对植物的危害.微生物可以通过自身的生命活动积极地改变环境中重金属的存在状态,降低重金属的活性(李军等,2009),同时具有耐重金属特性的微生物可积累可观的重金属浓度,从而减少植物的吸收(Zouboulis et al.,2004),这与本试验的研究结果一致.
试验结果表明灭菌显著的降低了土壤中交换态Pb、Cd含量和碳酸盐结合态Pb、Cd含量,这是因为灭菌过程降低了土壤土著微生物含量,而微生物对活化土壤重金属十分重要,Chanmugathas等(1988)报道灭菌处理和不灭菌处理从土柱中淋溶出来的镉分别为6%和9%,说明灭菌降低了土壤中Cd的活性,这与本文的试验结果是一致的.
5 结论(Conclusions)1) 接种两株菌均能显著促进小白菜的生长.
2) 接种两种真菌可以显著降低未灭菌土壤上小白菜体内Pb、Cd含量和累积量;在灭菌土壤上接种产黄头孢霉10 mL可以显著降低小白菜Pb含量和累积量,接种两种真菌可以降低小白菜体内Cd含量和累积量,但这种降低不显著.
3) 接种两种耐重金属真菌可以降低或显著降低土壤中交换态、碳酸盐结合态和铁锰结合态Pb、Cd,且显著增加土壤中有机结合态Pb、Cd,但是对残渣态Pb、Cd含量影响不显著,因此降低了土壤中Pb、Cd的活性.
| [1] | 曹德菊.2004.3种微生物对Cu、Cd生物吸附效应的研究[J].农业环境科学学报, 23 (3):471–474. |
| [2] | Chanmugathas P, Bollag J M. 1998.A column study of the biological mobilization and speciation of cadmium in soil[J]. Archives of Environmental Contamination & Toxicology, 17 (2): 229–237. |
| [3] | Chen C, Wang J L. 2011.Cell surface characteristics of Saccharomyces cerevisiae after Pb (Ⅱ) uptake[J]. Acta Scientiae Circumstantiae, 31 (8): 1587–1593. |
| [4] | 戴军, 刘腾辉.1995.广州菜地生态环境的污染特征[J].土壤通报, 26 (3):102–104. |
| [5] | 冯恭衍, 张炬吴, 吴建平.1993.宝山区菜区土壤重金属污染的环境质量评价[J].上海农学院学报, 11 (1):35–42. |
| [6] | Fernandez A J, Ternero M, Barragan F J, et al. 2000.An approach to characterization of sources of urban airborne particles through heavy metal speciation[J]. Chemosphere-Global Change Science, (2): 123–136. |
| [7] | 郭军康. 2014.耐Cd植物促生菌对番茄幼苗生长及Cd吸收转运的影响机制[D].天津:天津大学 |
| [8] | Hiroki M. 1992.Eeffets of heavy metal contamination on soilmicrobial population[J]. Soil Sci-Plant Nur, 38 : 141–147. |
| [9] | 黄凤球, 孙玉桃, 宋光良, 等.2014.长期种植蔬菜土壤的重金属累积与污染风险评估[J].农业现代化研究, 35 (5):354–357. |
| [10] | Impellitteri C A, Saxe J K, Cochran M, et al. 2003.Predicting the bioavaillability of copper and zinc in soils:Modeling the partitioning of potential bioavailable copper and zinc from solid to soil solution[J]. Environmental Toxicology and Chemistry, 22 (6): 1380–1386. |
| [11] | 靳治国.2010.耐铅镉菌株的筛选及其在污染土壤修复中的应用[D].重庆:西南大学 |
| [12] | Kamala G, Chitrita C, Bhaskar G. 2012.Isolation and characterization of heavy metal tolerant Gram-positive bacteria with bioremedial properties from municipal waste rich soil of Kestopur canal (Kolkata), West Bengal, India[J]. Biologia, 67 (5): 827–836. |
| [13] | 李军, 苏永杰, 马学文, 等.2009.土壤重金属污染用微生物修复的研究[J].中国科技博览, (28):343–343. |
| [14] | 李梦杰, 王翠玲, 李荣春, 等.2013.汞、铅、铬污染土壤的微生物修复[J].环境工程学报, 7 (4):1568–1572. |
| [15] | 李仁英, 周文鳞, 张慧, 等.2010.南京城郊菜地土壤Pb在小白菜体内的分布及富集作用研究[J].土壤通报, 41 (1):212–215. |
| [16] | 廖金凤.2001.城市化对土壤环境的影响[J].生态科学, 20 (1):91–95. |
| [17] | 刘灵芝, 张玉龙, 李培军, 等.2012.铅锌矿区分离丛枝菌根真菌对万寿菊生长与吸镉的影响[J].土壤学报, 49 (1):43–48. |
| [18] | 刘乃瑜, 马小凡, 谢忠雷, 等.2004.长春市城市土壤中重金属元素的积累及其微生物特性研究[J].吉林大学学报(地球科学版), S1 :134–138. |
| [19] | 莫争, 王春霞, 陈琴, 等.2002.重金属Cu,Pb,Zn,Cr,Cd在土壤中的形态分布和转化[J].农业环境保护, 21 (1):9–12. |
| [20] | Morgan J A W, Bending G D, White P J. 2005.Biological costs and benefits to plant-microbe interactions in the rhizosphere[J]. J Experimental Botany, 56 (417): 1729–1739. |
| [21] | 钱春香, 王明明, 许燕波.2013.土壤重金属污染现状及微生物修复技术研究进展[J].东南大学学报(自然科学版), 43 (3):669–674. |
| [22] | 盛下放, 白玉, 夏娟娟, 等.2003.镉抗性菌株的筛选及对番茄吸收镉的影响[J].中国环境科学, 23 (5):20–22. |
| [23] | Sastre J, Hernandez E, Rodriguez R, et al. 2004.Use of sorption and extraction tests to predict the dynamics of the interaction of trace elements in agricultural soils contaminated by a mine tailing accident[J]. Science of the Total Environment, 329 : 261–281. |
| [24] | 宋菲, 郭玉文, 刘孝义, 等.1996.土壤中重金属镐锌铅复合污染的研究[J].环境科学学报, 16 (4):431–436. |
| [25] | Srivastava S, Thakur I S. 2006.Evaluation of bioremediation and detoxification potentiality of Aspergillus niger for removal of hexavalent chromium in soil microcosm[J]. Soil Biology & Biochemistry, 38 (7): 1904–1911. |
| [26] | 吴敏, 王锐, 关旸, 等.2014.土壤重金属污染的微生物修复机理研究进展[J].哈尔滨师范大学自然科学学报, 03 :147–150. |
| [27] | 徐慧, 陈明.2015.土壤铅、镉污染及其微生物修复研究进展[J].安徽农业科学, 43 (1):65–67. |
| [28] | 薛高尚, 胡丽娟, 田云, 等.2012.微生物修复技术在重金属污染治理中的研究进展[J].中国农学通报, 28 (11):266–271. |
| [29] | Xian X F. 1989.Response of kidney bean to concentration and chemical form of cadmium, zinc, and lead in polluted soils[J]. Environmental Pollution, 57 (2): 127–137. |
| [30] | Zhang X H, Yang W J, Wang L M, et al. 2013.Effects of arbuscular mycorrhizal fungi(AMF) on growth of upland rice under soil Pb contamination[J]. Agricultural Science & Technology, 14 (11): 1624–1628. |
| [31] | 赵庆龄, 张乃弟, 路文如.2010.土壤重金属污染研究回顾与展望Ⅱ——基于三大学科的研究热点与前沿分析[J].环境科学与技术, 33 (7):102–106. |
| [32] | Zhu H H, Guo J H, Chen M B, et al. 2012.Burkholderia dabaoshanensis sp. nov., a heavy-metal-tolerant bacteria isolated from Dabaoshan Mining Area Soil in China[J]. Plos One, 7 (12): e50225. |
| [33] | Zouboulis A I, Loukidou M X, Matis K A. 2004.Biosorption of toxic metals from aqueous solutions by bacteria strains isolated from metal-polluted soils[J]. Process Biochem, 39 (8): 909–916. |
 2016, Vol. 36
2016, Vol. 36


