2. 农业部西北植物营养与农业环境重点实验室, 杨凌 712100
2. Key Laboratory of Plant Nutrient and the Agri-environment in Northwest China, Ministry of Agriculture, Yangling 712100
硒是人和动物必需的微量元素,适量的硒(40~400 μg · d-1)能够抵御外界胁迫造成的过氧化损伤,具有防癌、抗衰老等重要作用(杨海滨等,2014).硒缺乏会导致人和动物神经系统、免疫系统、甲状腺功能失调,患各种地方性疾病(曹莹等,2006).据统计,全世界约有5×108~10×108的人缺硒,而我国72%的县(市)为低硒区,其中1/3 为严重缺硒区(赵中秋等,2003),因此,如何补硒是当今多领域的一个研究热点.土壤施入硒肥以提高饮食中硒含量和选育耐硒基因是当前最常采用的方法(Pilon-Smits et al., 2009),前者因简单易行和安全而广泛用于农业生产实践中.亚硒酸盐和硒酸盐是农业上最常用的硒肥,由于硒酸盐的生物有效性高,作物对其的吸收远大于亚硒酸盐,使其成为硒生物强化研究的重点(吴雄平等,2009).
硫是植物必需的营养元素之一,也是一些氨基酸(半胱氨酸和蛋氨酸)、抗氧化物质(还原性谷胱甘肽、GSH)、酶的组成部分(Khan et al., 2014).由于农业生产中普遍大量施用氮、磷、钾,有机肥施用量逐年减少,加上土壤中硫素的淋失,导致一些土壤硫缺乏(吴宇等,2007).施用硫肥是提高缺硫地区作物产量和改善品质的重要手段(周杰等,2012).硫与硒为同族元素,与硒具有相似的物理化学性质(刘新伟等,2014; Stroud et al., 2010).有研究认为,硒酸盐通过硫酸盐转运子吸收,并通过硫酸盐代谢途径代谢,因此,两者之间存在着吸收竞争作用(Renkema et al., 2012; Stroud et al., 2010).与此相反,Harris等(2014)却发现,硫酸盐和硒酸盐对芥菜硫、硒吸收均有促进作用,而硫酸盐对两个品种沙漠王羽的硒吸收无显著(p>0.05)影响.另外,很多研究也都发现,硫酸盐对硬质小麦和春油菜(Renkema et al., 2012)、生菜(Ríos et al., 2008)、大麦和水稻(Mikkelsen et al., 1990)硒酸盐吸收均有协同效应.也有研究认为,除了硫酸盐代谢途径外,作物还可以通过其他途径富集硒、忍耐硒毒(Freeman et al., 2010;White et al., 2004).因此,有关硫酸盐与硒酸盐相互作用对硒吸收的影响尚无定论.
小白菜对硒具有较强的吸收和耐受能力(段曼莉等,2011).因此,本研究以小白菜为供试作物,采用土培盆栽的方法研究不同外源剂量硫和硒配合施用对小白菜生长、硒吸收和转运的影响,探究硫酸盐和硒酸盐相互作用关系,旨在为低硒地区饮食补硒和硒污染修复提供理论依据.
2 材料与方法(Materials and methods) 2.1 试验材料供试土壤为塿土,采自陕西省杨凌西北农林科技大学南校区试验田,采用多点取样法采集表层土壤(0~20 cm),自然风干后,剔去残茬、碎砾,全部过孔径5 mm筛.土壤基本理化性质为:pH=7.74,阳离子交换量(CEC)为23.34 cmol · kg-1,黏粒含量为39.5%,碳酸钙为55.00 g · kg-1,有机质16.33 g · kg-1,全氮1.11 g · kg-1,速效磷17.05 mg · kg-1,速效钾144.83 mg · kg-1,全硒0.131 mg · kg-1.
盆栽作物为小白菜(pak choi),品种为秦白2号,由西北农林科技大学种子公司提供.供试硒为硒酸盐(十水硒酸钠),硫为硫酸钠(十水硫酸钠),均为分析纯试剂,且均为钠盐,以减少伴随离子的可能影响.
2.2 试验设计根据实际生产中硫的施用水平和预试验结果,硫设置不施硫(S0)、低硫(50 mg · kg-1,S50)和高硫(100 mg · kg-1,S100)3个水平;硒酸盐设置的硒剂量为0、1.0、2.5和5.0 mg · kg-14个水平(分别表示为Se0、Se1.0、Se2.5、Se5.0).将硫与硒各水平进行完全交互设计,共12个处理,每个处理重复4次.
具体操作方法为:选择内径7 cm、深13 cm的塑料盆,每盆装土2.5 kg.配制对应浓度的硫酸钠、硒酸钠溶液,用小型雾器均匀喷入土壤中,混匀,N(试剂为尿素,分析纯)和K(试剂为氯化钾,分析纯)的施入量分别为0.15 g · kg-1(以N计)和0.1 g · kg-1(以K计).用称重法控制水分为田间持水量的60%,平衡10 d后播种.每盆播小白菜种子12颗,7 d后间苗,10 d后定苗至5株.小白菜在网室生长,生长期间用称重法保持土壤湿度为田间持水量的70%左右,40 d后收获.收获时,将小白菜连根收获,用蒸馏水将根和叶子洗干净,并用吸水纸擦干,将地上部、根分离后待用.测定根长、株高及地上部酶活性;植物样品90 ℃杀青30 min后,60 ℃烘至恒重,称量地上部干重和根干重,并测定植株样品中硒含量.
2.3 样品采集与指标测定叶绿素含量(SPAD值)直接用叶绿素仪测定,过氧化物酶(POD)酶液的提取参照Xu等(2009)的方法,并采用愈创木酚比色法测定.植物样品经HNO3-HClO4(体积比为4 ∶ 1)消解和6 mol · L-1盐酸还原后,用氢化物发生-原子荧光光谱法(北京吉天AFS-930双道原子荧光光度计)测定硒含量.土壤基本理化性质用常规方法(鲍士旦,2000)测定.
2.4 数据分析使用DPS 7.05、Origin 9.0、SPSS 19.0和Excel 2010进行数据分析处理,采用Duncan法进行多重比较,不同字母表示在5%显著性水平下具有显著差异.
3 结果分析(Results) 3.1 硫酸盐与硒酸盐交互作用对小白菜生长的影响 3.1.1 硫酸盐与硒酸盐交互作用对小白菜株高和根长的影响根系长度、 株高等形态学参数是衡量作物生长状况的重要指标.由图 1a可以看出,单施硫促进了小白菜株高的增长,但影响不显著(p>0.05),但却显著抑制了小白菜根的生长(p<0.05),施硫小白菜的根长均显著低于对照处理(p<0.05).单施硒对小白菜株高的影响与硒剂量有关,低剂量硒(1.0 mg · kg-1)处理小白菜的株高较对照处理增加了8.4%,但高剂量硒(5.0 mg · kg-1)处理小白菜株高较对照下降了15.8%.与株高不同,施硒抑制了小白菜根系的生长,1.0、2.5和5.0 mg · kg-1 Se处理小白菜根长分别较对照显著下降了20.5%、28.3%和49.4%(p<0.05).
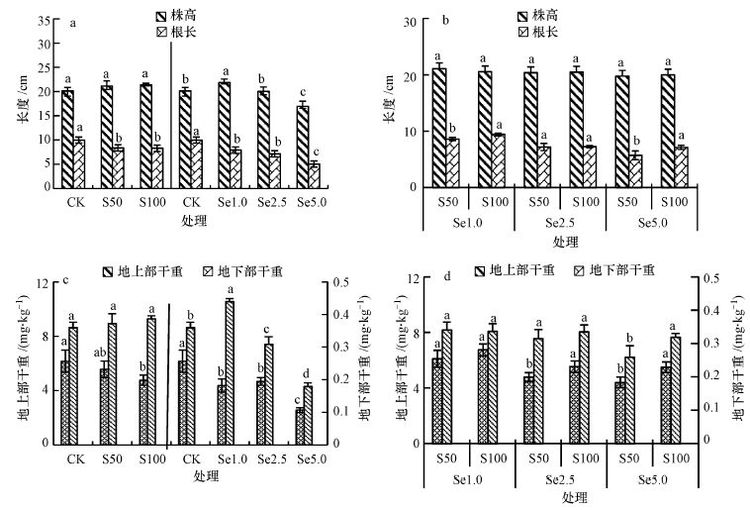 |
| 图1 硫酸盐与硒酸盐单一及交互作用对小白菜株高、根长(a,b)及生物量(c,d)的影响(不同字母表示在5%显著性水平下具有显著差异,下同) Fig.1 Single and combined effects of sulphate and selenate on shoot height and root length(a,b),as well as dry weight(c,d)of pak choi(Different letters indicate significant differences(p<0.05),the same as below) |
硫酸盐与硒酸盐复合处理,相同硒剂量下施硫对小白菜株高无显著影响(p>0.05),但施硫对小白菜根长的影响与硒剂量有关(图 1b).低硒(1.0 mg · kg-1)高硫处理的根长显著大于同等硒剂量的低硫处理(p<0.05),与高硒(5.0 mg · kg-1)剂量时相似,中等硒剂量(2.5 mg · kg-1)时硫剂量对根长无显著影响(p>0.05).低硫剂量下施硒抑制小白菜株高,高剂量硫无显著影响(p>0.05).相同硫剂量下,施硒显著抑制小白菜根系的生长(p<0.05),表现在小白菜根系长度随硒剂量的增大而显著下降.
3.1.2 硫酸盐与硒酸盐交互作用对小白菜生物量的影响由图 1c和图 1d可以看出,小白菜地上部的生物量显著大于地下部(p<0.05),前者约为后者30倍.单施硫促进小白菜地上部干物质的积累,但未达到显著水平(p>0.05)(图 1c),却抑制小白菜地下部干物质的积累,低硫和高硫处理小白菜地下部干重分别较对照下降了9.7%和22.7%.单施硒处理,小白菜地上部干重先随外源硒剂量增大,在1.0 mg · kg-1 Se处理达到最大,而后随外源硒剂量的增大而显著下降(p<0.05); 与此不同,小白菜的地下部干重随外源硒剂量的增大持续下降,硒剂量1.0、2.5和5.0 mg · kg-1处理的地下部干重分别较对照下降了29.2%、24.1%和58.5%,说明该研究设定的硒剂量范围对小白菜根系生长有显著抑制作用(p<0.05).
硫酸盐与硒酸盐复合处理对小白菜地上部和地下部干物质积累的影响相似(图 1d),相同硫剂量下施硒抑制小白菜干物质的积累,表现为地上部干重及地下部干重均随硒剂量的增大而减小.低硒剂量(≤1.0 mg · kg-1)下,施硫对小白菜干物质积累无显著影响(p>0.05),当硒剂量≥2.5 mg · kg-1时,施硫减缓了硒的毒害作用,表现为小白菜干物质的积累显著增加(p<0.05).
3.2 硫酸盐与硒酸盐交互作用对小白菜生理代谢的影响 3.2.1 硫酸盐与硒酸盐交互作用对小白菜叶绿素含量的影响硫单独施用时,S50和S100处理的SPAD值分别较对照增加了8.4%和9.6%,但差异均未达到显著水平(图 2a).Se1.0处理亦促进叶绿素的合成,但高硒处理(≥2.5mg · kg-1)却抑制叶绿素的合成,表现为SPAD值随硒剂量的增大而减小.硫酸盐与硒酸盐交互作用下,施硫处理的SPAD值较相同硒剂量下的不施硫处理有所增加,但差异均不显著.相同硫剂量下,施硒抑制了SPAD的合成. 3.2.2 硫酸盐与硒酸盐交互作用对过氧化酶(POD)活性的影响 单施硫有利于小白菜的生长,POD活性较对照下降(图 2b).单施硒时,Se1.0处理亦有利于小白菜的生长,POD活性较对照减少了86.2 U · g-1 · min-1,但随硒剂量的增大,施硒对小白菜造成了显著的氧化胁迫,表现为Se2.5处理时POD活性显著增加,Se5.0处理时仅为对照的66.2%,此时硒的毒害可能已造成抗氧化系统破坏.硫酸盐与硒酸盐交互作用下,Se≥2.5 mg · kg-1时施硫处理缓解了硒对小白菜的氧化胁迫,表现在施硫处理的POD活性较不施硫处理下降.相同硫剂量下,Se1.0处理的POD活性较不施硒处理稍有增加,但差异不显著,Se5.0处理时则显著下降.
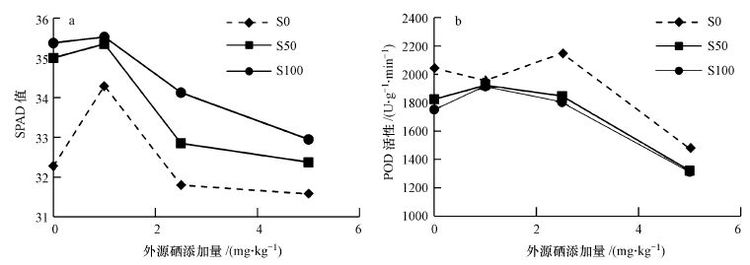 |
| 图2 硫酸盐与硒酸盐单一及交互作用对叶绿素含量(a)和过氧化酶POD活性(b)的影响 Fig.2 Single and combined effects of sulphate and selenate on chlorophyll content(SPAD)(a) and peroxidases activity(POD)(b) |
作物体内元素含量是衡量作物对该元素吸收能力和强度的最直观的指标.由图 3可以看出,所有处理小白菜地上部硒含量均大于地下部,这与硒酸盐在土壤中有效性和移动性高有关.尽管原始土壤中硒剂量很低,施硫仍抑制了小白菜对硒的吸收,但差异不显著(p>0.05).单施硒,小白菜地上、地下硒含量均随外源硒剂量的增大而显著增大(p<0.05),1.0 、2.5、5.0 mg · kg-1 Se 处理的地上部和地下部硒含量分别较对照处理(0 mg · kg-1 Se)增加了98.9、373.4、703.3和82.6、289.3、254.5倍.
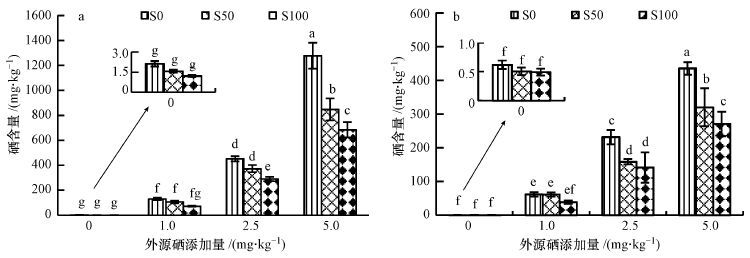 |
| 图3 硫酸盐与硒酸盐单一及交互作用对小白菜地上部(a)和地下部(b)硒吸收的影响 Fig.3 Single and combined effects of sulphate and selenate on the uptake of selenate by pak choi shoots(a) and roots(b) |
硫酸盐与硒酸盐复合作用时,相同硒剂量下,施硫对植物硒吸收的影响与硒剂量有关,外源硒剂量≤1.0 mg · kg-1,硫剂量对小白菜硒含量无显著影响,而高硒剂量时,施硫显著抑制了小白菜对硒的吸收(p<0.05),小白菜地上、地下部硒含量均随硫剂量的增大显著下降.相同硫剂量下,小白菜硒含量随外源硒剂量的增大而显著增大(p<0.05).
3.3.2 硫酸盐与硒酸盐交互作用对硒富集和转运的影响为了表明小白菜富集转运硒的能力,本研究引入了硒富集系数(BCFshoot和BCFroot)和转运系数TF.其中,BCFSe-shoot和BCFSe-root分别指地上部硒含量、地下部硒含量与收获后土壤中硒含量的比值(BCFSe-shoot=C地上部/C介质,BCFSe-root=C地上部/C介质),表征小白菜不同部位富集硒的能力;TF指地上部硒含量与地下部硒含量的比值(TF=C地上部/C地下部),表征小白菜根部向地上部转运硒的能力.
由图 4可以看出,单施硫对小白菜硒富集有一定抑制作用.不施硫时,小白菜地上硒富集系数随外源硒剂量的增大而显著增加(p<0.05),1.0 、2.5和5.0 mg · kg-1 Se 处理的BCFSe-shoot分别为对照处理的21.5、33.3和50.7倍.BCFSe-root随外源施入硒剂量的增大而显著增大(p<0.05),但硒剂量2.5 mg · kg-1与5.0 mg · kg-1处理间无显著差异(p>0.05).硫酸盐与硒酸盐复合作用,相同硒剂量下,小白菜地上、地下部硒富集系数均随硫剂量的增大而显著减小(p<0.05);相同硫剂量下,小白菜硒地上部、地下硒富集系数均随外源硒剂量的增大而增大.
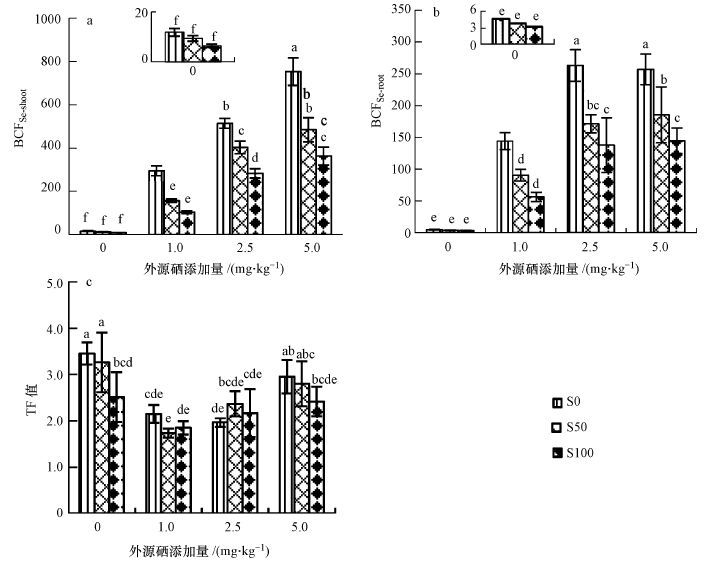 |
| 图4 硫酸盐与硒酸盐单一及交互作用对硒富集和转运的影响 Fig.4 Single and combined effects of sulphate and selenate on selenium accumulation and translocation in pak choi |
单施硫会抑制硒从小白菜根部向地上部的转运,但低硫剂量处理影响不显著(p>0.05)(图 4c).单施硒处理的小白菜硒转运系数均小于不施硒处理,且随外源硒剂量的增大先减小,并于2.5 mg · kg-1处达到最小值1.96,再随硒剂量的增大而增大,说明施硒均抑制小白菜根部硒向地上部的转运,且在2.5~5.0 mg · kg-1之间的某个剂量其抑制作用最大.硫酸盐与硒酸盐复合作用下,相同硒剂量下施硫对硒从小白菜根部向地上部的转运无显著影响(p>0.05).相同硫剂量下,施硒处理的转运系数均小于不施硒处理,且随硒剂量的增大而增加.
4 讨论(Discussion)外源硒对植物生长的影响与其剂量有关,在一定的剂量范围内促进植物的生长,过量则导致生长受阻、代谢紊乱甚至死亡(Feng et al., 2013;Guerrero et al., 2014).付冬冬等(2011)研究发现,低剂量硒酸盐(1.0 mg · kg-1)促进小麦生长而高剂量(≥2.5 mg · kg-1)却抑制生长,与本研究的结果相一致.本研究还发现,与地上部相比,小白菜地下部对硒胁迫更敏感,即使在对地上部生长有益的剂量(1.0 mg · kg-1)下,小白菜根长和地下部干重均显著低于对照处理(p<0.05).赵文龙等(2013)也发现,所有硒剂量处理(1.0~5.0 mg · kg-1)小白菜根长和地下部干重均低于对照.究其原因是当土壤受到外界毒害时,会首先破坏植物体根部细胞的超微结构(林义章等,2007),抑制了细胞分裂和伸长,进而导致植株根系生长受阻,因此,植物根系是外界毒害最重要的靶器官(韩阳等,2005).
Se(Ⅵ)与S(Ⅵ)的外层电子排布都是3d10 4s2 4p4,化学性质相似,两者之间的相互作用十分复杂.许多研究都发现:高浓度SO42-能抵御硒对植物生长的毒害作用(Kikkert et al., 2013).本研究发现,一定的硒剂量(≥1.0 mg · kg-1)下,根长、地上部干重与地下部干重均随着硫剂量的增大而增加,说明施硫缓冲了硒对小白菜生长的胁迫; Harris等(2014)也发现硫酸盐浓度为5 mmol · L-1时,施硒处理的醉蝶花羽叶生物量与不施硒处理无显著差异(p>0.05).与Hajiboland 等(2008)、Fournier等(2010)、Renkema等(2012)的研究结果相似,本研究还发现,一定的硒剂量下,施硫抑制了小白菜地上部和地下部对硒的吸收和转运.刘新伟等(2014)在油菜的水培试验中发现施硫对硒吸收的抑制率高达96%以上.这可能是因为:一方面,硫酸盐和硒酸盐在根部吸收过程中竞争相同的转运子(Mikkelsen et al., 1990; Zayed et al., 1992).Renkema等(2012)认为无硫时,外源施硒会增加硫转运子的数量,硒通过硫的转运机制被植物吸收富集,而有硫酸盐时,植物会选择性地吸收硫而降低硒的吸收.另一方面,由于SO42-和SeO42-结构上的相似性,两者会竞争相同的结合位点(Terry et al., 2000; Sors et al., 2005),再加上两者同化途径相同,植物对硫酸盐和硒酸盐的吸收间存在竞争作用.生物量是表征植物生长状况及受硒胁迫程度的重要指标(吴雄平等,2009).本研究发现,小白菜硒含量、富集系数(BCFSe-shoot、BCFSe-root)均与生物量呈显著相关(p<0.05),因此,硫对硒胁迫的减缓作用可能与其对硒吸收和富集的抑制作用有关(表 1),其受外源硫和硒的剂量及类型、植物种类、培养介质等的影响(Lo et al., 2015; Hajiboland et al., 2008).因此,硫硒相互作用的机理,需要从土壤中的硒的形态、分子水平、亚细胞分布等方面进行更深入的研究.
| 表1 小白菜生物量与硒吸收富集转运系数的相关性分析 Table 1 Correlation analysis on biomass and selenium accumulation and translocation in pak choi |
虽然硒不是植物生长的必需元素,但很多研究证实硒能够参与植物的生理代谢,进而影响植物的生长.本研究发现适量剂量硒(1.0 mg · kg-1)促进小白菜叶绿素的合成,而高剂量硒(≥2.5 mg · kg-1)却抑制了叶绿素的合成.除此之外,由于硫酸盐与硒酸盐在物理化学性质上的高度相似性,过量的硒可能会取代小白菜体内的硫参与一些氨基酸的合成,破坏酶的结构,从而影响小白菜的生理代谢(周鑫斌等,2007).当外源施入硫时,由于植物根系对硫的亲和性较强,硒无法取代硫参与氨基酸的合成,小白菜的酶系统得到了保护,因此,相同硒剂量下,施硫处理的SPAD值均高于不施硫处理.POD是植物体内重要的抗氧化酶,对植物抗逆抗氧化和自我保护非常重要(Yu et al., 2007).与SPAD值相反,低剂量硒(1.0 mg · kg-1)处理下小白菜POD 活性下降,高剂量硒(2.5 mg · kg-1)时则增加,但当硒剂量达到5.0 mg · kg-1时则显著下降,说明高硒剂量处理通过刺激POD活性来增强小白菜的抗氧化能力(付冬冬等,2011),而当硒胁迫超过小白菜的防御能力时(5.0 mg · kg-1),小白菜的抗氧化系统遭到破坏(Wang et al., 2012).施硫处理的POD活性均低于不施硫处理.一般认为,适量硒促进植物生长是由于其促进了叶绿素的合成,增强植物的光合作用,提高可溶性蛋白质的含量,增强了抗逆和抗氧化能力,并刺激植物根系的生长及根系活力;而过量硒的毒害作用则是因为其取代了半胱氨酸中的硫形成硒代半胱氨酸,参与蛋白质的合成,改变了蛋白质的结构、pKa及其亲核攻击的能力,扰乱植物的正常代谢,从而影响植物的生长(Hoewyk et al., 2013; Hondal et al., 2013).
硒富集植物是指硒含量达到1000 mg · kg-1以上的植物,本研究发现在一定硫剂量下,小白菜硒含量均随外源硒剂量的增大而增大,且其地上部最高含量可达1278 mg · kg-1,说明小白菜是硒酸盐的富集植物(Harris et al., 2014; Kikkert et al., 2013).有研究认为,在高富集植物中,地上部硒含量大于地下部,而在非富集植物中则相反(Ilbas et al., 2012; Barillas et al., 2012).本研究发现,相同处理下,小白菜地上部硒的吸收量显著大于地下部(p<0.05).原因可能是:其一,在土壤中硒酸盐的生物有效性较高,与植物根系的亲和力较大,容易被植物根系吸收,并以主动运输的方式被硫转运蛋白转运进入细胞膜,因此,吸收速率快,更多的存在于地上部(Terry et al., 2000);其二,硒高富集植物根部有比硫酸盐专一性更强硒酸盐的转运子—Sultr1;2,能够高效地将硒酸盐从根部转运到地上部(Harris et al., 2014).根据植物对重金属的两大解毒机制理论:外排机制(即将大部分金属保留在根部以避免植物吸收和运输过量的重金属造成毒害,收获时去掉根部以降低重金属的剂量)和区隔化机制(即将根系吸收的重金属多数转运到地上部,其体内具有特殊的解毒机制)理论(李影等,2010),小白菜是通过将更多的硒转运并储存于地上部,并转化成毒性较低的硒形态(如硒代蛋氨酸和硒代丝氨酸)以降低硒的毒害,属于区隔化机制.
5 结论(Conclusions)1)施硒对小白菜生长的影响与小白菜部位有关.低剂量硒(1.0 mg · kg-1)促进小白菜地上部的生长,高剂量硒(≥2.5 mg · kg-1)却抑制其生长.与此不同,所有硒处理均抑制小白菜根系的生长,且抑制作用随外源硒剂量的增大而增大.
2)施硫能减缓高剂量硒对小白菜生长的胁迫,表现为小白菜根长、地上部干重和地下部干重均随硫剂量的增大而增大.
3)低剂量硒(≤1.0 mg · kg-1)通过促进叶绿素的合成、增强抗氧化能力来促进小白菜的生长;高剂量硒(≥2.5 mg · kg-1)抑制其生理代谢和生长.硫酸盐通过自身的营养作用促进叶绿素的合成、增强小白菜的抗逆能力来缓解外源硒的毒害.
4)小白菜硒含量与富集系数与其生物量呈显著负相关,说明硫酸盐通过调控小白菜对硒的吸收和富集来减缓硒的胁迫.综合株高、地上部干重、各生理指标及硒含量,本研究推荐1.0 mg · kg-1硒酸盐与50 mg · kg-1硫酸盐复合处理作为植物补硒硫、硒配施的最佳方案.
| [1] | 鲍士旦.2000.土壤农化分析[M].北京:中国农业出版社 |
| [2] | Barillas J R V,Quinn C F,Freeman J L,et al.2012.Selenium distribution and speciation in the hyperaccumulator Astragalus bisulcatus and associated ecological partners[J].Plant Physiology,159(4):1834-1844 |
| [3] | 曹莹,王振林.2006.微量元素在人体中的适宜量、需要量和中毒剂量[J].国外医学(医学地理分册),27(4):171-173 |
| [4] | 段曼莉,胡斌,梁东丽,等.2011.4种蔬菜对硒酸盐的吸收、富集与转运特征的研究[J].农业环境科学学报,30(3): 422-428 |
| [5] | Feng R,Wei C,Tu S.2013.The roles of selenium in protecting plants against abiotic stresses[J].Environmental and Experimental Botany,87:58-68 |
| [6] | Fournier E,Adam-Guillermin C,Potin-Gautier M,et al.2010.Selenate bioaccumulation and toxicity in Chlamydomonas reinhardtii: Influence of ambient sulphate ion concentration[J].Aquat Toxicol 97:51-57 |
| [7] | Freeman J L,Tamaoki M,Stushnoff C,et al.2010.Molecular mechanisms of selenium tolerance and hyperaccumulation in Stanleya pinnata[J].Plant Physiology,153(4):1630-1652 |
| [8] | 付冬冬,段曼莉,梁东丽,等.2011.不同价态外源硒对小白菜生长及养分吸收的影响[J].植物营养与肥料学报,17(2):358-365 |
| [9] | Guerrero B,Llugany M,Palacios O,et al.2014.Dual effects of different selenium species on wheat[J].Plant Physiology and Biochemistry,83:300-307 |
| [10] | 韩阳,雪梅,延姝.2005.环境污染与植物功能[M].北京:化学工业出版社 |
| [11] | Hajiboland R,Amjad L.2008.The effects of selenate and sulphate supply on the accumulation and volatilization of Se by cabbage,kohlrabi and alfalfa plants grown hydroponically[J].Agricultural & Food Science,17(2):177-189 |
| [12] | Harris J,Schneberg K A,Pilon-Smits E A.2014.Sulfur-selenium-molybdenum interactions distinguish selenium hyperaccumulator Stanleya pinnata from non-hyperaccumulator Brassica juncea (Brassicaceae)[J].Planta,239(2):479-491 |
| [13] | Hoewyk V.2013.A tale of two toxicities: malformed selenoproteins and oxidative stress both contribute to selenium stress in plants[J].Annals of Botany,112(6):965-972 |
| [14] | Hondal R J,Marino S M,Gladyshev V N.2013.Selenocysteine in thiol/disulfide-like exchange reactions[J].Antioxid Redox Sign,18(13):1675-1689 |
| [15] | Ilbas A I,Yilmaz S,Akbulut M,et al.2012.Uptake and distribution of selenium,nitrogen and sulfur in three barley cultivars subjected to selenium applications[J].Journal of Plant Nutrition,35(3):442-452 |
| [16] | Khan M I R,Asgher M,Khan N A.2014.Alleviation of salt-induced photosynthesis and growth inhibition by salicylic acid involves glycinebetaine and ethylene in mungbean (Vigna radiata L) [J].Plant Physiology and Biochemistry,80:67-74 |
| [17] | Kikkert J,Berkelaar E.2013.Plant uptake and translocation of inorganic and organic forms of selenium[J].Archives of Environmental Contamination and Toxicology,65(3): 458-465 |
| [18] | 李影,王友保.2010.4种蕨类草本植物对Cu的吸收和耐性研究[J].草业学报,19(3):191-197 |
| [19] | 林义章,徐磊.2007.铜污染对高等植物的生理毒害作用研究[J].中国生态农业学报,15(1):201-204 |
| [20] | 刘新伟,段碧辉,夏全杰,等.2014.硫对土壤中硒形态变化及油菜硒吸收的影响[J].环境科学,35(9):3564-3571 |
| [21] | Lo B P,Elphick J R,Bailey H C,et al.2015.The effect of sulphate on selenate bioaccumulation in two freshwater primary producers: A duckweed,Lemna minor,and a green alga,Pseudokirchneriella subcapitata[J].Environmental Toxicology & Chemistry, 34(12):2841-2845 |
| [22] | Mikkelsen R,Wan H.1990.The effect of selenium on sulfur uptake by barley and rice[J].Plant Soil,121(1):151-153 |
| [23] | Pilon-Smits E A,LeDuc D L.2009.Phytoremediation of selenium using transgenic plants[J].Current Opinion in Biotechnology,20(2):207-212 |
| [24] | Renkema H,Koopmans A,Kersbergen L,et al.2012.The effect of transpiration on selenium uptake and mobility in durum wheat and spring canola[J].Plant Soil,354(1/2):239-250 |
| [25] | Ríos J J,Blasco B,Cervilla L M,et al.2008.Regulation of sulphur assimilation in lettuce plants in the presence of selenium[J].Plant Growth Regulation,56(1):43-51 |
| [26] | Sors T G,Ellis D R,Salt D E.2005.Selenium uptake,translocation,assimilation and metabolic fate in plants[J].Photosynthesis Research,86(3): 373-389 |
| [27] | Stroud J,Broadley M,Foot I,et al.2010.Soil factors affecting selenium concentration in wheat grain and the fate and speciation of Se fertilisers applied to soil[J].Plant Soil,332(1/2):19-30 |
| [28] | Terry N,Zayed A,De Souza M,et al.2000.Selenium in higher plants[J].Annual Review of Plant Biology,51(1):401-432 |
| [29] | Wang Y D,Wang X,Wong Y S.2012.Proteomics analysis reveals multiple regulatory mechanisms in response to selenium in rice[J].Journal of Proteomics,75(6):1849-1866 |
| [30] | White P,Bowen H,Parmaguru P,et al.2004.Interactions between selenium and sulphur nutrition in Arabidopsis thaliana[J].Journal of Experimental Botany,55(404):1927-1937 |
| [31] | 吴雄平,梁东丽,鲍俊丹,等.2009.Se(Ⅳ)和Se(Ⅵ)对小白菜生长及生理效应的影响[J].环境科学学报,29(10):2163-2171 |
| [32] | 吴宇,高蕾,曹民杰,等.2007.植物硫营养代谢、调控与生物学功能[J].植物学通报,24(6):735-761 |
| [33] | Xu Z Q,Zhou Q X,Liu W T.2009.Joint effects of cadmium and lead on seedlings of four Chinese cabbage cultivars in northeastern China[J].Journal of Environmental Sciences,(21): 1598-1606 |
| [34] | 杨海滨,邓敏,盛中雷,等.2014.土壤中硒元素研究进展[J].南方农业,8(22):36-39,44 |
| [35] | Yu X Z,Gu J D.2007.Metabolic responses of weeping willows to selenate and selenite[J].Environmental Science and Pollution Research,14(7):510-517 |
| [36] | Zayed A,Lytle C M,Terry N.1998.Accumulation and volatilization of different chemical species of selenium by plants[J].Planta,206(2):284-292 |
| [37] | 赵文龙,梁东丽,石美,等.2013.磷酸盐与硒酸盐相互作用对小白菜磷和硒吸收的影响[J].农业环境科学学报,32(12): 2331-2338 |
| [38] | 赵中秋,郑海雷,张春光,等.2003.土壤硒及其与植物硒营养的关系[J].生态学杂志,22(1):22-25 |
| [39] | 周鑫斌,施卫明,杨林章.2007.叶面喷硒对水稻籽粒硒富集及分布的影响[J].土壤学报,44(1):73-78 |
| [40] | 周杰,王东,满建国,等.2012.高氮条件下硫氮互作对冬小麦幼苗生长及氮、硫吸收利用的影响[J].植物营养与肥料学报,18(1): 42-51 |
 2016, Vol. 36
2016, Vol. 36


