2. 中国科学院大学, 北京 100049;
3. 河北工程大学, 邯郸 056038
2. University of Chinese Academy of Science, Beijing 100049;
3. Hebei University of Engineering, Handan 056038
海河流域是我国河流污染最严重的流域之一,其位于半干旱区域,由于水资源天赋不足,河流天然径流逐年减少导致河流自然补给过程弱化,城市工业废水和生活污水排放量逐年增加,河流呈现非常规水源补给特征(范兰池等,2013).由于工农业的发展,大量氮磷物质随着废水的排放进入河流,加之农业肥料的使用使得河流中多种营养物超标(张洪等,2015).同时,海河流域河流灌区密布,水利设施大量修建造成平原河流物理连续性变差,河流闸坝林立,河流水流缓滞(单保庆等,2012),库型特征明显,流域河流尤其是平原段河流富营养化问题突出(Pernet-Coudrier et al., 2012).
子牙河是海河流域的典型河流,位于海河流域中部,据研究表明子牙河水系水质28%处于重富营养化水平,31%处于极富营养化水平,因此子牙河水系沉积物中营养盐含量也引起广泛重视(张洪等,2015;Zhang et al..,2014).子牙新河和滏阳新河是海河流域典型的人工河流,是海河流域大量人工河流的缩影,河流曲率较小,形态学单一,并且和自然河流子牙河并行流淌,便于对比研究沉积物中磷形态及持留机制(朱晓春,2012).因此,本研究以子牙河(自然河流),子牙新河和滏阳新河(人工河流)为研究对象,利用SMT分级方法结合液相31P-NMR技术,研究河流沉积物中磷形态特征及其组分之间的含量差异,对于认识磷的生物地球化学循环过程,控制河流内源污染具有重要意义.
沉积物磷形态的研究方法中最成熟的是化学连续提取法.化学连续提取法集中针对无机磷,最常用的方法是SMT(Standard Measurements Testing Program of European Union)连续提取法,该方法是欧洲标准测试测量组织在改进的Williams法的基础上,最终形成的淡水沉积物磷形态连续提取方法(Ruban et al., 2001).SMT法通过采用酸、碱提取剂连续地对沉积物样品进行提取,得到总磷、有机磷、无机磷、铁铝结合态磷以及钙结合态磷,适合研究磷的形态来源(黄清辉等,2006).然而SMT法只能得到有机磷总量,不能获取其组成信息,无法深入认识有机磷(Brandes et al., 2007).自1980年,Tate第一次将核磁共振技术用于分析环境样品中的有机磷开始(Newman and Tate, 1980),液相核磁共振技术(31P-NMR)已经成为分析环境样品中有机磷的重要手段.现已成功分析出环境样品中的磷酸单酯、磷脂、DNA磷、膦酸盐、焦磷酸盐、多聚磷酸盐等多种成分及其含量(Cade-Menun,2005;Turner et al., 2005),是目前研究有机磷最为有效的方法.因此,本研究选择SMT分级法结合液相31P-NMR技术系统研究自然河流和人工河流沉积物样品中的磷形态.
2 材料与方法(Materials and methods) 2.1 研究区域概况及样品采集海河流域属于温带东亚季风气候区,降水量较少,易形成干旱天气.上游地区往往截流灌溉导致中下游地区水量锐减,因此其库型河特征明显,物理连续性差,水流缓滞,自净能力弱,是我国污染最严重的流域.子牙河和子牙新河是海河流域的主要河流,位于海河流域中部,横跨河北省东南部的邯郸、石家庄、邢台、衡水和沧州5个地区,河流的补给水源主要以接纳沿岸城市的生产和生活废水为主,污径比高.由于水资源短缺和大量磷素的输入,加之河流闸坝众多,流速缓慢,进一步加剧了河流富营养化程度.
子牙河是海河流域重要的支流之一,全长700余公里,献县以上由两大支流组成,分别是滹沱河和滏阳河.滹沱河发源于山西省五台山北侧,沿途在山西和河北境内接纳了清水河和冶河,而滏阳河发源于邯郸市,沿途接纳了澧河等支流.子牙河是海河南系的重要河流.因此,子牙河是海河流域较为典型的自然形成的大河.子牙新河和滏阳新河是建国后人工开挖的泄洪河道,自艾辛庄起,与子牙河成为两条并行的河道,流经河北省的献县、河间、大城、青县、黄骅等县,最终注入渤海湾.人工河流的特点是河道蜿蜒度小,河岸带整齐,坡降小,闸坝多等(海河志编撰委员会,1998).
本次样品取自子牙河与子牙新河,共布设了8个采样点,采样点沿河流流向依次布设(图 1),子牙河有4个采样点(1、2、3、4),子牙新河和滏阳新河4个采样点(5、6、7、8),其中,采样点3、6和采样点4、7相距2 km以内,作为人工河流和自然河流的样点进行对比研究.样点1位于邯郸市,样点2位于艾辛庄闸坝附近,样点3位于衡水市附近,样点4、5位于献县节制闸附近,样点6、7、8分布于沧州市内.
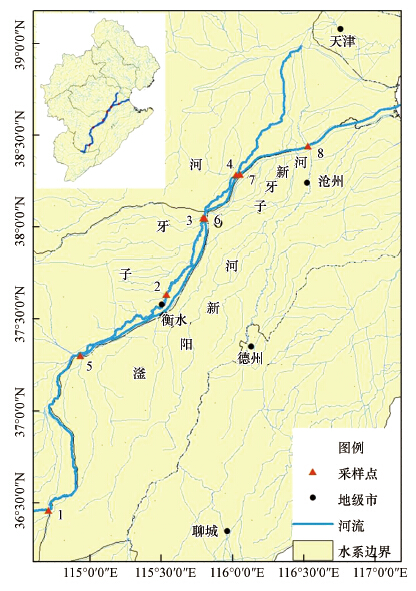 |
| 图 1 子牙河、子牙新河和滏阳新河取样点位置 Fig. 1 Distribution of the sampling sites in Ziya River, Ziyaxin River and Fuyangxin River |
样品采集于2014年8月进行,上覆水在距水面约0.20 m处使用有机玻璃采水器进行采集,样品采集后用聚乙烯采样瓶保存并带回实验室分析.表层沉积物样品利用彼得森自重力采泥器采集,采集沉积物表层约5 cm的样品,为了取得代表性的样品,样点布设时,根据目标样点实际情况每个样点同时设置3~5个子样点,每个子样点间间距不小于200 m.样品采集后现场充分混匀,采用隔氧保存法装入可密封的聚乙烯塑料袋中并于冷藏箱低于4 ℃密封保存.运回实验室后,将沉积物样品冷冻,并使用LGJ10冷冻干燥机干燥48 h,研磨过100目筛后,四分法取土壤样品密封低温保存待用(金相灿等,2004).
上覆水过0.45 μm水系滤膜后放入4 ℃冰箱保存待测.TP使用电感耦合等离子体发射光谱仪(ICP-OES)和电感耦合等离子质谱仪(ICP-MS)进行测定.沉积物理化指标TC、TN和TS,通过称取20~30 mg过100目筛土壤样品,利用Vario EL Ⅲ型元素分析仪测定(鲁如坤,2000).
2.3 沉积物磷SMT分级磷分级采用改进的SMT分级法,OP含量根据差减法得到(Ruban et al., 1999;2001).通过使用不同性质的提取剂HCl、NaOH提取,将沉积物磷分为无机磷(IP)、有机磷(OP)、NaOH提取态磷(NaOH-P,主要为Fe/Al/Mn-P)、HCl提取态磷(HCl-P,主要为Ca-P)及3.5 mol·L-1 HCl提取总磷(HCl-TP)(图 2).每个提取步骤后,使用离心机离心15 min,分离固液相,各种形态提取液的磷均根据《水与废水监测分析方法(第4版)》采用钼锑抗分光光度法测定上清液磷的含量.
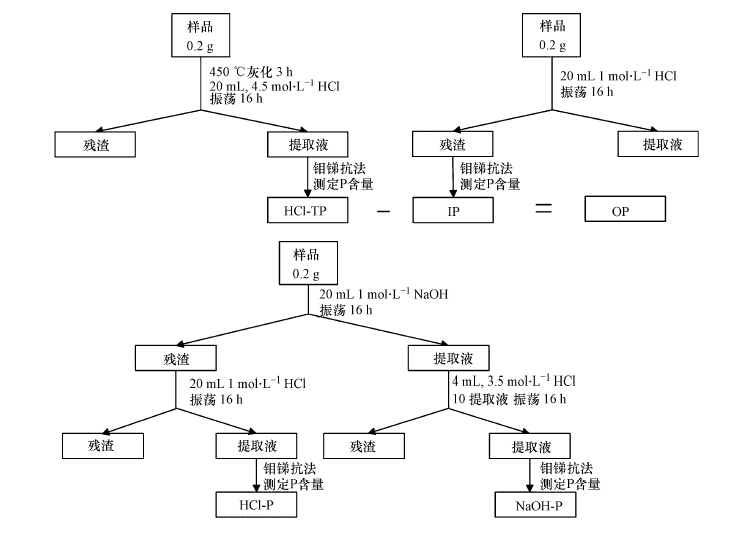 |
| 图 2 SMT分级法 Fig. 2 SMT harmonized protocol |
HCl-TP测定:准确称量0.2 g过100目筛沉积物样品于坩埚中,马弗炉中450 ℃灰化3 h,待样品在干燥皿中温度降到室温后转移到离心管中,加入20 mL 3.5 mol·L-1 HCl(HCl可直接加到坩埚中以减少转移粉末产生的损失),旋紧盖后水平放置于摇床中,在恒温20 ℃振速250 r·min-1条件下振荡16 h进行提取.振荡后使用美国BECKMAN Allegra X-22离心机在2000 g(RCF)下离心15 min,离心后使用0.45 μm水系滤膜过滤,上清液适当稀释后使用钼锑抗分光光度法测量吸光度,得到HCl-TP.
IP与OP测定:测定IP时,准确称取0.2 g样品于离心管中,加入20 mL 1 mol·L-1 HCl,振荡16 h,振荡结束后在2000 g条件下离心15 min,过滤后比色法测定上清液磷含量.沉积物OP为总磷和有机磷的差值.
NaOH-P与HCl-P测定:准确称取0.2 g沉积物样品于离心管中,加入20 mL 1 mol·L-1 NaOH,充分振荡16 h.振荡结束后在2000 g条件下离心15 min,过滤后保留残渣.取10 mL过滤后的上清液于新离心管中,加入4 mL 3.5 mol·L-1 HCl,剧烈摇晃20 s后静置16 h.静置后在200 g条件下离心15 min,过滤后测定上清液P含量得到NaOH-P.残渣则使用12 mL 1 mol·L-1 NaCl清洗,剧烈摇晃5 min后,再在2000 g条件下离心15 min,小心弃掉上清液,重复清洗两次.清洗后在离心管残渣中加入20 mL 1 mol·L-1HCl,2000 g条件下离心15 min,过滤后适当稀释上清液,比色法测定P含量,得到HCl-P(Ruttenberg,1992).
2.4 沉积物OP提取与液相31P-NMR分析本研究中选择目前在沉积物有机磷方面应用相对广泛的提取剂比例m(土壤):V(提取剂)=1:10(g/mL),提取时间16 h(Cade-Menun and Preston, 1996).准确称取3 g过100目筛沉积物样品于冷冻离心管中,加入30 mL 0.25 mol·L-1 NaOH和50 mmol·L-1 EDTA的混合溶液,旋紧盖后水平放置于摇床中,在恒温20 ℃振速250 r·min-1条件下振荡16 h,振荡结束后使用美国BECKMAN Avanti J-26XP冷冻离心机在4 ℃、8000 r·min-1条件下离心40 min,过滤后取上清液(Zhang et al., 2013).取适量提取液稀释后使用钼锑抗分光光度法分析TP,得到NaOH-TP.剩余提取液利用冷冻干燥机冷干至粉末状,冷藏待用(张文强和单保庆,2013).
称取冷冻干燥粉末300 mg用于31P-NMR分析.取300 mg冷冻干燥粉末于2 mL 离心管中,加入0.1 mL 10 mol·L-1 NaOH和0.6 mL D2O的混合溶液重新溶解,室温下超声振荡30 min后静止平衡5 min,之后14000 r·min-1条件下高速离心15 min,将离心获得的上清液转移至核磁共振管中上机检测,获得图谱.核磁共振仪选用瑞士BRUKER公司的BRUKERAV400,采用BRUKER标准腔5 mm的BBO探头,31P谱的脉冲P1=12.00 usec,脉冲功率PL1=3.00 dB,31P的共振频率为129.534 Hz,循环延迟dl=3.6 s,扫描20000次左右,测定温度为20 ℃(白秀玲等,2011).对图谱进行解析,所有31P化学位移均参照85%的正磷酸盐,根据参照文献中主要磷形态峰值的位移确定其组成,分别为:正磷酸盐(Ortho-P: 6~7 ppm)、磷酸单酯(Mono-P: 4~6 ppm)、磷脂(Lipid-P: 1~3 ppm)、DNA磷(DNA-P: 0 ppm)、膦酸盐(Phon-P: 18~20 ppm)、焦磷酸盐(Pyro-P: -3.5~-4.5 ppm)及多聚磷酸盐(poly-P: -17~-19 ppm)(Cade-Menun,2005;Turner et al., 2005).最后对沉积物有机磷不同组分图谱进行积分,根据不同组分所占比例及NaOH-TP含量,计算沉积物中不同组分有机磷的含量.
3 结果与讨论(Results and discussion) 3.1 河流沉积物基本理化性质子牙河、子牙新河和滏阳新河河流沉积物总磷等基本理化指标在不同样点间变化较大.河流沉积物总磷在568.2~9171.9 mg·kg-1之间,平均值为4159.7 mg·kg-1,且各点差异较大,远高于全国土壤磷平均含量500 mg·kg-1,含量较高,也高于该区域背景值,545 mg·kg-1(轮知颍等,2015).最高浓度出现在献县附近的子牙新河样点7,TP含量高达9171.9 mg·kg-1,而最低浓度出现在采样点7的对比样点献县附近的子牙河4号采样点.
河流沉积物及上覆水基本理化性质见表 1.沉积物有机质含量的测定通过TC来反映,总体较高(Bai et al., 2009).TC含量较一般河流土壤较高,含量在1.67%~7.32%之间,平均值为4.72%;TN含量在0.11%~0.79%之间,平均含量为0.49%,TC、TN最大值都出现在子牙新河7号采样点,说明该点有机质含量较高.TS含量在0.10%~0.89%之间,平均含量为0.48%,TS变化趋势不同于TC、TN,最大值1.31%出现在子牙河5号采样点.上覆水TP的含量范围为1.68至2.13 mg·L-1,均已远远超过我国地表水环境质量标准GB3838—2002 V类水标准(0.4 mg·L-1),无法满足任何应用.
| 表 1 沉积物基本理化性质 Table 1 Physiochemical properties of sediments |
TC和TP(C/P)的比值是有机质来源和有机磷生物地球化学循环过程的重要指标(Meyers,1994).较高的C/P 比值意味着磷损失,有机磷会随着有机质的降解而发生降解.C/P的比值较低意味着由于人类活动导致的磷输入而引起沉积物磷的大量累积.在本研究中,子牙新河和滏阳新河较高的C/P比说明人为污染较严重,C/P比值和沉积物中TP呈反相关关系意味着沉积物中的TP主要来源于人为污染源(李洁等,2015).
子牙河、子牙新河和滏阳新河河流沉积物总磷平均值为4159.7 mg·kg-1,远高于辽河表层沉积物219.0 mg·kg-1,滦河表层沉积物988.1 mg·kg-1以及黄河下游表层沉积物552.4 mg·kg-1(Zhang et al., 2015).子牙河、子牙新河和滏阳新河河流沉积物TC、TP含量高于其他河流沉积物的原因一方面与海河流域污染严重有关,海河流域每天有大量的工农业废水携带大量的磷流入到河流,并且大约有130 kg的P通过河流输入渤海(Pernet-Coudrier et al., 2012);另一方面也和海河流域河流闸坝众多有关,河流流动不连续,出现间歇性断流,截留了部分磷,水体中大量磷沉积在沉积物中,导致闸坝附近沉积物磷含量较高(刘国华等,2001).
3.2 SMT分级分析沉积物磷组成SMT分级方法分析所得河流沉积物磷组成结果见图 3.总体而言,沉积物中磷以无机磷为主,其中,HCl-P是无机磷的主要组成成分(张雷等,2011).无机磷占总磷含量的49.0%以上,无机磷的主要组成部分为HCl-P,占总量的25.5%~81.8%之间,其次为NaOH-P,所占比例为9.3%~55.5%;有机磷OP所占比例最小,为3.0%~23.4%.其中,Ca-P是HCl-P的一个主要存在形态,主要与样品所在区域的地质、地球化学背景及酸碱度有关,这种磷一般被看作永久性的P汇,较难被分解参与短时期的P循环,释放风险较小(Stutter et al., 2010).而NaOH-P主要为铁、铝、锰结合态磷,主要与无定形或非结晶氧化矿物含量有关,通过吸附等方式滞留磷,是沉积物中的易交换态磷,这类磷常被认为是内源P释放的主要来源,在不同pH、氧化还原条件下会导致其释放(朱广伟等,2003).
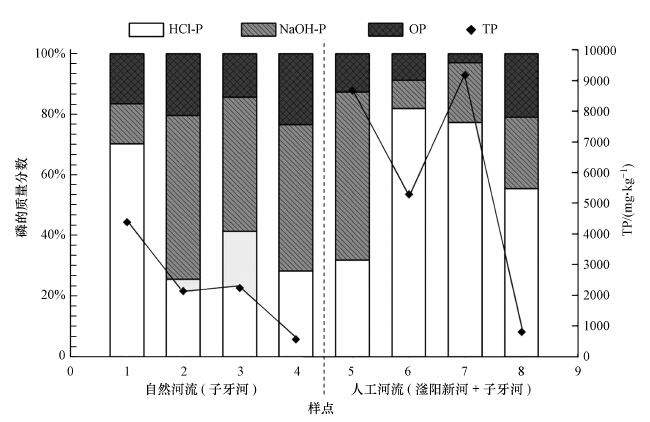 |
| 图 3 各样点SMT分级所得不同结合态磷所占比例 Fig. 3 Proportion of various phosphorus fractions in sediments by SMT protocol |
从图 3可看出,两条河流在沉积物磷组成方面存在很大的差异.子牙新河和滏阳新河沉积物总磷明显高于子牙河.
子牙河上游1号点TP为4386.4 mg·kg-1,是子牙河TP含量最高的点,同时不易释放的HCl-P比例也最高,达到70.17%左右.位于中游的样点2、3总量含量相差较少,都在2000~2500 mg·kg-1之间,且2号点略高于3号采样点的TP含量,可能由于2号样点位于闸坝后,在旱季时经常无水,磷累积相对较少,同时2号点NaOH-P所占的比例高达54.0%,其含量和比例在子牙河中都是最大的,说明其沉积物磷组成较不稳定,容易释放.下游的样点4总磷含量最低,接近于全国土壤平均值,而其有机磷比例很高,是所有样点OP比例最高的样点.子牙河中下游稳定的 HCl-P比例较小,而较易释放的 NaOH-P和OP所占比例较高,因此具有较高的释放风险(Rydin,2000).人工河流子牙新河和滏阳新河TP总体远高于相邻的自然河流子牙河,且5、6、8号点TP呈现逐渐降低的趋势.艾辛庄闸坝下游的样点5总磷含量高达8673.5 mg·kg-1,且55.5%的TP都是较易释放的NaOH-P,有机磷含量也较高,达到1101.6 mg·kg-1,说明其污染较严重,且沉积物磷具有较大的释放风险.与子牙河样点3对比的滏阳新河样点6总磷含量是3号点的2.5倍左右,且6号点81.7%的总磷都是HCl-P,可能与周边的农业污染有关,但沉积物磷组成较稳定,不易释放.子牙河4号点的对比样点子牙新河7号点总磷含量异常偏高,是所有样点中总磷含量最高的点.HCl-P比例也较高达到77.2%,且除HCl-P外,其NaOH-P和OP含量都低于对比样点4,说明虽然其TP含量很高,但大部分都是HCl-P,较稳定不易释放.位于下游的子牙新河样点8总磷含量较低,可能是由于下游水量较大,磷沉积较少.8号点有机磷比例较高,但含量较低,总体磷组成较稳定,释放风险较小.
3.3 液相31P-NMR分析沉积物有机磷形态河流沉积物样品核磁共振图谱见图 4.利用31P-NMR技术共在NaOH-EDTA提取液中检测到7类磷化合物,7种磷化合物分别为正磷酸盐(Ortho-P)、磷酸单酯(Mono-P)、磷脂(Lipid-P)、DNA磷(DNA-P)、焦磷酸盐(Pyro-P)、膦酸盐(Phon-P)以及多聚磷酸盐(Poly-P).
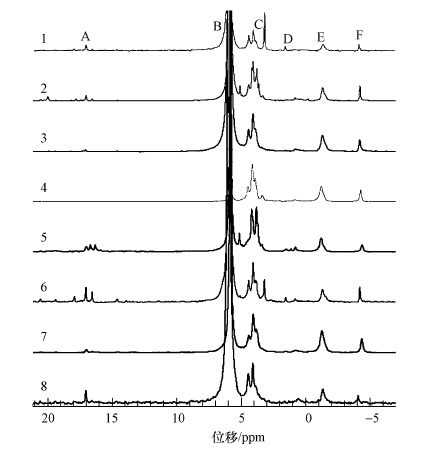 |
| 图 4 表层沉积物液相31P-NMR图谱 (A:Phon-P;B:Ortho-P;C:Mono-P;D:Lipids-P;E:DNA-P;F:Pyro-P) Fig. 4 31P-NMR spectra of NaOH extracts of the surface sediments |
提取液中NaOH-TP的含量范围为 464.5~9667.5 mg·kg-1.Ortho-P为NaOH-TP 提取液的主要成分,其含量范围为113.8~6226.2 mg·kg-1,占NaOH-TP的54.8%至94.4%.Mono-P是NaOH-TP 提取液中OP的主要成分,其含量范围为27.0~1991.9 mg·kg-1,DNA-P在子牙新河样点7含量较高,其含量范围为5.5~853.2 mg·kg-1,另一种磷酸二酯(Diesters-P)Lipid-P含量低于DNA-P,含量范围为0.0~184.7 mg·kg-1.Pyro-P的含量远远小于正磷酸盐,其含量范围为0.0~317.2 mg·kg-1.Phon-P含量范围为0.6~335.5 mg·kg-1,占NaOH-TP的0.4%~4.8%.Poly-P只在两个样点4、7检出,分别为9.8 mg·kg-1和25.4 mg·kg-1.
子牙河、子牙新河和滏阳新河沉积物中Ortho-P和Mono-P分别为TP和OP的主要组成成分(图 5),这与大量工农业废水的输入有关,同时OP还可以水解成为Ortho-P(Turner et al., 2005).沉积物的主要成分Ortho-P平均含量为2498.5 mg·kg-1,子牙新河和滏阳新河Ortho-P含量明显高于子牙河,其中子牙新河7号点Ortho-P含量最高,达到6226.2 mg·kg-1,Ortho-P被认为是可溶解性总磷中最易被生物利用的磷形态,常用来作为研究湖泊富营养化状态的参数(Han et al., 2013).同TP变化趋势相同,沿河流流向自然河流子牙河Ortho-P也呈现逐渐减少的趋势,而子牙新河和滏阳新河主要受污染的影响,含量都异常偏高,且变化趋势不明显.图谱所得到的无机磷成分还有Pyro-P和Poly-P,具有较高的活性,可以被水生生物直接利用,从而成为藻华爆发的潜在风险源(Ding et al., 2013).Pyro-P含量较低,最多只有8.6 mg·kg-1,部分来源于在碱提过程中Lipids-P和Poly-P的水解(Hupfer and Gächter,1995).Poly-P是一种活性很强的沉积物磷,相关研究表明其半衰期仅为2.0~6.0年(Reitzel et al., 2006).Poly-P仅在样点4、7检测到,说明位于沧州的对比样点4和7污染都较重,释放风险大.其他样点都未检测出也说明Poly-P在沉积物中较少,或在提取过程中出现大量水解.
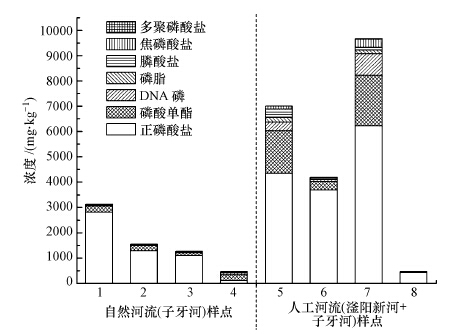 |
| 图 5 31P-NMR分析所得沉积物各部分磷含量 Fig. 5 hosphorus fractionation of sediments by 31P-NMR |
有机磷中Mono-P质量分数最多,占总量的5.81%~49.13%,在厌氧情况下,Mono-P会矿化成Ortho-P.其包括了一大类有机磷化合物,主要有肌醇磷酸、磷酸糖类等,在环境中可以和多价离子结合产生沉淀,稳定性较高(Ishii et al., 2010).其中肌醇磷酸被认为是Mono-P的主要组成部分,根据文献报道肌醇磷酸基本占到土壤OP的50%以上(Hill and Cade-Menun, 2009).从图 5可看出,子牙新河和滏阳新河Mono-P含量明显高于子牙河,样点5、7的Mono-P所占比例较高,在20%以上,其他样点在10%左右,子牙河样点4虽然TP含量较低,但Mono-P占NaOH-TP的49.13%,说明4号点释放风险较小(Makarov et al., 2002).磷酸二酯包含DNA、RNA等具有遗传功能的大分子,以及磷脂等细胞壁成分(Spohn and Kuzyakov, 2013).这类物质易被微生物利用,稳定性低于磷酸单酯,主要来源于细菌等的分解和水生植物的腐解,同时还可以指示微生物的丰度(Watts et al., 2002;Ahlgren et al., 2006).磷含量较高的区域其DNA-P含量也较高,表明在这些区域水生植物或藻类生长茂盛.DNA-P含量普遍高于Lipid-P,其中,5、7号点DNA-P含量较高,分别达到330.9和853.2 mg·kg-1以上,其余点在80 mg·kg-1以下;4号样点DNA-P所占比例15.56%,较其他样点较高,说明该点水生植物茂盛,微生物活性高.而对于Lipids-P,8号点未检出,其余点含量也较少,均少于DNA-P,这与二酯极易分解,采样过程和样品保存过程可能导致二酯含量的减少也有关系(Kleeberg et al., 2013).Phon-P被认为是原生生物新陈代谢的产物,又有C-P键的存在而导致这一类化合物十分稳定(Cade-Menun,2005),不易参与磷在水体中的循环,在土壤、富营养化的湖泊及海洋底泥中检出有少量存在(Kittredge and Roberts, 1969),在所有样点中均检测到了Phon-P.
由上述分析可得出,人工河流子牙新河和滏阳新河TP及Ortho-P、Mono-P含量均高于自然河流子牙河,一方面是由于子牙新河和滏阳新河污径比高,绝大部分靠污水补给,污染严重,有机磷含量高;另一方面可能和人工河流特殊的形态功能有关,由于是人工开挖,子牙新河和滏阳新河相比子牙河具有河道蜿蜒度小,河岸带形态单一,坡降小,闸坝多等特点,因此物理连续性差,自净能力弱,因此沉积物中磷含量较高,富营养化程度高.同时,自然河流子牙河TP及Ortho-P沿河流流向均有降低趋势,而子牙新河和滏阳新河此特征不明显,可能由于子牙新河和滏阳新河受污染影响较大,同时闸坝较多,河流不连续导致闸坝前后累积了大量的磷(Zhang et al., 2014).
3.4 不同形态磷含量间的相关性分析对子牙河、子牙新河和滏阳新河样点不同方法得到的磷形态含量进行相关性分析,得出相关系数矩阵结果,显示不同磷形态之间都呈现出显著的相关性.HCl-TP和NaOH-TP相关性显著,达到0.978,且回收率(NaOH-TP/HCl-TP)稳定在50%以上,平均值为75.53%,说明两种分析方法都是科学有效的,都可以反映样品的实际含量和分布规律,不会因为分析手段的不同而掩盖磷在不同土壤中的真实分布规律.
TC、TN与HCl-TP相关性显著,分别达到0.716、0.755,说明有机物和磷的生物地球化学循环有着密切的联系,子牙河、子牙新河和滏阳新河沉积物中TC、TN、TP具有一定的同源性(Bai et al., 2009).SMT所得3种组分中,HCl-P与TP相关性最显著,相关系数为0.859,其次是NaOH-P,最后是OP.这与不同形态磷所占总磷的比例有关,河流沉积物磷以无机磷为主,而绝大多数无机磷是HCl-P,其次是NaOH-P.Ortho-P和Mono-P相关性显著,达到0.827,而与其他变量相关性都不显著,表明子牙河、子牙新河和滏阳新河磷污染来源较复杂.子牙河流域污染严重且来源复杂,若不采取有效措施加以控制,磷的污染将会进一步加重(Jarvie et al., 2013).
| 表 2 不同形态磷含量间的相关性 Table 2 Pearson correlation coefficients between various phosphorus fractions in the sediments |
自然河流和人工河流在河流形态上具有明显的区别.自然河流多为河流自然冲刷行程的河道,河岸带形态一般较为健全,形态多样.而人工河河流形态较为单一,岸边带丧失,不利于污染物的持留.由于人工河流河道曲率较小,便于行洪,因此,自子牙新河和滏阳新河挖掘完成后,便成为子牙河流域的主要排污通道,由于河道形态单一,水生态系统缺乏,导致大量磷素在沉积物中积累,本研究中人工河流的4个样点,沉积物TP平均值为5984.2 mg·kg-1,而与之并行的子牙河系沉积物中TP平均含量为2335.3 mg·kg-1.沿河流流向,沉积物中TP在自然河流中的降低趋势高于人工河流.其主要原因推测为自然河流河道形态多样化,水生生态系统健全,有利于磷的降解,而人工河道不仅接纳的磷多,而且对磷的降解能力弱.磷在自然河流和人工河流中的循环转化过程及影响因素较多,需要通过室内模拟等更深入的研究予以解读.
4 结论(Conclusions)1) 海河流域典型河流子牙河、子牙新河和滏阳新河河流沉积物TC、TN、TP含量均很高,且相关性显著,具有同源性.TP含量在568.2~9171.9 mg·kg-1之间,平均值为4159.7 mg·kg-1,远高于其他河流沉积物,一方面与海河流域污染严重有关,一方面与海河流域水量少,闸坝较多,河流流动不连续有关.
2) 子牙河、子牙新河和滏阳新河两条河流在沉积物磷组成方面存在很大的差异.人工河流子牙新河和滏阳新河沉积物总磷明显高于自然河流子牙河.人工河流子牙新河和滏阳新河相比子牙河具有河道蜿蜒度小,河岸带形态单一,坡降小,闸坝多等特点,因此物理连续性差,自净能力弱,沉积物中磷含量较高,富营养化程度高.
3) HCl-TP和NaOH-TP相关性显著,说明SMT分级方法和改进的液相31P-NMR分析方法都是科学有效的.通过液相31P-NMR方法共检测出7种磷化合物,Ortho-P和Mono-P分别为TP和OP的主要组成成分.子牙新河和滏阳新河TP及Ortho-P、Mono-P含量均高于子牙河.
| [1] | Ahlgren J, Reitzel K, Danielsson R, et al. 2006.Biogenic phosphorus in oligotrophic mountain lake sediments:differences in composition measured with NMR spectroscopy[J]. Water Res, 40 (20): 3705–3712. |
| [2] | 白秀玲, 周云凯, 李斌, 等.2011.基于液相 31P 核磁共振分析的沉积物样品制备方法研究[J].环境科学, 32 (7):1980–1985. |
| [3] | Bai X L, Ding S M, Fan C, et al. 2009.Organic phosphorus species in surface sediments of a large, shallow, eutrophic lake, Lake Taihu, China[J]. Environmental Pollution, 157 (8): 2507–2513. |
| [4] | Brandes J, Ingall E, Paterson D. 2007.Characterization of minerals and organic phosphorus species in marine sediments using soft x-ray fluorescence spectromicroscopy[J]. Marine Chemistry, 103 : 250–265. |
| [5] | Cade-Menun B, Preston C. 1996.A comparison of soil extraction procedures for 31P-NMR spectroscopy[J]. Soil Science, 161 (11): 770–785. |
| [6] | Cade-Menun B J. 2005.Characterizing phosphorus in environmental and agricultural samples by 31P nuclear magnetic resonance spectroscopy[J]. Talanta, 66 (2): 359–371. |
| [7] | Ding S, Xu D, Bai X, et al. 2013. Speciation of organic phosphorus in a sediment profile of Lake Taihu Ⅱ. Molecular species and their depth attenuation[J]. Journal of Environmental Sciences, 25(5):925-932 |
| [8] | 范兰池, 朱龙基, 戴乙.2013.海河流域入河排污口变化及对策分析[J].海河水利, (01):13–15+22. |
| [9] | 海河志编撰委员会. 1997. 海河志[M]. 北京: 中国水利水电出版社 . |
| [10] | Han C, Geng J, Ren H, et al. 2013.Phosphite in sedimentary interstitial water of Lake Taihu, a large eutrophic shallow lake in China[J]. Environ Sci Technol, 47 (11): 5679–5685. |
| [11] | Hill J E, Cade-Menun B J. 2009.Phosphorus-31 nuclear magnetic resonance spectroscopy transect study of poultry operations on the Delmarva Peninsula[J]. Journal of Environ Qual, 38 (1): 130–138. |
| [12] | 黄清辉, 王磊, 王子健.2006.中国湖泊水域中磷形态转化及其潜在生态效应研究动态[J].湖泊科学, 18 (3):199–206. |
| [13] | Hupfer MGächter R. 1995.Polyphosphate in lake sediments:31P NMR spectroscopy as a tool for its identification[J]. Limnology and Oceanography, 40 (3): 610–617. |
| [14] | Ishii Y, Harigae S, Tanimoto S, et al. 2010.Spatial variation of phosphorus fractions in bottom sediments and the potential contributions to eutrophication in shallow lakes[J]. Limnology, 11 (1): 5–16. |
| [15] | Jarvie H P, Sharpley A N, Withers P J, et al. 2013.Phosphorus mitigation to control river eutrophication:murky waters, inconvenient truths, and "postnormal" science[J]. J Environ Qual, 42 (2): 295–304. |
| [16] | 金相灿, 王圣瑞, 庞燕.2004.太湖沉积物磷形态及 pH 值对磷释放的影响[J].中国环境科学, 24 (6):707–711. |
| [17] | Kittredge J S, Roberts E. 1969.A carbon-phosphorus bond in nature[J]. Science, 164 (3875): 37–42. |
| [18] | Kleeberg A, Herzog C, Hupfer M. 2013.Redox sensitivity of iron in phosphorus binding does not impede lake restoration[J]. Water Res, 47 (3): 1491–1502. |
| [19] | 刘国华, 傅伯杰, 杨平.2001.海河水环境质量及污染物入海通量[J].环境科学, 22 (4):46–50. |
| [20] | 轮知颍, 程志中, 严光生, 等.2015.中国不同景观区水系沉积物中39种元素的背景值[J].地学前沿(中国地质大学(北京);北京大学), 22 (5):226–230. |
| [21] | Makarov M, Haumaier L, Zech W. 2002.Nature of soil organic phosphorus:an assessment of peak assignments in the diester region of 31P NMR spectra[J]. Soil Biology and Biochemistry, 34 (10): 1467–1477. |
| [22] | Meyers P A. 1994.Preservation of elemental and isotopic source identification of sedimentary organic matter[J]. Chemical Geology, 114 (3): 289–302. |
| [23] | Newman R H, Tate K R. 1980.Soil phosphorus characterisation by 31P nuclear magnetic resonance[J]. Communications in Soil Science and Plant Analysis, 11 (9): 835–842. |
| [24] | Pernet-Coudrier B, Qi W, Liu H, et al. 2012.Sources and pathways of nutrients in the semi-arid region of Beijing-Tianjin, China[J]. Environ Sci Technol, 46 (10): 5294–5301. |
| [25] | Reitzel K, Ahlgren J, DeBrabandere H, et al. 2006.Degradation rates of organic phosphorus in lake sediment[J]. Biogeochemistry, 82 (1): 15–28. |
| [26] | 鲁如坤. 2000. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社 . |
| [27] | Ruban V, López-Sánchez J, Pardo P, et al. 1999.Selection and evaluation of sequential extraction procedures for the determination of phosphorus forms in lake sediment[J]. Journal of Environmental Monitoring, 1 (1): 51–56. |
| [28] | Ruban V, López-Sánchez J, Pardo P, et al. 2001.Development of a harmonised phosphorus extraction procedure and certification of a sediment reference material[J]. Journal of environmental monitoring, 3 (1): 121–125. |
| [29] | Ruban V, López-Sánchez J, Pardo P, et al. 2001.Harmonized protocol and certified reference material for the determination of extractable contents of phosphorus in freshwater sediments-A synthesis of recent works[J]. Fresenius' journal of analytical chemistry, 370 (2-3): 224–228. |
| [30] | Ruttenberg K C. 1992.Development of a sequential extraction method for different forms of phosphorus in marine sediments[J]. Limnology and Oceanography, 37 (7): 1460–1482. |
| [31] | Rydin E. 2000.Potentially mobile phosphorus in Lake Erken sediment[J]. Water Research, 34 (7): 2037–2042. |
| [32] | 单保庆, 营宇翔, 唐文忠.2012.北运河下游典型河网区水体中氮磷分布与富营养化评价[J].环境科学, 33 (2):352–358. |
| [33] | Spohn M, Kuzyakov Y. 2013.Phosphorus mineralization can be driven by microbial need for carbon[J]. Soil Biology and Biochemistry, 61 : 69–75. |
| [34] | Stutter M I, Demars B O, Langan S J. 2010.River phosphorus cycling:separating biotic and abiotic uptake during short-term changes in sewage effluent loading[J]. Water Res, 44 (15): 4425–4436. |
| [35] | Turner B L, Cade-Menun B J, Condron L M, et al. 2005.Extraction of soil organic phosphorus[J]. Talanta, 66 (2): 294–306. |
| [36] | Watts E, Dean P, Martin R. 2002.31P nuclear magnetic resonance study of sediment microbial phospholipids[J]. Canadian journal of analytical sciences and spectroscopy, 47 (5): 127–133. |
| [37] | 张洪, 林超, 雷沛, 等.2015.海河流域河流富营养化程度总体评估[J].环境科学学报, 35 (8):2336–2344. |
| [38] | Zhang W, Shan B, Li J, et al. 2015.Characteristics, distribution and ecological risk assessment of phosphorus in surface sediments from different ecosystems in Eastern China:A 31P-nuclear magnetic resonance study[J]. Ecological Engineering, 75 : 264–271. |
| [39] | Zhang W, Shan B, Zhang H, et al. 2013.Assessment of preparation methods for organic phosphorus analysis in phosphorus-polluted Fe/Al-rich Haihe river sediments using solution 31P-NMR[J]. PLoS One, 8 (10): e76525. |
| [40] | Zhang W, Shan B, Zhang H, et al. 2014.Phosphorus-31 nuclear magnetic resonance assignments of biogenic phosphorus compounds in sediment of an artificial Fuyangxin River, China[J]. Environ Sci Pollut Res Int, 21 (5): 3803–3812. |
| [41] | 朱广伟, 高光, 秦伯强, 等.2003.浅水湖泊沉积物中磷的地球化学特征[J].水科学进展, 14 (6):714–719. |
| [42] | 朱晓春.2012.海河流域非常规水利用现状调查[J].海河水利, 01 :1–4. |
 2016, Vol. 36
2016, Vol. 36


