微生物燃料电池(Microbial Fuel Cell,简称MFC)可以在处理废水的同时直接产生电能,是一种全新的兼具能源回收的生物废水处理工艺,近年来成为环境科学与工程和电化学领域新的研究热点(Logan and Regan, 2006;Rabaey et al., 2005).
电极是决定MFC产电性能与造价的关键因素(Wei et al., 2011),长期以来,研究者通过物理或化学方法对廉价的电极材料进行修饰或改性以提高电极性能,如阳极表面修饰电子介体(Feng et al., 2011)、重金属(Kim et al., 2005)、导电聚合物(Qiao et al., 2007)或纳米材料(Sharma et al., 2008),阴极表面修饰Pt等贵金属(Logan et al., 2005)催化剂或利用微生物作催化剂(Bergel et al., 2005)等.尽管修饰后的电极材料有效提升了MFC的产电性能,但修饰材料也大大提高了MFC的成本.
2004年,英国曼彻斯特大学物理学家A. K. Geim和K. S. Novoselov从石墨中分离出石墨烯(Graphene)(Novoselov et al., 2004),引起了全世界的研究热潮.这是一种由碳原子以sp2杂化轨道组成六角型呈蜂巢晶格的平面薄膜,只有一个碳原子厚度的二维材料,是目前已知的导电性最好的材料.同时,石墨烯的原料是廉价的石墨,制备过程中使用的材料也廉价易得,这对科学界来说无疑是一种具有无限潜能的革命性材料.2011年,中国科技大学俞汉青等将氧化石墨烯(Graphene Oxide,GO)运用到生物电化学系统(Huang et al., 2011),有效提高了电子转移速率.同年华南理工大学叶建山等采用石墨烯修饰不锈钢网作MFC阳极(Zhang et al., 2011),显著提升了MFC产电性能,由此拉开了石墨烯强化MFC产电性能研究的序幕.
2 石墨烯修饰电极MFC的研究进展 (Recent advances in microbial fuel cells with graphene-modified electrodes) 2.1 墨烯修饰阳极MFC在MFC阳极,微生物作用于废水中的有机质所产生的电子通过3种胞外电子传递机制传递到电极上(Borole et al., 2011):①细胞外活性蛋白质直接传递;②纳米导线;③电子中介体的间接传递.目前电极上固着的微生物量少以及胞外电子传递效率低是MFC的产电的限制因素,是阻碍MFC实际应用的瓶颈之一.石墨烯具有极高的比表面积(理论值约为2630 m2 · g-1),电阻率只有约10-6 Ω · cm,常温下其载流子迁移率可达220150617006 cm2 · V-1 · s-1),石墨烯修饰阳极不仅能有效降低电子传递阻抗,而且能为阳极微生物提供巨大的附着面积以及丰富的电子传递网络,从而有效提升阳极电子传递效率(Allen et al., 2010).此外,研究者还利用化学、物理或电化学等方法对石墨烯进行改性和修饰,以更好的提升阳极性能.
(1)单纯石墨烯修饰阳极MFC
2011年,叶建山等将石墨烯修饰的不锈钢网作MFC的阳极(Zhang et al., 2011),MFC的最大功率密度达到了2668 mW · m-2,分别是不锈钢网和聚四氟乙烯修饰不锈钢网的18和17倍.达到稳定周期电极的扫描电子显微镜(SEM)结果表明,不锈钢网负载石墨烯电极表面附着了大量的微生物是产电性能得到大幅提升的根本原因.2012年,西南大学李长明等用电化学沉积法将石墨烯负载在碳布上作阳极(Liu et al., 2012),MFC功率密度与能量转移效率分别提高了2.7倍和3倍.他们认为石墨烯显著增强了细菌的负载量,使直接电子传递活性中心增多,电子传递率增强.同年,斯坦福大学谢兴将不锈钢网夹在两块石墨烯修饰海绵之间作为阳极,也取得了明显提升产电效果(Xie et al., 2012),海绵的三维结构与石墨烯的优良性能协同提升了阳极导电性,降低了MFC的电压和能量损失.
(2)石墨烯复合导电聚合物或纳米材料修饰阳极MFC
导电聚合物和纳米材料修饰阳极提升MFC产电性能已成共识,石墨烯与这类材料的复合能产生更好的效果.2013年,北京工业大学刘中良等对比了石墨烯与聚苯胺(PANI)复合修饰碳布(PANI-ERGNO/CC)、石墨烯修饰碳布(ERGNO/CC)以及纯碳布(CC)阳极MFC的产电性能(Hou et al., 2013),结果显示,PANI-ERGNO/CC-MFC的最大功率密度和电流密度分别达到了1390 mW · m-2和2.67 A · m-2,分别是CC-MFC的3倍和2.7倍,同时也是ERGNO/CC-MFC的1.4倍和1.35倍.他们认为石墨烯不仅有效提升了阳极的导电性,同时为聚苯胺提供了巨大表面积,石墨烯和聚苯胺都具备良好的导电性,二者复合修饰的碳布为微生物提供了三维的接触面和更多电子传递路径,促进电子转移,显著增强电子传递效率.同年,南洋理工大学Yong用石墨烯-聚苯胺修饰泡沫镍也取得了类似的效果(Yong et al., 2013),Yong认为PANI在溶液中带正电荷,能够与带负电荷的细菌相互吸引而使生物膜更加牢固,是石墨烯-PANI修饰阳极MFC产电性能高于单纯石墨烯修饰阳极MFC的一个重要原因.此外,另一种常见的导电聚合物——聚吡咯也被用于与石墨烯复合修饰阳极,同样达到了令人满意的效果.冯春华等采用石墨烯-聚吡咯修饰石墨毡作为阳极(Lü et al., 2013),其MFC最大功率密度分别是石墨毡阳极MFC的8倍,化学还原石墨烯修饰阳极MFC的1.4倍.
碳纳米管(carbon nanotubes,简称CNTs)是石墨烯的同素异形体,也具有高比表面积,高机械强度以及良好的稳定性和导电性,被很多学者应用于MFC电极研究中(Holzinger et al., 2012).2013年,台湾国立清华大学的戴念華等(Chou et al., 2014)采用“滴涂”法将石墨烯和CNTs的混合液负载在三聚氰胺海绵表面,然后使用碳胶将处理后的海绵贴在不锈钢片上制备出还原氧化石墨烯(reduced graphene oxide,rGO)和CNTs共同修饰的阳极(rGO-CNT sponges).结果是海绵厚度为1.5 mm的rGO-CNT sponges效果最好,MFC的最大电流密度可达335 A · m-3.2014年,马杜赖卡玛拉大学G.Gnana kμmar等制备了氧化石墨烯/碳纳米管复合水凝胶阳极(Gnana et al., 2014).得出复合水凝胶可有效提高电极表面积以及活性位点,而促进电子传递过程,MFC平均电流密度达到了2502 mA · m-2.此外,其他纳米颗粒复合石墨烯修饰阳极也能取得显著的效果,如SnO2与rGO复合修饰阳极MFC的最大功率密度分别是rGO修饰电极和空白电极的2.8倍和4.8倍(Mehdinia et al., 2014).
(3)三维石墨烯和层层组装石墨烯修饰阳极MFC
将石墨烯负载在三维结构的电极材料(如泡沫镍)表面,控制石墨烯的空间分布,可制备出性能优异的三维(three-dimensional,3D)石墨烯电极.如南洋理工大学Yong采用化学气相沉积法将石墨烯负载在泡沫镍表面制备3D石墨烯电极(Yong et al., 2013),为克服气相沉积法制备的石墨烯的疏水性,继而在3D石墨烯表面原位聚合聚苯胺以增强细菌在电极表面的附着性.加利福尼亚大学Wang等采用水热法将GO分散液与泡沫镍在120 ℃下反应5 h制备出rGO-Ni(Wang et al., 2013),为提高rGO的导电性,将rGO-Ni在400 ℃下煅烧30 min.该法可通过控制rGO的负载次数控制rGO的负载量以及电极的比表面积.3D石墨烯阳极使得微生物与电极之间具有三维接触面积,从而可提供丰富的导电路径,有效增强电子传递,同时泡沫镍均一的微孔结构能保障有效的物质扩散,使微生物生长不至于受到基质扩散的限制.
层层组装技术(layer-by-layer assembly technique)主要是通过交替吸附带相反电荷的两种物质,而制备出均匀且形态和厚度可控的均一薄膜.河南师范大学孙建辉等(Guo et al., 2014)将预羧基化的碳纸先后放入带正电荷的聚乙烯亚胺溶液(PEI)和带负电荷的石墨烯分散液中各20 min,水洗后烘干得到一层PEI/GR,重复该过程就可制得多层PEI/GR修饰的电极.6层PEI/GR修饰碳纸的循环伏安和电化学阻抗测试结果表明,修饰电极提高了生物膜的电化学活性,与空白阳极MFC相较,修饰阳极MFC的最大功率密度高出51%,反应器启动时间缩短了31%.
此外,也有研究者将石墨烯功能化以提升石墨烯的修饰性能,如利用酸性离子液体(Zhao et al., 2013)或N掺杂功能化石墨烯(Fan et al., 2014).但无论应用到MFC阳极中的是单纯石墨烯、石墨烯与导电物质的复合物或者3D石墨烯,几乎所有研究都是利用了石墨烯比表面积大、导电性高等优点,或在此基础上进一步修饰石墨烯使得电极具有生物相容性,提高微生物在电极材料表面的负载量,并增多电子传递路径,增强电子传递效率,从而达到提升MFC产电性能的目的.
2.2 石墨烯修饰阴极MFC阴极的设计是MFC发展的一个最大挑战,发生在阴极上的电子、质子和氧气在催化剂上的三相反应难以控制.催化剂需覆盖于导电体表面,但又必须暴露在水和空气中,以便质子和电子从不同相到达同一点,催化剂的结构和性能对MFC的内阻以及电子传递效率具有重要影响.所以催化剂的选择是MFC产电性能的关键影响因素(Logan and Regan, 2006).
固体和液体材料均可以用作催化剂,目前使用最普遍的是含铂碳纸,可显著提升阴极性能,但由于成本过高而受限制,但铂电极为MFC电池的效果提供了有用的参考标准.如何在保证MFC产电性能的同时有效降低成本,是MFC应用必须解决的关键问题.近年来,研究者发现用某些物理或化学方法修饰过的石墨烯的氧化还原能力可与Pt相媲美,而且价格远低于Pt,具有极大的应用前景.
(1)氮/铁掺杂石墨烯修饰阴极MFC
研究发现,氮掺杂石墨烯(Nitrogen doped graphene,N-G)可以在石墨烯表面诱导形成高的局域电荷/自旋密度,会改变石墨烯对氧气的吸附行为,能有效降低O—O健的结合以利于氧气的还原(Gong et al., 2009).然而制备N-G,往往需要高温和复杂的过程,不利于开发利用.2011年,同济大学陈银广等报道了一种爆炸法制备N-G(Feng et al., 2011),该法简单易操作而且可以获取克量级的石墨烯.将石墨、三聚氰酰氯和三硝基酚放入不锈钢高压反应釜内,在320 ℃下先后在瞬时压力(60 MPa)和平衡压力(30 MPa)下反应,然后将生成的物质经水和乙醇洗涤后烘干得到N-G.该法平均每克三聚氰酰氯可得到0.1 g的N-G.测试了N-G负载玻碳电极上的氧化还原性能,结果表明,N-G负载玻碳MFC阴极具有和Pt/C相似的氧化还原能力,最大功率密度((1350±15)mW · m-2)稍低于Pt/C电极((1420±25)mW · m-2),电压((0.555±0.025)V)也仅稍低于Pt/C电极((0.570±0.015)V)(外电路电阻为1000 Ω).相比于昂贵的Pt,与Pt具有相近氧化还原性能的N-G显然更有实用价值.2013年,中国科学院重庆绿色智能技术研究院刘鸿等(Liu et al., 2013)将GO分散液用氨水将pH调至10并加热至95 ℃反应1 h后冷却至室温,然后加入氨腈反应30 min后旋转蒸发去除水分并烘干,将烘干的粉末在管式炉里依次经过550 ℃热解4 h和900 ℃热解1 h,最后将生成的物质经水和乙醇洗涤后烘干得到N-G.该工艺相比于陈银广等的制备过程复杂,但得到的N-G修饰碳纸的氧化还原性能还略高于Pt/C,其阴极MFC功率密度较Pt/C阴极MFC高出3%,电压输出高出6.5%,稳定性良好,反应器运行90 d后,功率密度仅降低了7.6%,可与Pt/C相媲美(90 d后降低6.7%).XPS测试表明该N-G含有4.83%的N元素,并以吡啶氮、吡咯氮和石墨相氮的形式存在,正是这些不同形态的氮元素创造更多的氧气还原活性位点.其中的吡啶氮和吡咯氮能将氧气还原过程从二电子反应途径提高到四电子反应途径,增强了电子转移速率.此外,N-G中的O元素高达13.09%,大量的含氧官能团能保护C-N,避免其与阴极中的H+作用,从而保证N-G具有长期稳定性.
尽管刘鸿等报道的N-G催化氧气还原过程是四电子反应途径,但是大多研究者制备出的N-G催化氧气还原过程同时存在二电子反应途径和四电子反应途径.由于二电子反应途径不仅会与四电子反应途径竞争,而且其过程产生的H2O2会对细胞膜和电极材料造成损伤,因此,氧气还原时经历四电子反应途径是人们所期望的(Maldonado et al., 2005).据报道,催化剂中引入Fe有助于N稳定地引入石墨烯平面内,促进氧气还原的电子转移.而且,Fe能促进H2O2的快速分解,有望使氧气还原过程向四电子反应途径进行(Wang et al., 2009).2012年,本课题组报道了铁/氮掺杂石墨烯(Fe-N-G)作MFC阴极催化剂(Li et al., 2012).相比于单纯石墨烯修饰阴极,Fe-N-G修饰阴极的氧化还原电位向正向偏移,表明石墨烯功能化后具有更强的氧气还原催化活性,使氧气还原反应更易进行.使用Fe-N-G作催化剂时,MFC最大功率密度为1149.8 mW · m-2,远高于Pt/C MFC(561.1 mW · m-2).2014年,刘鸿等进一步通过增加原位水解尿素的步骤制备了均匀沉积的Fe-N-G(Liu et al., 2015),其催化氧气还原过程亦是四电子反应途径,Fe-N-G-MFC的最大功率密度达到了865 mW · m-2,接近Pt/C-MFC(885 mW · m-2).
(2)MnO2复合石墨烯修饰阴极MFC
近年来,由于MnO2低廉、低毒、环境友好和高效的催化性能被用于MFC阴极提高氧化还原性能(Liu et al., 2010; Zhang et al., 2014; Mahmoud et al., 2011),所以当发现了石墨烯电极MFC的良好性能时,研究者很自然的会想到进一步探索MnO2和石墨烯这两种优异催化性能材料复合的效能.2012年,哈尔滨工程大学Wen采用微波法制备了MnO2和石墨烯的复合物(MnO2-graphene)MFC阴极催化剂(Wen et al., 2012),他比较了MnO2-graphene、Pt/C、MnO2以及无催化剂的4种空气阴极MFC的产电性能,最大功率密度排序为MnO2-graphene(2084 mW · m-2)>Pt/C(1714 mW · m-2)>MnO2(1470 mW · m-2)>无催化剂(333 mW · m-2).Wen认为石墨烯显示了良好的催化活性,且MnO2与石墨烯之间的相互作用保障了催化剂稳定性并促进了电子传递,而显著增强了阴极性能.2013年,印度理工大学Santimoy Khilari采用α-MnO2纳米管-石墨烯修饰碳布作空气阴极MFC阴极(Khilari et al., 2013),其MFC最大功率密度达到4.68 W · m-3,略低于Pt/C电极的5.67 W · m-3.他还比较了不同催化剂的制备成本与内阻,α-MnO2纳米管-石墨烯为3.51$ · g-1,内阻为85 Ω,Pt/C(10%Pt)为26 $ · g-1,内阻为75 Ω,表明尽管石墨烯在催化性能方面稍低于Pt/C,但在造价上有绝对的优势,与陈银广对材料造价的比较研究结果(Feng et al., 2011)类似.
此外,利用铁-四磺酸基酞菁(Zhang et al., 2012)、聚苯胺(Ren et al., 2013)、贵金属(Pt、Co等)(Yan et al., 2013)修饰石墨烯以及原位合成石墨烯(Zhuang et al., 2012)MFC阴极催化剂,也取得了较好的效果.在大多数研究中,尽管石墨烯或功能化石墨烯修饰电极的内阻略高于Pt/C电极,但由于石墨烯超强的导电性以及巨大的比表面积,经过功能化后催化性能显著,其MFC产电性能与Pt/C电极相差无几.而石墨烯、功能化石墨烯的制备成本远远低于Pt,这使得石墨烯修饰电极替代昂贵的Pt/C电极成为可能,从而推动MFC的实际应用.
以往的研究表明,石墨烯MFC阳极和阴极均能展现出显著的电化学活性,可有效提升MFC的产电性能,且由于制备成本不高,有利于降低MFC的整体造价.但从根本上来说,电极作为微生物的载体,是影响MFC产电的关键部件,需具备以下要求(Logan and Regan, 2006;Rabaey et al., 2005):①良好的导电性;②高比表面积和高孔隙率,利于附着微生物;③良好的化学稳定性与耐腐蚀性;④廉价,易制备和放大;⑤良好的生物相容性.石墨烯修饰电极能发挥如此大的作用,是因为其物理化学特性很好的满足了前四点要求,但对于第五点,研究者们似乎关注较少.通常人们采用SEM等手段观察反应器稳定运行时电极表面的微生物附着情况,从而判断石墨烯修饰电极的生物相容性.这是一种较粗放的研究手段,对于MFC产电的主体——电化学活性菌,需要更深入的研究其在石墨烯电极表面的生长成膜与膜变化,这方面研究是制备良好生物相容性石墨烯修饰电极的认识基础.但是,石墨烯作为纳米材料的典型代表物,其对微生物的潜在的抗菌性在MFC领域还未见研究报道.
3 石墨烯材料的抗菌性研究进展(Recent advances in antibacterial activity of graphene materials)自2004年石墨烯被成功制备以来,石墨烯材料在晶体管(Bonaccorso et al., 2012)、太阳能(Sun et al., 2015)、超级电容器(Brownson et al., 2011)、传感器(Lu et al., 2009)等领域的研究取得了长足的发展,为使石墨烯材料能有效的应用到实际当中,有必要对其在环境和健康领域的影响做系统的评价(Jastrzebska et al., 2012; Filip and Tkac, 2014).
3.1 石墨烯分散液的抗菌性2010年,中国科学院上海应用物理研究所的樊春海等研究GO分散液对E.coli的影响(Hu et al., 2010).结果表明,20 μg · mL-1GO分散液与E.coli接触 2 h后细菌代谢活性下降至70%,85 μg · mL-1的GO分散液则下降至13%,且透射电镜可观察到细胞严重变形,伴随细胞质的流出,说明高浓度的GO分散液有很强的抗菌活性.2011年,南洋理工大学陈元等比较了石墨(Gt)、氧化石墨(GtO)、氧化石墨烯(GO)、还原氧化石墨烯(rGO)4种材料的分散液的抗菌性(Liu et al., 2011),抑菌百分比分别是GO:69.3%±6.1%,rGO:45.9%±4.8%,Gt:26.1%±4.8%,GtO:15%±3.7%.抗菌作用明显的GO和rGO分散液在与E.coli接触2 h后都改变了细胞的形态,并且表现出较强的氧化应激,谷胱甘肽(GSH)的氧化率分别是22.2%±0.7%(GO),94.2%±1.1%(rGO).GSH的硫醇键(—SH)能被氧化成为二硫键(—S—S),能表征细胞内物质由氧化应激引起的破坏,被作为细胞氧化应激指标.研究表明,石墨烯纳米材料对细胞的直接物理性伤害与氧化应激的协同作用,导致了细胞死亡.同样,韩国建国大学Gurunathan( et al., 2012)和美国中佛罗里达大学Somen Das的研究(Das et al., 2013),也都证实了GO、rGO分散液对细菌的抗菌作用.
3.2 固定化石墨烯的抗菌性2010年,伊朗德黑兰沙里夫理工大学Akhavan等采用电泳沉积法将GO负载在不锈钢网上,并用肼蒸汽还原成rGO负载形态.将这两种材料置于培养皿中与细菌悬浮液共同培养1 h后发现,其中E.coli活性分别下降至41%±8%和16%±3%,S.aureus活性下降至26%±5%和5%±1%(Akhavan et al., 2010).Akhavan认为GO和rGO的尖锐的边缘对细菌均会造成细胞膜的损伤,并且由于rGO的电子传递速率更大且边缘更锋利,其对细菌的损害更大.而革兰氏阳性菌(S.aureus)缺少外膜,抗菌性比革兰氏阴性菌(E.coli)稍弱.同年,樊春海等研究了GO和rGO制备的抗菌纸对E.coli的影响(Hu et al., 2010),扫描电镜观察到两种材料均表现出显著的抗菌性,与E.coli接触12 h后绝大部分细菌都变形死亡.
目前石墨烯材料的抗菌性研究,主要针对分散液,负载型石墨烯的抗菌性研究很少.但鉴于石墨烯族材料在导电膜、电极材料、杀菌材料等多方面潜在的高应用前景,探究其负载形态的抗菌作用也尤为重要.
3.3 石墨烯抗菌影响因素由于石墨烯制备方法的多样性,虽然各不同方法制备的石墨烯材料的抗菌性难以同比,但影响石墨烯材料抗菌性的因素却是一样的.
(1)材料粒径
正如CNT的粒径是其抗菌性的关键影响因素一样(Liu et al., 2012; Lanone et al., 2013),石墨烯的粒径也几乎决定了它对细胞的抗菌性(Liu et al., 2012).陈元等对4种不同粒径的代表性石墨烯材料(Gt、GtO、GO、rGO)的抗菌能力进行了比较,结果如表 1所示.
| 表1 Gt、GtO、GO和rGO 4种材料的粒径、抗菌性及氧化能力对比 Table 1 Comparison of Gt,GtO,GO and rGO in size,antibacterial ability and oxidation ability(Liu et al., 2011) |
GO和GtO的化学功能团几乎一样,氧化能力相差无几,但是由于GO((0.31±0.20)μm)与GtO((6.87±3.12)μm)平均粒径不同导致抗菌能力[GO(69.3%±6.6%)/GtO(15.0%±3.7%)]有着显著的差别.GtO((6.28±2.50)μm)和Gt((6.87±3.12)μm)的粒径相差不是很大,但是Gt(26.1%±4.8%)的抗菌能力却比GtO(15.0±3.75)高很多,这可能与两者的氧化能力有关.rGO和GO相比,尽管rGO(94.2%±1.1%)的氧化能力远高于GO(22.2%±0.7%),但由于GO((0.31±0.20)μm)的粒径远小于rGO((2.75±1.18)μm),GO(69.3%±6.6%)的抗菌性也高于rGO(45.9%±4.8%).由此可看出,粒径与氧化能力都能影响石墨烯材料的抗菌性,但粒径是主要决定因素,粒径越小,抗菌性越大.
(2)分散液浓度与接触时间
与细菌细胞接触的石墨烯材料的浓度和反应时间也是影响抗菌效果的关键因素(Jastrzebska et al., 2012).2012年,韩国建国大学Sangiliy and i等研究不同浓度(0、25、50、75、100、125、150 μg · mL-1)GO、rGO分散液与绿脓杆菌(Pseudomonas aerμginosa)的抗菌作用(Gurunathan et al., 2012)发现,浓度越大的分散液抗菌性越强,其中150 μg · mL-1的GO、rGO分散液与细菌接触2 h后,细菌活性均下降至30%左右.且随着接触时间的增长,细菌活性逐渐下降.GO和rGO分散液对细菌的抗菌性都表现出显著的浓度、时间依赖性.
此外,阿肯色国家毒理学研究中心Zhang等测试rGO与SWCNT浓度(从0.1 μg · mL-1逐步上升到100 μg · mL-1)对老鼠神经PC12细胞的影响得出反应24 h后,两种材料的细胞毒性都表现出与浓度的正相关性(Zhang et al., 2010).对此,上海应用物理研究所的张小勇对MWCNT、GO、ND(nanodiamond)的比较研究中也得到了类似的结果.陈元等分析了Gt、GtO、GO、rGO 4种材料对大肠杆菌的抗菌性,也发现4种材料都存在反应时间、浓度与抗菌性的正相关性(Zhang et al., 2012).
此外,石墨烯材料的其他物理化学性质也会影响抗菌性的大小.2013年,Das等报道石墨烯材料表面的含氧官能团含量是影响抗菌性的重要因素(Das et al., 2013).尽管GO和rGO分散液都能显著增强细胞间ROS和mRNA水平,但GO分散液能对细胞DNA造成明显损坏而rGO分散液不会,因而同样粒径的GO分散液的抗菌性大于rGO分散液.随着rGO表面含氧官能团密度的降低,其因氧化应激造成的抗菌性降低.研究还发现,GO和rGO在水中不同的分散性和存在形态可导致细菌受到的物理损伤不同(Liu et al., 2011).GO具有良好的亲水性可在水中以片状分散,细菌会独立的被GO包裹起来导致细胞变形,而rGO由于含氧官能团的脱除导致亲水性明显降低并在水中沉降下来,细菌则会嵌入到沉降聚集的rGO中.
3.4 石墨烯的抗菌机理据文献调研分析,石墨烯材料的抗菌性来源于两方面(Liu et al., 2011):①细胞膜应力;②氧化应激,这与其他纳米材料抗菌机理相似.
(1)细胞膜应力
目前,有研究证明了纳米材料与细菌接触后能诱发细胞膜应力导致细菌死亡,即纳米材料与细胞接触后,刺透细胞膜深入胞内,造成细胞膜破损,细胞质流出,从而细菌死亡(Lewinski et al., 2008).
陈元等的研究结果显示,大肠杆菌在37 ℃的GO(40 μg · mL-1)分散液中培养2 h后大部分的大肠杆菌被GO包裹住而导致细胞膜变形(图 1),石墨烯引发的膜压力会导致细菌结构变形.与此类似,樊春海等的研究结果显示,大肠杆菌在37 ℃的GO(85 μg · mL-1)分散液中培养2 h后大量的大肠杆菌失去细胞的完整性并导致细胞质溶出(图 2).
 |
| 图1 大肠杆菌与GO接触前(a)和接触后(b)的TEM图[GO(40 μg · mL-1)分散液、37 ℃、2 h] Fig.1 Comparison of TEM imagesof E.coli before(a) and after(b)touched with GO suspension(Liu et al., 2011) |
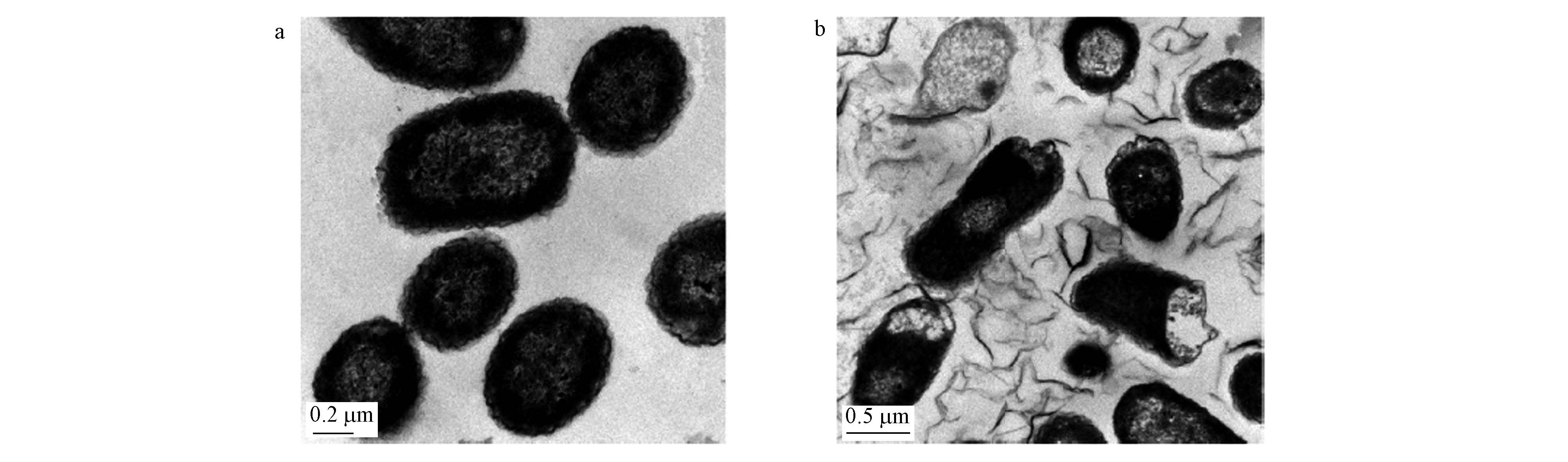 |
| 图2 大肠杆菌与GO接触前(a)和接触后(b)的TEM图[GO(85 μg · mL-1)分散液、37 ℃、2 h] Fig.2 Comparison of TEM imagesof E.coli before(a) and after(b)touched with GO suspension(Hu et al., 2010) |
上海大学系统生物学研究所涂育森等最近的一项研究表明(Tu et al., 2013),石墨烯在与细胞膜接触后,不仅能切断脂质膜,而且深入脂质膜的石墨烯能将膜内的磷脂抽取出来,从而造成细胞膜变稀疏直至变形并破损.他们采用TEM表征rGO与E.coli接触后的形态变化,并用分子动力学模拟rGO与生物膜接触后的插入和抽取状态,认为细胞膜应力来自石墨烯插入、切断细胞膜与抽取磷脂两种机制的联合作用.
(2)氧化应激
与细胞膜应力引起的直接物理损伤不同的氧化应激是石墨烯的另一种抗菌机制.一般来说,由石墨烯引发的氧化应激来自两个途径:①活性氧(Reactive Oxygen Species,简称ROS,包括过氧自由基、过氧化氢、羟基自由基)的产生所引起的强氧化作用;②石墨烯破坏或氧化细胞内的关键的分子或结构从而导致细胞失活(非ROS氧化应激)(Yonand et al., 2008).
为研究石墨烯引发的不同氧化应激途径,陈元等首先通过XTT实验测试石墨烯族材料引发的O2· -量来表征活性氧(ROS)的大小,发现E.coli在石墨烯族分散液中培养5 h之后没有检测到O2· -的生成,即使产生了ROS也是微量的,说明ROS不是石墨烯抗菌性的主要原因.然后,使用GSH氧化方法研究了石墨烯的非ROS氧化应激,结果表明Gt、GtO、GO、rGO对GSH的氧化能力分别是29.9%±0.7%、21.4%±1.1%、22.2%±0.7%、94.2%±1.1%,并与反应时间和石墨烯浓度正相关,说明石墨烯对细菌细胞的抗菌性主要来自于非ROS氧化应激.
与陈元等的研究结果不同的是,阿肯色国家毒理学研究中心Zhang的研究认为ROS生成是细胞凋亡的重要因素(Zhang et al., 2010).ROS可引起胞内成分的破坏,包括DNA和蛋白质,并能改变线粒体膜透性,破坏呼吸链引发凋亡.与此类似的是,韩国济州大学Karthikeyan指出rGO引发的ROS导致了脂质过氧化,激发了一系列的链式反应,最终导致细胞破损直至死亡(Krishnamoorthy et al., 2012).
文献调研发现,石墨烯的抗菌研究常常与CNTs联系起来,陈元等认为耶鲁大学Vecitis提出的单壁碳纳米管三步抗菌步骤(Vecitis et al., 2010)同样适用于石墨烯:①细菌附着或沉积在石墨烯表面;②细菌的细胞与石墨烯尖锐的边缘接触并引发膜应力;③石墨烯引发氧化应激破坏或氧化胞内关键的物质或结构.值得一提的是,尽管石墨烯的抗菌性研究结果与CNTs十分相似,但目前还没有石墨烯抗菌机理的定论,而对于石墨烯的氧化应激的来源还存在争议,而且石墨烯造成物理损伤的具体途径以及氧化应激引发的胞内物质的氧化或破坏情况还有待研究.总而言之,即使有大量的研究表明石墨烯与细菌接触后会导致细胞破损或死亡,但其具体的抗菌途径及机理仍有待进一步深入探索.
4 总结与展望(Conclusions and outlook)文献调研发现关于石墨烯的一个值得深思的问题是,一方面,研究已证明石墨烯修饰电极能有效提升MFC产电性能,另一方面,大量的石墨烯分散液毒性研究证明石墨烯对细菌具有明显的抗菌性.而在MFC中,石墨烯修饰电极作为电化学活性菌的载体,直接与电化学活性菌接触,那么,我们有理由提出这样的问题:石墨烯是否会对MFC电极表面的电化学活性菌具有抗菌性呢?为什么具有明显抗菌性的石墨烯在MFC依然能有效提升MFC产电性能?
然而,基于以下两方面的原因,已有的研究似乎不能回答这些问题:
(1)在已报道关于石墨烯电极MFC领域的研究,研究者绝大部分注意力都集中在提升MFC产电性能上,对石墨烯修饰电极与产电的主体——电化学活性菌的相互作用关注较少,通常只是采用SEM等一般性手段对生物膜整体进行观察,确认石墨烯修饰电极可显著提高微生物的负载量,增多电子传递路径,这仅仅是表面粗放的判断,缺乏细微深入的研究,有关石墨烯对电化学活性菌存在的抗菌作用还未见报道.
(2)已有的关于石墨烯的毒性研究与MFC的研究方法有很大不同,石墨烯的毒性研究大多是采用摇瓶实验测试石墨烯分散液的抗菌性,石墨烯可与细菌进行充分的物理接触,而在MFC领域,通常石墨烯采用固定化的方式修饰在电极表面,电化学活性菌以生物膜的形式生长在电极表面,石墨烯与电化学活性菌在物理接触的同时兼任着电子传递的任务,因此已有的石墨烯的抗菌性研究对MFC体系中石墨烯的抗菌性研究指导意义不足.
基于石墨烯修饰电极在MFC研究的良好发展前景,近期值得关注的研究热点有:
(1)探索石墨烯修饰电极对MFC阴、阳极电化学活性菌的生理代谢活动和电催化效应的影响.
石墨烯修饰电极常用固定化石墨烯的方式,近期有研究表明利用微生物原位还原氧化石墨烯也可成功制备石墨烯电极(Li et al., 2012),此两种不同形式的石墨烯修饰电极对MFC的电化学活性菌的生理代谢活动和电催化效应的影响,有待进一步深入研究.石墨烯修饰阴极对MFC阴极电催化性能的影响以及对电子在阴极传递的影响机制尚不清晰,亦需要进一步深入研究.
(2)探索功能化石墨烯或改性引入的基团或元素对于改变石墨烯对MFC阴阳极电化学活性菌的生理代谢或电催化活性的作用及机理研究.
目前合成石墨烯的方法众多,主要有:微机械剥落(Novoselov et al., 2004)、化学气相沉积(Li et al., 2009)、SiC表面外延生长(Berger et al., 2004)、化学还原氧化石墨烯等(Pei et al., 2012).不同方法制备的石墨烯的物理化学特性(如粒径,含氧官能团,导电性等)迥异,因此有必要比较研究不同功能化石墨烯或改性特异性引入的基团或元素对MFC中电化学活性菌以及对MFC产电性能的影响.
(3)进一步明确石墨烯材料的抗菌机理
石墨烯的抗菌机理还不十分明确,可从分子生物学或者细胞学等微观的角度,利用单分子测序技术、突变鉴定(SNP检测)等深入研究石墨烯修饰电极对电化学活性菌的生理代谢活动、电催化效应以及作用位点的变化情况,明确石墨烯与电化学活性菌接触后发生物理损伤的过程、作用方式、作用机制以及石墨烯引发的电化学活性菌的氧化应激机制.
(4)明确石墨烯生物电极运行过程的膜更新及缺损修复机制
采用原位氧化石墨烯还原制备的石墨烯生物电极,在运行过程中生物膜的更新、电极的缺损修复可能会受石墨烯抗菌性的影响,明确石墨烯生物电极运行过程生物膜更新、电极缺损修复的影响因素和机制对确保石墨烯生物电极稳定运行极为重要.
(5)石墨烯修饰MFC的应用前景
石墨烯修饰MFC电极有着良好的应用前景,在处理难降解有机物废水、重金属废水、合成小分子物质(H2O2等)及生物化学品、生物传感器等方面都存在巨大研究潜力.石墨烯修饰MFC电极为MFC和石墨烯材料的发展提供了新的研究思路.
尽管MFC历经数十年的研究仍距实用遥远,但石墨烯的出现为其提供了一个新的契机,有望使MFC的研究和应用取得重大进展.因此,深入研究石墨烯修饰电极与MFC电化学活性菌的相互作用关系对于有效利用石墨烯提升MFC产电性能具有极大的科研价值和现实意义,将推动MFC进一步迈向实际应用.
| [1] | Akhavan O, Ghaderi E. 2010.Toxicity of graphene and graphene oxide nanowalls against bacteria[J]. Acs Nano, 4:5731-5736 |
| [2] | Allen M J, Tung V C, Kaner R B, et al. 2010.Honeycomb Carbon:A Review of Graphene[J]. Chemical Reviews, 110:132-145 |
| [3] | Bergel A, Feron D, Mollica A. 2005. Catalysis of oxygen reduction in PEM fuel cell by seawater biofilm[J]. Electrochemistry Communications, 7(9):900-904 |
| [4] | Berger C, Song Z, Li T, et al.2004.Ultrathin Epitaxial Graphite:2D Electron Gas Properties and a Route toward Graphene-based Nanoelectronics[J]. The Journal of Physical Chemistry B, 108(52):19912-19916 |
| [5] | Bonaccorso F, Lombardo A, Hasan T, et al.2012.Production and processing of graphene and 2d crystals[J]. Materials Today, 15(12):564-589 |
| [6] | Borole A P, Reguera G, Ringeisen B. 2011.Electroactive biofilms:Current status and future research needs[J]. Energy and Environmental Science, 4:4813-4834 |
| [7] | Brownson D A C, Kampouris D K, Banks C E. 2011.An overview of graphene in energy production and storage applications[J]. Journal of Power Sources, 196(11):4873-4885 |
| [8] | Chou H T, Lee H T, Lee C Y, et al.2014.Highly durable anodes of microbial fuel cells using a reduced graphene oxide/carbon nanotube-coated scaffold[J]. Bioresource technology, 169:532-536 |
| [9] | Das S, Singh S, Singh V, et al.2013. Oxygenated functional group density on graphene oxide:its effect on cell toxicity[J]. Particle and Particle Systems Characterization, 30:148-157 |
| [10] | Fan M, Zhu C, Feng Z, et al.2014. Preparation of N-doped graphene by reduction of graphene oxide with mixed microbial system and its haemocompatibility[J]. Nanoscale, 6:4882-4888 |
| [11] | Feng C H, Ma L, Li F B, et al.2010.A polypyrrole/anthraquinone-2,6-disulphonic disodiμm salt (PPy/AQDS)-modified anode to improve performance of microbial fuel cells[J].Biosensors & Bioelectronics, 25(6):1516-1520 |
| [12] | Feng L, Chen Y, Chen L. 2011.Easy-to-Operate and Low-Temperature Synthesis of Gram-Scale Nitrogen-Doped Graphene and Its Application as Cathode[J]. Acs Nano, 5:9611-9618 |
| [13] | Filip J, Tkac J.2014. Is graphene worth using in biofuel cells?[J]. Electrochemical Acta, 136:340-354 |
| [14] | Gnana kμmar G, Joseph Kirubaharan C, Udhayakμmar S, et al.2014.Synthesis, Structural, and Morphological Characterizations of Reduced Graphene Oxide-Supported Polypyrrole Anode Catalysts for Improved Microbial Fuel Cell Performances[J]. ACS Sustainable Chemistry and Engineering, 2:2283-2290 |
| [15] | Gong K, Du F, Xia Z, et al.2009.Nitrogen-Doped Carbon Nanotube Arrays with HighElectrocatalytic Activity for Oxygen Reduction[J]. Science, 323(5915):760-764 |
| [16] | Guo W, Cui Y, Song H, et al.2014.Layer-by-layer construction of graphene-based microbial fuel cell for improved power generation and methyl orange removal[J]. Bioprocess and biosystems engineering, 37:1749-1758 |
| [17] | Gurunathan S, Han J W, Dayem A A, et al.2012.Oxidative stress-mediated antibacterial activity of graphene oxide and reduced graphene oxide in Pseudomonas aerμginosa[J]. International journal of nanomedicine, 7:5901-5914 |
| [18] | Holzinger M, Goff A L, Cosnier S. 2012. Carbon nanotube/enzyme biofuel cells[J]. Electrochimica Acta, 82:179-190 |
| [19] | Hou J, Liu Z. Zhang P.2013. A new method for fabrication of graphene/polyaniline nanocomplex modified microbial fuel cell anodes[J]. Journal of Power Sources, 224:139-144 |
| [20] | Hu W, Peng C, Luo W, et al.2010.Graphene-based antibacterial paper[J]. Acs Nano, 4:4317-4323 |
| [21] | Huang Y X, Liu X W, Xie J F, et al.2011.Graphene oxide nanoribbons greatly enhance extracellular electron transfer in bio-electrochemical systems[J]. Chemical communications, 47:5795-5797 |
| [22] | Jastrzebska A M, Kurtycz P, Olszyna A R. 2012.Recent advances in graphene family materials toxicity investigations[J]. Journal of nanoparticle research:an interdisciplinary forμm for nanoscale science and technology, 14:1320-1340 |
| [23] | Khilari S, Pandit S, Ghangrekar M M, et al.2013.Graphene supported α-MnO2 nanotubes as a cathode catalyst for improved power generation and wastewater treatment in single-chambered microbial fuel cells[J]. Rsc Advances, 3:7902-7911 |
| [24] | Kim J R, Min B, Logan B. 2005.Evaluation of procedures to acclimate a microbial fuel cell for electricity production[J]. Applied Microbiology and Biotechnology, 68(1):23-30 |
| [25] | Krishnamoorthy K, Veerapandian M, Zhang L, et al.2012.Antibacterial efficiency of graphene nanosheets against pathogenic bacteria via lipid peroxidation[J].the Jounal of Physical Chemistry, 116:17280-17287 |
| [26] | Lanone S, Andujar P, Kermanizadah A, et al.2013.Determinants of carbon nanotube toxicity[J]., Advanced Drμg Delivery Reviews, 65(15):2063-2069 |
| [27] | Lewinski N, Colvin V. Drezek R. 2008.Cytotoxicity of nanoparticles[J]. Small, 4:26-49 |
| [28] | Li, S, Hu Y, Xu Q, et al.2012.Iron-and nitrogen-functionalized graphene as a non-precious metal catalyst for enhanced oxygen reduction in an air-cathode microbial fuel cell[J]. Journal of Power Sources, 213:265-269 |
| [29] | Li X, Cai W, An J, et al.2009.Large-Area Synthesis of High-Quality and Uniform Graphene Films on Copper Foils[J]. Science, 324(5932):1312-1314 |
| [30] | Li Z, Yong Y, Guiqin Y, et al.2012.In situ formation of graphene/biofilm composites for enhanced oxygen reduction inbiocathode microbial fuel cells[J]. Electrochemistry Communications, 21:69-72 |
| [31] | Liu D, Wang L, Wang Z, et al.2012.Different cellular response mechanisms contribute to the length-dependent cytotoxicity of multi-walled carbon nanotubes[J]. Nanoscale Research Letters, 7:361 |
| [32] | Liu J, Qiao Y, Guo C X, et al.2012.Graphene/carbon cloth anode for high-performance mediatorless microbial fuel cells[J]. Bioresource technology, 114:275-280 |
| [33] | Liu S, Hu M, Zeng T H, et al.2012.Lateral dimension-dependent antibacterial activity of graphene oxide sheets[J]. Langmuir:the ACS journal of surfaces and colloids, 28:12364-12372 |
| [34] | Liu S, Zeng T, Hofmann M, et al.2011.Antibacterial activity of graphite, graphite oxide, graphene oxide, and reduced graphene oxide:membrane and oxidative stress[J]. Acs Nano, 5:6971-6980 |
| [35] | Liu X W, Sun X F, Huang Y X, et al.2010.Nano-structured manganese oxide as a cathodic catalyst for enhanced oxygen reduction in a microbial fuel cell fed with a synthetic wastewater[J]. Water Research, 44(18):5298-5305 |
| [36] | Liu Y, Jin X, Dionysiou D D, et al.2015.Homogeneous deposition-assisted synthesis of iron-nitrogen composites on graphene as highly efficient non-precious metal electrocatalysts for microbial fuel cell power generation[J]. Journal of Power Sources, 278:773-781 |
| [37] | Liu Y, Liu H, Wang C, et al.2013.Sustainable energy recovery in wastewater treatment by microbial fuel cells:stable power generation with nitrogen-doped graphene cathode[J]. Environmental science and technology, 47:13889-13895 |
| [38] | Logan B E, Murano C, Scott K, et al.2005.Electricity generation from cysteine in a microbial fuel cell[J]. Water Research, 39(5):942-952 |
| [39] | Logan B E, Regan J M. 2006.Microbial Fuel Cells-Challenges and Applications[J]. Environmental science and technology, 40:5181-5196 |
| [40] | Lu C H, Yang H H, Zhu C L, et al.2009.A Graphene Platform for Sensing Biomolecules[J]. Angewandte Chemie International Edition, 48(26):4785-4787 |
| [41] | Lü Z, Chen Y, Wei H, et al.2013.One-step electrosynthesis of polypyrrole/graphene oxide composites for microbial fuel cell application[J].Electrochimica Acta, 111:366-373 |
| [42] | Mahmoud M, Gad-Allah T A, EI-Khatib K M, et al.2011.Power generation using spinel manganese-cobalt oxide as a cathode catalyst for microbial fuel cell applications[J]. Bioresource Technology, 102(22):10459-10464 |
| [43] | Maldonado S, Stevenson K J. 2005.Influence of Nitrogen Doping on Oxygen Reduction Electrocatalysis at Carbon Nanofiber Electrodes[J]. The Journal of Physical Chemistry B, 109(10):4707-4716 |
| [44] | Mehdinia A, Ziaei E. Jabbari A. 2014.Facile microwave-assisted synthesized reduced graphene oxide/tin oxide nanocomposite and using as anode material of microbial fuel cell to improve power generation[J]. International Journal of Hydrogen Energy, 39:10724-10730 |
| [45] | Novoselov K S, Geim A K, Morozov S V, et al.2004.Electric Field Effect in Atomically Thin Carbon Films[J]. Science, 306(5696):666-669 |
| [46] | Pei S, Cheng H. 2012.The reduction of graphene oxide[J]. Carbon, 50:3210-3228 |
| [47] | Qiao Y, Li C M, Bao S J, et al.2007.Carbon nanotube/polyaniline composite as anode material for microbial fuel cells[J]. Journal of Power Sources, 170(1):79-84 |
| [48] | Rabaey K, Ossieur W, Verhaege M, et al.2005.Continuous microbial fuel cells convertcarbohydrates to electricity[J]. Water Science and Technology, 52(1-2):515-523 |
| [49] | Ren, Y, Pan D, Li X, et al.2013.Effect of polyaniline-graphene nanosheets modified cathode on the performance of sediment microbial fuel cell[J]. Journal of Chemical Technology and Biotechnology, 88:1946-1950 |
| [50] | Sharma T, Reddy A L M, Chandra T S, et al.2008.Development of carbon nanotubes and nanofluids based microbial fuel cell[J]. International Journal of Hydrogen Energy, 33(22):6749-6754 |
| [51] | Sun Y, Zhang W, Chi H, et al.2015.Recent development of graphene materials applied in polymer solar cell[J]. Renewable and Sustainable Energy Reviews, 43:973-980 |
| [52] | Tu Y, Lü M, Xiu P, et al.2013.Destructive extraction of phospholipids from Escherichia coli membranes by graphene nanosheets[J]. Nature nanotechnology, 8:594-601 |
| [53] | Vecitis C D, Zodrow K R, Kang S, et al.2010.Menachem elimelech electronic-structure-dependent bacterial cytotoxicity of single-walled carbon nanotubes[J]. Acs Nano, 4:5471-5479 |
| [54] | Wang, H, Wang G, Ling Y, et al.2013.High power density microbial fuel cell with flexible 3D graphene-nickel foam as anode[J]. Nanoscale, 5:10283-10290 |
| [55] | Wang P, Wang Z, Jia L, et al.2009.Origin of the catalytic activity of graphite nitride for the electrochemical reduction of oxygen:geometric factors vs. electronic factors[J]. Physical Chemistry Chemical Physics, 11(15):2730-2740 |
| [56] | Wei J, Liang P, Huang X. 2011.Recent progress in electrodes for microbial fuel cells[J]. Bioresource technology, 102:9335-9344 |
| [57] | Wen Q, Wang S, Yan J, et al.2012.MnO2-graphene hybrid as an alternative cathodic catalyst to platinμmin microbial fuel cells[J]. Journal of Power Sources, 216:187-191 |
| [58] | Xie X, Yu G Y, Bao Z, et al.2012.Graphene-sponges as high-performance low-cost anodes for microbial fuel cells[J]. Energy and Environmental Science, 5:6862-6866 |
| [59] | Yan Z, Wang M, Huang B, et al.2013.Graphene supported Pt-Co alloy nanoparticles as cathode catalyst for microbial fuel cells[J]. International Journal of Electrochemical Science, 8:149-158 |
| [60] | Yonand D L, Lvarez P J. 2008.A. Fullerene Water Suspension (nC60) Exerts Antibacterial Effects via ROS-Independent Protein Oxidation[J]. Environmental Science and Technology, 42:8127-8132 |
| [61] | Yong Y C, Dong X C, Chan-Park M B, et al.2012. Macroporous and monolithic anode based on polyaniline hybridized three-dimensional graphene for high-performance microbial fuel cells[J]. Acs Nano, 6:2394-2400 |
| [62] | Zhang P, Li K, Liu X. 2014.Carnation-like MnO2 modified activated carbon air cathode improve power generation in microbial fuel cells[J]. Journal of Power Sources, 264(15):248-253 |
| [63] | Zhang X, Hu W, Li J, et al.2012.A comparative study of cellular uptake and cytotoxicity of multi-walled carbon nanotubes, graphene oxide, and nanodiamond[J]. Toxicology Research, 1:62-68 |
| [64] | Zhang Y, Ali S F, Dervishi E, et al.2010.Cytotoxicity effects of graphene and single-wall carbon nanotubes in neural phaeochromocytoma-derived PC12 cells[J]. Acs Nano, 4(6):3181-3186 |
| [65] | Zhang Y, Mo G, Li X, et al.2011.A graphene modified anode to improve the performance of microbial fuel cells[J]. Journal of Power Sources, 196:5402-5407 |
| [66] | Zhang Y, Mo, G, Li X, et al.2012.Iron tetrasulfophthalocyanine functionalized graphene as a platinμm-free cathodic catalyst for efficient oxygen reduction in microbial fuel cells[J]. Journal of Power Sources, 197:93-96 |
| [67] | Zhao C, Wang Y, Shi F, et al.2013. High biocurrent generation in Shewanella-inoculated microbial fuel cells using ionic liquid functionalized graphene nanosheets as an anode[J]. Chemical communications, 49:6668-6670 |
| [68] | Zhuang L, Yuan Y, Yang G, et al.2012.In situ formation of graphene/biofilm composites for enhanced oxygen reduction in biocathode microbial fuel cells[J]. Electrochemistry Communications, 21:69-72 |
 2016, Vol. 36
2016, Vol. 36


