2. 中国人民大学环境学院, 北京 100872;
3. 北京大学城市与环境学院, 地表过程分析与模拟教育部重点实验室, 北京 100871;
4. University of Wisconsin-Madison, Environmental Chemistry and Technology Program, Madison, WI, USA, 53706
2. School of Environment and Natural Resources, Renmin University of China, Beijing 100872;
3. College of Urban and Environmental Sciences, Peking University, Beijing 100871;
4. University of Wisconsin-Madison, Environmental Chemistry and Technology Program, Madison, WI, USA, 53706
由于特殊的物理化学性质,汞是唯一主要以气相形式存在于大气中的重金属,并能通过大气环流而成为跨区域传输的全球性污染物.环境中汞的来源广泛,总体可以分为自然来源和人为来源.在工业革命之前,环境中的汞主要来源于自然环境过程,包括地表释放、自然水体向大气释放、火山、地震和地热活动等.从工业革命后期以来,环境中的汞逐渐开始以人类活动向环境中排放为主导,包括化石燃料燃烧、氯碱工业生产、金属冶炼等(蒋靖坤等,2005; 王少峰等,2006; Zhang et al,2015; Wu et al,2015).在1995—2000年期间,仅因矿物燃料燃烧,全球向大气环境中排放的汞量就高达2180 t(冯新斌等,2009; Zhang et al.,2012).我国是全球向大气直接排放汞最多的国家,约占全球总排放量的1/3,每年大气汞排放量约为500~700 t,并呈现一定的增长趋势(Streets et al,2005; 王书肖等,2006; Huang et al.,2011; Zhang et al,2015).由于人为活动导致汞大量排放,大气环境中汞浓度相比工业革命之前有了显著增加(Lamborg et al,2002).
作为环境中汞传输的最主要通道,大气在汞全球生物地球化学循环中起着极其重要的作用.大气中汞的存在形式主要有元素形态汞(GEM,占大气气态总汞90%以上),活性气态汞(RGM,如HgCl2、HgBr2、HgO等)和颗粒态汞(PHg).元素汞具有最强的远距离迁移能力,可以随着大气环流迁移至距污染排放源上千公里的地方,这也成为汞被认为是全球性污染物的最主要原因(Gustin and Jaffe,2010).人为活动导致的活性气态汞和颗粒态汞直接排放较少,但由于其具有更高的干沉降、湿沉降速率和化学反应活性(Lindberg and Stratton,1998; Xu et al,2000; Poissant et al,2005),因而更容易从大气转移到地表.元素汞干沉降速率为0.01~0.19 cm·s-1(Xu et al.,2000; Poissant et al,2005),而颗粒态汞和活性气态汞沉降速率则可达到0.1~2.1和0.4~7.6 cm·s-1(Lindberg and Stratton,1998; Xu et al,2000; Poissant et al,2005).进入到地表环境中的无机汞在微生物作用下可以转化为毒性更加强烈的甲基汞,通过水生食物链或是农作物生物富集,最终给食用人群带来严重的健康风险.
汞在大气环境传递过程中会经历复杂的均相和非均相化学反应,由此导致元素汞、活性气态汞和颗粒态汞的形态相互转化成为影响大气汞远距离传输尺度和沉降进入地表的关键过程,也成为了大气汞模拟传输不确定性的重要来源(Lindberg et al,2007; 万奇等,2008; Wang et al,2014; Ariya et al.,2009;2015).大气汞均相、非均相反应过程相关研究在国外部分科研机构已逐步开展,并取得了一定的进展,但在我国开展的相关研究仍相对较少.总体而言,现有研究对于大气汞相互转化过程仍然缺乏系统性的机理认识(Bidleman et al,2003; Weiss-Penzias et al,2009; Gustin and Jaffe,2010).活性气态汞和颗粒态汞的光致还原反应被认为是大气汞迁移过程中的重要化学过程,但目前对于这些过程的具体反应机制还缺乏深入研究(Ariya et al.,2009,2015; Gustin and Jaffe,2010).结合大气汞化学反应过程的研究现状,本文主要从大气汞在不同相界面之间分配过程和影响因素、大气汞均相和非均相主要氧化反应和还原反应等几个方面进行重点梳理和展望.
2 大气汞在不同相界面的分配过程(Partitioning of mercury between different interfaces)在大气气相、液相或非均相体系中,汞及其化合物均可发生一系列氧化还原反应(图 1,Ariya et al,2015).大气中汞的化学反应过程并不局限于纯气相或纯液相,比如在大气汞在对流层与NOx发生的非均相反应被认为在全球大气汞循环中起重要作用(Zondlo et al.,2000).对于非均相反应来说,第一步就是大气汞在不同相界面之间进行再分配(包括气-固分配、气-液分配等).大气环境中悬浮固体、液滴等具有较高的比表面积,从而为气相中原子或分子吸附、碰撞或发生界面反应提供了场所;同时气溶胶化学组分复杂,包括不同类型有机质和阴、阳离子,这也可以对大气汞在不同界面分配过程产生一定的影响.
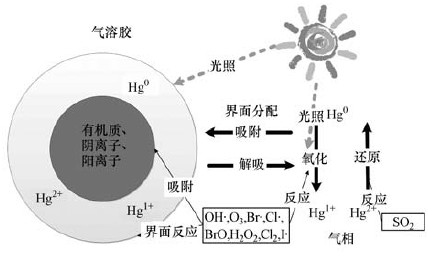 |
| 图 1 大气汞主要化学反应过程 Fig. 1 Physicochemical transformation of mercury in the atmosphere |
大气中不同介质对气相中汞的吸附主要分为物理吸附和化学吸附.物理吸附是大气中化学物质最常见的吸附类型.物理吸附相对较弱,主要通过范德瓦耳斯力完成,而化学吸附则需要通过新化学键形成来实现(Adamson and Gast,1967).亨利系数常数KH被用来描述化学物质在液相向气相或是气相向液相中的分配,但只适用于纯的二相体系中.在真实的大气环境中,有较多的水滴、成分复杂的气溶胶颗粒物,因此通过亨利系数来计算颗粒物对气相中汞的吸附并不可行(Finlayson-Pitts and Pitts,1986).物理吸附过程实验测定可以通过吸附等温线和吸附自由能来进行计算(Ariya et al,2015).大气液相环境中(如降水、雾滴等)不同化学物质对Hg2+的吸附过程也已有文献报道,主要是基于现场监测数据,但在这些研究中,大气环境的物理化学性质差异显著(如粒径分布、表面电荷、化学物质构成等),导致不同研究之间得到的吸附常数相差较大,因而不能得出明确的结论(Lin et al,2006).
2.2 界面吸附影响因素大气汞的界面吸附影响因素总体可以分为3类:相界面物理性质、相界面化学物质构成和外部环境条件.相界面的物理性质影响主要通过颗粒物或气溶胶的比表面积来体现.一般来说,大气颗粒物体积越小,比表面积越大,从而使得大部分气溶胶中的化学物质可以集中在颗粒物表面,影响界面吸附和非均相反应的发生.Finlayson-Pitts和Ariya等研究表明,对于一个直径为1 mm的球体颗粒来说,大概有1%质量的化学物质能够集中在球体表面;而当球体直径降低到3 nm时,所有物质分子均可集中到颗粒物表面(Finlayson-Pitts,2009; Ariya et al.,2015).
相界面的化学物质构成对汞吸附分配的影响更为复杂.大量直接或是间接证据表明,大气气溶胶表面化学性质会大大影响汞的界面吸附过程(Subir et al,2012).液相中盐类离子种类和浓度对于Hg0在气-液相之间分配过程的影响已有文献报道(Sanemasa et al,1981).当液相中有盐类存在时,Hg0的溶解性就会大大降低,从而更易于分配到气相环境中(图 2a).在海滨城市大气气溶胶中,Cl-的存在也会影响汞在颗粒物表面的吸附.Andersson等测定了纯水相和浓度为1.5 mol·L-1 NaCl溶液中Hg0的亨利系数常数.结果表明,在25 ℃下,Hg0在NaCl溶液中亨利系数常数要比纯水相中高1.2倍,也同样证明,当液相环境中含有较高的Cl-时,Hg0更倾向于分配到气相中(Andersson et al.,2008,图 2a).此外,温度对Hg0在液相中溶解性的影响也极为显著(图 2b).
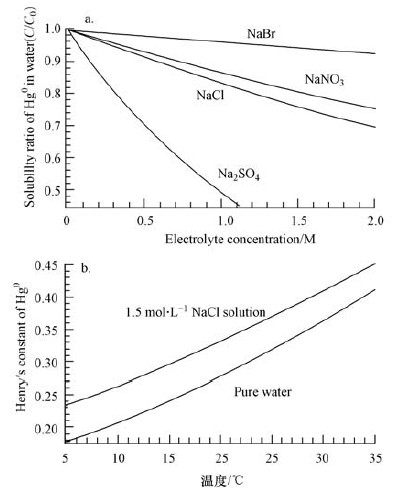 |
| 图 2 盐类类型(a)和环境温度(b)对Hg0在液相中溶解性的影响(Subir et al,2012) Fig. 2 Effect of salt types and concentrations on the solubility of elemental mercury (a) and the effect of temperature on Henry′s constant of Hg0 (b) |
考虑到Hg2+的可溶性,Hg2+在大气不同相界面之间的分配过程并不跟Hg0一致.在干燥气溶胶中,Hg2+在气相和颗粒物之间的吸附分配系数取决于颗粒物化学构成.颗粒物中的阴离子也会对Hg2+的吸附分配产生重要影响.Rutter和Schauer(2007a)的研究结果表明,在以硝酸盐和氯化盐为主的颗粒物中,Hg2+具有更高的固-气分配系数(硝酸盐:100~1000 m3·μg-1;氯化盐:10~100 m3·μg-1;有机质/硫酸盐:~1 m3·μg-1),从而使得Hg2+更容易吸附在以此为主要成分的颗粒物表面,而在硫酸铵或是有机质为主的气溶胶的分配系数则比前者要低一个数量级以上,因此Hg2+则更易于逃逸到气相中.
Hg2+在大气中气-固相之间的分配过程也极容易受到外界环境因素的影响.现有研究结果表明,随着环境温度的升高,颗粒物中Hg2+更容易逃逸到气相环境中,这一点也已经被现场监测和室内模拟实验所验证(Rutter and Schauer,2007b).研究人员根据Hg2+解吸焓认为,对于大气颗粒物来说,Hg2+可能更易受到较弱的化学吸附,而不是物理吸附,然而也可能存在一些例外,比如Hg2+与NaCl之间的化学吸附就比较强烈(Malcolm and Keeler,2007).现有研究对环境中相对湿度、光照等其他环境条件对Hg2+在气-固相之间分配过程的具体作用并不明确.
3 大气Hg0氧化反应(Atmospheric Hg0 oxidation reactions)关于大气汞形态转化过程中所存在的非均相化学反应研究工作受关注较晚,尤其是大气颗粒汞和活性气态汞的相关研究开始只有约20年的时间,大气汞耗散事件(Atmospheric Mercury Depletion Events,AMDEs)是全面认识大气汞氧化反应过程的开始,在大气汞化学反应研究中具有里程碑的意义.考虑到元素汞的化学性质,之前的研究普遍认为全球的大气汞浓度相对较为稳定,不易发生剧烈的形态转化.1998年,Schroeder等在Nature杂志报道了北极地区春季大气元素汞浓度突然降低(AMDEs)(Schroeder et al,1998).在每年春季的时候,大气中元素汞跟颗粒态汞、活性气态汞之间存在着快速的形态转化,大量的元素形态汞在较短时间内被氧化为活性气态汞,一部分活性气态汞被颗粒物吸附成为颗粒态汞,但Schroeder等仅报道了其监测结果,对其发生的化学机理并不明确(Schroeder et al,1998; Steffen et al,2014).正是因为对AMDEs的深入研究,才推动了大气汞氧化还原反应过程的相关研究和科学认识.
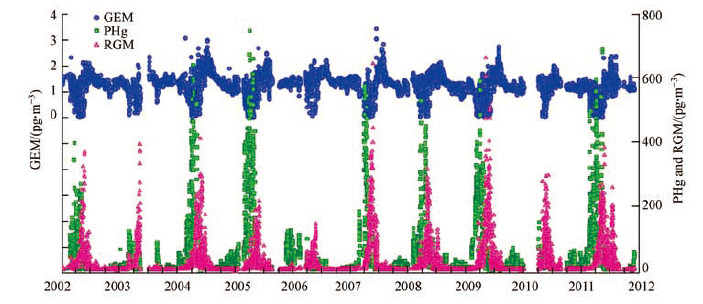 |
| 图 3 加拿大Alert观测站GEM、PHg和RGM的日变化情况(2002—2011年) Fig. 3 Daily average GEM, PHg, and RGM concentrations at Alert (Canada) from 2002 to 2011 |
Hg0与OH·、O3之间的氧化反应过程一直被认为是大气中影响汞环境归趋行为的重要过程(Subir et al,2011; Hynes et al,2009),并在大气汞传输模拟中有着广泛的应用.Schroeder等(1998)最初发现大气汞亏损的同时发现其与臭氧亏损显著相关,因而推断O3在元素汞氧化中具有显著的作用.现有研究对于Hg0与OH·自由基和O3之间的氧化反应主要是基于卡尔弗特和林德伯格的理论依据(Calvert and Lindberg,2005),但对此研究人员也存在较大的争议,因为这些研究主要是依靠室内模拟实验完成,而缺乏在实际环境中验证,存在极大不确定性(Ariya et al,2015).大气中Hg0与OH·和O3之间氧化反应主要遵循以下反应过程,表 1给出了Hg0和O3、OH·的氧化反应速率及在北极洁净地区的半衰期.
| 表 1 大气中主要氧化剂对Hg0氧化反应速率和在北极地区半衰期估计 Table 3 The main oxidation reaction rates of Hg0 and half-life in the Arctic |
Hg0(g)+O3(g)HgO+O2(g)
Hg0(aq)+O3(g)Hg2+(a)+O2+ OH·
Hg0(aq)+ OH·(aq)Hg+(aq)+ OH-
Hg+(aq)+ OH·(aq)Hg2+(aq)+ OH-
Hall对元素汞和O3氧化反应速率进行了测定,并推算出元素汞在大气中的滞留时间可长达两年(Hall,1995),需要指出的是,鉴于实验条件限制,当时的研究关注于单一化学氧化剂在高浓度情况下对于元素汞氧化反应的影响,难以代表自然环境中的真实状况.在该反应机理实际应用过程中,Seingeur等(2006)发现使用不同研究人员的动力学数据,会对模拟结果产生较大影响.如果使用Pal和Ariya(2004)的室内实验动力学数据,大气中元素汞的模拟存在半衰期仅仅为11 d,远远高于现有的估算,因此现有的大气汞传输模拟仍主要采用Hall的氧化反应速率实验结果.
现实生活中大气化学成分远远比实验室模拟的环境更为复杂,而这些污染大气中Hg0与OH·、O3之间的氧化反应速率与室内实验结果较为一致.Calvert和Lindber(2005)解释认为,在实验室模拟中,可能存在如NO2和过氧自由基之类的二次反应物,这些反应物有助于Hg0的氧化反应.也有研究观点认为,环境中大量的气溶胶有助于加速Hg0和O3、OH·之间的化学反应(Subir et al,2012),这些表面氧化反应过程也有一定的理论依据(Snider et al,2008; Rutter et al,2012).在2000年6月进行的一项探空实验中,研究人员注意到在地面垂直高度3 km左右大气中会出现Hg2+浓度的显著增加,最高可达260 pg·m-3(Sillman et al,2007).在美国南部田纳西州,新近开展的一项研究详细分析了垂直高度0~6 km范围内大气中Hg2+和颗粒汞浓度,监测结果也表明,在大气垂直高度2~4 km之间,每年的夏天都会出现Hg2+浓度的增加,对此,研究人员认为是OH·在其中的氧化反应导致(Brooks et al,2014).
3.2 卤族元素对Hg0的氧化作用卤族元素在紫外光照下产生的自由基都具有较强的氧化性,并体现为类似的氧化性质.与OH·和O3相比,卤族元素对大气Hg0的氧化效果更为显著(表 1).Br·自由基在元素汞氧化作用主要从AMDEs事件开始.2002年,Lindberg等根据UVB(即波长320~400 nm之间的光)、BrO·和元素汞、活性气态汞浓度之间的相关关系,认为在极地光照中UVB的诱导下,活性卤素参与下的Hg0快速氧化是元素汞突然“消失”的重要原因(Lindberg et al,2002).以上监测结果使得研究人员意识到,考虑到有卤族元素参与,大气中Hg0的滞留时间可能远远比之前研究人员所估计的要短.尽管如此,研究人员对Br·在海洋边界层和自由大气中所起的氧化作用仍然存在一定的疑惑,因为Br·和Hg0之间的氧化反应机制仍然存在较大不确定性(Seigneur and Lohman,2008; Holmes et al,2010; Saiz-Lopez and von Glasow,2012).现有的大部分的实验研究中,只是提供一个Br·和Hg0的总反应速率常数,但对于具体每一步的氧化反应速率参数并不清楚.在现有的大气汞传输模拟模型中,Br·和Hg0之间的氧化反应过程被越来越多的用于大气汞的远距离传输模拟中,主要因为Br·和Hg0之间反应过程的加入可以使得模拟结果与现有的全球大气汞监测网络结果更为一致,尽管对具体的反应过程现有认识仍然不足.Lindberg等(2002)研究人员认为,除了Br·之外,Cl·也具有类似的化学性质,通过与臭氧的光反应生成ClO等,从而引发链式反应(Rossi,2003),进而与气态单质汞氧化生成Hg2Cl2、HgCl2等活性气态汞.也有实验表明,I·也具有一定的氧化能力(Calvert and Lindberg,2004a; 2004b).
4 大气活性汞还原反应(Reduction of reactive mercury in the atmosphere)大气中活性汞(气态汞和颗粒态汞)还原反应是大气汞形态转化和传输迁移过程中的重要组成部分,活性汞的还原反应的重要性已经被越来越多的科研人员意识到,但对其反应过程、反应速率及在大气汞传输模型中的应用尚存在较大局限(Lin et al,2006; Subir et al,2011,2012; Ariya et al,2015).颗粒态汞和活性气态汞在大气中浓度较低,容易沉降,具有较高的反应活性,其含量受环境条件、汞释放源等因素影响尤为强烈,浓度水平会因为环境的氧化还原条件而出现较大波动(冯新斌等,2009).大气中活性气态汞和颗粒态汞的还原反应意味着实际环境中可能有更多的Hg0释放,并参与远距离迁移,从而不利于汞污染的治理.
4.1 大气液相中汞还原反应考虑到活性气态汞具有较高的可溶性,在以往研究中,其还原过程通常被认为仅是在液相中发生的,比如湖泊、海洋和大气液相环境中.据估计,全球有39%的大气汞排放来自于海洋表层水体Hg2+还原产生的Hg0(Ravichandran Fitzgerald,2004; Steffen et al,2014).在液相中,Hg2+还原反应取决于其在水体中的配合物形态,并易受到光照和水体中有机质的影响,通过配体到金属之间的电子迁移来完成还原反应(Ligand to Metal Charge Transfer,LMCT)(Griffiths and Anderson,1991).在现有大多数的大气传输模型中,大气汞的还原反应被认为仅能够在液相和颗粒态汞发生,并被认为具有化学惰性,不影响其他氧化还原反应过程(Seigneur et al.,2006).气溶胶中水的质量比重可以占30%~50%.云层、雾和雨滴都可以为汞的还原反应提供充足的液相环境场所.大气中大多数汞的化合物电子跃迁都发生在波长298 nm以下,这种波长在低层大气中并不常见.但如果含汞化合物被吸附到大气颗粒物的表面,那么光谱的跃迁就可能发生.另一个还原途径是,当环境介质存在溶解性有机质的时候,汞的还原反应更容易发生.有机质可以跟大气环境中的汞牢固结合,并能够加速Hg2+的还原反应.有研究报道,在微生物或有机质的参与下,液相中Hg2+还原反应速率都能被显著提高,且这一过程并不依赖于光照(Ravichandran,2004).液相中的Hg2+还原反应过程也受到液相中pH、溶解氧、Cl-等影响(Ravichandran,2004).
4.2 大气气相中汞还原反应尽管汞的还原反应以往都被认为是在液相中进行,而越来越多的研究证据表明,活性气态汞和颗粒态汞的还原反应也可能在气相中发生(Edgerton et al,2006).在气-固相之间的非均相还原反应过程中,HgO可以被SO2还原为Hg2SO4,并进一步转变为HgS和HgSO4(Subir et al,2012),飞灰颗粒物表面的亚硫酸盐也可以与颗粒态汞发生类似的非均相反应(Feinberg et al,2015).相比于元素汞氧化反应,活性气态汞和颗粒态汞的还原反应受关注时间更晚.最早研究报道见于2006年,Edgerton等观测火电厂周边大气中元素汞、活性气态汞和颗粒态汞浓度,发现元素汞在总汞中所占的比例约为84%,而根据火电厂燃煤中汞组成和EPRI-ICR汞形态模型分析结果,火电厂废气中元素汞比例应该约为42%,研究人员因此推断,周边大气中可能存在着活性气态汞的还原反应过程,正是由于Hg2+还原反应的存在导致当地环境大气中元素汞的比例比理论计算值要高(Edgerton et al,2006).在2010年,Carignan和Sonke(2010)在研究中指出,在AMDEs之后,可以观察到会有相当一部分被氧化的Hg2+和PHg会被重新还原为Hg0并释放到大气中.此后开展的研究开始关注Hg2+和PHg还原反应的发生机制,并逐步认识到光照除了在元素汞氧化中有作用之外,也可能在PHg和Hg2+还原反应中起作用.Zhao等在研究中指出,在水蒸气作用下,大气中NO和SO2可以促使Hg2+还原为Hg0(Zhao,2006).Si和Ariya(2008)研究了二羧酸对大气液相中离子汞的还原作用,研究指出离子汞的光致还原反应可以通过离子汞和二羧酸形成的螯合物诱导来实现,而氯离子可以通过与二羧酸竞争跟离子汞形成螯合物来阻碍还原反应的进行.
4.3 光致还原反应光照在汞的氧化反应中的作用已经被现有的研究重视,但在还原过程中的作用尚不明确.Hg2+光致化学反应是陆地系统中汞形态转化的重要过程,光提供了汞形态转化过程中电子迁移所需要的能量.在液相中,汞会跟一些无机物质(如HCO3-,Cl-等)或是有机配体结合在一起.光致化学反应过程可能涉及了这些配体化合物的直接光解,并通过配体和金属之间的电子迁移(LMCT)发生还原反应.在这一过程中,配体吸收了光子,并释放电子将Hg2+还原为Hg0.这一反应过程中会产生大量的反应中间体,并引发二次还原反应.产生的反应中间体可能会与Hg2+发生反应,并导致了Hg0的生成.干燥气溶胶中Hg2+的光致还原反应过程也已经有了一些直接的证据,尽管其中确切的反应机理并未明确.Tong等通过合成气溶胶的方式证实,除了液相环境中,干气溶胶中同样存在强烈的颗粒态汞光致还原反应,这一反应过程受到光照辐射强度、波长和气溶胶化学组成的影响,气溶胶中氧化性物质,如Fe3+,可以遏制反应的进行.然而该研究中,并没有明确的筛分颗粒物的粒径,导致气溶胶粒径在其中所起的作用并不明确(Tong et al,2013; 2014).发电厂飞灰中的Hg2+还原反应以往都是基于观测现象而推断的假设,但新近的研究已证实,发电厂飞灰中的Hg2+也存在着显著的光致还原反应过程.在模拟日光照射下,含碳较高的飞灰、低碳/低硫飞灰和高硫飞灰中的还原反应速率分别为12.2%·h-1±1.4%·h-1,18.8%·h-1±0.6%·h-1和12.3%·h-1±1.6%·h-1.实验过程中3种飞灰的其他变量并不一致,比如Fe、Al、pH等,因此很难得出飞灰含碳量或者含硫量在飞灰颗粒态汞的光致还原反应中的具体作用.该实验中也对飞灰水溶性物质的Hg2+还原反应速率进行了测定,发现水溶性物质中的Hg2+还原反应速率接近或者略高于所对应的飞灰.这一结果显示,飞灰中的可溶性物质有可能是由飞灰中的水溶性物质决定的(Tong et al,2013; 2014).每年全球发电厂家会排放大量的飞灰颗粒,考虑到飞灰的巨大排放量,飞灰中被还原释放的汞可能是大气中汞的重要来源,而这一过程中产生的光致还原反应可能会大大增加大气元素汞的排放.在现阶段的模型中,这一反应过程也没有得到体现.
5 结论与展望(Conclusions and prospect)大气中一些微量重金属元素的氧化还原反应已被证明存在(如Fe2+,Cu2+和Mn2+等),但需要注意的是,与这些金属元素相比,活性气态汞和颗粒态汞的化学反应过程可能会有显著差异,其原因是由于还原产物的化学惰性(主要为元素汞),Hg0更倾向于分配到气相中;还原反应的底物也应考虑气相中的活性气态汞,因其存在较强的挥发性,很容易在气相和颗粒相之间形成再分配(Rutter和Schauer,2007).现有的研究在大气中新型氧化剂在Hg0氧化过程中的作用已经做出了深入研究,比如Br·、OH·、Cl·等,尽管大部分的研究仍然建立在野外监测的基础之上;现阶段的研究也已经逐步意识到,活性气态汞的还原反应不仅局限于液相环境中,也可以发生在气相中;光照对于活性气态汞还原的作用也已被承认,还原性气体如SO2在活性气态汞还原过程中的作用也被重视.然而,总体来说,现有的研究对大气汞在气溶胶中所进行的化学反应的认识仍然是薄弱的,在大气汞反应理论基础、室内模拟与大尺度传输模拟整合和野外监测分析等诸多方面仍然需要加强.
1)室内反应过程模拟需反映真实大气环境特点,避免出现室内模拟结果和实际监测数据不一致的情况.室外大气环境成分复杂,且在不同气象条件下差异显著.现有的室内模拟并不能够完全反映真实环境状况,从而导致野外监测数据和室内测定结果存在极大的差异,进而影响了反应机理过程在数值模拟中的应用.根据实际环境特点,研究人员需尽可能真实的在室内模拟大气汞的实际反应过程,得到能够反映实际情况的科学数据.
2)利用新兴技术了解微观物理化学过程.在过去数十年的发展过程中,科学家已经能够在分子甚至原子水平上对物质表面的表面形态做出定性和定量的分析,但在大气汞研究的相关应用较少.研究人员可以考虑通过借助相关的分析手段(如各种新型电子显微镜),在微观水平上明确气溶胶表面化学与大气汞吸附分配的本质.汞同位素示踪以及同位素稀释技术的应用可更准确地反映大气汞的转化行为和来源,在大气汞的化学反应研究中发挥更加重要的作用.
3)大气汞微观机理研究和宏观数值模拟研究的联系需要进一步加强.大气汞微观机理研究是宏观数值模拟的基础,但由于研究人员的学科背景差异,现有的宏观数值模拟一般往往是从模拟结果的好坏判断模型中的化学反应过程,而模型涉及的反应过程较为简单,缺乏系统性整合.大气汞形态间转化规律认识不明、传输模型与大气汞化学转化过程没有融合被认为是造成模拟结果和观测结果不相符的重要原因,影响了科研人员对于大气汞环境行为的整体认识.
4)光照在大气汞形态转化中的具体作用需要进一步明确.光照是大自然化学污染物形态转化的原始驱动力,元素汞的氧化基本都是在光照诱导下发生的(Shia et al,1999; Selin et al,2007).现阶段的研究并没有完全明确光照波长、辐射强度和大气氧化还原性气体在元素汞氧化反应中的具体作用和在不同条件下的反应速率,并忽视了同时存在的光照在活性气态汞和颗粒态汞还原反应中的促进作用,间接导致了研究人员低估了大气元素汞的真实氧化反应速率.
| [1] | Adamson A W, Gast A P. 1967. Physical Chemistry of Surfaces 6th ed.[M]. New York:John Wiley & Sons |
| [2] | Andersson M, Sommar J, Gårdfeldt K, et al. 2008. Enhanced concentrations of dissolved gaseous mercury in the surface waters of the arctic ocean[J]. Mar Chem, 110:190-194 |
| [3] | Ariya P A, Peterson K, Snider G, et al. 2009. Mercury chemical transformations in the gas, aqueous and heterogeneous phases:state-of-the-art science and uncertainties, in Mercury Fate and Transport in the Global Atmosphere[M]. US:Springer, 459-501 |
| [4] | Ariya A, Amyot M, Dastoor A, et al. 2015. Mercury physicochemical and biogeochemical transformation in the atmosphere and at atmospheric interfaces:A review and future directions[J]. Chem Rev. 115(10):3760-3802 |
| [5] | Brooks S, Ren X, Cohen M, et al. 2014. Airborne vertical profiling of mercury speciation near tullahoma, TN, USA[J]. Atmosphere, 5:557-574 |
| [6] | Bidleman T, Macdonald R, Stow J. 2003. Sources, occurrence, trends and pathways in the physical environment[R]. Canadian Arctic contaminants assessment report Ⅱ, xxi-332 |
| [7] | Calvert J G, Lindberg S E. 2005. Mechanisms of mercury removal by O3 and OH in the Atmosphere[J]. Atmos Environ, 39:3355-3367 |
| [8] | Carignan J, Sonke J. 2010. The effect of atmospheric mercury depletion events on the net deposition flux around Hudson Bay, Canada[J]. Atmos Environ, 44(35):4372-4379 |
| [9] | Ebinghaus R, Kock H H, Temme C, et al. 2002. Antarctic springtime depletion of atmospheric mercury[J]. Environ Sci Technol, 36(6):1238-1244 |
| [10] | Edgerton E S, Hartsell B E, Jansen J J. 2006. Mercury speciation in coal-fired power plant plumes observed at three surface sites in the southeastern US[J]. Environ Sci Technol, 40(15):4563-4570 |
| [11] | 冯新斌, 仇广乐, 付学吾, 等. 2009. 环境汞污染[J]. 化学进展, 21(2/3):436-457 |
| [12] | Feinberg A, Kurien U, Ariya P A. 2015. The kinetics of aqueous mercury(Ⅱ) reduction by sulfite over an array of environmental conditions[J]. Water Air Soil Pollut, 226(4):1-12 |
| [13] | Finlayson-Pitts B J, Pitts J N Jr. 1986. Atmospheric Chemistry. Fundamentals and Experimental Techniques[M]. New Jersey:John Wiley & Sons |
| [14] | Finlayson-Pitts B J. 2009. Reactions at surfaces in the atmosphere:integration of experiments and theory as necessary (but Not Necessarily Sufficient) for Predicting the Physical Chemistry of Aerosols[J]. Phys Chem Chem Phys, 11:7760-7779 |
| [15] | Griffiths T R, Anderson R A. 1991. Electronic spectra of anionic mixed halide complexes in solution:identification, computation of spectra and stability constants and assignment of transitions of[HgX2Y]- and[HgX2Y2]2-[J]. Journal of the Chemical Society Faraday Transactions, 87:1697-1705 |
| [16] | Gustin M, Jaffe D. 2010. Reducing the uncertainty in measurement and understanding of mercury in the atmosphere[J]. Environ Sci Technol, 44:2222-2227 |
| [17] | Hall B. 1995. The gas phase oxidation of elemental mercury by ozone[J]. Water Air Soil Pollut, 80(1):301-315 |
| [18] | Holmes C D, Jacob D J, Corbitt E S, et al. 2010. Global atmospheric model for mercury including oxidation by bromine atoms[J]. Atmos Chem Phys, 10:12037-12057. |
| [19] | Huang X, Li M, Friedli H R, et al. 2011. Mercury emissions from biomass burning in China[J]. Environ Sci Technol, 45(21):9442-9448 |
| [20] | Hynes A J, Donohoue D L, Goodsite M E, et al. 2009. In mercury fate and transport in the global atmosphere[M]. New York:Springer |
| [21] | 蒋靖坤, 郝吉明, 吴烨, 等. 2005. 中国燃煤汞排放清单的初步建立[J]. 环境科学, 26(2):34-39 |
| [22] | Malcolm E G, Keeler G J. 2007. Evidence for a sampling artifact for particulate-phase mercury in the marine atmosphere[J]. Atmos Environ, 41:3352-3359 |
| [23] | Lamborg C H, Fitzgerald W F, O'Donnell J, et al. 2002. A non-steady-state compartmental model of global-scale mercury biogeochemistry with interhemispheric atmospheric gradients[J]. Geochimicaet Cosmochimica Acta, 66(7):1105-1118 |
| [24] | Lin C J, Pongprueksa P, Lindberg S E, et al. 2006. Scientific uncertainties in atmospheric mercury models I:Model science evaluation[J]. Atmos. Environ, 40:2911-2928 |
| [25] | Lindberg S E, Brooks S, Lin C J, et al. 2002. Dynamic oxidation of gaseous mercury in the arctic troposphere at polar sunrise[J]. Environ Sci Technol, 36(6):1245-1256 |
| [26] | Lindberg S, Bullock R, Ebinghaus R, et al. 2007. A Synthesis of progress and uncertainties in attributing the sources of mercury in depos[J]. AMBIO, 36(1):19-33 |
| [27] | Pal B, Ariya P A. 2004. Studies of ozone initiated reactions of gaseous mercury:Kinetics, product studies, and atmospheric implications[J]. Phys Chem Chem Phys, 6:572-579 |
| [28] | Ariya P A, Amyot M, Dastoor A, et al. 2015. Mercury physicochemical and biogeochemical transformation in the atmosphere and at atmospheric interfaces:A review and future directions[J]. Chem Rev. DOI:10.1021/cr500667 |
| [29] | Peleg M, Matveev V, Tas E, et al. 2007. Mercury depletion events in the troposphere in mid-latitudes at the dead sea, israel[J]. Environ Sci Technol, 41(21):7280-7285 |
| [30] | Poissant L, Pilote M, Beauvais C, et al. 2005. A year of continuous measurements of three atmospheric mercury species (GEM, RGM and Hgp) in southern Québec, Canada[J]. Atmos Environ, 39(7):1275-1287 |
| [31] | Ravichandran M. 2004. Interactions between mercury and dissolved organic matter-a review[J]. Chemosphere, 55:319-331 |
| [32] | Rutter A P, Schauer J J. 2007a. The impact of aerosol composition on the particle to gas partitioning of reactive mercury[J]. Environ Sci Technol, 41:3934-3939 |
| [33] | Rutter A P, Schauer J J. 2007b. The effect of temperature on the gas-particle partitioning of reactive mercury in atmospheric aerosols[J]. Atmos Environ, 41:8647-8657 |
| [34] | Rutter A, Shakya K, Lehr R, et al. 2012. Oxidation of gaseous elemental mercury in the presence of secondary organic aerosols[J]. Atmos Environ, 59:86-92. |
| [35] | Sanemasa I, Takagi E, Deguchi T, et al. 1981. Preconcentration of inorganic mercury with an anion-exchange resin and direct reduction-aeration measurements by cold-vapour atomic absorption spectrometry[J]. Anal Chim Acta, 130:149-156 |
| [36] | Saiz-Lopez A, von Glasow R. 2012. Reactive halogen chemistry in the troposphere[J]. ChemSoc Rev, 41:6448-6472 |
| [37] | Schroeder W H, Anlauf K G, Barrie L A, et al. 1998. Arctic springtime depletion of mercury[J]. Nature, 394(6691):331-332 |
| [38] | Seigneur C, Lohman K. 2008. Effect of bromine chemistry on the atmospheric mercury cycle[J]. J Geophys Res:Atmos, 113:D23309 |
| [39] | Seigneur C, Vijayaraghavan K, Lohman K. 2006. Atmospheric mercury chemistry:Sensitivity of global model simulations to chemical reactions[J]. J Geophys Res:Atmos, 111:D22306 |
| [40] | Selin N E, Jacob D J, Park R J, et al. 2007. Chemical cycling and deposition of atmospheric mercury:Global constraints from observations[J]. Journal of Geophysical Research. 2007, 112, D02308 |
| [41] | Shia R L, Seigneur C, Pai P et al. 1999. Global simulation of atmospheric mercury concentrations and deposition fluxes[J]. Journal of Geophysical Research:Atmospheres. 104(D19):23747-23760 |
| [42] | Snider G, Raofie F, Ariya P A. 2008. Effects of Relative Humidity and CO(g) on the O3-Initiated Oxidation Reaction of Hg0(G):Kinetic & Product Studies[J]. PhysChemChemPhys, 10:5616-5623 |
| [43] | Si L, Ariya P A. 2008. Reduction of oxidized mercury species by dicarboxylic acids (C2-C4):Kinetic and product studies[J]. Environ Sci Technol, 42(14):5150-5155 |
| [44] | Sillman S, Marsik F J, Al-Wali K I, et al. 2007. Reactive mercury in the troposphere:Model formation and results for florida, the Northeastern United States, and the Atlantic Ocean[J]. J Geophys Res:Atmos, 112:D23305 |
| [45] | Subir M, Ariya P A, Dastoor A P. 2011. A Review of uncertainties in atmospheric modeling of mercury chemistry I. Uncertainties in existing kinetic parameters-fundamental limitations and the importance of heterogeneous chemistry[J]. Atmos Environ, 45:5664-5676 |
| [46] | Subir M, Ariya P A, Dastoor A P. 2012. A review of the sources of uncertainties in atmospheric mercury modeling Ⅱ. Mercury surface and heterogeneous chemistry-a missing link[J]. Atmos Environ, 46:1-10 |
| [47] | Steffen A, Bottenheim J, Cole A, et al. 2014. Atmospheric mercury speciation and mercury in snow over time at alert, canada[J]. Atmos Chem, 14:2219-2231 |
| [48] | Steffen A, Lehnherr I, Cole A, et al. 2015. Atmospheric mercury in the canadian arctic. Part I:A review of recent field measurements[J]. Sci Total Environ, 509-510:3-15 |
| [49] | Streets D G, Hao J M, Wu Y, et al. 2005. Anthropogenic mercury emissions in China[J]. Atmos Environ, 39(40):7789-7806 |
| [50] | Tong Y D, Terry E, Michael R O, et al. 2014. Comparison of heterogeneous photolytic reduction of Hg(Ⅱ) in the coal fly ashes and synthetic aerosols[J]. Atmos Res, 138(1):324-329 |
| [51] | Tong Y D, Terry E, Michael R O, et al. 2013. Atmospheric photolytic reduction of Hg(Ⅱ) in dry aerosols[J]. Environ Sci Process Impacts, 15:1883-1888 |
| [52] | Vijayaraghavan K, Seigneur C, Karamchandani P, et al. 2007. Development and application of a multipollutant model for atmospheric mercury deposition[J]. J Appl Meteorol Clim, 46(9):1341-1353 |
| [53] | 王书肖, 刘敏, 蒋靖坤, 等. 2006. 中国非燃煤大气汞排放量估算[J]. 环境科学, 27(12):2401-2406 |
| [54] | 王起超, 沈文国, 麻壮伟. 1999. 中国燃煤汞排放量估算[J]. 中国环境科学, 19(4):318-321 |
| [55] | 王少峰, 冯新斌, 仇广乐, 等. 2006. 大气汞的自然来源研究进展[J]. 地球与环境, 34(2):1-11 |
| [56] | 万奇, 冯新斌, 郑伟, 等. 2008. 长白山地区大气气态总汞含量的季节性特征研究[J]. 环境科学, 29(2):296-299 |
| [57] | Wang F Y, Wang S X, Zhang L, et al. 2014. Mercury enrichment and its effects on atmospheric emissions in cement plants of China[J]. Atmos Environ, 92(0):421-428 |
| [58] | Weiss-Penzias P, Gustin M S, Lyman S N. 2009. Observations of speciated atmospheric mercury at three sites in Nevada:Evidence for a free tropospheric source of reactive gaseous mercury[J]. J Geophys Res, 114:D14302 |
| [59] | Wu Q, Wang S, Hui M, et al. 2015. New insight into atmospheric mercury emissions from zinc smelters using mass flow analysis[J]. Environ Sci Technol, 49:3532-3539 |
| [60] | Xu X H, Yang X S, Helble J J, et al. 2000. A regional scale modeling study of atmospheric transport and transformation of mercury. I. Model development and evaluation[J]. Atmos Environ, 34(28):4933-4944 |
| [61] | Zhang L, Wang S X, Meng Y, et al. 2012. Influence of mercury and chlorine content of coal on mercury emissions from coal-fired power plants in China[J]. Environ Sci Technol, 46(11):6385-6392 |
| [62] | Zhang L, Wang S, Wang L, et al. 2015. Updated emission inventories for speciated atmospheric mercury from anthropogenic sources in China[J]. Environ Sci Technol, 49:3185-3194 |
| [63] | Zhao Y X, Mann M D, Olson E S, et al. 2006. Effects of sulfur dioxide and nitric oxide on mercury oxidation and reduction under homogeneous conditions[J]. J Air Waste Manageasso, 56:628-635 |
| [64] | Zhang H. 2006. In recent developments in mercury science[M]. New York:Springer |
| [65] | Zondlo M A, Hudson P K, Prenni A J, et al. 2000. Chemistry and microphysics of polar stratospheric clouds and cirrus clouds[J]. Annu Rev PhysChem, 51:473-499 |
 2016, Vol. 36
2016, Vol. 36


