2. 哈尔滨工业大学 市政环境工程学院, 哈尔滨 150090
2. School of Municipal and Environmental Engineering,Harbin Institute of Technology,Harbin 150090
在厌氧生物制氢系统中,乙醇型发酵和丁酸型发酵是两种典型的产氢发酵类型(Lee and Rittmann, 2009; Ren et al., 2007a; Ren et al., 2006; 昌盛,2012),而不同的发酵类型能够产生不同的代谢产物,其氢气产率也存在着差异(Ren et al., 2007a),连续流厌氧发酵生物制氢的研究中,绝大部分的国外研究者基本将反应器的发酵类型控制在丁酸型发酵上(昌盛,2012; Li et al., 2007; Ramachandran et al., 2008; Pan et al., 2008; Wu et al., 2008),并获得了较高的产氢效能(Pan et al., 2008; Wu et al).而乙醇型发酵产氢类型自1995年被发现以来,只有少数几个研究团队进行了研究和报道(Ren et al., 2007; Ren et al., 2007; Li et al., 2007; Xing et al., 2006; Guo et al., 2008),同时,任南琪(Ren et al., 2007a; Ren et al., 2007b),李建政(Li et al., 2007; Li et al., 2009)和邢德峰(Xing et al., 2006)等的研究结果均显示,乙醇型发酵比丁酸型发酵获得的产氢效率高,乙醇型发酵是厌氧生物制氢反应器的最佳适宜控制类型(Li et al., 2007; Xing et al., 2006; Guo et al., 2008).然而,值得注意的是,他们的研究均仅比较了反应器在单一有机负荷条件下乙醇型发酵和丁酸型发酵的产氢能力(Ren et al., 2007a; Ren et al., 2007b; Li et al., 2009).而对于不同的厌氧产酸发酵产氢微生物而言,其生长代谢能力在不同的有机负荷条件存在差异(Show et al., 2011; Ren et al., 2010; Van and LoganBruce,2005),厌氧制氢系统内的微生物菌群会随着有机负荷的改变发生演替,形成不同的顶级微生物群落结构,进而表现出不同的产氢效能(Zhang et al., 2006).所以,当乙醇型发酵反应器在某一有机负荷下具有最佳的产氢效能时,丁酸型发酵未必也能同时在该有机负荷下表现出较好的产氢性能.因此,有必要研究在不同有机负荷条件下乙醇型发酵和丁酸型发酵产氢性能,以对乙醇型、丁酸型发酵产氢能力进行系统的对比分析,以探索不同发酵类型呈现最佳产氢性能时的适宜控制参数.
HRT不仅能影响反应器的水力流态和传质效率,还能影响系统内活性污泥的活性,所以,HRT作为有机负荷的重要调控手段,对厌氧反应器的控制至关重要(Wang and Wan, 2009).HRT的缩短不仅会将代时较长的发酵产酸或产氢微生物从系统中淘汰出去(Shen et al., 2009),而影响系统运行性能,同时还会对系统造成负荷冲击,甚至引起系统内厌氧活性污泥流失,导致厌氧系统崩溃(Wu et al., 2008; Li et al., 2010).为此,本文以连续流厌氧生物制氢反应器的运行为基础,系统比较了ACR丁酸型和乙醇型发酵制氢系统在不同HRT条件下的运行特性,以为制氢反应器运行控制提供技术参数.
2 材料和方法(Materials and methods) 2.1 实验装置研究采用的ACR参照发明专利“厌氧接触式产酸发酵制氢反应器”(ZL 200710144460.1)设计(李建政和昌盛,2008),制氢反应器的有效反应容积为10.8 L(图 1).由有机玻璃制成,采用电热丝缠绕在反应器外壁上的方式加热保温,并通过温控仪将反应系统的温度控制在(35±1)℃.
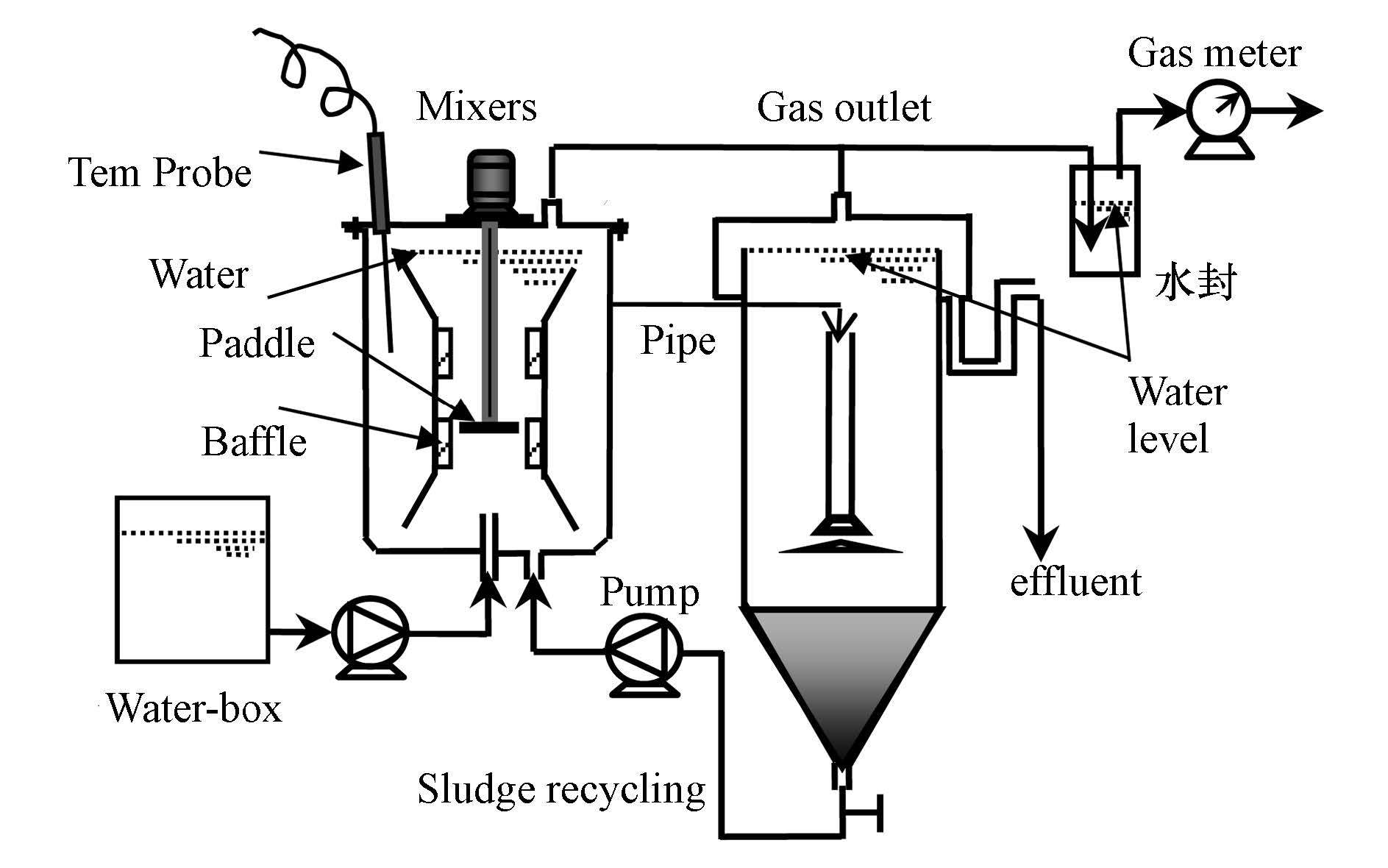 |
| 图1 ACR发酵制氢反应器示意图 Fig.1 Schematic diagram of ACR |
实验废水采用甜菜制糖厂的废糖蜜加水稀释而成.在配制废水时,投加一定量的农用复合肥,使废水中的 C、N、P 的质量比保持在(200~500)∶ 5 ∶ 1左右,以保证污泥在生长过程中对 N、P 营养元素的需求.糖蜜、复合肥的组分以及具体的投加比例与前期研究相同(昌盛,2012).
2.3 反应系统的运行控制接种污泥取自城市污水厂的剩余污泥,经淘洗、过滤后分别接种于两套相同的ACR系统中,污泥接种量均为3.58 g MLVSS · L-1.两套反应器除了系统控制的pH条件存在差异外,其它运行条件完全相同.反应器在进水COD 5000 mg · L-1,HRT为12 h下启动,通过向进水中添加小苏打的方式分别将两套制氢系统的pH控制在4.5~5.0、5.5~6.0间,经过运行并达稳定后,再分阶段将HRT由12 h逐步缩短到8 h、6 h、4 h,以考察HRT对ACR发酵产氢系统的影响.在每次调节系统HRT前,系统均稳定运行10 d左右.
2.4 分析项目与方法pH、碱度(alkalinity)、COD和生物量(MLSS和MLVSS)等常规监测项目采用国家标准方法测定(American Public Health Association,1998).配置的糖蜜废水和反应器出水中的含糖量采用苯酚-硫酸法测定(昌盛,2012 ).包括乙酸、丙酸、丁酸在内的挥发性有机酸(VFAs)以及乙醇的检测采用气相色谱仪(SP-6890,山东鲁南瑞虹化工仪器有限公司)测定(昌盛等,2015),发酵气组分采用另一台气相色谱仪(SP-6801T,山东鲁南瑞虹化工仪器有限公司)分析(昌盛等,2015).
3 实验结果与讨论(Results and analysis) 3.1 HRT对乙醇型发酵制氢系统的影响 3.1.1 产氢速率图 2展现了ACR乙醇型发酵反应器在不同HRT下的产气情况.结果显示,随着HRT的减小,系统的产气速率和产氢速率均呈现上升趋势.HRT的缩短使得反应器内微生物在单位时间内可利用的营养基质增加,其代谢产物的绝对质量也增加,因而,反应器的产气速率和产氢速率随HRT的缩短而上升.当HRT由12 h逐步缩短到8 h、6 h、4 h时,ACR乙醇型发酵制氢系统的产气速率分别为36.4、43.6、56.2、61.6 L · d-1,产氢速率分别为13.9、20.9、26.5、30.1 L · d-1,而氢气含量仅由HRT=12 h的38.1%上升到HRT=8 h时 的48.1%后,不再随HRT的进一步降低而增加,在HRT介于4 h~8 h间,氢气含量基本保持在47.1%~48.9%的水平(图 2).以上的变化特征说明HRT由12 h缩短到8 h时,反应器内的微生物群落可能发生了一定演替,各产氢代谢途径所占份额发生变化.因反应器在首次遭受冲击负荷(HRT由12 h调为8 h的阶段)后,反应器内存活的微生物种群活性较强,反应器的抗冲击负荷能力得到增强,系统内的微生物群落结构也较为稳定,所以,在HRT由8 h缩短到4 h的运行过程中,反应器的氢气含量基本不变.以上结果表明,ACR乙醇型发酵系统在HRT=4 h时,表现出最大的产氢速率.而根据任南琪等的研究(Ren et al., 2006),一体化CSTR发酵制氢反应器在HRT=4 h时,系统污泥流失,反应器难以稳定运行,这表明ACR发酵制氢反应工艺较CSTR具有更好的应用前景.
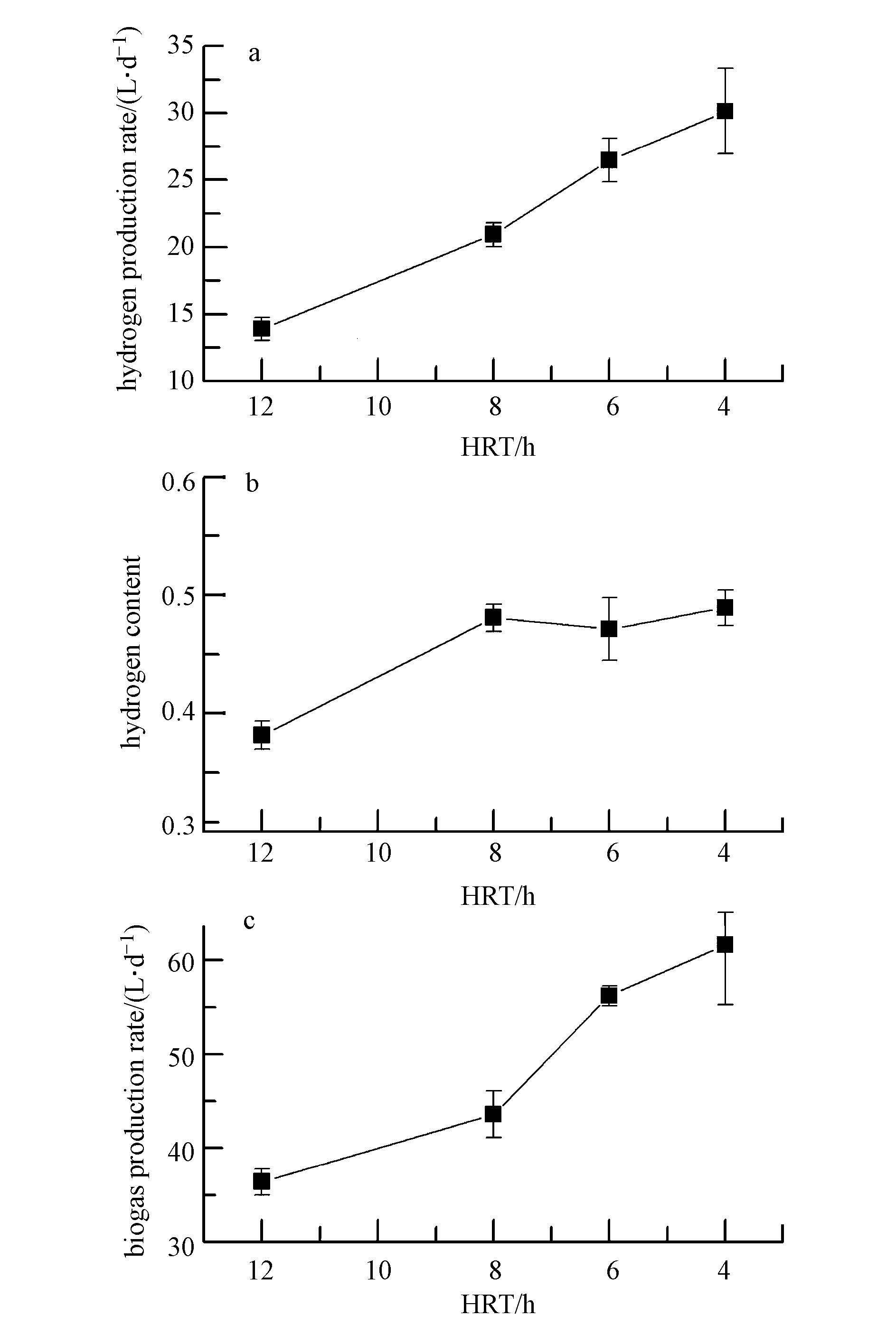 |
| 图2 ACR乙醇型发酵在不同HRT下的产气情况 Fig.2 Biogas production rate of ethanol-type fermentation in ACR system under different HRT |
因不同的产酸发酵产氢微生物的生长动力学特征存在差异,厌氧反应器内微生物群落和代谢特性将能随着HRT变化而发生改变,其液相发酵产物各组分含量势必也随之改变.Wu和Li等的研究结果也都证明,HRT的改变引发了系统内的微生物种群演替,进而影响了系统的产氢性能(Wu et al., 2008; Li et al., 2010).本文的研究也得到了类似的结果.ACR发酵制氢系统在不同HRT下,反应器出水中的溶解性代谢产物组分也存在着差异(图 3).由图 3可见,当HRT由12 h缩短到6 h时,乙醇含量的增幅尤为明显,其浓度由814.8 mg · L-1增加到1643.1 mg · L-1,但当HRT进一步降低到4 h时,乙醇浓度反而有所降低,为1312.1 mg · L-1,而乙酸的含量由HRT为12 h的338.7 mg · L-1增加到HRT为8 h的643.5 mg · L-1后,其增幅较弱.分析认为,这是由于反应器的pH控制在4.5~5.0间,乙醇型发酵产氢微生物活性较强,并且HRT的缩短对活性较强的乙醇型发酵产氢微生物进行了筛选,其代谢活性较强的产氢微生物在制氢系统内得以保留下来,因而其乙醇含量随HRT缩短而增加,而当HRT缩短到4 h时,系统可能因对底物转化率有所减小而导致乙醇含量下降.如前所述,反应器pH始终控制在4.5~5.0间,而产丁酸厌氧微生物和产丙酸微生物的适宜pH分别为5.5~6.5、4.0~4.5(Ren et al., 2007a; Li et al., 2009),所以,在连续流反应器的初始运行阶段(HRT=12 h)期间,产丁酸厌氧发酵菌属和产丙酸发酵菌属就已受到抑制,活性较差的产酸发酵菌群已随出水而被淘汰,在系统内存活下来的产丁酸厌氧发酵菌属和产丙酸发酵菌属活性较强,其受HRT影响可能较小,所以,反应器在HRT为4~12 h的运行阶段,丙酸、丁酸的浓度基本未随HRT的缩短而发生变化.在反应器的整个运行阶段,丙酸和丁酸浓度分别保持在152.3~185.9 mg · L-1和76.8~134.7 mg · L-1的水(图 3).以上实验结果表明,ACR乙醇型发酵系统在HRT由12 h分步降为4 h的运行过程中,乙醇、乙酸含量总体呈现上升趋势,而丙酸、丁酸基本保持不变.在HRT分别为12 h、8 h、6 h、4 h时,反应器出水中乙醇和乙酸的质量分数之和分别为78.2%、87.7%、90.6%、88.5%,即乙醇型发酵特征随着HRT的缩短而更为明显,这进一步说明,随着HRT的减小,ACR系统中的产乙醇发酵产氢种群在厌氧菌群中的丰度增加,因此,ACR发酵系统在较低的HRT下表现出更好的产氢性能(图 2).
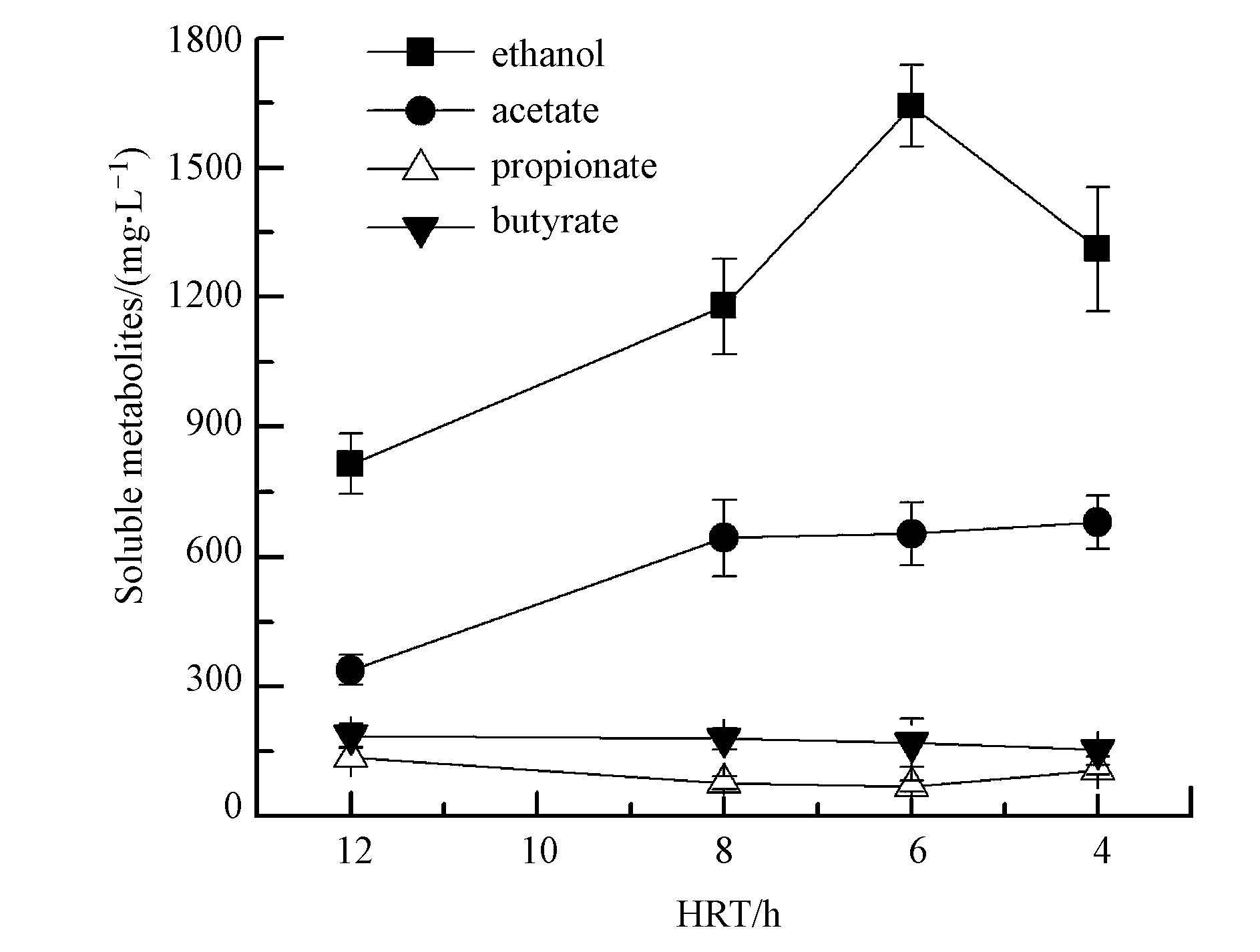 |
| 图3 ACR乙醇型发酵在不同HRT下溶解性发酵产物 Fig.3 Soluble metabolites of ethanol-type fermentation in ACR system under different HRT |
与乙醇型发酵特性不同,ACR丁酸型发酵系统除产气速率外,氢气含量和产氢速率没有随HRT的缩短而呈递增趋势(图 4).相反,ACR系统仅当HRT由12 h缩短到8 h时,产氢速率有所提高外(即产氢速率由9.0 L · d-1增加到9.3 L · d-1),在HRT为4~8 h的运行期间,ACR发酵制氢系统的产氢速率随HRT的降低而呈递减趋势,其氢气含量也由HRT=8 h的36.8%逐级下降到HRT=4 h的24.9%(图 4).这表明对于ACR丁酸型发酵系统而言,随着HRT的减小,系统中代时较长的产氢微生物被淘汰出去,导致其利用基质进行发酵产氢的能力下降.ACR丁酸型发酵系统在HRT由8 h缩短为6 h时,系统的产气速率由25.4 L · d-1增加到29.0 L · d-1,但其产氢速率却由8.5 L · d-1减小为7.2 L · d-1(图 4).以上结果表明,HRT对ACR丁酸型发酵和乙醇型发酵产氢系统的影响不同,ACR丁酸型发酵系统在HRT=8 h时,表现出最大的产氢速率.
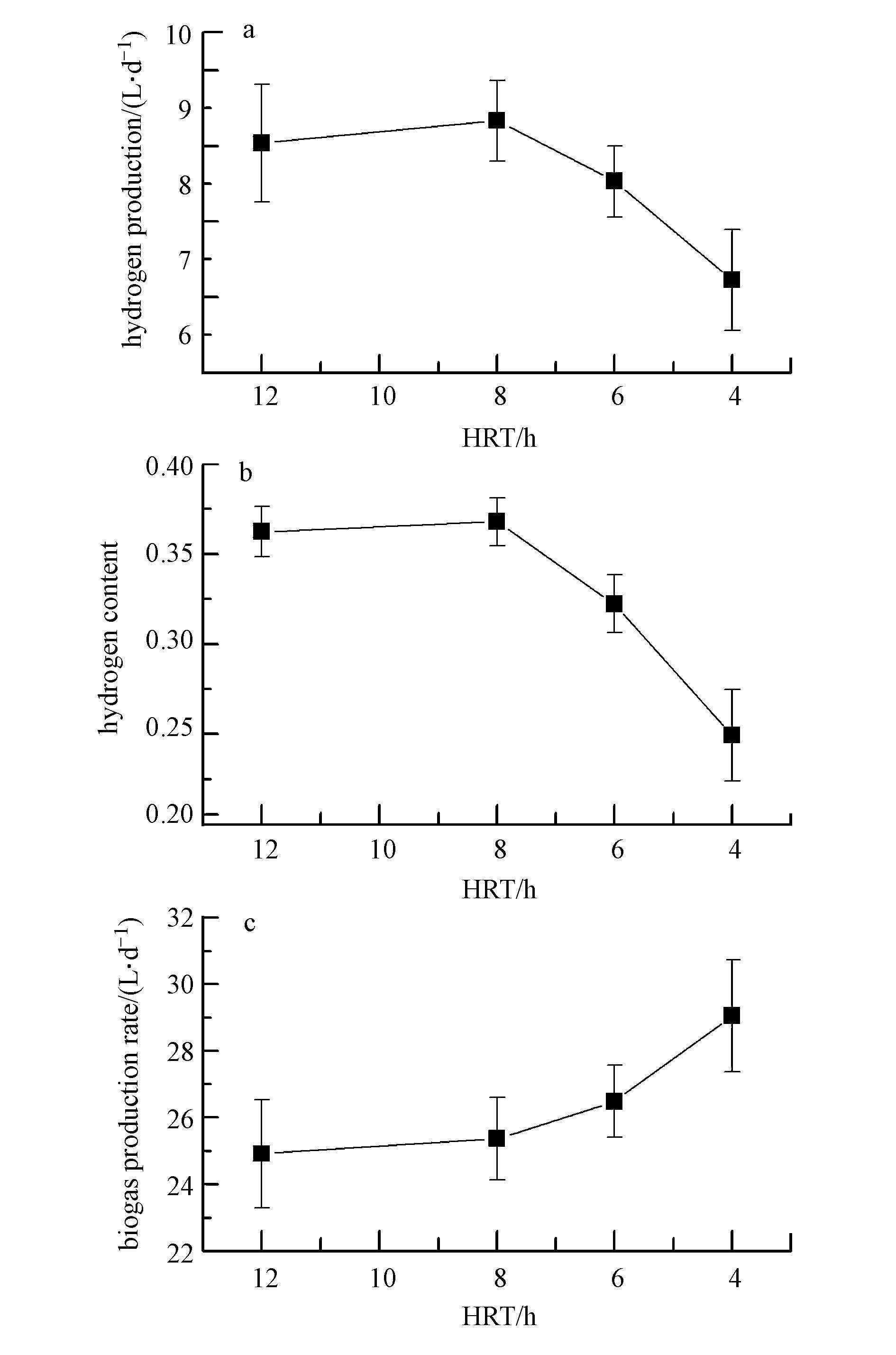 |
| 图4 ACR丁酸型发酵在不同HRT下的产气情况 Fig.4 Biogas production rate of butyric-type fermentation in ACR system under different HRT |
ACR丁酸型发酵系统在不同HRT下液相末端发酵产物的变化情况如图 5所示.由图可见,当HRT由12 h降低到8 h时,液相末端发酵产物各组分含量基本不变,这说明这一HRT的变化未对反应器内的微生物群落结构产生显著影响,因而其气体组分也保持不变(图 4).但在HRT由8 h逐级降低到4 h的过程中,液相发酵产物中的丁酸呈递减趋势,而丙酸呈逐渐上升的变化规律,其中丁酸浓度由HRT=8 h的1116.9 mg · L-1减小到HRT=4 h的803.8 mg · L-1,丙酸浓度由HRT=8 h的211.6 mg · L-1增加到HRT=4 h的416.9 mg · L-1(图 5).根据各类产氢微生物的发酵代谢途径,丙酸型发酵菌属的代谢不仅不伴随氢气的产生,反而会消耗氢气(Lee and Rittmann, 2009).所以,ACR丁酸型发酵系统在HRT为4~8 h的运行期间,其氢气含量随HRT的降低而减小,同时,反应器因丁酸型产氢发酵微生物活性可能随HRT减小而降低,其产氢速率也随之下降(图 4).以上结果表明,与乙醇型发酵系统相似,虽然HRT的改变也能引起ACR丁酸型发酵制氢系统内的微生物群落结构发生改变,但HRT的缩短使得ACR丁酸型发酵反应器内的产丁酸产氢菌群的活性或数量降低,所以,ACR丁酸型发酵系统在较高的HRT(8 h)下表现出更好的产氢性能(图 4).
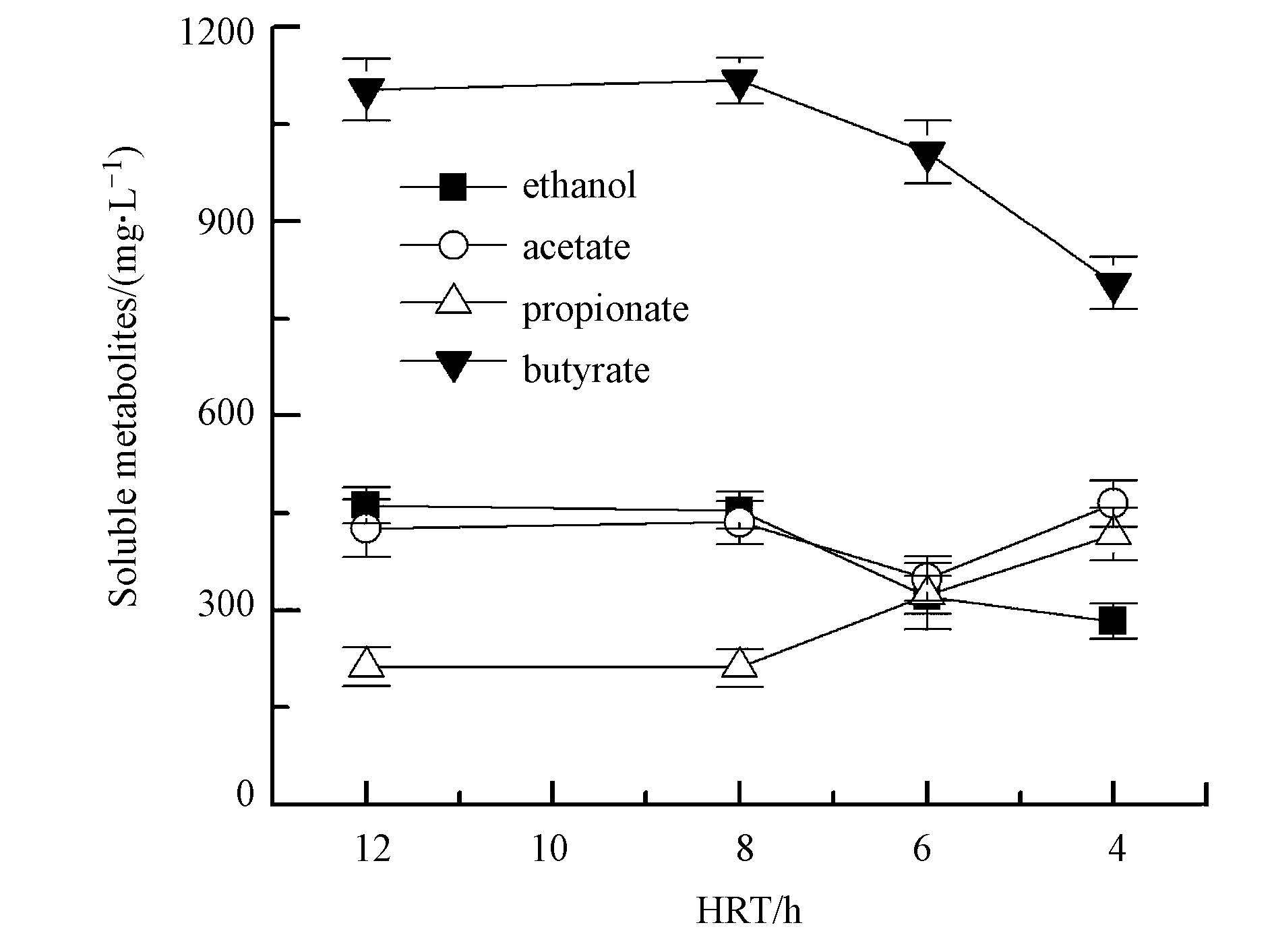 |
| 图5 ACR丁酸型发酵在不同HRT下溶解性发酵产物 Fig.5 Soluble metabolites of butyric-type fermentation in ACR system under different HRT |
ACR乙醇型和丁酸型发酵系统在不同HRT下生物量的变化情况如图 6所示.由图可见,在各HRT条件下,乙醇型发酵系统中的生物量始终高于丁酸型发酵系统,并且随着HRT的缩短,生物量的变化规律不同.对于乙醇型发酵系统而言,当HRT处于6~12 h间运行时,系统生物量随HRT的减小而增加,分析认为这是因为HRT的缩短,导致底物营养的增加,为微生物的繁殖提供了必要条件.当HRT缩短到4 h时,系统生物量有微弱降低趋势,ACR乙醇型发酵制氢系统生物量由HRT=6 h的9.6 g · L-1降低到9.2 g · L-1(图 6),这可能是因部分产氢微生物代时较长,从系统中淘汰出去所致.然而,对于丁酸型发酵系统而言,当HRT降低到8 h后,系统内的生物量随着HRT的减小而降低,这表明丁酸型发酵系统中的发酵产酸产氢微生物的增殖能力较产乙醇产氢微生物菌群的要弱,当系统HRT进一步缩短时,其被淘汰出系统,在HRT=4 h时,ACR丁酸型发酵系统中的生物量仅为3.47 g · L-1,进而使得发酵产物中丁酸的含量随HRT减小而降低(图 6).以上研究结果表明,在ACR发酵型反应器内,产乙醇产氢微生物的活性要高于产丁酸产氢菌属,其能在较低的HRT下存活,进而维持制氢反应系统的高效运行(图 2~图 5).
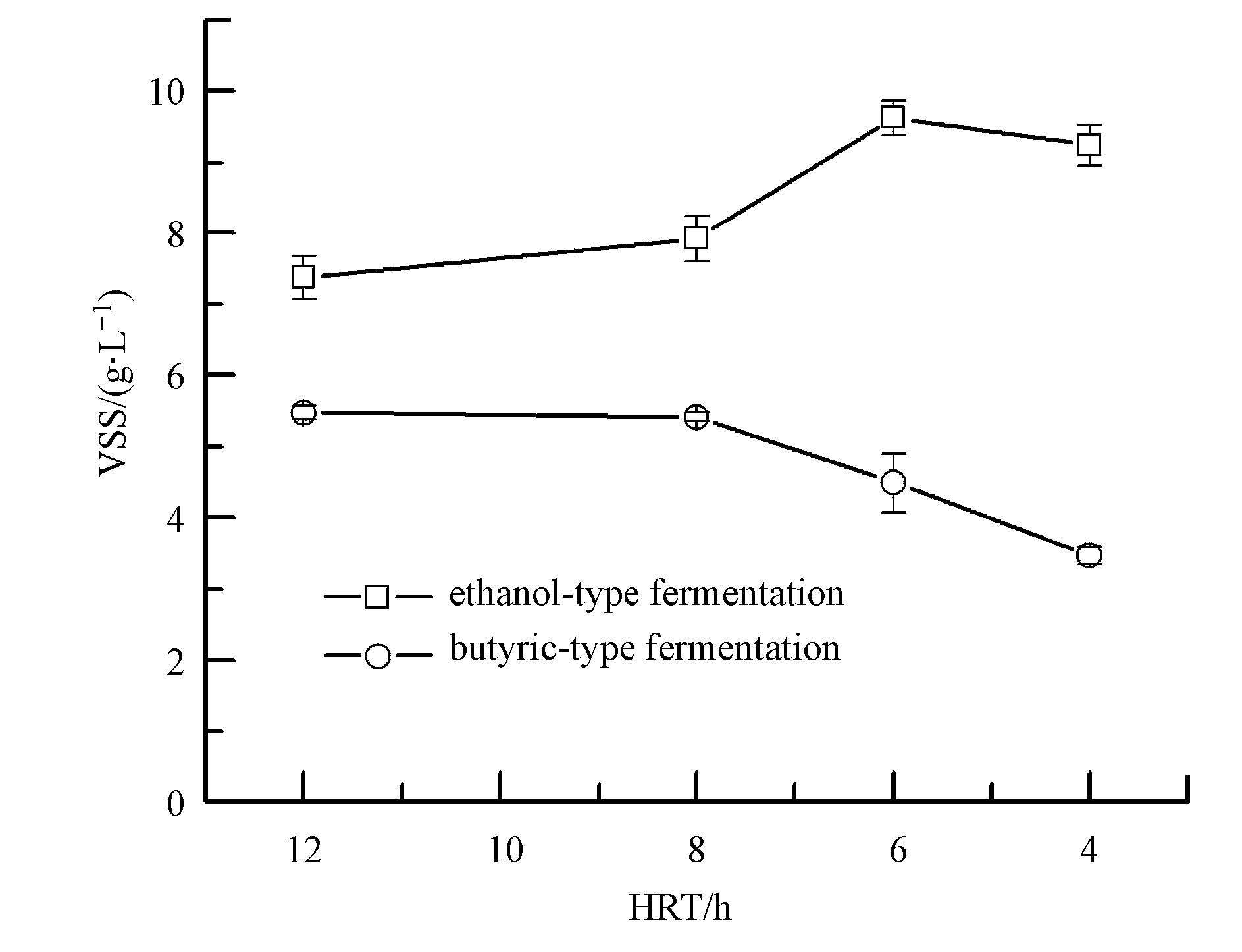 |
| 图6 不同HRT下ACR乙醇型和丁酸型发酵系统中的生物量 Fig.6 Biomass concentration of ACR system under different HRT by ethanol-type fermentation and butyric-type fermentation |
根据上述实验结果,ACR乙醇型发酵制氢系统在HRT=4 h时,系统产氢速率最大,而ACR丁酸型发酵系统在HRT=8 h时,获得的产氢速率最大.为了系统比较ACR乙醇型发酵和丁酸型发酵产氢系统在各HRT条件下的产氢效能,对系统单位基质的氢气转化率和污泥比产氢速率也进行了比较(表 1).从反应器各阶段对废水中糖类的转化率来看,当ACR系统在HRT控制为12 h、8 h时,乙醇型发酵型和丁酸型发酵对糖类的转化率相当,分别均保持在94.8%、95%和87.5%、86.3%的水平,但当系统HRT进一步缩小到6 h、4 h时,乙醇型发酵和丁酸型发酵系统对糖的转化率分别下降到85.6%、72.9%和66.0%、60.7%,这表明,在较短HRT下,丁酸型发酵系统相对乙醇型发酵系统而言,其对底物的利用率要小得多,分析认为这是由于产丁酸发酵产氢微生物的代谢和增殖活性相对产乙醇发酵产氢微生物较弱(图 3和图 5),HRT的缩短使得丁酸型发酵系统内的生物量下降(图 6)所致.另外,因HRT的缩短能将系统内活性较低的微生物淘汰出去,在较小的HRT 控制条件下,反应器内存活的微生物活性和代谢能力强,因而ACR乙醇型发酵和丁酸型发酵反应器内的污泥比产氢速率均呈现出随HRT的缩小而升高的变化规律.但值得注意的是,乙醇型发酵系统中污泥的比产氢速率要高于丁酸型发酵系统,在HRT为12 h、8 h、6 h、4 h时,ACR乙醇型发酵和丁酸型发酵系统的污泥比产氢速率分别为7.8、10.9、11.4、13.5 mmol · g-1 · d-1和6.8、7.1、7.8、8.6 mmol · g-1 · d-1.同时,从基质的氢气转化率来看,乙醇型发酵系统也要优于丁酸型发酵系统,乙醇型发酵和丁酸型发酵在HRT为12 h、8 h、6 h、4 h的的单位基质氢气转化率分别为1.9、2.2、2.1、1.8 mol ·(mol-glucose)-1和1.3、1.0、1.0、0.5 mol ·(mol-glucose)-1,乙醇型发酵的单位基质氢气转化率是丁酸型发酵的1.5~2.2倍.综合上述反应器在不同HRT条件下的产氢速率、糖降解率、污泥比产氢活性以及基质的氢气转化率来看,ACR乙醇型发酵制氢系统的产氢性能明显优于丁酸型发酵系统.当以糖蜜废水为底物,在进水COD为5000 mg · L-1的条件下,在取得较好的底物利用(大于80%)的基础上,ACR乙醇型和丁酸发酵制氢系统的HRT宜分别控制在6 h和8 h的水平.
| 表1 对比分析不同HRT下ACR乙醇型和丁酸型发酵系统产氢性能 Table 1 Comparison of characteristics biohydrogen production in ACR system by ethanol-type and butyric-type fermentation |
1)以糖蜜废水为基质,保持进水COD为5000 mg · L-1不变,在HRT由12 h依次降低到8 h、6 h、4 h的运行过程中,ACR乙醇型发酵系统的产氢效能始终优于丁酸型发酵制氢系统,乙醇型发酵系统的单位基质氢气转化率约为丁酸型发酵的1.5~2.2倍.
2)对于乙醇型发酵系统而言,HRT的缩短导致乙醇型发酵产氢菌属得到不断富集,使得系统在HRT=4 h时,系统的产氢速率达到30.1 L · d-1,污泥的比产氢速率高达13.5 mmol · g-1 · d-1.
3)对于丁酸型发酵系统而言,HRT的缩短使得系统内生物量减小,导致底物的转化率明显下降,反应器在HRT为8 h时,产氢速率最佳,为9.3 L · d-1.
| [1] | American Public Health Association. 1998. Standard Methods for the Examination of Water and Wastewater [S]. 19th ed. Washington DC, USA |
| [2] | 昌盛. 2012. 厌氧接触式发酵制氢反应器的运行调控与产氢效能[D]. 哈尔滨: 哈尔滨工业大学 |
| [3] | 昌盛,李建政,付青,等. 2015.ACR在不同进水COD浓度下的产氢性能与菌群结构[J].化工学报, (3):1156-1162 |
| [4] | Guo W Q, Ren N Q, Wang X J, et al.2008. Biohydrogen production from ethanol-type fermentation of molasses in an expanded granular sludge bed (EGSB) reactor[J]. International Journal of Hydrogen Energy.33(19):4981-4988 |
| [5] | Lee H S, Rittmann B E. 2009. Evaluation of metabolism using stoichiometry in fermentative biohydrogen[J]. Biotechnology and Bioengineering, 102 (3): 749-758 |
| [6] | Li C L, Fang H H P. 2007. Fermentative hydrogen production from wastewater and solid wastes by mixed cultures[J]. Critical Revivews in Environmental Science and Technology, 37(1):1-39 |
| [7] | Li H Z, Li B K, Zhu G F, et al. 2007. Hydrogen production from diluted molasses by anaerobic hydrogen producing bacteria in an anaerobic baffled reactor (ABR) [J]. International Journal of Hydrogen Energy, 32(15):3274-3283 |
| [8] | 李建政, 昌盛. 2008. 厌氧接触式发酵制氢反应器 [P]. China, 200710144460. 2008-05-14 |
| [9] | Li J, Zheng G, He J, et al. 2009. Hydrogen-producing capability of anaerobic activated sludge in three types of fermentations in a continuous stirred - tank reactor [J]. Biotechnology Advances, 27 (5): 573-577 |
| [10] | Li S L, Whang L M, Chao Y C, et al. 2010. Effects of hydraulic retention time on anaerobic hydrogenation performance and microbial ecology of bioreactors fed with glucose-peptone and starch-peptone[J]. International Journal of Hydrogen Energy, 35(1):61-70 |
| [11] | Pan C M, Fan Y T, Zhao P, et al. 2008. Fermentative hydrogen production by the newly isolated Clostridium beijerinckii Fanp3[J]. International Journal of Hydrogen Energy, 33(20):5383-5391 |
| [12] | Ren N Q, Li J, Li B, et al. 2006. Biohydrogen production from molasses by anaerobic fermentation with a pilot-scale bioreactor system [J]. International Journal of Hydrogen Energy, 31 (15): 2147-2157 |
| [13] | Ramachandran U, Wrana N, Cicek N, et al. 2008. Hydrogen production and end-product synthesis patterns by Clostridium termitidis strain CT1112 in batch fermentation cultures with cellobiose or alpha-cellulose[J]. International Journal of Hydrogen Energy, 33(23):7006-7012 |
| [14] | Ren N Q, Chua H, Chan S Y, et al. 2007a. Assessing optimal fermentation type for bio- hydrogen production in continuous - flow acidogenic reactors [J]. Bioresource Technology, 98 (9): 1774-1780 |
| [15] | Ren N, Xing D, Rittmann B E, et al. 2007b. Microbial community structure of ethanol type fermentation in bio - hydrogen production [J]. Environmental Microbiology, 9 (5): 1112-1125 |
| [16] | Ren N Q, Tang J, Liu B F, et al. 2010. Biological hydrogen production in continuous stirred tank reactor systems with suspended and attached microbial growth[J]. International Journal of Hydrogen Energy, 35(7):2807-2813 |
| [17] | Shen L H, Bagley D M, Liss S N. 2009. Effect of organic loading rate on fermentative hydrogen production from continuous stirred tank and membrane bioreactors[J]. International Journal of Hydrogen Energy, 34(9):3689-3696 |
| [18] | Show K Y, Lee D J, Chang J. 2011. Bioreactor and process design for biohydrogen production [J]. Bioresource Technology, 102 (18): 8524-8533 |
| [19] | Van G S W, Logan B. 2005. Increased biological hydrogen production with reduced organic loading [J]. Water Research, 39 (16): 3819-3826 |
| [20] | Wang J L, Wan W. 2009. Factors influencing fermentative hydrogen production: A review[J]. International Journal of Hydrogen Energy, 34(2):799-811 |
| [21] | Wu S Y, Hung C H, Lin C N, et al. 2006. Fermentative hydrogen production and bacterial community structure in high-rate anaerobic bioreactors containing silicone-immobilized and self-flocculated sludge [J]. Biotechnology and Bioengineering, 93(5): 934-946 |
| [22] | Wu S Y, Hung C H, Lin C Y, et al. 2008. HRT-dependent hydrogen production and bacterial community structure of mixed anaerobic microflora in suspended, granular and immobilized sludge systems using glucose as the carbon substrate[J]. International Journal of Hydrogen Energy, 33 (5):1542-1549 |
| [23] | Xing D F, Ren N Q, Li Q B, et al. 2006. Ethanoligenens harbinense gen. nov., sp nov., isolated from molasses wastewater[J]. International Journal of Systematic and Evolutionary Microbiology, 56 (Pt 4):755-760 |
| [24] | Zhang Z P, Show K Y, Tay J H, et al. 2006. Effect of hydraulic retention time on biohydrogen production and anaerobic microbial community[J]. Process Biochemistry, 41(10):2118-2123 |
 2016, Vol. 36
2016, Vol. 36


