人工湿地是人工设计建造的由填料、植物和微生物组成的可控制工程化的污水处理生态系统,依靠系统中物理、化学及生物共同作用实现对污水的净化.人工湿地具有投资少、运行费用低、维护方便的特点,且对有机物有较强的降解能力,对N、P去除率较高,对负荷变化适应性强,以及兼具美学价值(李娟等,2011),因而受到了越来越多的关注.
我国华北、东北、西北地区冬季气候寒冷漫长,冰冻期长达3~6个月,其中,北部边陲地区年最低气温可达到-30 ℃以下.严酷的气候条件使该地区人工湿地系统中的植物在冬季基本上都会枯萎死亡,系统中微生物的数量也会大幅度减少;同时,微生物代谢外源物质的能力也有所降低,导致污水处理效果变差,甚至不达标.因此,如何保证人工湿地在冬季的污水处理效果成为亟待解决的问题.
微生物作为人工湿地除污的主体和核心,完成物质的矿化、硝化、反硝化等转化的作用不言而喻(Hoppe et al., 1988;Savin et al., 1998;Martin et al., 1994;贺锋等,2005).根据微生物生长温度特性可将其分为高温微生物、中温微生物和低温微生物3类.其中,低温微生物是极端微生物之一,其具有独特的生理功能适应环境,因此,研究这类微生物不仅具有重要的理论意义,而且在实际推广应用中还产生了日益明显的经济效益和环境效益(李兵等,2010).在寒冷的冬季,这些低温微生物在人工湿地生态系统中起着非常重要的作用,为人工湿地污水处理提供了崭新的发展途径.
降解菌能否在自然环境中发挥降解作用是降解菌投入实际应用的关键,也是水污染生物修复技术能否成功的关键.外源投加的微生物本身在环境中的行为和对环境的影响如何也是关系到降解菌使用的一个重要问题,目前也越来越受到关注(李顺鹏等,2004;叶央芳等,2006).然而人工湿地是一个复杂的生态系统,既要充分发挥降解菌的降解作用,同时又要防止破坏湿地自然的生态结构,就有必要研究降解菌对湿地土壤中土著微生物的影响,为评价外源投加菌在水污染修复过程中对人工湿地生态系统的影响提供基础数据.基于此,本研究在山东南四湖人工湿地的底泥中分离驯化出一株在低温条件下生长速率及代谢速率最高的菌株,并对其进行形态特征、生理生化特性及16S rDNA序列分析鉴定.同时,探索在北方冬季条件下,该菌投加到人工湿地中在提高废水处理效率的同时,对湿地中土著可培养微生物类群数量和酶活性的影响.
2 材料与方法(Materials and methods) 2.1 复合垂直流构建湿地结构实验人工湿地采用复合垂直流结构设计,底部相通,污水由下行池表面均匀投配,垂直下行,经连通层到达上行池,再垂直上行,通过收集管排出.其中,下行流池长150 cm、宽100 cm、深65 cm,上行流池长120 cm、宽100 cm、深55 cm,卵石层深20 cm,投配负荷 2~20 cm · d-1,有机负荷 15~20 kg · hm-2 · h-1(以BOD5计).湿地基质选用了不同粒径的砾石和砂土特别组配而成,湿地结构如图 1所示,其中,图中箭头表示污水流动方向.
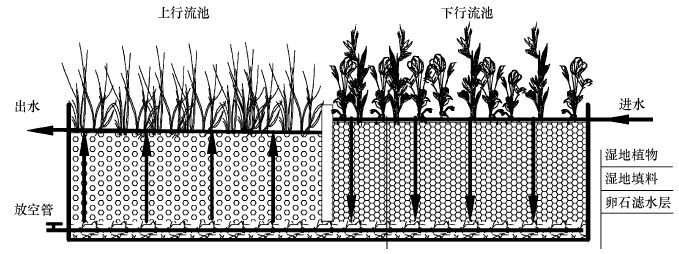 |
| 图1 复合垂直流湿地系统结构示意图 Fig.1 Schematic diagram of the integrated vertical-flow constructed wetland |
系统所选植物为除污能力强的常见湿地植物美人蕉(Canna generalis)和菖蒲(Acorus calamus),在2012年4月份种植于人工湿地反应器中,种植密度为8 株· m-2,湿地植物生长状况良好,已完全遮盖基质表面,根系发达,至实验时为止,该系统已稳定运行半年时间.系统进水来源为取自山东省曲阜市生活污水处理厂的进水.当水力停留时间为10 d 时,系统进出水参数见表 1.
| 表1 人工湿地系统进出水参数 Table 1 Parameters of inflow and outflow of the IVCW |
菌株Pseudomonas flava WD-3 于冬季从南四湖人工湿地的底泥中培养、分离、筛选出来,经鉴定为黄假单胞菌(Pseudomonas flava),命名为Pseudomonas flava WD-3,基因登陆号为JX114950(唐美珍等,2013).该菌株为好氧微生物,其对污水中有机污染物具有很好的净化效果,同时兼顾有较好的脱氮除磷能力.本文分别对菌株生长的时间、温度、pH、盐度、碳源和氮源进行了研究,确定其最佳的生长条件为:培养时间48 h,温度16 ℃,pH 6.0~8.0,盐度为1%,最佳碳源和氮源分别为蔗糖、蛋白胨(唐美珍等,2013).
2.3 Pseudomonas flava WD-3菌的投加将斜面保存的Pseudomonas flava WD-3菌种于30 ℃下活化培养24 h后,接种到装有100 mL LB液体培养基中,6~8 ℃条件下恒温培养至达到对数生长期(约48 h),再将菌悬液在1.2×103 r · min-1下离心(去除培养基的营养成分),收集菌体细胞,取湿菌体细胞再悬浮于无菌生理盐水中,在600 nm波长下其吸光度为1.0~1.2,菌悬液的浓度为4.575×108个 · mL-1.
人工湿地系统稳定运行半年后,于2013年1月中旬(水温的变化范围为6~8 ℃)开始投入Pseudomonas flava WD-3,接种方法采用一次性投加.接种量V(菌液)/V(污水)为1.5%~10%,以未接菌的人工湿地为对照组.
2.4 土壤样品的采集投菌后采用梅花形布点法在上、下行池分别取第1、3、5、7、10 d的土样,上、下行样混合后,一部分立即测定土壤微生物的数量;另一部分经自然风干-研磨-过筛(20目)-保存,用于土壤酶活性的测定.
2.5 土壤微生物数量及酶活性的测定方法土壤中细菌、真菌、放线菌计数采用平板培养法(混菌法)测定,硝化细菌和反硝化细菌采用最大或然(MPN)法测定.土壤脲酶采用奈氏比色法测定,脱氢酶采用TTC紫外分光光度法测定,过氧化氢酶采用高锰酸钾滴定法测定,蔗糖酶采用硫代硫酸钠滴定法测定(许光辉等,1986;中国科学院南京土壤研究所微生物室,1985).
2.6 数据处理实验数据均为3次重复的平均数,采用Excel和SPSS19.0作统计处理.
3 结果与讨论(Results and discussion) 3.1 土壤微生物数量随Pseudomonas flava WD-3菌投加量和时间的分布变化Pseudomonas flava WD-3投入到人工湿地后,其土著微生物数量随投菌量及时间的变化情况见图 2.从图 2及进行单因素方差分析后发现,接种Pseudomonas flava WD-3后,人工湿地中可培养细菌、真菌、放线菌、硝化细菌及反硝化细菌的数量(以干重计)均产生了显著变化(p<0.01).在1.5%~6.0%的接种量情况下,随着Pseudomonas flava WD-3投加量的增加,湿地系统中可培养细菌、放线菌、硝化细菌及反硝化细菌的数量也随着增加,而真菌呈现下降的趋势,并在6.0%的接种量时,各种可培养微生物数量增加或减少到最大值.与对照组相比,湿地系统中可培养细菌、放线菌、硝化细菌及反硝化细菌数量最大分别增加了1.3、1.9、2.3、1.3倍,而可培养真菌数量最大减少了23.3%.但当投菌量提高到10.0%时,参比6.0%时的投菌量,人工湿地系统中各种可培养微生物数量稍微有些降低.究其原因可能是,当投加量增加到一定数量后,Pseudomonas flava WD-3可能作为一种生物入侵种,容易为了争夺养分、空间等而进行种类斗争,从而使人工湿地系统中各种可培养微生物数量有所降低.
 |
| 图2 复合垂直流人工湿地中细菌(a)、真菌(b)、放线菌(c)、反硝化细菌(d)和硝化细菌(e)数量的变化 Fig.2 The quantity change of bacteria(a), fungus(b), actinomyces(c), denitrifing bacteria(d), nitrifying bacteria(e) in the integrated vertical-flow constructed wetland |
Pseudomonas flava WD-3投入到人工湿地后,其土壤酶活性(均以干土质量计)随投菌量及时间的变化情况见图 3.过氧化氢酶能催化土壤中过氧化氢的分解,减弱过氧化氢所产生的毒害作用,在一定程度反映了土壤微生物学过程的强度.从图 3a可知,Pseudomonas flava WD-3投加后能显著促进土壤过氧化氢酶活性的增加.当Pseudomonas flava WD-3为水处理效果最佳投加量(6.00%)时,与对照组相比,其最大增幅高达69.2%.
 |
| 图3 复合垂直流人工湿地土壤中过氧化氢酶(a)、蔗糖酶(b)、脲酶(d)及脱氢酶(d)活性的变化 Fig.3 Activity change of catalase(a), sucrose(b), urease(c) and dehydrogenase(d) in the soil of integrated vertical-flow constructed wetland |
蔗糖酶活性可用来表征土壤的肥力状况和熟化程度.从图 3b可知,Pseudomonas flava WD-3投加后能显著促进土壤蔗糖酶活性(当NH4+-N计).当Pseudomonas flava WD-3为水处理效果最佳投加量(6.00%)时,与对照组相比,最大增加了2.3倍.
脲酶是一种酰胺酶,能酶促有机质分子中肽键的水解,参与土壤中氮素的转化.从图 3c可知,Pseudomonas flava WD-3投加后能显著促进土壤脲酶活性.当Pseudomonas flava WD-3为水处理效果最佳投加量(6.00%)时,与对照组相比,其最大增幅达41.3%.
脱氢酶是一种与土壤有机质转化有关的酶,它能酶促碳水化合物、有机酸等有机质的脱氢反应,起着氢的中间传递体的作用.从图 3d可知,Pseudomonas flava WD-3投加后能显著促进土壤脱氢酶活性.当Pseudomonas flava WD-3为水处理效果最佳投加量(6.00%)时,与对照组相比,其最大增幅达54.5%.
4 讨论(Discussion)土壤微生物的组成和数量变化与土壤健康状况密切相关,真菌型土壤向细菌型转变是土壤健康状况改善的一个生物指标(Yuan et al., 2012;Kalyani et al., 2010;马军伟等,2013).古丽君等(2013)研究发现,深绿木霉施入草坪土壤后,引起土壤中细菌数量明显增加,真菌数量显著减少,促使土壤由真菌型向细菌型转化.刘方春等(2013)报道,具有促生功能的枯草芽孢杆菌显著提高了冬枣根际土壤细菌、放线菌数量及微生物总量,明显降低了真菌数量.本研究结果支持这一观点,研究发现,Pseudomonas flava WD-3投入人工湿地后,可明显提高土壤中可培养细菌、硝化细菌、反硝化细菌及放线菌数量,这可能是由于外源功能菌的加入抑制了土著有害菌株,增强了土壤有益微生物的活性(陈雪丽等,2008),这也表明Pseudomonas flava WD-3的加入有利于改善人工湿地的微环境,促使土壤由真菌型向细菌型转变,从而提高人工湿地的污水净化能力.许多土壤真菌是植物发病的根源(凌宁等,2009),Pseudomonas flava WD-3能显著降低人工湿地土壤中真菌的数量,表明Pseudomonas flava WD-3有防治或减少一些土传真菌病害发生的可能,具体有待进一步的研究证实.
人工湿地接种Pseudomonas flava WD-3后,其各种可培养的微生物数量表现为先升高后下降,分析原因可能是:①由于本实验是针对冬季低温污水的处理,因此,设计的水力停留时间较长(10 d).在水力停留时间内,基本上属于静态实验.在实验的初始时间(1~5 d)内,污水中含有大量的有机物、N和P,能够充足提供微生物生长繁殖所需的营养物质,所以微生物的数量均呈现上升的趋势;但随着水中COD、N和P等污染物的去除,水中为微生物繁殖提供能量的营养物逐渐减少,特别是有机碳源减少,微生物因为没有足够的有机底物支持,数量就逐渐降低.②微生物在降解污水中有机污染、氮和磷过程中的中间产物在水体中的释放对微生物有一定的毒害作用,以及模拟试验中温度等环境因素共同导致湿地系统中微生物量下降(Weon et al., 2002).
酶参与土壤中物质的循环和转化,土壤酶活性的强弱可作为土壤肥力和质量的评价指标(陈波浪等,2014;Guo et al., 2011).在本试验条件下,接种Pseudomonas flava WD-3能提高人工湿地土壤过氧化氢酶、蔗糖酶、脲酶及脱氢酶活性.究其原因可能是因为土壤微生物数量的增加提高了包括土壤酶在内的内分泌物的数量,进而增强土壤酶活性(路怡青等,2014).这一结果表明,接种Pseudomonas flava WD-3有利于改善人工湿地土壤的肥力与健康状况.
综上可知,Pseudomonas flava WD-3投加到人工湿地后能显著提高污水的净化能力(表 1),这是因为Pseudomonas flava WD-3本身是一种耐低温的高效降解菌,对污水有着很好的净化能力;另一方面,Pseudomonas flava WD-3对人工湿地土著微生物具有很好的促生作用,将其投加到人工湿地后,能显著提高土著可培养细菌、硝化细菌、反硝化细菌及放线菌的数量,同时增强土壤中各种酶的活性,从而提高污水净化效果.
5 结论(Conclusions)1)冬季Pseudomonas flava WD-3投入复合垂直流人工湿地后,明显提高了湿地土壤中可培养细菌、硝化细菌、反硝化细菌、放线菌数量及土壤过氧化氢酶、蔗糖酶、脲酶及脱氢酶活性,而真菌数量呈下降趋势.
2)在实验投菌量为最佳投加量6%时(水净化效果最佳),人工湿地土壤中各种可培养微生物数量及酶活性增加或减少到最大值.与对照组相比,湿地系统中可培养细菌、放线菌、硝化细菌及反硝化细菌数量最大分别增加了1.3、1.9、2.3、1.3倍,而可培养真菌数量最大减少了23.3%;过氧化氢酶、蔗糖酶、脲酶及脱氢酶活性分别增加了69.2%、230%、41.3%及54.5%.
| [1] | 陈波浪,蒋平安,盛建东.2014.磷肥对棉田土壤有效磷及土壤酶活性的影响[J].土壤通报,45(1):185-188 |
| [2] | 陈雪丽,王光华,金剑,等.2008.两株芽孢杆菌对黄瓜和番茄根际土壤微生物群落结构影响[J].生态学杂志,27(11):1895-1900 |
| [3] | 古丽君,徐秉良,梁巧兰,等.2013.生防木霉对草坪土壤微生物区系的影响及定殖能力研究[J].草业学报,22(3):321-326 |
| [4] | Guo P,Wang C Y,Jia Y,et al.2011.Responses of soil microbial biomass and enzymatic activities to fertilizations of mixed inorganic and organic nitrogen at a subtropical forest in East China[J].Plant and Soil,338(1):355-366 |
| [5] | Hoppe H G,Emerick L C,Gocke K.1988.Microbial decomposition in aquatic environments: combined processes of extra cellular activity and substrate uptake[J].Appl Environ Microbiol,54:784-790 |
| [6] | Kalyani S S,Sharma J,Durej A P,et al. 2010.Influence of endosulfan on microbial biomass and soil enzymatic activities of a tropical alfisol[J].Bulletin of Environmental Contamination and Toxicology,84(2):351-356 |
| [7] | 贺锋,吴振斌,陶菁,等.2005.复合垂直流人工湿地污水处理系统硝化与反硝化作用[J].环境科学,26(1):47-50 |
| [8] | 李兵,张庆芳,窦少华,等.2010.低温石油降解菌LHB16的筛选及降解特性研究[J].生物技术,20(5):83-85 |
| [9] | 李娟,张龙庄,段亮,等.2011.人工湿地废水处理技术的研究现状以展望[J].南方农业学报,42(1):69-73 |
| [10] | 李顺鹏,蒋建东.2004.农药污染土壤的微生物修复研究进展[J].土壤,36(6):577-583 |
| [11] | 凌宁,王秋君,杨兴明,等.2009.根际施用微生物有机肥防治连作西瓜枯萎病研究[J].植物营养与肥料学报,15(5):1136-1141 |
| [12] | 刘方春,邢尚军,马海林,等.2013.根际促生细菌(PGPR) 对冬枣根际土壤微生物数量及细菌多样性影响[J].林业科学,49(8):75-80 |
| [13] | ,朱安宁,张佳宝,等.2014.免耕和秸秆还田对土壤酶活性和微生物群落的影响[J].土壤通报,45(1):85-89 |
| [14] | ,孙万春,胡庆发,等.2013. 氰胺类肥料对连作土壤微生物种群结构的影响[J].浙江大学学报(农业与生命科学版),39(3):281-290 |
| [15] | Martin C D,Moshiri G A.1994.Nutrient reduction in an in-series constructed wetland system treating landfill leachate[J].Water Sci Technol,29(4):267-272 |
| [16] | Savin M C,Amador L A.1998.Biodegredation of norflurazon in a bog soil[J].Soil Biol Biochem,30:275-284 |
| [17] | 唐美珍,李婷婷,王艳娜,等.2013.人工湿地中一株高效低温菌的分离鉴定与去除特性研究[J].环境科学学报,33(3):708-714 |
| [18] | Weon S Y,Lee C W,Lee S,et al. 2002.Nitrite inhibition of aerobic growth of Acinetobacter sp.[J].Water Res,36(18):4471-4476 |
| [19] | 许光辉 郑洪元.1986.土壤微生物分析方法手册[M].北京: 农业出版社 |
| [20] | Yan B C,Yue D X.2012.Soil microbial and enzymatic activities across a chronosequence of Chinese pine plantation development on the Loess Plateau of China[J].Pedosphere,22(1):1-12 |
| [21] | 叶央芳,闵航. 2006.代谢指纹评估苯噻草胺对水稻土微生物群落的短期影响[J].土壤学报,43(2):287-294 |
| [22] | 中国科学院南京土壤研究所微生物室.1985.土壤微生物研究法[M].北京:科学出版社.40-59 |
 2016, Vol. 36
2016, Vol. 36


