2. 安徽工业大学能源与环境学院, 马鞍山 243000
2. College of Energy and Environment, Anhui University of Technology, Ma'anshan 243000
活性污泥絮体作为微型生物单元在污水生化处理中起着重要作用(Han et al., 2012),絮体结构特征可采用絮体大小、絮体形状、絮体密实程度和絮体单位悬浮固体内总细丝长度等表征(Costa et al., 2013; Wilén et al., 2003; Nasser,2014; Walaszek and Ay, 2006).絮体大小、形状反映污泥对污染物吸收与降解性能,絮体孔隙率反映絮体内部结构,往往直接影响废水的传质从而影响污水处理效果,孔隙率的大小还反映污泥的脱水沉降性(Li et al., 2008).丝状菌对活性污泥絮体结构的形成与污泥沉降性起着重要作用(Mesquita et al., 2011; Turtin et al., 2006).絮体大小和形状的演化能够用来描述絮体形成情况(李振亮等,2013),从而从微观层面反映污泥成长成熟特征.
活性污泥法废水纯氧曝气处理时,纯氧压力高于空气中氧的分压,可显著提高氧的转移速率,改变工艺技术参数(Chen et al., 2003; Zupančič and Roš,2008; Rodríguez et al., 2012).前人研究发现纯氧曝气活性污泥法具有高有机负荷、高污染去除性能,可显著提高污泥沉降速率和改善污泥脱水性能,系统运行的稳定性、抗冲击能力强.而这些宏观工艺参数的改变都是系统微观特征(微生物种群、絮体结构)变化的结果,然而,对纯氧曝气活性污泥法中絮体微观结构特征及其变化的研究未见报道.
为了探索纯氧曝气活性污泥培养过程中絮体结构变化,本研究采用纯氧曝气序批式反应器(SBR)直接培养和驯化活性污泥絮体.通过絮体显微图像分析,考察直接培养和驯化过程中絮体大小、形状、密实程度和单位悬浮固体内总细丝长度等特征的变化规律,为更好地培养纯氧曝气污水处理活性污泥提供微观分析技术基础.
2 材料与方法(Materials and methods) 2.1 活性污泥培养污泥培养采用柱状反应器,底面直径7.20 cm,高度92.00 cm,有效容积3.20 L,氧气罐供氧,供气量为0.1 L · min-1,培养过程中污水中溶解氧保持在6.00—8.00 mg · L-1.试验分成两组:第1组反应器中不投加接种污泥,采用生活污水直接培养法培养活性污泥,生活污水取自安徽工业大学污水管,污水中添加葡萄糖、NH4Cl和KH2PO4以控制碳氮磷比为100 ∶ 5 ∶ 1,进水COD、NH3-N、TP分别为(1000.00±100.00)mg · L-1、(50.00±10.00)mg · L-1、(5.00±2.00)mg · L-1.运行周期为720 min,其中排水、进水5 min、曝气600 min、沉降115 min.另一组反应器采用接种污泥法驯化活性污泥,接种污泥取自马鞍山某污水处理厂二沉池(污泥浓度(MLSS)为4744.00 mg · L-1),对取回的污泥进行絮凝沉降,取出沉降性良好的污泥作为接种污泥,使用污水和运行方式与第1组相同.运行过程中均不排泥.
2.2 污泥絮体结构特征参数的测量絮体大小、形状、密实程度和丝状菌指数分别以当量直径(Deq)、规则度(Rd)、孔隙率(Po)和单位悬浮固体内总细丝长度(Ftl)来表征.Deq和Ftl计算参见文献(Costa et al., 2013).
规则度的计算以圆为参照物,设圆为完全规则形状,将在显微镜观察面上投影面积与圆相同的污泥絮体周长与圆的周长相比较,比值越接近于1,说明絮体形状越规则.具体公式如下:

孔隙率的计算根据孔隙是造成絮体结构松散的主要原因,将絮体投影面内孔隙面积比上絮体总面积,比值越大,说明絮体结构越松散.公式如下:

以上参数均利用显微分析技术测量(Costa et al., 2013; 李振亮等,2013).在曝气条件下,从反应器中部量取一定体积的活性污泥,混匀后使用带有刻度的胶头滴管滴取0.05 mL的污泥样品于载玻片中央,盖上盖玻片置于显微镜(奥林巴斯BX53,日本)载物台上,显微镜接数码相机(明美Mshot DC30,中国),并用配套的软件(明美MShot Digital Imaging System,中国)对载玻片逐行拍摄采集絮体图片,并保存为1024×768像素的JPEG格式图像.一个载玻片采集图像数为80张左右,其中含有絮体320个左右,分析时取自平均值.利用Image-pro Plus图像分析软件对采集的图片进行对比度、颜色饱和度、HSI测量区域选择等预处理,然后选择测量参数(面积、孔隙面积、周长、丝状菌长度),测量值导出到Excel中,最后计算出每个絮体结构特征参数值.
显微镜拍摄采集絮体图片时,观察污泥絮体中原生动物、后生动物,参照图谱(沈韫芬等,1990)鉴别计数.
3 结果与讨论(Results and discussion) 3.1 活性污泥培养阶段确定污泥浓度(MLSS)是活性污泥的基本特征.纤毛虫是活性污泥系统重要的指示原生动物之一,其在活性污泥中存在周期最长,且细胞体积大,便于鉴别计数等优势(Luna-Pabello et al., 1990; Abraham et al., 1997; Lee et al., 2004; Madoni,2005),因此试验中将MLSS与纤毛虫的密度变化作为污泥直接培养、驯化过程阶段划分的依据.
污泥培养过程中,MLSS变化如图 1所示.直接培养过程中MLSS从无到有,缓慢增长,22 d后指数式快速增长到3941.00 mg · L-1.直接培养1~7 d系统内原生动物的优势种为鞭毛虫,不存在纤毛虫.第8 d开始出现纤毛虫,并大量繁殖成为优势种(22 d密度达到938 ind. · L-1).第23 d系统内开始出现后生动物(轮虫、线虫等),由于捕食作用导致纤毛虫数量开始减少并在35 d时相对稳定在220 ind. · L-1左右.35 d后形成以固着型纤毛虫为优势种的微型动物种群,变化不大,此时COD去除率达到95.10%,可认为污泥培养基本完成.因此,试验中将1~7 d、8~22 d、23~35 d分别确定为污泥直接培养的初期、中期、后期.
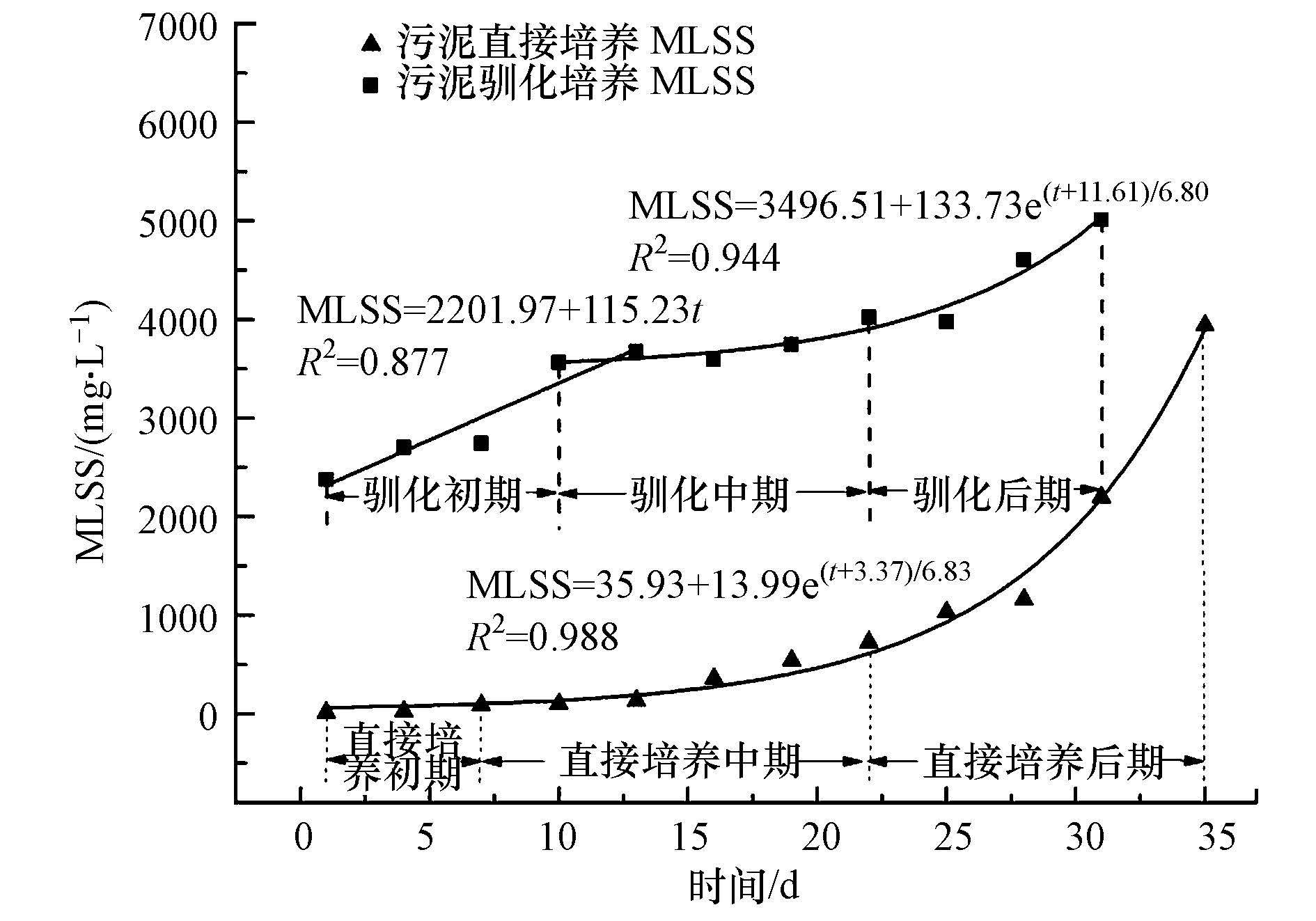 |
| 图1 污泥培养过程中MLSS变化 Fig.1 The MLSS change during the process of activated sludge culture |
污泥驯化培养过程中,从开始驯化到第10 d,MLSS呈线性增长趋势,10 d后也以指数方式增长,整个驯养过程MLSS增加了2637.00 mg · L-1,增长量比污泥直接培养法少1290.00 mg · L-1,总的增长率低于直接培养法.存在一定数量纤毛虫(25 ind. · L-1)的接种污泥在缓慢适应新环境过程中,系统内纤毛虫数量先小幅度增加(238 ind. · L-1)后又减少到初始值.第11 d开始纤毛虫数量逐步增加到22 d最大值(1575 ind. · L-1).第23 d系统内开始出现后生动物,纤毛虫数量开始降低,并在31 d时相对稳定在220 ind. · L-1左右,此时,COD去除率达到97.31%,可认为污泥驯化完成.因此,试验中将1~10 d、11~22 d、22~31 d分别确定为污泥驯化的初期、中期、后期.
因此,直接培养初期与驯化培养初期、中期时间有所差异,但总时间相同.由于直接培养的后期比驯养培养长(4 d),直接培养污泥需要更长的时间达到系统稳定.
3.2 活性污泥直接培养和驯化过程中絮体结构变化 3.2.1 絮体结构大小活性污泥直接培养、驯化培养过程中絮体大小变化如图 2所示(图中标准差反映不同大小的絮体结构分布范围,图 3、图 4误差棒意义相同).活性污泥直接培养过程中絮体Deq呈现出不断增长的趋势(从1.00 μm到250.90 μm).培养初期絮体Deq增长速度较快,中期增长缓慢,后期又快速增长.这是由于培养初期污水中营养丰富,微生物量少,微生物快速生长、聚集形成污泥絮体并快速增大;培养中期,微生物大量繁殖,造成污水中营养限制,微生物及其生长载体的污泥絮体增长缓慢,Deq变化比较平稳;培养后期,系统中存在大量污泥絮体,这些小的污泥絮体通过生物絮凝作用形成大絮体,使得絮体Deq迅速增大.
 |
| 图2 污泥培养过程中絮体Deq变化 Fig.2 The change of floc Deq during the activated sludge culture |
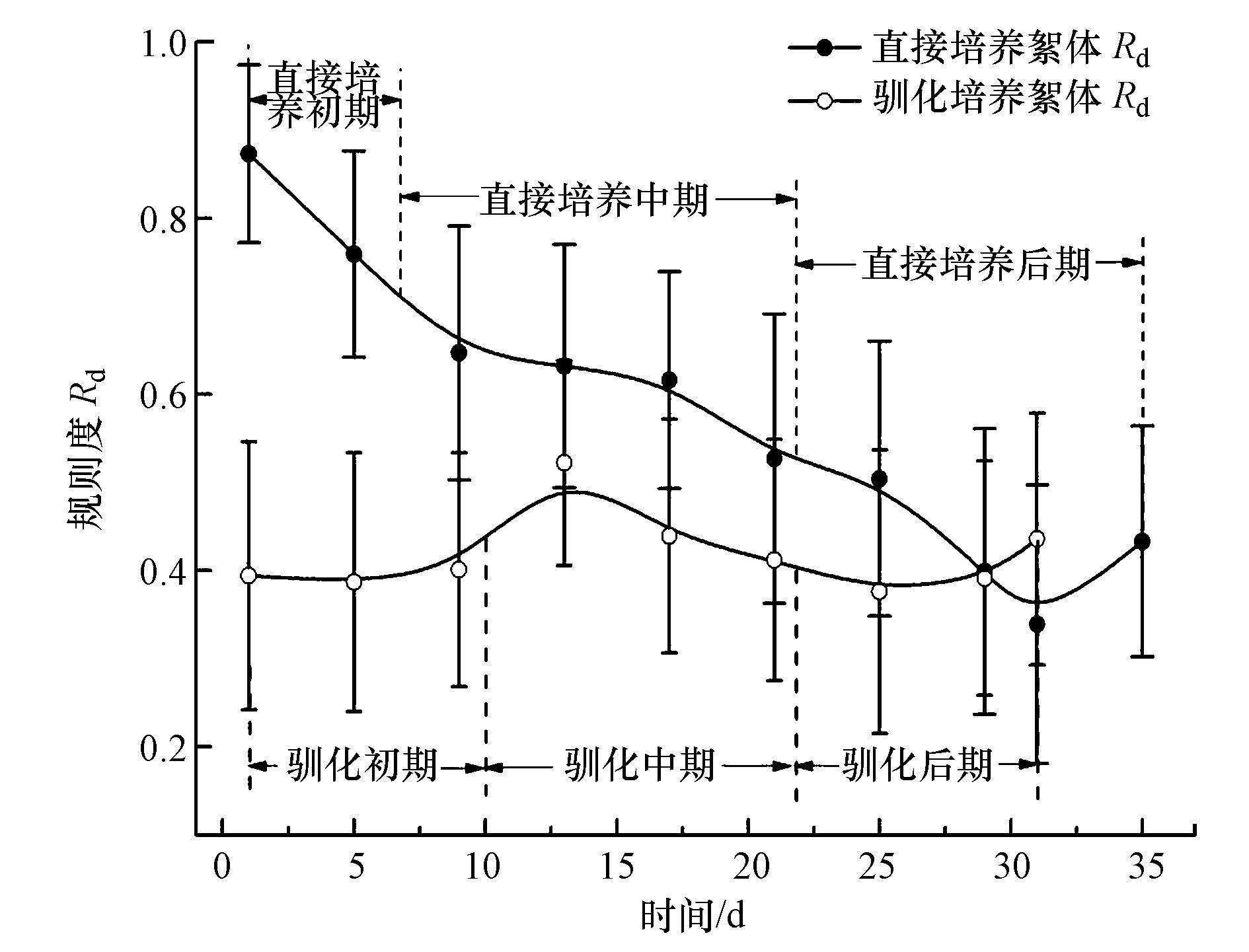 |
| 图3 污泥培养过程中絮体Rd变化 Fig.3 The change of floc Rd during the activated sludge culture |
污泥驯养过程中,絮体Deq整体也呈现出增长趋势.但在驯养初期絮体Deq由开始的196.00 μm先降低到111.40 μm,中后期絮体Deq呈现增长趋势,逐步增大到31 d的281.50 μm.这是由于驯化污泥取回前在无曝气、无营养物质的二沉池内经过长时间停留,絮体内微生物长期处于失活状态.在取泥、 运输和絮凝沉降过程中,剪切力使得污泥絮体结构强度又被大大减弱(Jarvis et al., 2005),致使污泥附着的原生动物游离出絮体.这些游离的原生动物在污泥系统内运动捕食,导致大量絮体解体,絮体Deq逐步减小.驯化中期,絮体上附着菌大量繁殖,微生物的新陈代谢物质附着于越来越密实的絮体上,絮体Deq迅速增大.驯化后期,絮体附着物和细菌分泌的胞外聚合物(EPS)使絮体表面更松散,絮体开始出现解体,导致絮体Deq减小.
两种方法培养的污泥絮体颗粒大小均呈增长趋势,但增长速率有所不同,直接培养法污泥絮体增长速率比驯化法快,成熟后驯化培养的污泥絮体颗粒略大.
3.2.2 絮体形状变化培养过程中絮体规则度(Rd)变化规律如图 3所示,污泥直接培养过程中絮体Rd不断减小,从0.873减小到0.339,后期稍有回升.镜检发现,在最初形成的絮体大多数为圆形,随着絮体的生长,絮体结构逐渐变成中期的椭圆形、长条形、垂丝形等松散结构,再演变成后期的内部结构密实,表面形状不规则的絮体(图 4a~c).而驯化污泥絮体Rd变化不大,在0.400~0.520内波动.驯化初期多为不规则絮体,中期形状稍有改观,后期也是内部结构密实,表面形状各异的絮体(图 4d~f).
 |
| 图4 污泥培养过程中絮体形状变化(注:直接培养过程絮体,a~c分别为培养5、21、35 d;驯化培养过程絮体d~f为分别为培养5、21、31 d) Fig.4 The change of floc shapes during the process of activated sludge culture(Flocs in the process of direct culture,a~c from 5、21、31 d respectively; flocs in the process of domestication,d~f from5、21、31 d respectively) |
絮体Rd的变化不是独立的,它与粒径变化密切联系.随着絮体粒径增大,絮体形状越不规则,这一结论与Vahedi和Gorczyca(2011)的研究结果相一致.根据Deq将絮体划分为小絮体(Deq﹤130.00 μm)、大絮体(Deq>130.00 μm),小絮体Rd均大于0.520,大絮体Rd均小于该值.
两种方法培养的成熟污泥絮体规则度大小相似,但变化规律不同,直接培养污泥絮体Rd逐步减小,而驯化污泥是0.400上下波动.
3.2.3 絮体密实程度变化污泥培养过程中絮体孔隙率(Po)变化如图 5所示.污泥直接培养絮体Po变化范围小(0.008~0.049),培养初期、中期絮体Po呈现增大趋势,后期有一定的波动性.驯化污泥絮体Po受絮体的解体和重絮凝影响大,其变化范围较大(0.030~0.120),驯化初期、后期絮体Po呈现减小趋势,中期呈增长趋势.
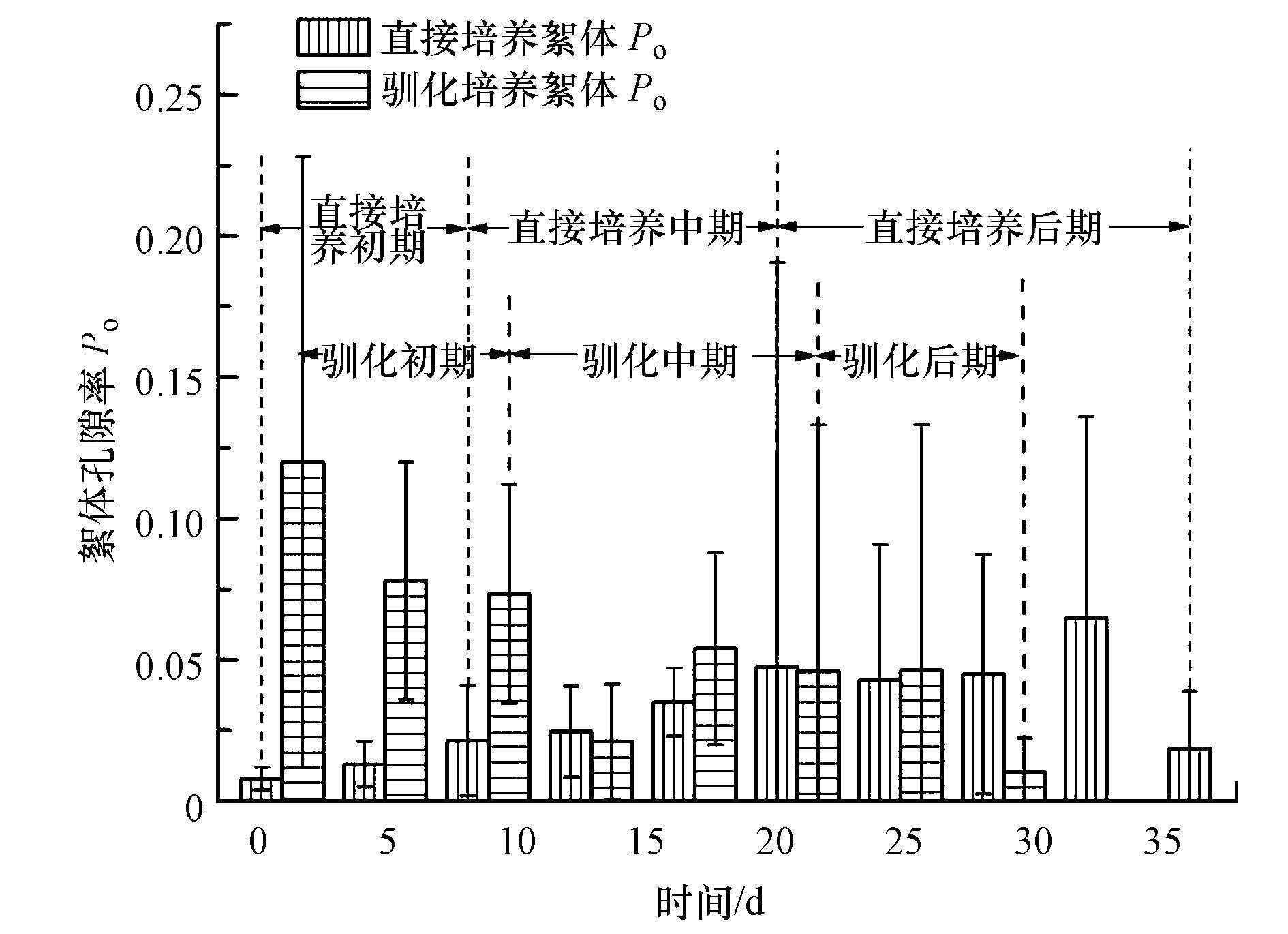 |
| 图5 污泥培养过程中絮体Po变化 Fig.5 The change of floc Po during the process of activated sludge culture |
污泥絮体Deq和Po变化(图 2、图 5)表明:絮体Deq小于104.00 μm时,随着絮体粒径的增大,絮体孔隙率不断增大.根据斯莫卢霍夫斯基(Sposito,1997)的絮团-絮团动力学凝聚过程可以理解,絮体与絮体在碰撞凝聚时必然存在孔隙,凝聚的越多孔隙越多,因此随着絮体粒径的增大,絮体孔隙率也越大.但当絮体Deq大于104.00 μm时,由于挤压作用,随着絮团-絮团不断絮凝,形成的絮体内部结构紧密,孔隙减小(Yang and Li, 2009; Sheng et al., 2010; Wang et al., 2014),因此孔隙率不随絮体粒径变化.
因此,直接培养初期和中期絮体Po呈增大趋势,驯化培养初期和后期呈减小趋势,培养成熟后,直接培养的污泥絮体Po小于驯化污泥絮体Po.
3.2.4 絮体丝状菌指数变化污泥培养过程中的絮体丝状菌指数(Ftl)变化如图 6所示.直接培养前16 d和驯化培养整个过程,絮体内丝状菌含量少(0~0.40 μm · mg-1).这是由于本研究采用纯氧曝气氧含量高,且营养配比合理,而丝状菌适于在低溶解氧或低负荷环境生长(Martins et al., 2004),但是污泥直接培养过程的中期,系统中开始出现大量丝状菌(图 4b),到污泥培养的第31 d达到絮体Ftl最大值(30.50 μm · mg-1),污泥容积指数(SVI)为41.90 mL · g-1.产生这一现象的原因,主要由于培养污泥絮体在中后期絮体粒径增大,结构密实,导致营养物质、氧气很难传输到絮体内部,抑制了常规微生物的生长,丝状菌获得更多的营养,快速生长;丝状菌的生长反过来又促进营养物质、氧气在絮体内部的流动,致使污泥培养成熟后絮体内丝状菌数量迅速减少,试验第35 d系统内丝状菌指数已恢复到3.00 μm · mg-1.当然,直接培养后期由于丝状菌大量存在,增加了絮团-絮团絮凝的能力(Martins et al., 2004; 龙腾锐等,2000),从而促进絮体Deq迅速增大.
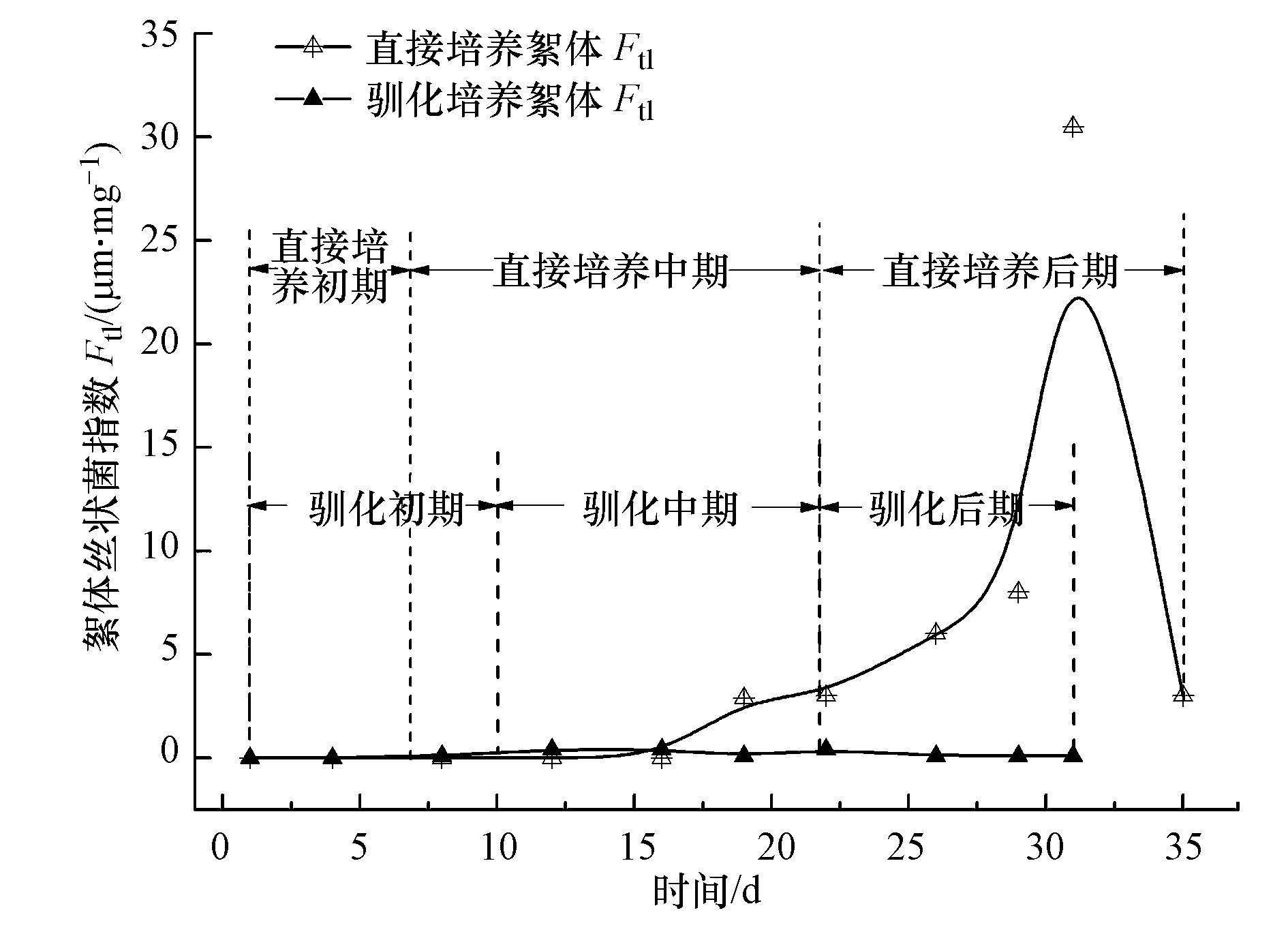 |
| 图6 污泥培养过程中絮体Ftl变化 Fig.6 The change of floc Ftl during the process of activated sludge culture |
活性污泥絮体结构各特征间相互影响、相互制约.直接培养污泥、驯化污泥的絮体结构特征参数Pearson相关性如图 7所示.
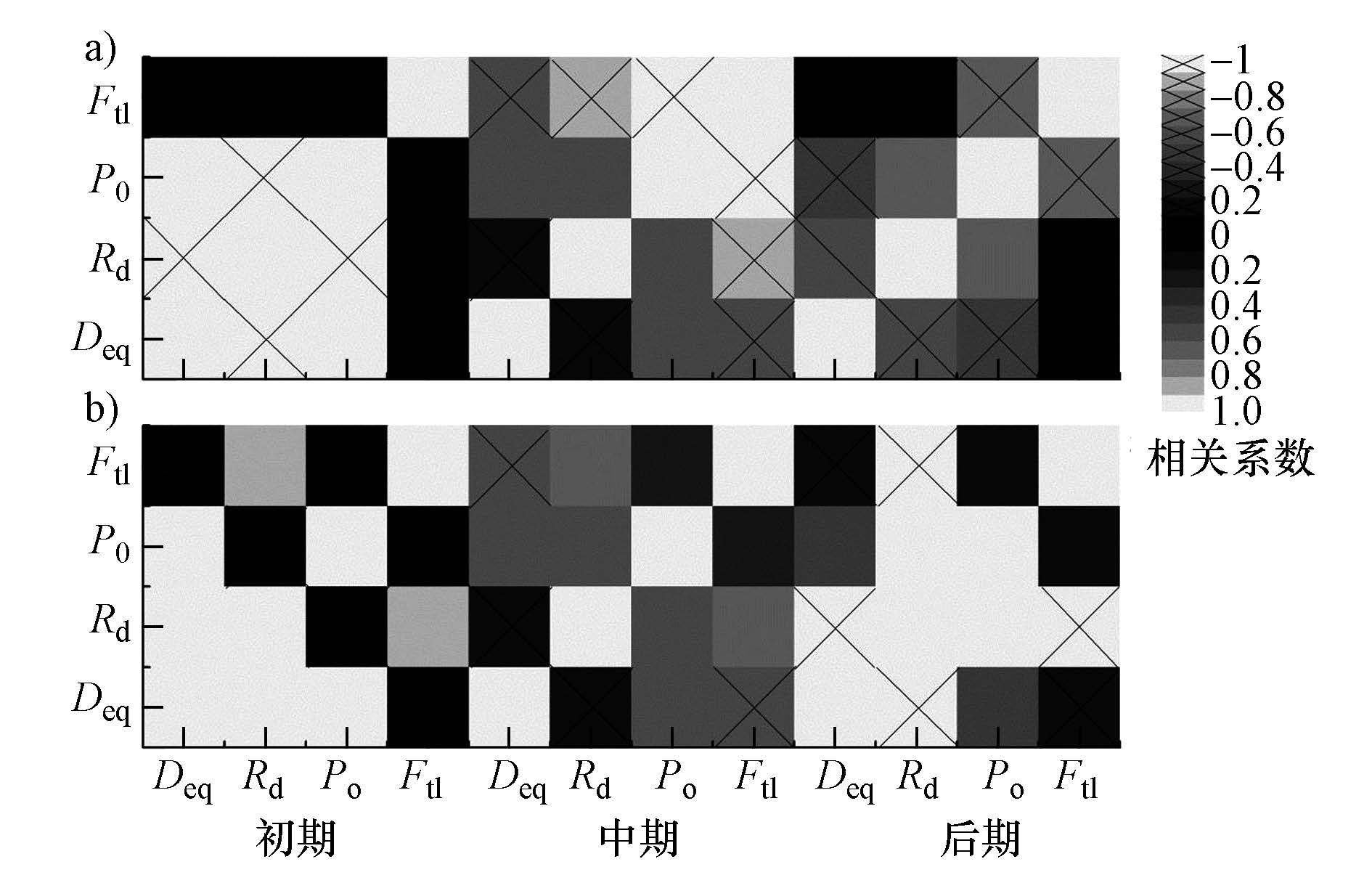 |
| 图7 不同培养阶段污泥絮体结构特征参数相关系数矩阵图(注:a. 直接培养絮体,b. 驯化培养污泥) Fig.7 The correlation coefficient matrix graph of floc structure parameters at different stage(a. sludge direct culture; b. sludge domestication) |
活性污泥直接培养初期,絮体Deq与Po显著正相关(r=0.996,p<0.05),因为此阶段的絮体大多为微小絮体(Deq仅为1.00 μm),絮体的数量较少,不容易发生微絮体间的凝聚现象,形成的孔隙也小.絮体Rd和Deq、Rd和Po显著负相关,相关系数r分别为-0.945(p<0.05),-0.97(p<0.05).因为在污泥培养系统刚启动时系统内无丝状菌,随着微絮体-微絮体凝聚成絮体过程中,絮体Deq不断增大,絮体内部孔隙越来越大,絮体形状也越来越不规则.直接培养中期,丝状菌对絮体结构起了较大作用,絮体Ftl与絮体Po和Rd都显著负相关,相关系数r分别达到-0.959(p<0.05)、-0.875(p<0.05).由于丝状菌从絮体中伸出来,向各个方向随机地生长繁殖,促进絮体的不规则生长,使絮体内部松散,孔隙增大,外形轮廓更加不规则.直接培养后期,各参数间相关性均不十分显著,其中絮体Po和Rd的正相关性较大(r=0.655,p<0.05),絮体Po和Ftl负相关性较大(r=-0.638,p<0.05).和中期不同,尽管培养后期系统内丝状菌仍大量存在,但大多丝状菌变得很长,伸出絮体外长度可达到絮体Deq的2~3倍,这些絮体外丝状菌对絮体结构的作用减小.
污泥驯化初期,絮体Deq和Rd、Deq和Po均显著正相关,r分别为1(p<0.05)、0.958(p<0.05).比较图 2、图 3中污泥驯化初期絮体Deq和絮体Rd变化规律可知,尽管絮体Rd随着絮体Deq的减小而减小,但絮体Rd减小的幅度很小.絮体孔隙大小随着絮体Deq的减小而大幅度减小,因为絮体-絮体解体后,孔隙消失,絮体Po减小.驯化中期各参数间相关性都不十分显著,其中只有Ftl和Rd的r大于0.6(p<0.05),少量丝状菌影响絮体规则度.驯化后期,对絮体结构起较大作用的是絮体Rd,它与其他参数均显著相关,其中与絮体Deq、Ftl显著负相关(r= -1,p<0.05),与Po显著正相关(r=1,p<0.05).
4 结论(Conclusions)1)直接培养污泥过程中絮体Deq不断增大,从1.00 μm 增加到250.90 μm;而驯化污泥絮体Deq是先减小后增大,Deq由196.00 μm减小到111.40 μm,然后又不断增大.驯化培养成熟后的污泥絮体颗粒比直接培养法略大.
2)直接培养污泥絮体Rd在培养过程中不断减小,从0.873减小到0.339,絮体形成过程中,絮体的形状由圆形逐步变成不规则形状.而驯化污泥絮体Rd变化不大,在0.400~0.520范围内波动,絮体逐步从不规则形状的松散结构变成内部结构密实,表面形状各异的絮体.
3)直接培养污泥絮体Po变化范围小,从0.008~0.049内波动,初期和中期絮体Po呈现出随粒径增大而增大的趋势.驯化污泥絮体Po受絮体的解体和重絮凝影响大,导致变化范围广,初期和后期絮体Po呈现减小趋势.直接培养法得到的污泥结构更加密实.
4)污泥直接培养中期开始出现丝状菌,并在后期达到30.50 μm · mg-1,随即又恢复到3 μm · mg-1;污泥驯化整个过程中系统内均无大量丝状菌出现.
5)污泥直接培养初期絮体Deq与Po显著正相关,Rd与Deq、Po显著负相关;中期絮体Ftl与Po、Rd都显著负相关,丝状菌作用较大;后期各参数间相关性均不十分显著.污泥驯化初期,絮体Deq与Rd、Po均显著正相关,中期各参数间相关性不显著.驯化后期Rd起较大作用,与其他参数均显著相关.
6)两种培养方法各有优势,驯化培养污泥MLSS增长速度优于直接培养法,适应于污水处理污泥的快速培养需要;直接培养法絮体结构优于驯化培养法,结构稳定,适应于高质量污泥的培养需要.
| [1] | Abraham J V, Butler R D, Sigee D C. 1997. Ciliate populations and metals in an activated-sludge plant[J]. Water Research, 31(5):1103-1111 |
| [2] | Chen J H, Hsu Y C, Chen Y F, et al. 2003. Application of gas-inducing reactor to obtain high oxygen dissolution in aeration process[J]. Water Research, 37(12):2919-2928 |
| [3] | Costa J C, Mesquita D P, Amaral A L, et al. 2013. Quantitative image analysis for the characterization of microbial aggregates in biological wastewater treatment:a review[J]. Environmental Science and Pollution Research, 20(9):5887-5912 |
| [4] | Han Y P, Liu J X, Guo X S, et al. 2012. Micro-environment characteristics and microbial communities in activated sludge flocs of different particle size[J]. Bioresource Technology, 124:252-258 |
| [5] | Jarvis P, Jefferson B, Gregory J, et al. 2005. A review of floc strength and breakage[J]. Water Research, 39(14):3121-3137 |
| [6] | Lee S, Basu S, Tyler C W, et al. 2004. Ciliate populations as bio-indicators at Deer Island Treatment Plant[J]. Advances in Environmental Research, 8(3/4):371-378 |
| [7] | Li J F, Li Y Z, Ohandja D G, et al. 2008. Impact of filamentous bacteria on properties of activated sludge and membrane-fouling rate in a submerged MBR[J]. Separation and Purification Technology, 29:238-243 |
| [8] | 李振亮, 张代钧, 卢培利, 等. 2013. 活性污泥絮体粒径分布与分形维数的影响因素[J]. 环境科学, 34(10):3975-3980 |
| [9] | 龙腾锐, 何强, 林刚. 2000. 活性污泥中丝状菌与絮体结构的关系研究[J]. 中国给水排水, 16(2):5-8 |
| [10] | Luna-Pabello V M, Mayén R, Olvera-Viascan V, et al. 1990. Ciliated protozoa as indicators of a wastewater treatment system performance[J]. Biological Wastes, 32(2):81-90 |
| [11] | Madoni P. 2005. Ciliated protozoan communities and saprobic evaluation of water quality in the hilly zone of some tributaries of the Po River (northern Italy)[J]. Hydrobiologia, 541(1):55-69 |
| [12] | Martins A M P, Pagilla K, Heijnen J J, et al. 2004. Filamentous bulking sludge-a critical review[J]. Water Research, 38(4):793-817 |
| [13] | Mesquita D P, Amaral A L, Ferreira E C. 2011. Identifying different types of bulking in an activated sludge system through quantitative image analysis[J]. Chemosphere, 85(4):643-652 |
| [14] | Nasser M S. 2014. Characterization of floc size and effective floc density of industrial papermaking suspensions[J]. Separation and Purification Technology, 122:495-505 |
| [15] | Rodríguez F A, Reboleiro-Rivas P, Osorio F, et al. 2012. Influence of mixed liquid suspended solids and hydraulic retention time on oxygen transfer efficiency and viscosity in a submerged membrane bioreactor using pure oxygen to supply aerobic conditions[J]. Biochemical Engineering Journal, 60:135-141 |
| [16] | 沈韫芬, 章宗涉, 龚循矩, 等. 1990. 微型生物监测新技术[M]. 北京:中国建筑工业出版社 |
| [17] | Sheng G P, Yu H Q, Li X Y. 2010. Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems:A review[J]. Biotechnology Advances, 28(6):882-894 |
| [18] | Sposito G. 1997. Scaling invariance of the von Smoluchowski rate law[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 120(1/3):101-110 |
| [19] | Turtin I, Vatansever A, Sanin F D. 2006. Phosphorus defficiency and sludge bulking[J]. Environmental Technology, 27(6):613-621 |
| [20] | Vahedi A, Gorczyca B. 2011. Application of fractal dimensions to study the structure of flocs formed in lime softening process[J]. Water Research, 45(2):545-556 |
| [21] | Walaszek W, Ay P. 2006. Porosity and interior structure analysis of pellet-flocs[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 280(1/3):155-162 |
| [22] | Wang B B, Chang Q, Peng D C, et al. 2014. A new classification paradigm of extracellular polymeric substances (EPS) in activated sludge:Separation and characterization of exopolymers between floc level and microcolony level[J]. Water Research, 64:53-60 |
| [23] | Wilén B M, Jin B, Lant P. 2003. Impacts of structural characteristics on activated sludge floc stability[J]. Water Research, 37(15):3632-3645 |
| [24] | Yang S F, Li X Y. 2009. Influences of extracellular polymeric substances (EPS) on the characteristics of activated sludge under non-steady-state conditions[J]. Process Biochemistry, 44(1):91-96 |
| [25] | Zupančič G D, Roš M. 2008. Aerobic and two-stage anaerobic-aerobic sludge digestion with pure oxygen and air aeration[J]. Bioresource Technology, 99(1):100-109 |
 2016, Vol. 36
2016, Vol. 36


