2. 环境污染过程与基准教育部重点实验室(南开大学), 天津 300071;
3. 农业部农产品质量安全检测与评价重点实验室, 广州 510640
2. Key Laboratory of Pollution Processes and Environmental Criteria(Nankai University), Ministry of Education, Tianjin 300071;
3. Key Laboratory of Testing and Evaluation for Agro-product Safety and Quality, Ministry of Agriculture, Guanghou 510640
随着镉(Cd)在电镀、化工、电子和核工业等领域的广泛应用,Cd对农田土壤环境的污染也日益严重.农田土壤中的Cd不仅影响作物的产量和品质,还可通过食物链影响人类的健康(张会民等,2006).农产品中Cd的残留和富集给人类健康带来极大的安全隐患.更危险的是,土壤Cd污染具有不可逆转性,被Cd污染的土壤可能要100~200年,甚至更长的时间才能够恢复(陈兴兰和杨成波,2010).2014年4月国家环境保护部和国土资源部公布的全国土壤污染状况调查公报显示:Cd的点位超标率最高,正式被确定为中国土壤的首要污染物(环境保护部和国土资源部,2014).因此,迫切需要研发有效的土壤Cd污染治理和控制技术.
硒(Se)是人和动物必需的微量元素(Ellis et al., 2004),也是植物生长的有益元素.近年来有关Se在植物生长中作用的研究越来越多,研究指出:土壤施Se或作物喷Se可以起到很好的增产效果(昝亚玲等,2010).此外,国内外学者围绕Se增强植物对重金属的抗性、降低重金属在植物体内富集等领域做了大量研究(彭玲等,2015;Prado et al., 2010; Qing et al., 2015).研究结果表明,Se有助于缓解重金属对植物的毒害作用(吕选忠等,2006; Yadav, et al., 2010).
目前,低浓度的硒可缓解重金属(如Cd、Cr等)的胁迫已被证实(铁梅等,2014; Sun et al., 2010).硒缓解植物镉毒害的研究主要集中在植物体内(Cartes et al., 2010; Qing et al., 2015).硒对植物根际土壤镉化学行为的影响及其与植物镉毒缓解作用的关系研究少见报道.本研究以酸性黄棕壤为供试土壤,构建人工Cd污染土壤试验系统.以小白菜为供试试验植物,采用根箱培养的方式,研究了不同浓度硒对镉胁迫下小白菜生长、光合特性及根际土壤镉化学行为特征的影响,旨在从叶片光合特性及根际土壤Cd形态差异方面探索Se对菜地Cd污染的调控机理,并为菜地Cd污染控制与蔬菜安全生产提供科学依据.
2 材料与方法(Materials and methods) 2.1 供试土壤制备供试土壤为南方酸性黄棕壤,有机质2.06%,碱解氮72.37 mg · kg-1,速效磷31.38 mg · kg-1,速效钾48.86 mg · kg-1,pH 4.6,有效Se 11.52 μg · kg-1,未检出Cd.
称取过20目筛的供试土壤并装盆,每盆3 kg,共计36盆.36盆土壤随机分成3组,每组12盆,分别添加外源Cd(2CdCl2 · 5H2O)0.00,0.50,5.00 mg · kg-1土(Cd以溶液的形式与过20目筛的风干土壤充分混匀),进行Cd的熟化,熟化时间为50 d(期间保持土壤水分含量60%左右).Cd熟化结束后,将以上各组再随机分成3小组,每组4盆.向每组添加不同浓度外源Se(由Na2SeO3 · 5H2O配置的Se溶液)至土壤Se浓度分别达到0.00,0.25,1.00 mg · kg-1.充分混匀,备用(薛瑞玲等,2011).
Se、Cd交互共设置9个处理,分别为CK(Cd0+Se0)、Cd0+Se0.25、Cd0+Se1.0、Cd0.5+Se0、Cd0.5+Se0.25、Cd0.5+Se1.0、Cd5.0+Se0、Cd5.0+Se0.25、Cd5.0+Se1.0.各处理4次重复.
2.2 施肥与管理试验选取十字花科植物的小白菜(Brassica chinensis L.)(白叶四月慢)为种植蔬菜,采用根箱(容量3 kg)栽培.将上述2.1节处理好的土壤配合各种养分元素一起混匀后装入根箱.所有矿质养分以溶液加入土壤,大量元素用量为N:0.20 g · kg-1、P2O5:0.15 g · kg-1、K2O:0.20 g · kg-1,肥源分别为尿素、磷酸二氢铵和硫酸钾;微量元素以每kg土壤加入1 mL阿农营养液(1000倍)进行补充.向根箱内室中播入小白菜种子,待小白菜发芽后,保留长势一致并在根箱中分布均匀的3棵幼苗进行培养,其余幼苗间苗后还土.实验使用去离子水作为灌溉水源,并将根箱放置在防雨棚内进行生长管理.
2.3 样品的获取待小白菜生长成熟后,以自封袋采集小白菜样品,并分别采集各根箱根际及非根际土壤样品.土壤样品采集时,为消除因空气中的沉降物和灌溉淋洗对试验产生的影响,去除根箱各室2 cm表层土壤和2 cm底层土壤.剩余的非根际土壤全部获取.由于黄棕壤质地粘重,不适合采用抖土法收集根际土壤,所以采集时取出根箱内室全部剩余土壤,去除根系等植物残体后获得根际土壤样品.土壤样品风干后混合均匀,磨取过20目筛和过100目筛的土样,待测.
2.4 测定项目与方法 2.4.1 植物样品中硒镉总量测定称取烘干的小白菜样品0.50 g于100 mL三角瓶中,加入10 mL高氯酸 ∶ 硝酸=1 ∶ 4的酸液,过夜后置于电热板加热,温度调为180~200 ℃;待瓶内黄色褪去加入10 mL 1 ∶ 1的盐酸,继续加热至黄色消褪,用去离子水洗出消化液,过滤定容至50 mL比色管中以原子吸收分光光度法和原子荧光光度法分别测得Cd和Se的含量.
2.4.2 土壤全镉的测定称取过100目筛的土样1.00 g于100 mL的三角瓶中,加入王水置于电热板加热,温度调至200 ℃左右;待王水消褪至无色后加入5 mL高氯酸,继续加热消解至瓶内白烟消散瓶内余酸2 mL左右时完成消化.用去离子水多次洗出消化液,过滤定容至50 mL比色管中以原子吸收分光光度计测得Cd含量.
2.4.3 植物样品光合作用特性的测定采用英国PPSystems公司生产的Ciras-2型便携式光合测定系统在10:00—12:00测定叶片的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr).测定时光强约600 μmol · m-2 · s-1,CO2浓度为390 μL · L-1,温度为25 ℃. 2.4.4 根际与非根际土壤镉各形态含量的测定 参照Tessier 5步连续提取法(Tessier et al., 1979),本试验在样品质量、试剂用量和处理时间方面进行了改进.取1.000 g供试土样,依表 1处理后吸取上清液定容至25 mL容量瓶,离心管中残余物加4 mL去离子水离心5 min后倒掉上清液供下步提取用.提取液中镉的质量分数用Z-2000型原子吸收分光光度计测定,试验中采用空白样和标准样控制实验数据质量.
| 表1 土壤重金属镉形态连续提取法 Table 1 Sequential extraction procedure of Cd in soil |
实验采用Excel和OriginPro 9进行数据处理和作图,采用PASW Statistics 18进行方差分析(ANOVA),应用LSD多重比较法进行P<0.05水平的显著性分析,多重比较结果以小写英文字母表示.
3 结果(Results) 3.1 镉胁迫下硒对小白菜生物量的影响不同浓度Cd胁迫下施硒对小白菜生物量的影响如图 1所示.由图 1可看出:在本实验浓度范围内,Cd胁迫并未显著影响到小白菜的生物量;不同浓度Cd胁迫下,随硒施用量的增加,小白菜生物量均呈现递增的趋势.其中,Cd浓度为5 mg · kg-1处理组,硒增产的效果最为显著,施用0.25和1.0 mg · kg-1 Se分别将小白菜生物量提高15.65%和21.39%.
 |
| 图1 镉胁迫下施硒对小白菜生物量的影响(注:上标小写字母完全不同表示p<0.05水平的显著性差异,下同) Fig.1 Effects of selenium on biomass of Chinese cabbage under cadmium stress |
Cd胁迫下Se对小白菜光合作用特性(光合速率、气孔导度、CO2浓度、蒸腾速率)的影响如表 2所示.由表 2可看出:随着Cd浓度的增大,小白菜叶片光合速率呈现递增的趋势.较对照组,0.50和5.0 mg · kg-1 Cd处理组分别增加0.85%和17.23%,后者达显著水平;各浓度Cd胁迫下,Se的施用均显著增加了小白菜光合速率,其中,0.50 mg · kg-1 Cd胁迫下,Se增加小白菜光合速率的效果最为显著,但0.25和1.0 mg · kg-1 Se处理间无显著差异.
| 表2 镉胁迫下硒对成熟期小白菜光合作用特性的影响 Table 2 Effect of selenium on the photosynthetic characteristics of Chinese cabbage in the mature period |
Cd胁迫下,随着Cd浓度的增大,小白菜叶片气孔导度无显著变化趋势.各浓度Cd胁迫下,Se的施用均增加了小白菜叶片的气孔导度,其中,5 mg · kg-1 Cd处理组,Se的施用使得气孔导度显著增加,0.25和1.0 mg · kg-1 Se处理之间无显著差异.
Cd胁迫下,随着Cd浓度的增大,小白菜叶片胞间CO2浓度呈显著降低的趋势.各浓度Cd胁迫下,Se的施用均未显著改变小白菜叶片的气孔导度.
Cd胁迫降低了小白菜叶片的蒸腾速率,但在本实验的浓度范围内,0.5和5 mg · kg-1 Cd处理组无显著差异.在不同浓度Cd污染下,Se的施用均显著增加了小白菜叶片的蒸腾速率,且随Se浓度的增加而增加;高浓度Cd胁迫下,Se对小白菜叶片蒸腾速率的增幅最为显著,但0.25和1.0 mg · kg-1 Se处理间无显著差异.
3.3 镉胁迫下硒对小白菜地上部镉含量的影响Cd胁迫下,Se的施用对小白菜地上部(可食用部位)Cd含量的影响如图 2所示.从图 2可看出:与对照相比,随着Cd浓度的增加,小白菜地上部Cd含量显著上升.Cd胁迫下,低浓度Se(0.25 mg · kg-1)的施用有效降低了小白菜地上部Cd含量,其中,0.5 mg · kg-1 Cd处理组,0.25 mg · kg-1 Se显著降低了小白菜地上部Cd含量;然而,1.0 mg · kg-1 Se显著增加了小白菜地上部Cd含量,这表明当Cd浓度较低时,过高浓度的Se处理对小白菜造成了损伤,增加了Cd离子进入小白菜体内的含量;在高浓度Cd(5.0 mg · kg-)处理组,Se的施用也基本表现出同样的富集规律.
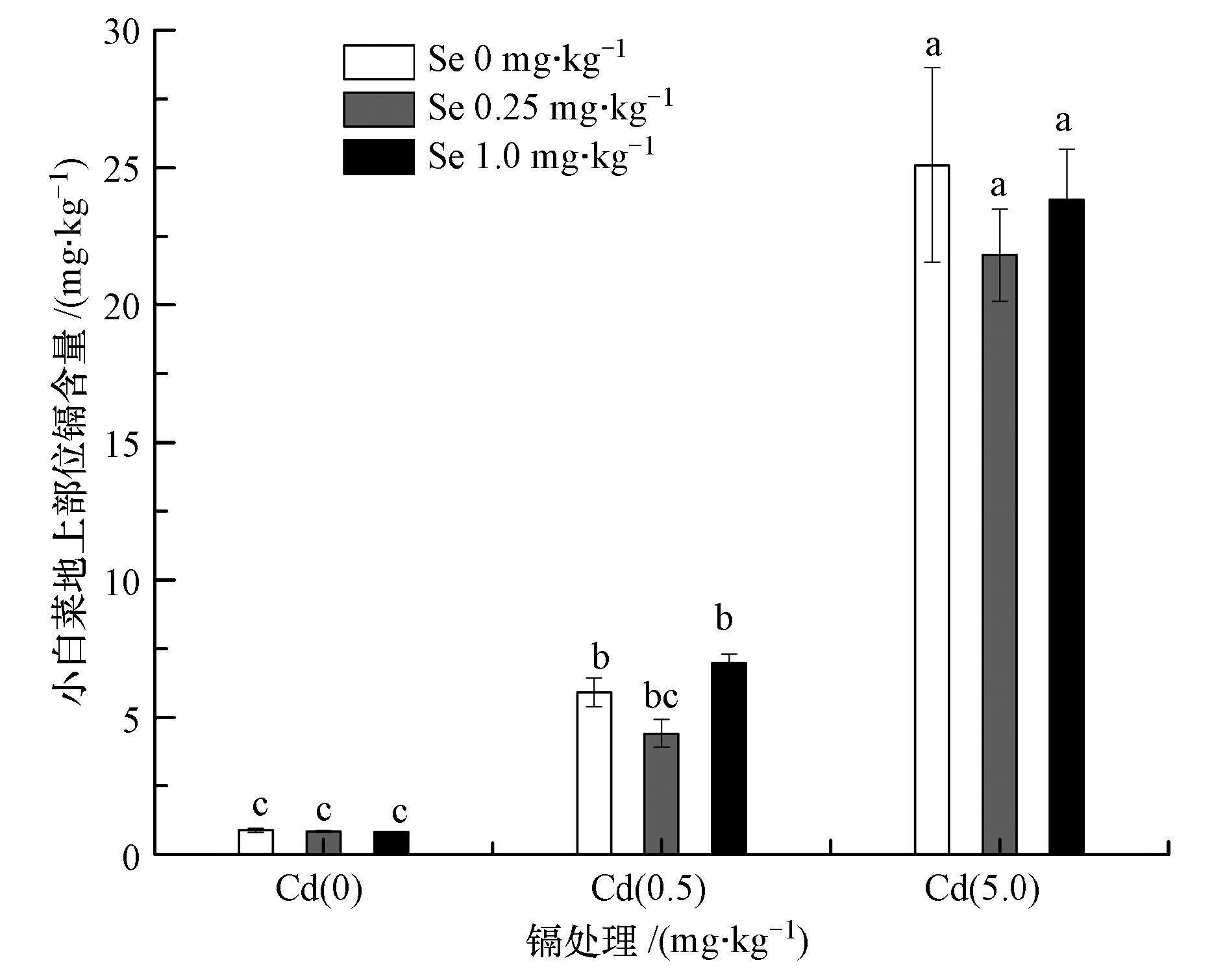 |
| 图2 镉胁迫下硒对小白菜地上部分镉含量的影响(注:图中数据分别在相同镉污染条件下进行差异性分析) Fig.2 Effect of selenium on the cadmium content of Chinese cabbage above ground under the stress of cadmium |
Se对Cd胁迫下小白菜根际土壤各形态Cd分布的影响如图 3所示.从图中可看出,对照组中Cd主要以残渣态存在,约占总Cd含量的85%.相比对照,无Se处理下:Cd污染浓度为0.5 mg · kg-1时,Cd形态含量分布为交换态>铁锰氧化物结合态>残渣态,其中,交换态Cd占到近80%;当Cd浓度达5.0 mg · kg-1时,各形态Cd含量分布依次为残渣态(50.55%)>交换态(36.26%)>铁锰氧化结合态(9.85%)>碳酸盐结合态(2.74%)>有机结合态(0.6%).
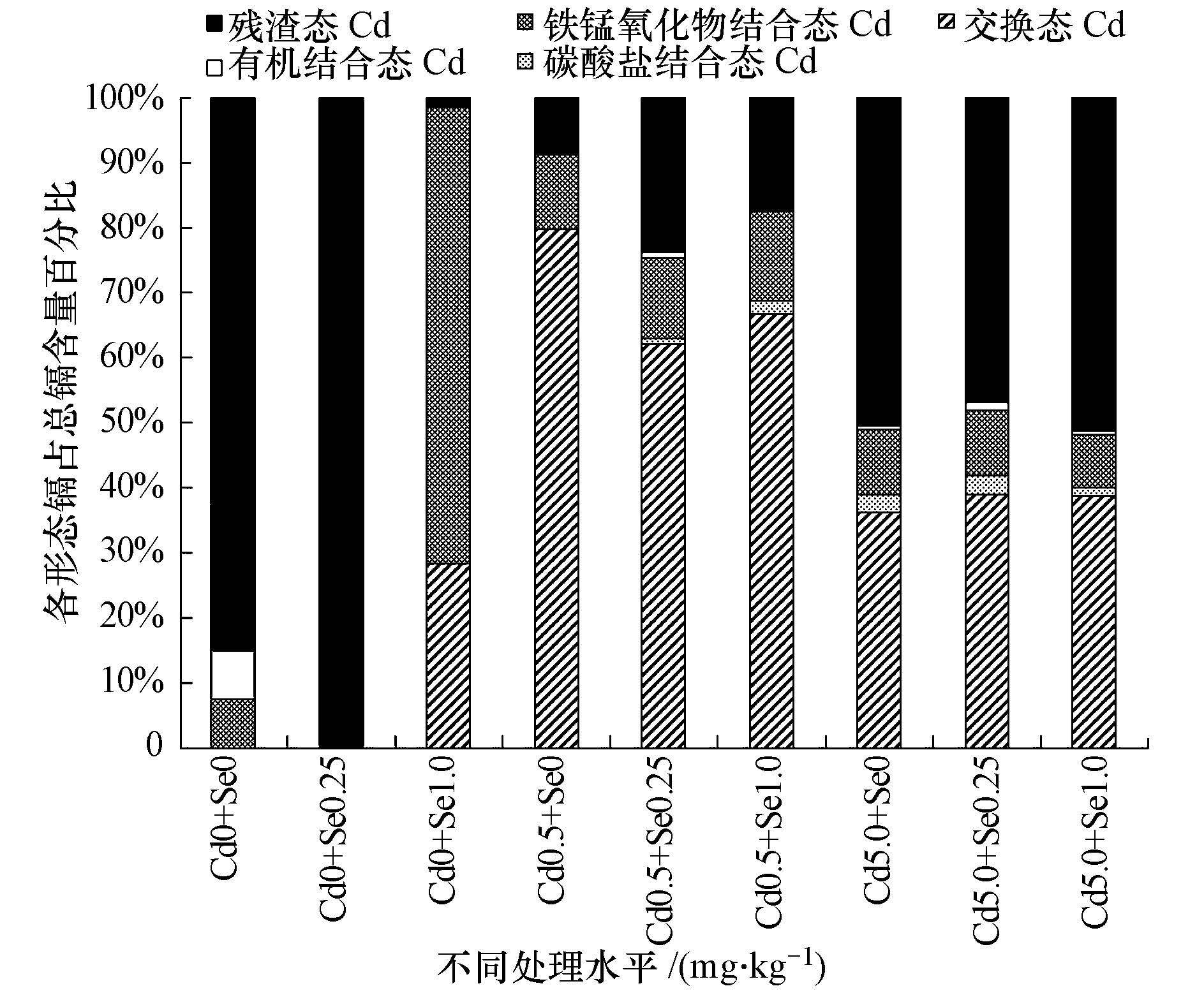 |
| 图3 根际土壤镉形态分布 Fig.3 Distribution of different forms of cadmium in the rhizosphere soil |
Cd污染浓度为0.5 mg · kg-1时,施用0.25 mg · kg-1 Se处理与无Se处理组比,交换态Cd从79.77%降为62.06%,达显著水平,残渣态Cd从8.74%显著增至23.81%;施用1.0 mg · kg-1 Se处理中残渣态Cd有减少趋势,但含量高于无Se处理组,交换态Cd有增加趋势,但含量低于无Se处理组;各Se水平处理下铁锰氧化物结合态Cd含量均未发生明显变化.
Cd污染浓度为5.0 mg · kg-1时,随着Se施用量的增加,残渣态、铁锰氧化物结合态、交换态Cd含量均未发生明显变动;与无Se处理比,Se的施用量为0.25 mg · kg-1时,有机结合态Cd和碳酸盐结合态Cd的含量分别增加了128.33%、10.58%,Se的施用量为1.0 mg · kg-1时,有机结合态Cd和碳酸盐结合态Cd分别降低了16.67%、52.19%.
3.4.2 硒对镉胁迫下非根际土壤镉形态的影响Se对Cd胁迫下非根际土壤Cd形态分布的影响如图 4所示.从图中可看出:对照组中镉均以残渣态形式存在.与对照相比,当Cd污染浓度为0.5 mg · kg-1时,Cd形态含量分布表现为交换态(50.58%)>残渣态(23.84%)>铁锰氧化物结合态(17.77%)>碳酸盐结合态(5.86%)>有机态(1.95%);当Cd污染浓度达5.0 mg · kg-1时,Cd各形态含量分布表现为残渣态(47.28%)>交换态(38.82%)>铁锰氧化结合态(10.95%)>碳酸盐结合态(2.05%)>有机结合态(0.89%).随Cd污染浓度的增加,Cd从其他形态向残渣态转化.
 |
| 图4 非根际土壤镉形态分布 Fig.4 Distribution of different forms of cadmium in the non-rhizosphere soil |
Cd污染浓度为0.5 mg · kg-1时,施用0.25 mg · kg-1 Se处理与无Se处理组比,交换态Cd含量由50.58%降至28.43%,碳酸盐态由5.86%降至1.76%,残渣态由23.84%增至46.75%;施用1.0 mg · kg-1 Se处理组中,交换态Cd含量有增加趋势且稍高于无Se处理组,残渣态Cd有降低趋势且低于无Se处理组;铁锰氧化物结合态和有机态Cd无显著变化,碳酸盐态Cd含量趋近于零.
Cd污染浓度为0.5 mg · kg-1时,Se的施用对Cd形态含量分布的影响不显著.
综合图 3和图 4来看,土壤中Cd的存在形态主要是交换态、残渣态、铁锰氧化物结合态等3种形态,且Se的施用对Cd形态的影响也主要体现在这3种形态间的转化,对其他形态的影响不显著.整体而言,随着Cd污染水平的提高,根际与非根际土壤中交换态Cd含量所占的比例均呈现先升高后降低的趋势;残渣态Cd含量在根际和非根际呈现先降低后升高的趋势;铁锰氧化物结合态Cd含量所占的比例未呈现显著变化.
当土壤受到Cd污染时,交换态Cd含量明显增多.低浓度Cd污染下,施用不同浓度Se后根际和非根际土壤交换态Cd含量均先降低后升高,表明:在低浓度Cd污染的土壤,施用低浓度Se有助于改变根系分泌物的组成,进而抑制土壤Cd的活性,降低交换态Cd的比例;小白菜根际土壤交换态Cd含量普遍高于非根际土壤Cd含量,表明:在根系分泌物的作用下,根际土壤Cd被活化的程度高于非根际土壤;高Cd污染水平下,施用各种浓度的Se后,根际、非根际土壤各种形态Cd含量差异均不显著,表明:Cd浓度过高时,就会在土壤中形成相对稳定的Cd形态动态平衡,其各种形态含量的变化受到Se的影响不显著.
4 讨论(Discussion)重金属Cd对于生物的毒性为我们所共知,有关Se对逆境胁迫下植物生长的提升作用也已证实:将Se作为微肥施用对作物的生物量提升具有积极作用(刘燕和蒋光霞,2008; 王海男和刘汉湖,2012; Lin et al., 2003),低浓度的Se有助于缓解重金属对植物的毒害作用(彭玲等,2015; Li et al., 2013; Feng et al., 2013; Qing et al., 2015).本研究和前人结论基本一致:Cd胁迫下,施Se可以在一定程度上提升小白菜的生物量,且在本实验条件下无Cd胁迫和高Cd胁迫下施用高浓度Se的效果更为明显(本实验的高Se处理水平在上述前人实验中处于中低水平).在Cd胁迫的土壤施用低浓度Se后,小白菜地上部分对Cd的吸收呈降低趋势,施用高浓度Se后对于Cd的吸收量反而呈增加趋势,这说明低浓度的Se可以抑制植物对Cd的吸收,高浓度Se的这种抑制作用减弱或者消失.此外,本研究还发现在Cd污染土壤中施用Se可增强小白菜的光合速率和蒸腾速率,且随着Cd污染程度的增加这种增强作用越明显,这与小白菜生物量随着施Se量的增加而持续增长形成统一,可见光合速率和蒸腾速率跟生物量大小息息相关;另外Cd污染严重时施用Se还可增加小白菜叶片的气孔导度,在本文研究范围内并未发现这一现象的可利用价值.
土壤Cd污染态势已然很严峻.在我国的东北和华南一些地区,土壤Cd污染已导致食品和生态安全问题,因此,加强Cd污染土壤的修复治理已刻不容缓(丁华毅,2014; 彭少邦等,2014).由于Cd的化学形态决定了其在土壤中的移动性和生物可利用性等土壤化学行为,进而影响到其被植物根部吸收的难易程度(Lorenz et al., 1994).而植物根系的生长、根系分泌物的释放、根系对化学物质的吸附和解吸以及根系对水的吸收,使得根际与非根际有了截然不同的化学、物理和/或生物性质.研究表明根际土壤中重金属含量的动态变化、毒性和生物有效性与非根际土壤中大不相同(胡林飞,2012; Shuman and Wang et al., 1997; Lin et al., 2003).本研究从根际和非根际土壤Cd形态转化行为角度探讨了Se的施用对Cd生物有效性的影响,研究发现:低Cd污染下根际与非根际中Cd形态含量的变化趋势相同但各形态含量分布差异大.施用Se后,根际/非根际土壤中残渣态Cd含量均呈现先升高后降低趋势,交换态镉含量均呈现先降低后升高的趋势,表明低浓度的Se有助于抑制Cd的活化而高浓度Se的这种抑制作用减弱,这与小白菜地上部分对Cd的吸收量呈现的先减后增加趋势基本吻合;根际土壤交换态Cd的含量显著高于非根际土壤,根际残渣态Cd含量显著低于非根际土壤,表明交换态Cd流动性较强,发生由非根际土壤向根际土壤的转移;在本实验浓度范围内,土壤Cd污染严重时,Se的施用未显著改变根际/非根际Cd的形态分布,这表明Cd污染达到一定程度时,Cd在土壤中的存在形态转化达到了一种动态平衡,外源Se对其影响不显著.
土壤各形态Cd之间的相互转化取决于根际微环境对Cd的活化程度以及植物对可交换态Cd的吸收(胡林飞,2012).本研究中,不同Se处理土壤中根际/非根际土壤Cd形态含量的变化趋势较大,这可能是由于根系及其分泌物通过形成镉螯合物(Krishnamurti et al., 1997)、诱导改变土壤微生物活化固定态和结合态的Cd(Chanmugathas and Bollag, 1987)等方式从而影响到Cd形态的转化.本研究结果表明根系及其分泌物对Cd的活化产生了一定的促进作用,这一点与他人研究结果基本一致(Lin et al., 2003).施用低浓度Se后,非根际土壤中出现活化态Cd并且活化到交换态,根际土壤中出现的交换态镉全部被吸收;施用高浓度Se后,非根际土壤Cd形态未发生显著改变,根际中交换态Cd含量反而增多且几乎无残渣态Cd,这表明高浓度Se会损伤根系细胞,破坏根系结构,改变根系分泌物的组成,进而改变其对Cd活化.适量的外源Se是如何改变根系分泌物的组分进而改变根际Cd形态,及其生理与分子机制尚有待深入研究.
5 结论(Conclusions)1)在受到Cd污染土壤中施用Se有助于增强小白菜叶片的光合速率和蒸腾速率,进而可增加小白菜的单株产量;高Cd污染下Se的施用可增强小白菜叶片的气孔导度.
2)在低Cd污染水平(0.5 mg · kg-1)下,低浓度的Se可显著降低小白菜地上部对于Cd的吸收,而浓度过高的Se却促进了小白菜地上部对Cd的富集.
3)在Cd污染水平低的土壤,外源Se可有效抑制土壤Cd的活化,这种抑制作用在Se的浓度较低时表现更加明显;交换态Cd易发生从非根际向根际的转移,使得根际土壤交换态Cd含量所占比例升高,非根际土壤交换态Cd含量所占比例下降;当Cd污染较严重时,根际/非根际土壤Cd形态分布达到了相对稳定的平衡状态,外源Se对Cd形态分布的影响不显著.
| [1] | Cartes P, Jara A A, Pinilla L, et al. 2010. Selenium improves the antioxidant ability against aluminium-induced oxidative stress in ryegrass roots[J]. Annals of Applied Biology, 156(2):297-307 |
| [2] | Chanmugathas P, Bollag J M. 1987. Microbial mobilization of cadmium in soil under aerobic and anaerobic conditions[J]. Journal of Environmental Quality, 16(2):161-167 |
| [3] | 陈兴兰, 杨成波. 2010. 土壤重金属污染、生态效应及植物修复技术[J]. 环境整治, (3):58-62 |
| [4] | 丁华毅. 2014. 生物炭的环境吸附行为及在土壤重金属镉污染治理中的应用[D]. 厦门:厦门大学 |
| [5] | Ellis D R, Sors T G, Brunk D G, et al. 2004. Production of Se-methylselenocysteine in transgenic plants expressing selenocysteine methyltransferase[J]. BMC Plant Biology, 4(1):1-11 |
| [6] | Feng R W, Wei C Y, Tu S X. 2013. The roles of selenium in protecting plants against abiotic stresses[J]. Environmental and Experimental Botany, 87:58-68 |
| [7] | 环境保护部, 国土资源部. 2014. 全国土壤污染状况调查公报[R]. 北京:环境保护部 国土资源部 |
| [8] | 胡林飞. 2012. 两种基因型水稻根际微域中重金属镉形态差异及其有效性研究[D]. 杭州:浙江大学 |
| [9] | Krishnamurti G S R, Cieslinski G, Huang P M, et al. 1997. Kinetics of cadmium release from soils as influenced by organic acids:Implication in cadmium availability[J]. Journal of Environmental Quality, 26(1):271-277 |
| [10] | Li Y, Zhang XL, Yang Y Q, et al. 2013. Soil cadmium toxicity and nitrogen deposition differently affect growth and physiology in Toxicodendron vernicifluum seedlings[J]. Acta Physiologiae Plantarum, 35(2):529-540 |
| [11] | Lin Q, Chen Y X, Chen H M, et al. 2003. Chemical behavior of Cd in rice rhizosphere[J]. Chemosphere, 50(6):755-761 |
| [12] | 刘燕, 蒋光霞. 2008. 硒对镉胁迫下油菜生物学特性的影响[J]. 河南农业科学, (3):47-51 |
| [13] | Lorenz S E, Hamon R E, McGrath S P, et al. 1994. Differences between soil solutions obtained from rhizosphere and non-rhizosphere soils by water displacement and soil centrifugation[J]. European Journal of Soil Science, 45(4):431-438 |
| [14] | 吕选忠, 宫象雷, 唐勇. 2006. 叶面喷施锌或硒对生菜吸收镉的拮抗作用研究[J]. 土壤学报, 43(5):868-870 |
| [15] | 彭玲, 贾芬, 田小平, 等. 2015. 硒对油菜根尖镉胁迫的缓解作用[J]. 环境科学学报, 35(8):2597-2604 |
| [16] | 彭少邦, 蔡乐, 李泗清. 2014. 土壤镉污染修复方法及生物修复研究进展[J]. 环境与发展, 26(3):86-90 |
| [17] | Prado C, Rodríguez-Montelongo L, Gonzálezc J A, et al. 2010. Uptake of chromium by Salvinia minima:Effect on plant growth, leaf respiration and carbohydrate metabolism[J]. Journal of Harzardous Materials, 177(1/3):546-553 |
| [18] | Qing X J, Zhao X H, Hu C X, et al. 2015. Selenium alleviates chromium toxicity by preventing oxidative stress in cabbage (Brassica campestris L. ssp. Pekinensis) leaves[J]. Ecotoxicology and Environmental Safety, 114:179-189 |
| [19] | Shuman L M, Wang J. 1997. Effect of rice variety on zinc, cadmium, iron, and manganese content in rhizosphere and non-rhizosphere soil fractions[J]. Communications in Soil Science and Plant Analysis, 28(1/2):23-36 |
| [20] | Sun H W, Ha J, Liang S X, et al. 2010. Protective role of selenium on garlic growth under cadmium stress[J]. Communications in Soil Science and Plant Analysis, 41(10):1195-1204 |
| [21] | Tessier A, Campbell P G C, Bisson M. 1979. Sequential extraction procedure for the speciation of particulate trace metals[J]. Analytical Chemistry, 51(7):844-851 |
| [22] | 铁梅, 刘阳, 李华为, 等. 2014. 硒镉处理对萝卜硒镉吸收的影响及其交互作用[J]. 生态学杂志, 33(6):1587-1593 |
| [23] | 王海男, 刘汉湖. 2012. 硒对油菜镉中毒缓解作用的研究[J]. 山东农业科学, 44(4):62-64 |
| [24] | 薛瑞玲, 梁东丽, 王松山, 等. 2011. 外源亚硒酸盐和硒酸盐在土壤中的价态转化及其生物有效性[J]. 环境科学, 32(6), 1726-1733 |
| [25] | Yadav S K, Dhote M, Kumarb P, et al. 2010. Differential antioxidative enzyme responses of Jatropha curcas L. to chromium stress[J]. Journal of Harzardous Materials, 180(1/3):609-615 |
| [26] | 昝亚玲, 王朝辉, 毛晖, 等. 2010. 施用硒、锌、铁对玉米和大豆产量与营养品质的影响[J]. 植物营养与肥料学报, 16(1):252-256 |
| [27] | 张会民, 吕家珑, 徐明岗, 等. 2006. 土壤镉吸附的研究进展[J]. 中国土壤与肥料, (6):8-12 |
 2016, Vol. 36
2016, Vol. 36


