2. 广东工业大学资源综合利用与清洁生产省教育厅重点实验室, 广州 510006
2. Provincial Education Department Key Laboratory of Resources Comprehensive Utilization and Cleaner Production, Guangdong University of Technology, Guangzhou 510006
电镀行业是目前全球三大污染行业之一,其水质十分复杂,涉及铜、镍、铬等多种重金属及酸、碱、氰化物等其它毒性杂物,特别是重金属对人类和环境危害极大,因此,对电镀废水中重金属的处理迫在眉睫(曹从荣,2012;廖志民等,2008).其中,含铜废水是电镀废水的重要组成部分,其产生于各种不同的电镀工序中(安成强,2002).而在电镀过程中使用的大量的络合剂,如乙二胺四乙酸二钠(EDTA)、酒石酸(TA)、柠檬酸(CA)等会与Cu2+形成稳定的EDTA-Cu、TA-Cu、CA-Cu等酸性络合物,能在较宽的pH值范围内稳定存在,使含铜电镀废水难以有效去除.目前,最经济且广泛应用的重金属废水处理方法是以氢氧化物、硫化物为主的传统化学沉淀法(林朋飞等,2014;何绪文等,2013;苏平等,2009;戴文灿等,2009;Qi et al., 2008;Xu et al., 2006;Heidenerie et al., 2002).但用传统化学沉淀法对重金属污染进行控制,尤其对酸性络合态重金属废水而言存在一定的局限性,一方面在酸性条件下,生成的氢氧化物沉淀物容易返溶,使重金属废水难以达标排放;另一方面,过量的硫化物遇酸会释放硫化氢气体,易引起二次污染.其他方法如电解法(Kabdasli et al., 2009)、离子交换法(Kołodyńska,2011)、吸附法(Ge et al., 2015; Martín-Lara et al., 2014;张义婕等,2014)、高级氧化还原法(邵天元等,2015;陆朝阳等,2015;Park et al., 2006)等,普遍存在反应周期长、处理过程较复杂、处理成本高,易引起二次污染等不足,限制了其实际应用,因此,亟待开发一种对酸性络合铜进行高效脱除的方法.
以二硫代氨基甲酸盐(DTC)为代表的重金属捕集剂由于具有强大的螯合能力,能直接处理络合态重金属废水,形成强稳定性的螯合沉淀物,已成为重金属污染领域的热点,受到广泛关注(严苹方等,2015;王贞等,2010;Shaaba et al., 2013;Zhen et al., 2012;Zaman et al., 2007).目前,DTC类重金属捕集剂主要分为两类:高分子螯合剂和小分子螯合剂.高分子螯合剂分子量大,沉淀效果较好,但由于分子链较长,螯合基团(二硫代氨基甲酸基)存在空间位阻,使一部分螯合基团无法与重金属离子进行螯合,利用率较低,因此,重金属去除效果不甚理想,同时高分子螯合剂的成本较高(令玉林等,2011;刘立华等,2010).小分子螯合剂的螯合基团利用率一般较高,特别是含有多个螯合基团的小分子螯合剂,由于重金属可以与不同的螯合基团位点进行配位,或者螯合剂之间进行配位,可使形成的螯合沉淀絮体不断增大,有助于絮凝沉降.
本文针对以上情况,在前期研究的基础上(王风贺等,2013;令玉林等,2011),以乙二胺和二硫化碳为原料,在混合溶剂(乙醇/去离子水)条件下快速合成一种多硫代氨基甲酸基团的巯基类重金属捕集剂,命名为EDTC,采用紫外光谱、红外光谱和元素分析对其结构进行表征.同时,以EDTA-Cu、TA-Cu、CA-Cu 3种酸性模拟络合铜废水为研究对象,系统研究EDTC投加量、初始pH、反应时间等因素对Cu去除效果的影响,并验证螯合沉淀物的稳定性,同时探讨该重金属捕集剂脱除络合Cu的机理,以期为实际含铜废水的高效脱 Cu技术提供理论依据.
2 材料与方法(Materials and methods) 2.1 实验材料聚丙烯酰胺(PAM)、硫酸铜(CuSO4·5H2O)、柠檬酸(CA)、乙二胺四乙酸二钠(C10H14N2O8Na2·2H2O)、 氢氧化钠(NaOH)、酒石酸钾钠(TA)、无水乙醇、无水乙二胺、浓硝酸、二硫化碳(CS2)均为分析纯.
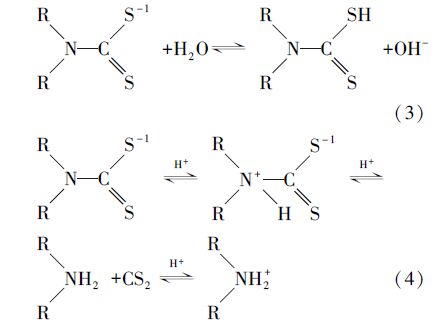
2.2 实验方法 2.2.1 EDTC的合成实验往配有搅拌和冷凝的三口烧瓶中加入40 mL混合溶剂(V乙醇/VH2O=1 ∶ 2),之后加入乙二胺0.1 mol(6.68 mL),在冰水浴中缓慢滴加CS2 0.25 mol(15.08 mL),滴加结束后升温至室温,稳定反应2 h,抽滤,分别用去离子水和无水乙醇洗涤产物1~2次,40 ℃真空干燥至恒重,得到白色粉末固体N,N -双(二硫代羧基)乙二胺,即EDTC.制备重金属捕集剂EDTC的基本反应方程式如下:
在室温条件下,取100 mL 50 mg · L-1模拟络合铜废水(由五水硫酸铜与EDTA、CA、TA按物质量比1 ∶ 1配置)置于150 mL烧杯中,调节pH,加入一定量捕集剂EDTC,置于六联搅拌器中快速(250 r · min-1)搅拌2 min,投加絮凝剂PAM 1.0 mg · L-1,并缓慢搅拌(50 r · min-1)5 min,静置10 min后取液面2 cm处清液,滤纸过滤后用原子吸收分光光度计测定上清液中残留的Cu浓度,计算去除率.分别研究了EDTC投加量、废水初始pH、反应时间等因素对EDTC去除Cu的影响. 2.2.3 重金属溶出实验 将EDTC与酸性络合铜废水反应生成的螯合沉淀物(EDTC为最佳投加量)经去离子水洗涤过滤,然后于40 ℃真空干燥备用,对沉淀物进行半自动溶出(SDLT)实验.
SDLT实验参照Chang等(2002)的方法,实验步骤如下:将沉淀物颗粒加入3个具塞锥形瓶内,按100 ∶ 1(mL/g)的固液比分别加入pH为2.5和5.0的醋酸溶液及pH为9.0的NaOH溶液,进行静置溶出实验,每隔一段时间测定溶出的Cu2+浓度.
2.3 分析方法pH指标采用雷磁pHS-25 酸度计测定;Cu2+浓度采用火焰原子吸收分光光度计测定(日立 Z2000 型,检出限 0.001 mg · L-1,日本日立仪器有限公司);重金属捕集剂EDTC反应前后表征:①采用KBr压片法,Nicolet380 傅里叶变换红外光谱仪(Nicolet380,美国THERMO Fisher Scientific)在波数4000~400 cm-1范围内测定透光率,仪器分辨率为0.4 cm-1.②将EDTC配成浓度为5 mg · L-1和15 mg · L-1的水溶液,用紫外可见分光光度计(UV-2100,中国北分瑞利)分析EDTC,扫描范围220~400 nm;③采用有机元素分析仪(2400Ⅱ,美国PerkinElmer)测定捕集剂和螯合产物碳、氢、氮、硫含量.
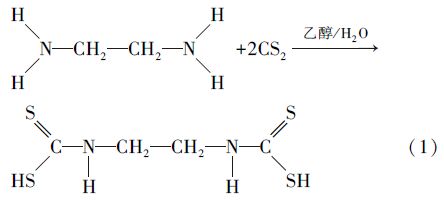
3 结果与讨论(Results and discussion) 3.1 EDTC的结构表征 3.1.1 EDTC的紫外光谱配置5 mg · L-1和15 mg · L-1两种浓度的EDTC水溶液,以去离子水为参比,220~400 nm段的扫描结果如图 1所示.由图 1可知,重金属捕集剂EDTC在284 nm、251 nm处各存在最大吸收,251 nm处为N—C—S基团的 π-π*跃迁,284 nm处为—CS2基团上的S的非键电子向共轭体系的n-π*跃迁,表明碳氮和碳硫之间具有部分双键的结构特征(Tombeux et al., 1972),可初步确定EDTC的主要官能团有C—N、C S及C—S,EDTC上存在二硫代氨基.
 |
| 图1 EDTC的紫外光谱图 Fig.1 Ultraviolet spectrogram of EDTC |
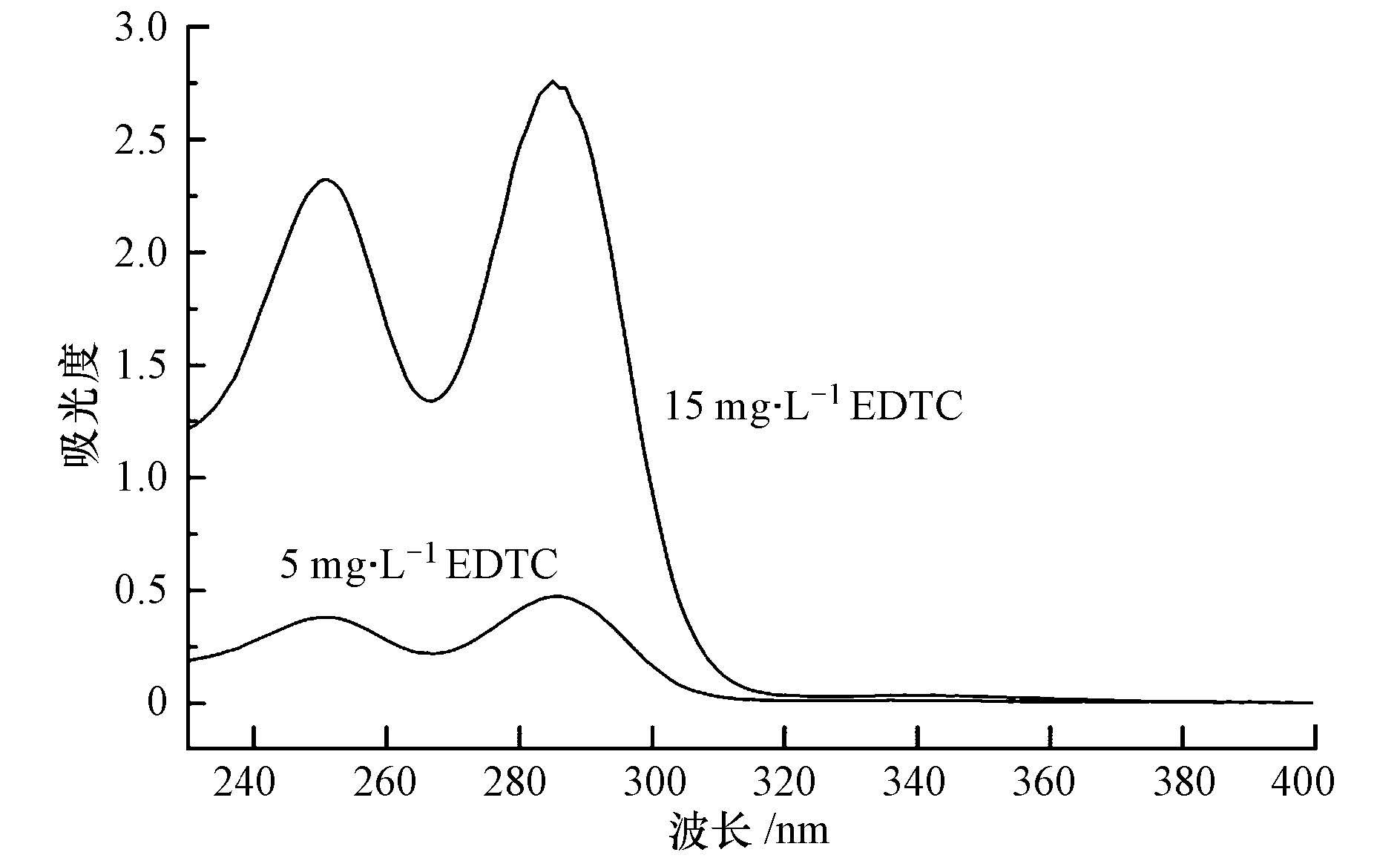
在400~4000 cm-1范围内对EDTC进行红外光谱测定,结果如图 2所示.在3445 cm-1有—OH的伸缩振动峰,说明EDTC分子中含有结晶水;3213 cm-1处的吸收峰为N—H的伸缩振动峰;2952 cm-1处为C—H伸缩振动,且低于3000 cm-1,该峰为 C—H的饱和吸收峰;2858 cm-1处为—CH2的对称伸缩振动峰;2576 cm-1处为—SH的伸缩振动峰;1635 cm-1处为 N—H 的变形振动峰;1508 cm-1处为 N—CS2的伸缩振动吸收峰,此峰介于C—N单建(1300 cm-1)和C=N双键(1600 cm-1)之间,具有部分双键性质;在1480~1510 cm-1处的ν(C—N)伸缩振动及在940~990 cm-1处的ν(C—S)伸缩振动表明二硫代甲酸盐是双齿配体(Oktavec et al., 1980);C—S的红外特征吸收在1007 cm-1,低于C=S双键的特征吸收(1501~1200 cm-1),而且是一个强吸收峰.以上结果可以说明EDTC分子类含有二硫代氨基甲酸基团.
 |
| 图2 EDTC的红外光谱图 Fig.2 FTIR spectrum of EDTC |
由表 1数据计算可知,EDTC中C、H、N和S的摩尔比为2 ∶ 4 ∶ 1 ∶ 2,可以推导EDTC的最简式为C2H4NS2.结合EDTC的紫外光谱和红外光谱分析可推断乙二胺和CS2反应生成EDTC的分子结构式为:
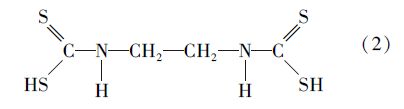
| 表1 EDTC的元素分析 Table 1 Elementary analysis of EDTC |
模拟含铜废水中的Cu浓度均为50 mg · L-1,调节反应体系pH值为5.0左右,投加不同剂量的重金属捕集剂EDTC,反应2 min,PAM为1.0 mg · L-1,反应时间5 min,静置10 min,考察EDTC投加量对Cu去除效果的影响,结果如图 3所示,图中EDTC投加量换算成与废水中Cu的质量比,以mEDTC/mCu计.
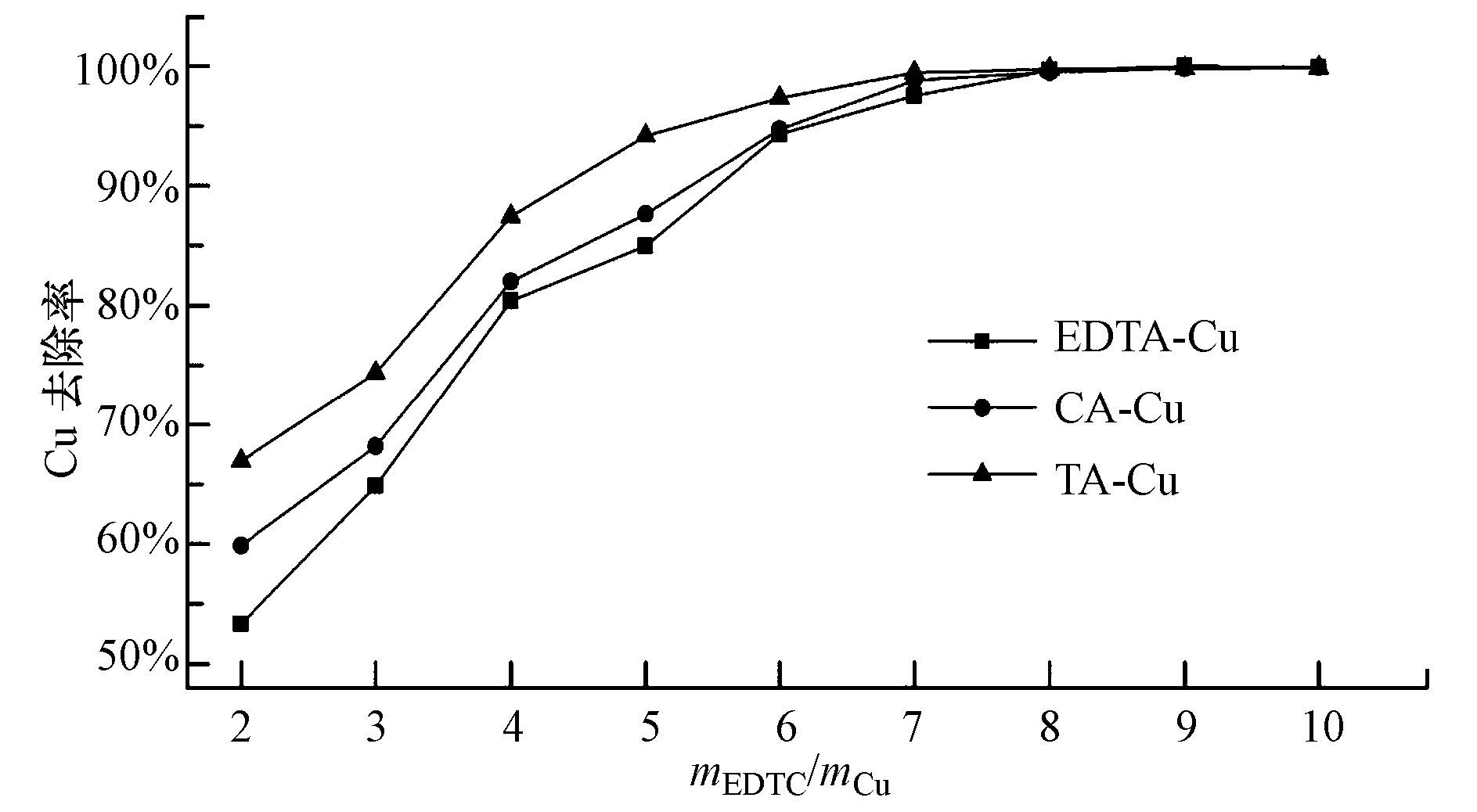 |
| 图3 EDTC投加量对络合铜离子去除的影响(T=25℃,pH=5.0,PAM=1.0 mg · L-1,t=5 min) Fig.3 Effects of EDTC dosage on complex copper removal rates |
在同一投加量条件下,体系中剩余Cu离子浓度随着络合剂的不同呈以下顺序:EDTA-Cu >CA-Cu> TA-Cu.Cu的去除效率随着EDTC投加量的增加而迅速增加;当mEDTC/mCu≥8时,去除率趋于稳定,达到99.5%以上,此时反应体系中的Cu浓度均低于0.25 mg · L-1,低于《电镀污染物排放标准(GB21900-2008)》中关于 Cu污染物特别排放限值要求(<0.3 mg · L-1).可以看出,EDTC对于3种络合铜都能有效去除,这表明DTC基团对Cu2+的螯合能力要比EDTA、TA、CA还要强.而继续加大EDTC投加量,虽然能进一步提升Cu的去除效率,但变化不大,同时考虑到过量的EDTC会增加反应体系COD,当mEDTC/mCu=8时,反应前后反应体系COD由178.5 mg · L-1上升到363.5 mg · L-1,故本实验得出的EDTC最佳投加量为8倍于废水中Cu含量,即mEDTC/mCu=8.
3.3 初始pH对Cu去除效果的影响取浓度为50 mg · L-1的各络合铜水100 mL,用0.1 mol · L-1的硝酸或氢氧化钠溶液调节反应体系pH,mEDTC/mCu=8,絮凝剂PAM为1 mg · L-1,同时与不投加EDTC的络合铜废水做对比,考察初始pH值对络合Cu去除效果的影响,结果如图 4所示.
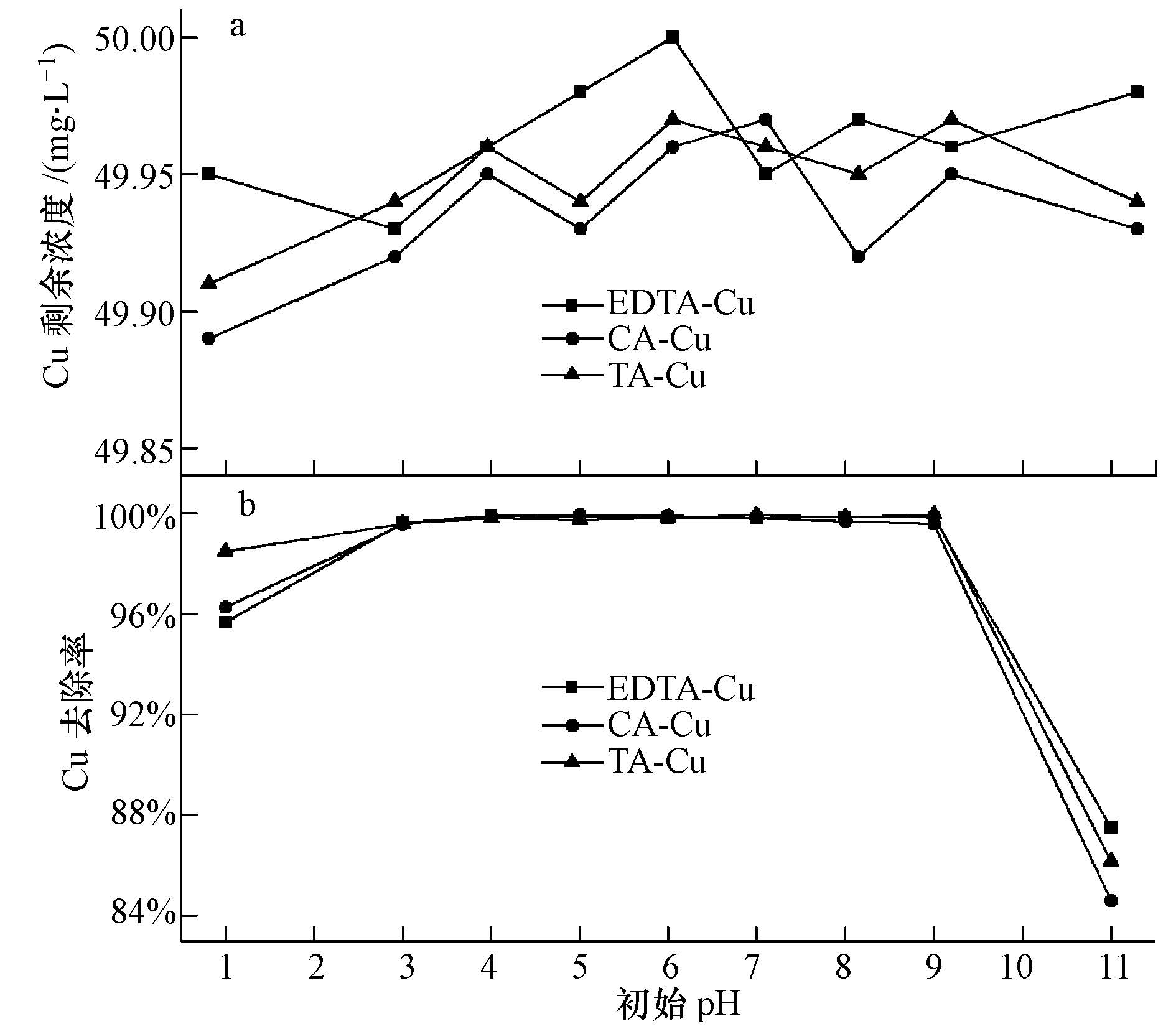 |
| 图4 废水初始pH对络合Cu2+去除的影响(a.mEDTC/mCu=0,b.mEDTC/mCu=8) Fig.4 Effect of wastewater initial pH on complex copper removal rates |
由图 4a可知,3种络合铜废水中不添加EDTC时,pH值即使达到11,去除率接近为0,没有Cu(OH)2沉淀产生,这说明EDTA-Cu、CA-Cu、TA-Cu很稳定,铜离子不能直接以氢氧化物的形式去除,即碱中和沉淀不能处理络合铜废水,需先进行破络才能进一步处理.加入EDTC后,在pH值范围为3~9内,Cu的去除率稳定在99.5%以上,残余Cu浓度均达到排放标准;而当初始pH>11时,Cu的去除率下降至90%以下,反应前后溶液pH基本不变.分析原因:EDTC在水中存在式(3)电离平衡,随着体系pH上升,平衡向生成DTC移动,会离解出更多的DTC基团与Cu2+螯合,且形成的絮体还能吸附溶液中一部分重金属离子,致使去除率上升;但在强碱条件下(pH>11),络合离子如EDTA、柠檬酸等与Cu2+形成的配合物稳定性较强,抑制了EDTC对Cu的捕集效果.以EDTA为例,在水溶液中,EDTA以H6Y2+、H5Y+、H4Y、H3Y-、H2Y2-、HY3-、Y4-这7种形式存在,在不同的pH条件下,各种形式的浓度是不同的.在pH>10.26的碱性溶液中,主要以Y4-形式为主,Y4-能与Cu2+直接配位,随着pH的增加,Y4-的离子浓度就越大,EDTA对Cu2+的配位能力越强(王芬,2006).因此,在强碱条件下,Cu的去除率有所下降.在强酸条件下,一方面式(3)电离平衡右移,DTC基团减少,EDTC对Cu2+的去除效果下降,同时EDTC还可能会按式(4)分解为CS2和质子化的胺(Saegnsa et al., 1978),这样会消耗一部分EDTC,Cu的去除率随之降低.另一方面H+浓度较高,可能会与Cu2+竞争重金属捕集剂表面的螯合活性位点(Bai et al., 2011).这与刘新梅等(2008)用捕集剂DTC(BETA)对含铜废水进行螯合处理,Cu的去除最佳pH范围在3~9之间的研究结果是一致的.
因实际电镀废水多为酸性废水(pH在5左右),传统化学沉淀法需要先消耗大量碱液调节pH,甚至需要经过破络,而EDTC在酸性条件下也能直接有效去除重金属,弥补了传统化学沉淀法的不足(魏广艳等,2006),其为EDTC的一大优点.
3.4 反应时间对Cu去除效果的影响取浓度50 mg · L-1的各络合铜废水100 mL,调节pH=5.0,mEDTC/mCu=8,絮凝剂PAM为1 mg · L-1,调整慢搅时间0~12 min,考察反应时间对Cu去除效果的影响,结果如图 5所示.可以看出,在前30 s,EDTC对络合Cu的去除率仅为80%~90%,分析原因可能是由于EDTC与络合离子对Cu2+的螯合竞争作用所致.在反应前3 min内,Cu的去除率随着反应时间的延长而增加,在3 min后,EDTC与络合铜的反应基本结束,Cu的去除率稳定在99.9%以上,出水浓度<0.15 mg · L-1,远低于国家排放标准.当反应时间超过10 min后,Cu的去除率略有降低,但仍在99.5%以上.分析认为:反应结束后,继续延长搅拌时间会导致絮体颗粒破碎,不能完全沉降,影响出水水质.总体来说,反应时间对Cu的去除效果影响没有EDTC投加量和初始pH值大,考虑到反应时长关系到应用实际工程的反应池容积的大小,涉及经济成本,故选择反应时间为3 min.
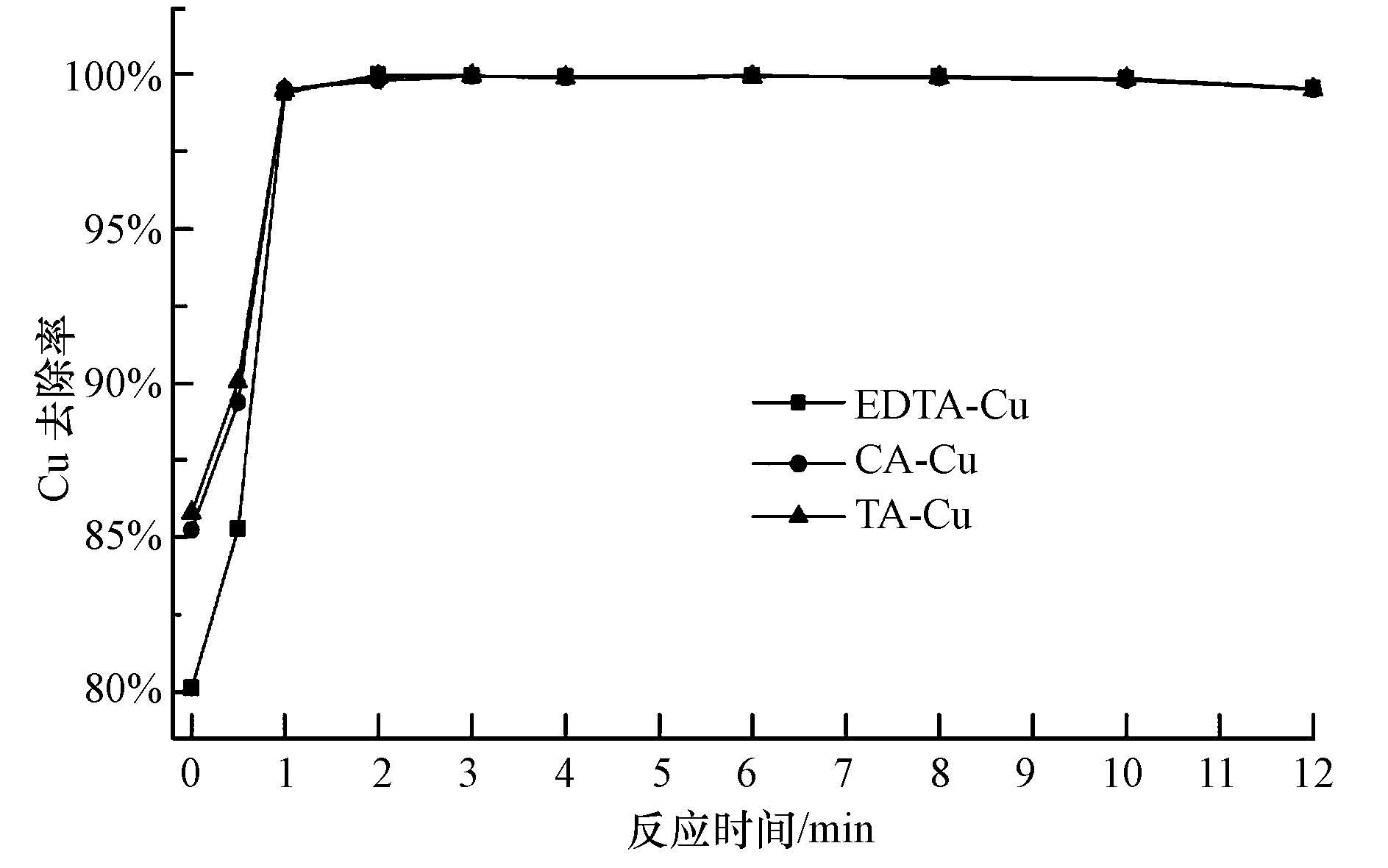 |
| 图5 反应时间对络合Cu2+去除的影响(T=25℃,pH=5.0,PAM=1.0 mg · L-1) Fig.5 Effect of reaction time on complex copper removal rates |
EDTA-Cu、CA-Cu、TA-Cu模拟废水与EDTC按上述优化工艺条件反应得到棕色沉淀产物,沉淀产物经过滤、洗涤、真空干燥后进行红外光谱表征,其红外光谱图如图 6所示.由图可知,b、c、d 3种沉淀物曲线的出峰位置及峰强度基本一致,可以说明3种沉淀物所拥有的官能团基本是相同的.因EDTA、CA、TA三者官能团不全相同,由此可以判断:在反应过程中不同的络合剂并没有参与最后沉淀物的形成,也有可能是EDTA、柠檬酸、酒石酸的特征官能团吸收峰与EDTC的吸收峰发生部分重叠.
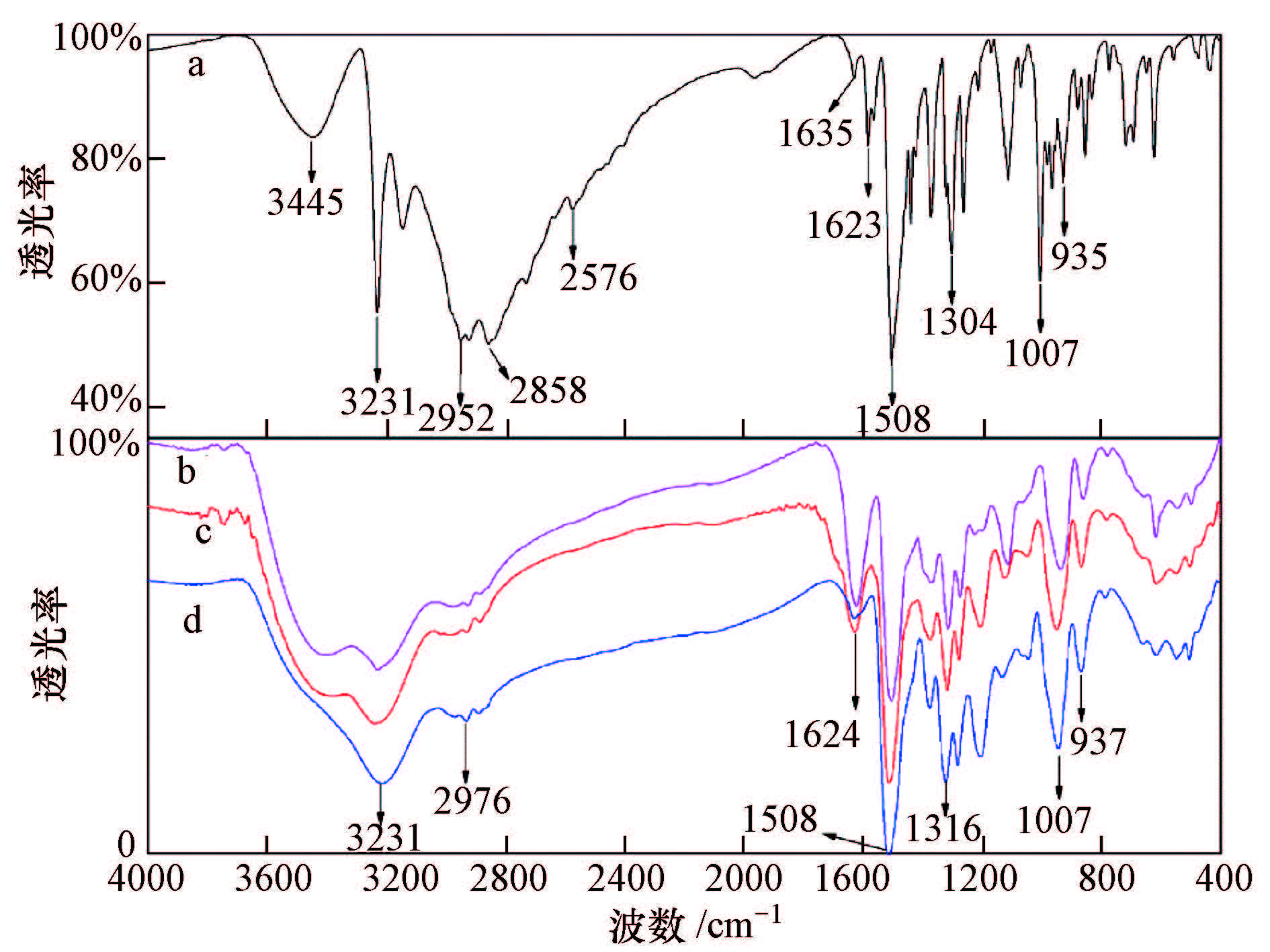 |
| 图6 EDTC与3种螯合沉淀物的红外光谱图(4000~400 cm-1)(a. EDTC固体,b.EDTC和EDTA-Cu的反应沉淀物,c.EDTC和TA-Cu反应沉淀物,d:EDTC和CA-Cu反应沉淀物) Fig.6 FTIR spectrum of EDTC and three kinds of chelate precipitates(4000~400 cm-1) |
由图 6可知,重金属捕集剂EDTC反应后在2576 cm-1处的—SH 特征吸收峰消失,1508 cm-1处的N—CS2伸缩振动吸收峰和1007 cm-1处的C—S特征吸收峰强度有所降低,1304 cm-1处的C S特征吸收峰后移至1316 cm-1且强度有所减弱,这几个峰反映了螯合的关键基团,正是由于S与Cu的螯合作用,减小了S的电负性,引起峰的变化.由此可推断,EDTC 捕集金属Cu的主要官能团是—SH,而EDTC中的其它基团没有参与反应.进一步对3种螯合沉淀物进行元素分析,其各元素含量百分比如表 2所示.由表 2可知,3种模拟络合铜废水的螯合产物与EDTC-Cu(EDTC与CuSO4按摩尔比为1 ∶ 1反应制备)的理论含量值基本一致.
| 表2 三种螯合产物(a、b、c)和EDTC-Cu理论元素含量对比 Table 2 Organic elemental analysis of three kinds of chelate precipitates(a,b,c) and EDTC-Cu |
由上述推断可知,EDTC与Cu的作用机理为脱络-螯合,即EDTC进攻络合铜离子,由于EDTC与Cu2+的螯合能力更强,使Cu2+与其他络合剂脱离,与Cu2+螯合生成更稳定的EDTC-Cu沉淀物,从而有效脱除Cu,反应总方程式如式(5)所示,其中,M代表络合剂(EDTA/TA/CA).反应沉淀产物中不含有EDTA、柠檬酸(CA)、酒石酸(TA),使得3种螯合产物的红外谱图基本一致.峰高的差异体现了EDTC在反应过程中的变化:3种络合剂与Cu2+的络合稳定性不同,EDTC对络合铜进行脱络时,所需能量不同,键能发生变化,导致了3种螯合沉淀物红外谱图的略小差异.

图 7为在不同pH值条件下螯合沉淀物EDTC-Cu溶出Cu2+的累积分数.SDLT实验结果表明,在pH值为2.5时,累积溶出铜占总铜量的3.21%,而在pH值为5.0和9.0时,30 d的累积溶出铜仅占0.05%和0.08%.这与令玉林等(2011)用重金属捕集剂RDTC对含铜废水进行处理,其沉淀物溶出特性的研究结果相似.由此说明,EDTC能沉淀铜离子且能长期安全放置,不易产生二次污染.
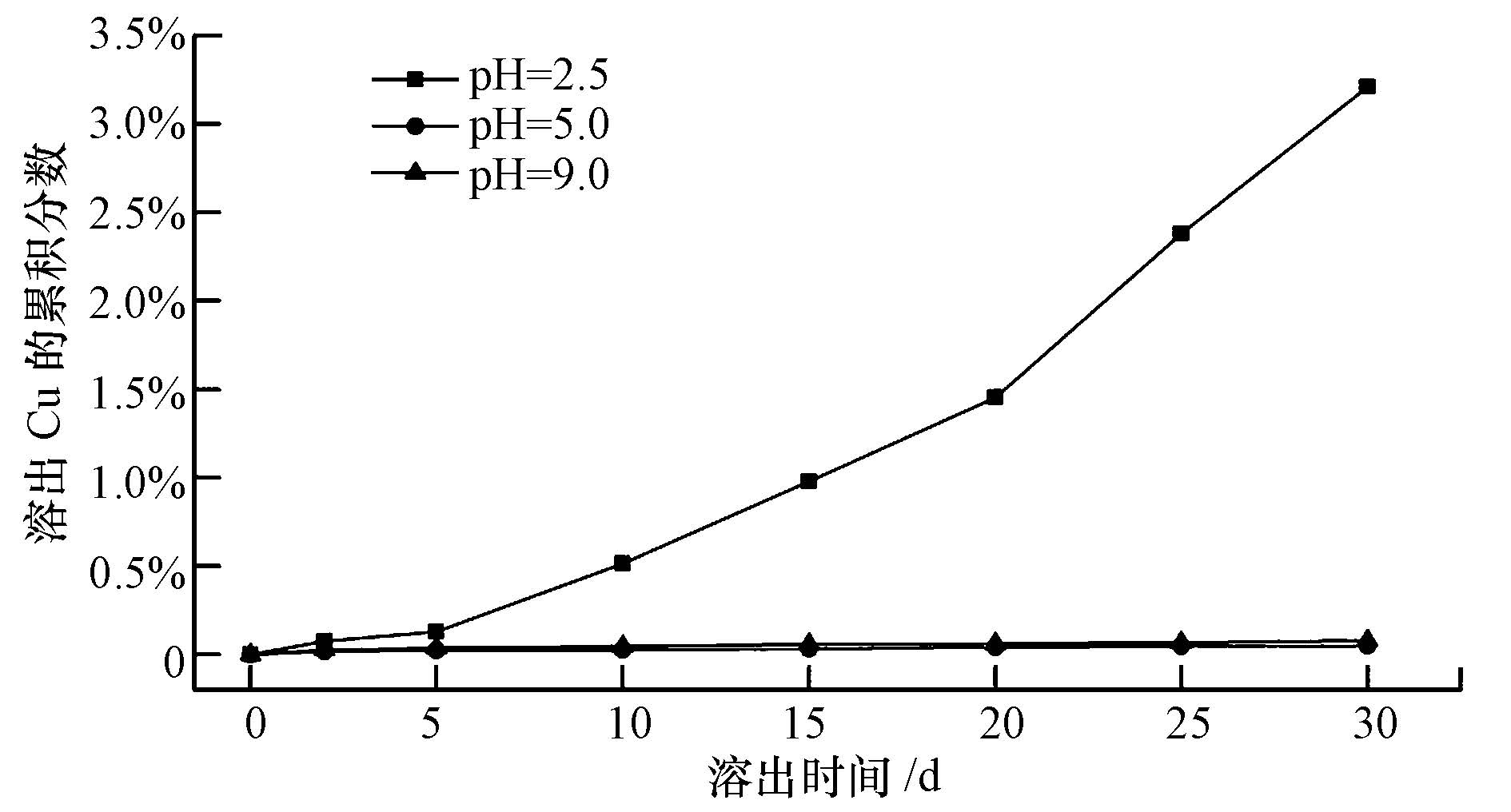 |
| 图7 SDLT中EDTC-Cu沉淀溶出铜的累积分数随时间变化曲线 Fig.7 Cumulative fraction of Cu leached as a function of time for Cu-EDTC precipitates in SDLT |
1)以乙二胺和CS2在混合溶剂(V乙醇/VH2O=1 ∶ 2)中制备了一种巯基类重金属捕集剂EDTC,产物为白色固体粉末,有利于储存运输.EDTC分子内含有2个二硫代氨基甲酸基团,有助于螯合废水中的重金属.
2)EDTC能快速高效地去除络合态Cu,处理初始浓度为50 mg · L-1的各络合铜,pH为3~9,EDTC投加量为8倍于Cu含量(质量比),反应时间3 min,PAM为1 mg · L-1,处理后的出水Cu浓度均低于0.25 mg · L-1,去除率达到99.5%以上,达到《电镀污染物排放标准(GB21900—2008)》中关于 Cu污染物特别排放限值要求(<0.3 mg · L-1),其中,EDTC投加量和初始pH对Cu的去除效果影响较大.
3)EDTC在与络合铜反应时,和原有的络合剂竞争Cu2+,并与Cu2+生成更稳定的螯合沉淀物EDTC-Cu.SDLT实验表明,螯合沉淀物EDTC-Cu可在弱酸性和弱碱性条件下长期稳定存在,不易造成二次污染.
| [1] | 安成强.2002.电镀三废治理技术[M].北京:国防工业出版社.10-13 |
| [2] | Bai L,Hu H,Fu W,et al. 2011.Synthesis of a novel silica-supported dithiocarbamate adsorbent and its properties for the removal of heavy metal ions[J].J Hazard Mater, 195:261-275 |
| [3] | Chang Y K,Chang J E,Lin T T,et al.2002.Integrated copper-containing wastewater treatment using xanthate process[J].J Hazard Mater,94(I):89-99 |
| [4] | 曹从荣.2012.电镀企业排污达标执行能力分析[J].电镀与精饰,34(11):28-31 |
| [5] | 陈瑾瑾,常青,徐敏.2009.高分子重金属絮凝剂MAPEI处理含汞废水[J].环境科学学报,29(6):1442-1446 |
| [6] | 戴文灿,孙水裕,陈涛.2009.沉淀浮选法处理电镀废水的试验研究[J].有色金属,(5):17-20 |
| [7] | 付念,毛祖国,丁运虎,等.2013.3种典型絮凝剂处理电镀废水的效果[J].电镀与装饰,32(8):38-41 |
| [8] | Ge Y Y,Cui X M,Kong Y,et al.2015.Porous geopolymeric spheres for removal of Cu(II) from aqueous solution:Synthesis and evaluation[J]. Journal of Hazardous Materials, 283:244-251 |
| [9] | 何绪文,胡建龙,李静文,等.2013.硫化物沉淀法处理含铅废水[J].环境工程学报,7(4):1394-1398 |
| [10] | Heidenerich H.2002.Removal of heavy metal ios from aqaueous media[P].U.S.Patent 6,342,162. 2002-1-29 |
| [11] | 贾玉岩,高宝玉,卢磊,等.2009.二硫代氨基甲酸盐的絮凝作用机理及除油性能[J].中国环境科学,29(2):201-206 |
| [12] | Kabdasli I,Arslan T,Hancci T,et al.2009.Complexing agent and heavy metal removals from metal plating effluent by electrocoagulation with stainless steel electrodes[J].J Hazard Mat,165:838-845 |
| [13] | Kołodyńska D.2011.Application of strongly basic anion exchangers for removal of heavy metal ions in the presence of green chelating agent[J]. Chemical Engineering Journal,168(3):994-1007 |
| [14] | 廖志民,朱小红,杨圣云,等.2008.电镀废水处理与资源化回用技术发展现状与趋势[J].环境保护,(20):71-73 |
| [15] | 林朋飞,张晓健,陈超.2014.硫化物沉淀法在水源突发锌污染中的应用研究[J].中国给水排水,30(11):48-51 |
| [16] | 令玉林,周建红,李国斌,等.2011.高效重金属螯合剂 RDTC 的研制及处理含铜废水性能[J].环境化学, 30(8):1390-1395 |
| [17] | 刘立华,吴俊,令玉林,等.2010.高分子重金属螯合絮凝剂的制备及其除Cu2+、Ni2+的性能研究[J].湖南科大学学报(自然科学版), 25(4):104-109 |
| [18] | 刘新梅,毛文洁,陈夏.2008.重金属捕集剂 DTC(BETA)处理含铜废水效果研究[J].广西工学院学报, 19(4):90-92 |
| [19] | 陆朝阳,尹德强,林锋,等.2015.自催化氧化还原技术处PCB络合废水试验研究[J].环境科学与技术,(2):146-150 |
| [20] | Martín-Lara M A,Blazquez G,Trujillo M C,et al.2014.New treatment of real electroplating wastewater containing heavy metal ions by adsorption onto olive stone[J].Journal of Cleaner Production,81(7):120-129 |
| [21] | Oktavec D,Beinrohr E,Garaj J.1980.Effect of structure and electron effects on the IR spectra of dithiocarbamates[J].Collec Czechoslov Chem Commun,45:1495-1499 |
| [22] | Park E H, Jung J H, Chung H H.2006. Simultaneous oxidation of EDTA and reduction of metal ions in mixed Cu(Ⅱ)/Fe(Ⅲ)-EDTA system by TiO2photocatalysis[J].Chemosphere,64:432-436 |
| [23] | Qi B C,Aldrich C.2008.Biosorption of heavy metals from aqueous solutions with tobacco dust[J].BioresourceTechnology, 99(13):5595-5601 |
| [24] | Saegnsa T,Kobayashi S,Hayashi K,et al.1978.Preparation nd chelating properties of mercaptoethylated and dithiocarboxylated poly (styrene-g-ethyienimine) s[J].Polym J,10(4):403-408 |
| [25] | Shaaba A F,Fadel D A, Mahmoud A A,et al.2013. Synthesis and characterization of dithiocarbamate chelating resin and its adsorption performance toward Hg(II), Cd(II) and Pb(II) by batch and fixed-bed column methods[J]. Journal of Environmental Chemical Engineering, 1(3):208-217 |
| [26] | 邵天元,李新宝,张宝锋,等.2015.电芬顿法处理重金属络合物Ni-EDTA的研究[J].环境科学学报,35(3):745-749 |
| [27] | 苏平.2009.硫化物沉淀法及其对金属硫化物去除率的探讨[J].中国有色冶金,(4):6-10;22 |
| [28] | Sun S L, Wang A Q.2006.Adsorption kinetics of Cu(II) ions using N,O-carboxymethyl-chitosan[J].Journal of Hazardous Materials B,131:103-111 |
| [29] | Tombeux J,VanPouke,EeckhautZ.1972.A speetrophotometric study ofthe metal ioncomplexes of N,N'-bis(dithiocarboxy)piperazine[J].Spectrochim,Axta,28:1943-1947 |
| [30] | 王芬.2006.分析化学[M].北京.中国农业出版社.117-120 |
| [31] | 王风贺,王君杰,雷武,等.2013.重金属螯合捕集剂NBMIPA的合成及其捕集Cu2+、Zn2+性能[J].环境科学学报,33(1):88-91 |
| [32] | 王贞,叶国祥,杨岳平.2010.重金属捕集剂法处理低浓度电镀废水[J].浙江大学学报(理学版),37(6):665-669 |
| [33] | 魏广艳,徐颖.2006.重金属捕集剂对废水中铅捕集效果研究[J].水处理技术,32(3):32-34 |
| [34] | 修莎,周勤,黄志勇.2009.重金属捕集剂XL9对含铜电镀废水处理效果的研究[J].环境工程学报, 3(10):1812-1815 |
| [35] | Xu Y,Zhang F.2006.Experimental research on heavy metal wastewater treatment with dipropyldithiophosphate[J].Journal of Hazardous Materials,137:1636-1642 |
| [36] | 严苹方,孙水裕,叶茂友,等.2015.巯基重金属捕集剂脱除电镀废水中低浓度 Ni 的效能及机理研究[J].环境科学学报,35(9):2833-2839 |
| [37] | ZamanK M,Blue L Y,Huggins F E,et al.2007.Cd、Hg、and PbCompounds of Benzene-1,3-diamidoethanethiol(BDETH2)[J]. Inorganic Chemistry,46:1975-1980 |
| [38] | 张文杰,徐敏,常青,等.2011.具有重金属捕集功能的高分子絮凝剂MAC去除Cd2+的性能研究[J].环境科学学报,31(4):777-784 |
| [39] | 张义婕,司志华,胡晓静,等.2014.改性沸石对废水中Cu2+、Cr3+的去除作用研究[J].工业水处理,34(12):42-45 |
| [40] | Zhen H B,Xu Q,Hu Y Y,et al.2012.Characteristics of heavy metals capturing agent dithiocarbamate (DTC) for treatment of ethylene diaminetetraacetic acid-Cu (EDTA-Cu) contaminated wastewater[J].Chemical Engineering Journal, 209:547-557 |
 2016, Vol. 36
2016, Vol. 36


