2. 浙江大学细胞生物学研究所, 杭州 310058
2. Institute of Cell Biology, Zhejiang University, Hangzhou 310058
镉(Cd)、铅(Pb)是环境中存在的主要重金属环境污染物,它们通过大气、水、食物进入人体,与人体内蛋白质及各种酶发生强烈的相互作用,使之失去活性(Razmiafshari et al., 2001),引起一系列细胞结构和功能的改变,造成儿童和成人多个器官和系统疾病(孟紫强,2000; Järup,2003).镉,铅均为慢性蓄积性毒物,小剂量持续的进入机体后能逐渐积累而对肝、肾、肺、睾丸、脑、骨骼及血液系统均可产生毒性,并具有致癌和致突变性作用(Waisberg et al., 2003; Beyersmann and Hartwig, 2008),其对人体的危害已引起人们的广泛关注.如何快速有效检测低剂量重金属污染物的剂量效应关系和评价其生物毒性大小、一直困扰着环境毒理学界.研究表明,镉、铅是一类显著引起免疫毒性的污染物(Mishra,2009; Ohsawa,2009),因此,利用重金属环境污染物的免疫毒性作为敏感的生物指示物(Biomarker)在环境生物检测中有重要意义.巨噬细胞是对自身所处微环境敏感,参与多种免疫调节功能的主要免疫细胞,但低剂量重金属污染物对巨噬细胞影响的相关研究,鲜见报道(管琼峰和李继承,2003; Bussolaro et al., 2008).本研究以在机体免疫反应中极为活跃的腹腔巨噬细胞(Peritoneal Macrophage,PMФ)为模型,探讨不同浓度氯化镉(CdCl2),乙酸铅(Pb(CH3COO)2)对小鼠腹腔巨噬细胞形态和功能的影响,以反映重金属污染物镉、铅对巨噬细胞的免疫毒性,旨在建立一套快速而灵敏的生物检测系统,为环境污染的生物监测提供科学依据.
2 材料和方法(Materials and methods) 2.1 实验动物健康成年纯系NIH雄性小鼠20只,体重(20±2)g,常规饲养.由浙江大学实验动物中心提供.
2.2 污染物和主要试剂分析纯CdCl2和Pb(CH3COO)2、中性红(Neutral Red)、伊红(Eosin)购自上海生工;RPMI 1640培养基购自GIBCO公司,小牛血清购自杭州四季青生物工程研究所;噻唑蓝(MTT)试剂购自Fluka公司;Griess试剂(1%对胺基苯磺酰胺,0.1N二盐酸-α-萘乙二胺、3%磷酸,按1∶1∶1新鲜配制).
2.3 PMФ分离和培养正常生长小鼠腹腔注射3%无菌硫乙醇酸钠3mL,常规饲养.3 d后颈椎脱臼法处死小鼠,无菌条件下消毒腹部,剪开皮肤,腹腔内注人3mL无菌D—Hanks液,轻揉腹部1min.回抽腹腔液,并用无菌D—Hanks液冲洗2次.收集腹腔液1000r·min-1离心2次,每次10 min,下层沉淀即为PMФ.RPMI 1640培养液重悬沉淀后细胞计数,并调整细胞至2×105个· mL-1或5×105个· mL-1的细胞悬液待用.根据不同的实验内容要求,将适量PMФ悬液常规接种于培养板(96孔板细胞密度为1×105个·孔-1;24孔板细胞密度为2×105个·孔-1).37 ℃,5%CO2,饱和湿度培养箱培养.4 h后PMФ贴壁生长,吸出上清液除去非贴壁细胞,加入新鲜的含小牛血清的RPMI 1640培养液培养.
2.4 污染物的配制和PMФ染毒处理用CdCl2和Pb(CH3COO)2溶液用D-Hanks液配制,并过滤除菌备用.PMФ培养24h后,分别用10-8、10-7、10-6、10-5、10-4 mol·L -1 CdCl2或10-8、10-7、10-6、10-5、10-4 mol·L -1 Pb(CH3COO)2染毒,同时设空白对照组和溶剂对照组.根据不同的实验要求,选择相应的培养板及处理时间.
2.5 PMФ形态学观察 2.5.1 扫描电镜观察PMФ染毒培养48 h后,将细胞爬片按照扫描电镜常规方法处理.4 ℃固定于2.5%的戊二醛磷酸缓冲液(pH=7.4)中24~48 h,加入1%的锇酸,固定1h.梯度乙醇和丙酮脱水,醋酸乙戊酯置换,临界点干燥,镀金,CAMBRIDGE S-260 扫描电镜观察细胞微细结构变化.图像用Flyvidoe图像处理软件处理.
2.5.2 透射电镜观察PMФ染毒培养48 h后,培养基清洗两次,刮取细胞经2000 r·min-1离心10 min,吸弃培养基,加入2.5%戊二醛,固定2h以上,0.1 mol·L-1 PBS洗涤,1%锇酸后固定,梯度乙醇和丙酮脱水,Epon812环氧树脂包埋,LEICA EM UC6型超薄切片机超薄切片,枸橼酸铅-醋酸双氧铀双染色,PHILIPS TECNAI 10透射电镜观察.
2.6 PMФ功能检测 2.6.1 PMФ活力检测PMФ染毒培养72 h后,各孔加入20 μL浓度为5 mg·mL-1的MTT,继续培养3 h.小心吸弃上清液,加入二甲基亚砜(DMSO)100 μL,振荡10 min后于全自动酶标仪490 nm波长处测定光密度值(OD490),以(处理组OD490÷对照组OD490)×100%值表示PMФ的相对活力.
2.6.2 中性红吞噬能力检测PMФ染毒培养48 h后,加入0.1%的中性红生理盐水100 μL,继续培养2 h,弃上清液,用PBS洗3遍,小心吸出残液后,每孔加入细胞溶解液(乙酸∶无水乙醇=1∶1)200 μL过夜,待细胞全部溶解后,全自动酶标仪于490 nm波长处测定光密度值(OD490),以(处理组OD490÷对照组OD490)×100%值表示PMФ的相对吞噬能力.
2.6.3 NO产量检测PMФ染毒培养48 h后,小心吸出上清液100 μL,加入100 μL新鲜配制的Griess试剂,混匀,全自动酶标仪于550nm波长处测定光密度值(OD550),以(处理组OD550÷对照组OD550)×100%值表示PMФ产生NO的相对能力.
2.7 统计分析所有实验数据的统计处理用SPSS11.0软件完成,测定值以均数±标准差( ±s)表示,两组比较用配对t检验,P≤0.05为有显著性差异.
3 结果与分析(Results and analysis) 3.1 CdCl2、Pb(CH3COO)2对PMФ形态的影响图 1扫描电镜形态学研究结果显示,对照组PMФ圆形或卵圆形,形态完整,生长良好,贴壁牢固(图 1a),细胞伪足丰富(图 1b).在10-4 mol·L -1氯化镉染毒组,贴壁细胞数目稀少(图 1c),表面伪足减少,变细消失(图 1d).在10-4 mol·L -1 醋酸铅染毒组,细胞大小不匀,皱缩聚集(图 1e),少数细胞表面可见发芽,起泡,形成凋亡小体(图 1f).
 |
| 图 1 CdCl2 、Pb(CH3COO)2(10-4 mol·L-1)染毒48 h对PMФ形态结构的影响的扫描电镜观察 (a,b. 对照组,箭头示细胞表面伪足;c,d. CdCl2处理组,箭头示细胞表面伪足;e,f. Pb(CH3COO)2处理组,箭头示凋亡小体) Fig.1 SEM images showing the morphology Change of PMФ treated by CdCl2 or Pb(CH3COO)2(10-4 mol·L-1) for 48h(a, b.control, Pseudopod(↑); c, d. CdCl2, Pseudopod(↑); e, f. Pb(CH3COO)2, Apoptotic body(↑)) |
图 2透射电镜形态学研究结果显示,对照组PMФ细胞生长状态良好,细胞表面有丰富的突起,细胞核不规则形,胞质中含有丰富的嵴清晰的线粒体和吞饮泡(图 2a).在10-4 mol·L -1 氯化镉染毒组,绝大部分PMФ呈现典型细胞坏死特征,细胞表面突起消失,细胞膜破裂,胞质释放,细胞器结构损坏,胞质中出现数个空泡,细胞核染色质凝集(图 2b).在10-4 mol·L -1 醋酸铅染毒组,多数PMФ细胞表面突起变得更加细长,细胞膜完整,胞质中含有数个含铅盐的吞噬小体,线粒体嵴不明显,细胞核固缩染色质边集(图 2c);部分PMФ细胞凋亡形成凋亡小体,小体中包含线粒体、胞质、及断裂固缩的细胞核(图 2d).
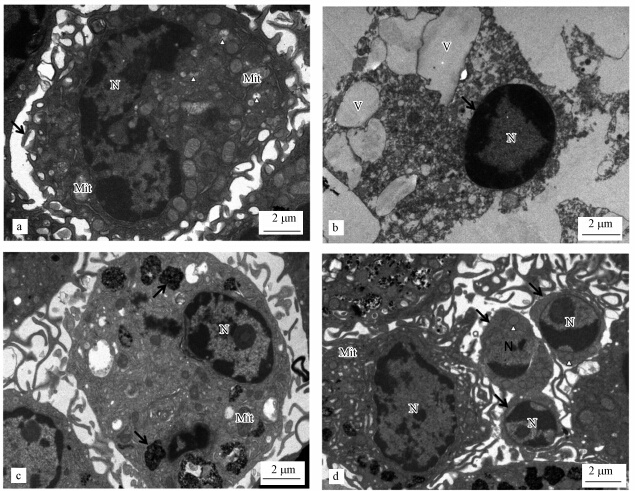 |
| 图 2 CdCl2 、Pb(CH3COO)2(10-4 mol·L-1)染毒48h对PMФ形态结构的影响的透射电镜观察(a. 对照组,不规则细胞核(N),线粒体(Mit),细胞表面突起(↑); b. CdCl2处理组,细胞核染色质边集(↑),胞质空泡(V); c. Pb(CH3COO)2处理组,细胞核(N)固缩,胞质含有铅盐的吞噬小体(↑); d. Pb(CH3COO)2处理组,凋亡小体(↑),凋亡小体中的线粒体(Δ)) Fig.2 TEM observation of morphology change of PMФ treated by CdCl2 or Pb(CH3COO)2(10-4mol·L-1)for 48h(a. control; b. CdCl2,condensed chromatin(↑),vacuoles(V); c. Pb(CH3COO)2,phagosome with lead salt(↑),d. Pb(CH3COO)2,Apoptotic body(↑)) |
以往的研究也发现,高浓度无机铅(20~40 μmol·L-1)暴露24~72 h后,引起家鼠PMФ(Gargioni et al., 2006)死亡;高浓度氯化汞(10-4 mol·L-1)暴露48h后,小鼠PMФ因细胞器严重损伤而引起细胞死亡(管琼峰和李继承,2003).本实验结果表明,高浓度氯化镉(10-4 mol·L-1)染毒导致PMФ死亡方式为细胞坏死,而高浓度醋酸铅(10-4 mol·L-1)染毒组中,有少量PMФ凋亡.这一结果提示,电镜形态学检测指标较适合反映高浓度镉、铅染毒的状态.
3.2 CdCl2,Pb(CH3COO)2对PMФ还原MTT的影响细胞活力是细胞毒理学研究中反映培养细胞功能改变的基本检测项目和可靠参数.本实验MTT实验结果显示(图 3),各剂量组氯化镉,醋酸铅染毒后72 h,均能明显抑制小鼠腹腔巨噬细胞还原MTT的活力(p<0.05或p<0.01),而且两组污染物对PMФ活力抑制程度随污染物浓度升高而增大,具有明显的剂量依赖效应.即使在极低浓度10-8 mol·L -1时,镉、铅污染物也可明显影响细胞活力(p<0.05).当污染物浓度达到10-4 mol·L -1时,细胞活力抑制最明显.以上实验结果说明各浓度氯化镉、醋酸铅染毒均可造成小鼠腹腔巨噬细胞活力下降,影响其正常免疫功能的发挥.以往的研究表明,铅对不同种属和不同来源的免疫细胞活力的效应是不同的,本实验的研究结果与Hemdan 等(Hemdan et al., 2005)在人外周血单核细胞Pb(CH3COO)2染毒试验中观察到的结果相一致.这一细胞活力抑制的机制可能是镉、铅影响细胞代谢的结果.
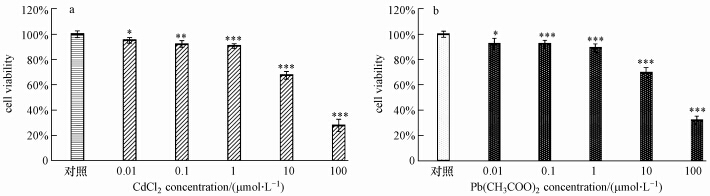 |
| 图 3 CdCl2、Pb(CH3COO)2降低巨噬细胞的活性(x±s,n=10) Fig.3 Concentration effect of CdCl2 and Pb(CH3COO)2 on the viability of PMФ(x±s,n=10)(*,p<0.05; **,p<0.01; ***,p<0.001) |
吞噬是巨噬细胞基本的生物功能,其在非特异性免疫、抗原递呈等过程中起着重要作用,因此检测其吞噬功能,可用来评价外来化合物的免疫毒性.本研究中性红吞噬实验结果显示(图 4),10-8、10-7、10-6 mol·L -1浓度氯化镉明显促进PMФ对中性红吞噬(p<0.001),10-4 mol·L -1浓度氯化镉则显著抑制PMФ吞噬功能(p<0.001),而10-5 mol·L -1浓度氯化镉染毒组PMФ吞噬能力与对照组一致,这一浓度可能是影响PMФ对镉吞噬功能的临界值.相比较而言,10-8 mol·L -1浓度醋酸铅促进PMФ对中性红吞噬,10-4 mol·L -1浓度醋酸铅显著抑制PMФ吞噬功能,其它各浓度醋酸铅对PMФ吞噬中性红能力几乎无影响.以往的研究也表明,低浓度镉、铅能促进培养细胞的增殖,而高浓度镉、铅均能抑制PMФ吞噬功能(Waseem et al., 1993; Misra et al., 2002).高浓度镉、铅抑制PMФ吞噬功能的分子机理可能是减少细胞膜E-cadherin粘附分子的表达,导致E-cadherin/beta-catenin复合体与细胞骨架结合的不稳定(Bruscalupi et al., 2009),破坏了细胞与细胞连接的完整性和吞噬泡的形成;也可能是通过与呼吸链上的酶结合严重干扰三磷酸腺生成而影响细胞膜的运输作用;还有可能是促进PMФ合成分泌前列腺素E2(PGE2),提高cAMP水平,抑制受体粘附表达和吞噬介导,从而影响了PMФ吞噬活性(邱士起等,1996).或者是以上3种途径共同造成的,其全面的影响机制有待进一步研究证实.这一结果提示,低浓度镉、铅不但不抑制PMФ吞噬功能,而且还有促进效应,高浓度时才呈现显著抑制效应.说明不同浓度镉,铅对PMФ吞噬功能的影响是不一样的,并不是简单的细胞毒性放大.
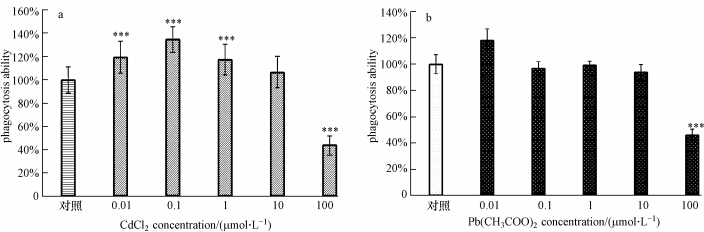 |
| 图 4 CdCl2、Pb(CH3COO)2对PMФ吞噬能力的影响(x±s,n=8) Fig.4 Effects of CdCl2 and Pb(CH3COO)2 on phagocytosis ability of PMФ(x±s,n=8)(***,p<0.001) |
NO是活化巨噬细胞分泌的重要免疫分子,是PMФ抑制细菌、真菌和寄生虫、杀伤肿瘤细胞等的效应分子(Bogdan,2001).PMФ是体内合成NO的重要部位之一,其与机体免疫功能之间具有紧密的联系(Nussler and Billiar, 1993).本研究不同浓度氯化镉、醋酸铅染毒对PMФ分泌NO的影响结果显示(图 5),各浓度组氯化镉对PMФ产生NO均有显著的抑制作用(p <0.05),其中10-8 mol·L -1浓度组氯化镉对PMФ产生NO抑制作用最为显著(p <0.001).在醋酸铅染毒组,10-8、10-7、10-6 、 10-5 mol·L -1浓度醋酸铅均对PMФ产生NO有极显著的抑制作用(p<0.001),而10-4 mol·L -1浓度醋酸铅对PMФ产生NO虽有抑制作用,但与对照组相比无统计学差异.这与文献报告5 μmol·L -1镉就能明显抑制PMФ分泌NO(吴静等,1999)、2 μmol·L -1铅能抑制成熟PMФ分泌NO的结果一致(Bussolaro et al., 2008).其抑至效应的分子机制可能是镉、铅通过与细胞生物分子内巯基的高亲和性实现的.巨噬细胞主要通过诱导合成一氧化氮合成酶(inducible nitric oxide synthase,iNOS)产生NO,其活性不依赖钙离子和钙调蛋白,故氯化镉、醋酸铅可能通过结合iNOS分子内巯基抑制巨噬细胞在体外分泌NO(Bogdan,2001).这一结果提示,各浓度氯化镉、醋酸铅均对PMФ分泌NO有显著的抑制效应,即使在极低浓度10-8 mol·L -1 就可明显抑制PMФ产生NO,而且抑制程度随污染物浓度升高而加大,具有明显的剂量依赖效应.说明氯化镉、醋酸铅通过抑制NO合成阻碍巨噬细胞发挥细胞毒和免疫调节作用.
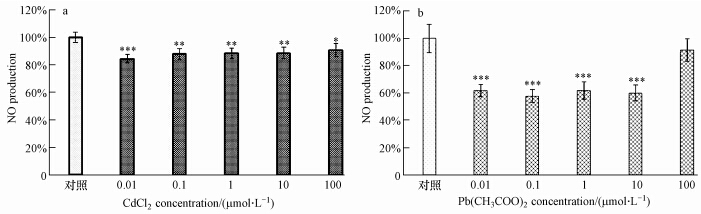 |
| 图 5 CdCl2、Pb(CH3COO)2降低巨噬细胞产生NO(x±s,n=10) Fig.5 Exposure of CdCl2 and Pb(CH3COO)2 to PMФ reduced their NO production(x±s,n=10)(Compared with control group,*,p<0.05; **,p<0.01; ***,p<0.001) |
传统的理化分析在环境监测中起了很重要的作用,能准确定量分析污染物中主要成分的含量,但是不能直接反映各种有毒物质对环境和生物的综合影响.而生物监测(bio-monitoring)通过检测生理、生化等变化参数,能够直接反映污染物的剂量和时效生物毒性效应,其监测具有连续、灵敏、综合等优点,已广泛应用于环境污染的研究.建立快速有效检测、反映污染物的剂量效应关系和评价其生物毒性大小的生物监测系统,一直是环境毒理学界研究的热点(吴邦灿等,2014; 尚惠华等,2004).本实验研究了不同浓度环境污染物镉、铅对小鼠腹腔巨噬细胞的毒性效应.PMФ的细胞形态学改变研究结果表明,10-4 mol·L -1浓度氯化镉,醋酸铅小鼠PMФ染毒时,出现明显毒性效应,PMФ因细胞结构破坏而引起PMФ死亡.氯化镉引起的PMФ死亡以细胞坏死为主,而醋酸铅引起部分PMФ细胞凋亡.PMФ的细胞功能改变研究结果表明,小鼠PMФ对氯化镉,醋酸铅染毒反应十分灵敏,极低浓度10-8 mol·L -1 氯化镉,醋酸铅就可使得小鼠巨噬细胞活力和NO分泌功能下降,而且这两个生化指标有很好的浓度依赖性.在所有检测剂量中,除高浓度10-4 mol·L -1剂量组细胞活力下降为20%外,其它浓度组细胞活力均在60%以上,说明细胞对镉、铅有较好的耐受性,是适合的生物学检测指标.本实验测定的有害浓度比常在儿童和动物体内检测到的低毒性、无症状铅浓度10-6 mol·L -1还低2个数量级(Hemdan et al., 2005),说明镉、铅即使在10-8 mol·L -1浓度也会对PMФ造成显著的毒性,直接影响巨噬细胞对病原微生物的吞噬,抗原递呈作用,降低机体免疫机能.本实验室以往的工作也证明在低浓度硫酸钠和氯化汞对PMФ染毒时,同样使得体外巨噬细胞活力和NO分泌功能显著下降(管琼峰和李继承,2003).因此,腹腔巨噬细胞的镉、汞、铅毒性效应在环境监测中可以作为一个潜在的灵敏生物监测指标.其它重金属污染物是否也能在不同浓度染毒时,对小鼠PMФ造成类似的毒性效应,相关研究正在进行中.
5 结论(Conclusions)1)重金属污染物镉、铅对小鼠腹腔巨噬细胞有明显的剂量依赖的细胞毒性作用.
2)小鼠腹腔巨噬细胞取材方便,对于检测指标反应灵敏,可以快速高效直观地反映污染物的危害,是一个合适的监测重金属污染物镉、铅危害的生物指示物.
| [1] | Beyersmann D, Hartwig A. 2008. Carcinogenic metal compounds:recent insight into molecular and cellular mechanisms[J]. Archives of Toxicology, 82(8):493-512 |
| [2] | Bogdan C. 2001. Nitric oxide and the immune response[J]. Nature Immunology, 2(10):907-916 |
| [3] | Bruscalupi G, Massimi M, Devirgiliis L C, et al. 2009. Multiple parameters are involved in the effects of cadmium on prenatal hepatocytes[J]. Toxicology in Vitro, 23(7):1311-1318 |
| [4] | Bussolaro D, Filipak Neto F, Gargioni R, et al. 2008. The immune response of peritoneal macrophages due to exposure to inorganic lead in the house mouse Mus musculus[J]. Toxicology in Vitro, 22(1):254-260 |
| [5] | Gargioni R, Filipak Neto F, Buchi D F, et al. 2006. Cell death and DNA damage in peritoneal macrophages of mice (Mus musculus) exposed to inorganic lead[J]. Cell Biology International, 30(7):615-623 |
| [6] | 管琼峰, 李继承. 2003. 环境污染物对巨噬细胞的影响及生物监测意义[J]. 实验生物学报, 36(5):330-334 |
| [7] | Hemdan N Y A, Emmrich F, Adham K, et al. 2005. Dose-dependent modulation of the in vitro cytokine production of human immune competent cells by lead salts[J]. Toxicological Sciences, 86(1):75-83 |
| [8] | Järup L. 2003. Hazards of heavy metal contamination[J]. British Medical Bulletin, 68(1):167-182 |
| [9] | 孟紫强. 2000. 环境毒理学[M]. 北京:中国环境科学出版社. 131-139 |
| [10] | Mishra K P. 2009. Lead exposure and its impact on immune system:a review[J]. Toxicology in Vitro, 23(6):969-972 |
| [11] | Misra U K, Gawdi G, Akabani G, et al. 2002. Cadmium-induced DNA synthesis and cell proliferation in macrophages:the role of intracellular calcium and signal transduction mechanisms[J]. Cellular Signalling, 14(4):327-340 |
| [12] | Nussler A K, Billiar T R. 1993. Inflammation, immunoregulation, and inducible nitric oxide synthase[J]. Journal of Leukocyte Biology, 54(2):171-178 |
| [13] | Ohsawa M. 2009. Heavy metal-induced immunotoxicity and its mechanisms[J]. Yakugaku Zasshi, 129(3):305-319 |
| [14] | 邱士起, 陈成章, 童胜璋. 1996. 镉对小鼠腹腔巨噬细胞吞噬功能影响与PGE2关系的实验研究[J]. 中国公共卫生学报, 15(5):278-279 |
| [15] | Razmiafshari M, Kao J, d'Avignon A, et al. 2001. NMR identification of heavy metal-binding sites in a synthetic zinc finger peptide:toxicological implications for the interactions of xenobiotic metals with zinc finger proteins[J]. Toxicology and Applied Pharmacology, 172(1):1-10 |
| [16] | 尚惠华, 胡绍燊, 刘冬姝, 等. 2004. 生物标志物在环境评价中的应用研究概况与趋向[J]. 污染防治技术, 17(1):49-53 |
| [17] | Waisberg M, Joseph P, Hale B, et al. 2003. Molecular and cellular mechanisms of cadmium carcinogenesis[J]. Toxicology, 192(2/3):95-117 |
| [18] | Waseem M, Bajpai R, Kaw J L. 1993. Reaction of pulmonary macrophages exposed to nickel and cadmium in vitro[J]. Journal of Environmental Pathology Toxicology and Oncology, 12(1):47-54 |
| [19] | 吴邦灿, 费龙. 2014. 现代环境监测技术(第三版)[M]. 北京:中国环境科学出版社 |
| [20] | 吴静, 张琳, 程学敏, 等. 1999. 镉对巨噬细胞分泌功能影响的研究[J]. 环境与健康杂志, 16(6):332-333 |
 2015, Vol. 35
2015, Vol. 35


