2. 西南大学生命科学学院, 重庆 400715;
3. 南开大学生命科学学院植物生物学和生态学系, 天津 300071;
4. 山西省农业科学院园艺研究所, 太原 030031
2. College of Life Sciences, Southwest University, Chongqing 400715;
3. Department of Plant Biology and Ecology, College of Life Science, Nankai University, Tianjin 300071;
4. Institute of Horticulture, Shanxi Academy of Agricultural Sciences, Taiyuan 030031
二氧化硫(Sulfur dioxide,SO2)是常见的大气污染物之一,主要来源于煤、石油燃烧和含硫矿石的冶炼等.SO2易溶于水,会生成亚硫酸,并形成危害严重的酸雨,进而制约植物的生长发育(Pan et al., 2001),也可以以气体方式从气孔进入植物体内,产生HSO-3和SO2-3,SO2-3被氧化成SO2-4,同时产生大量活性氧(ROS),如超氧阴离子(O-2)、过氧化氢(H2O2)、羟基自由基(· OH),从而产生氧化胁迫(Madamanchi et al., 1991;Xia et al., 2012; Li et al., 2012),对组织、细胞和生物大分子产生作用(夏宗良等,2009).
气孔在植物与外界进行气体和水分交换中起着关键作用.气孔保卫细胞能够感知环境中温度、光照、空气湿度及气体组分等的变化,对多种内外刺激做出反应(Pei et al. 2000; Sirichandra et al., 2009).大气中的SO2通过气孔进入植物体后,植物可以通过调节气孔开度来限制SO2进入组织,防御 SO2伤害,调节植物的抗逆反应(Fan et al., 2004; 李利红等,2008).低浓度的SO2能影响植物气孔运动,导致气孔开度减小,影响植物的正常生理活动,高浓度的SO2会造成气孔保卫细胞结构损伤,甚至死亡(Madamanchi et al., 1991;Yi et al., 2012;魏爱丽等,2014).
研究表明,NO、H2O2、Ca2+、脱落酸(ABA)SA和H2S等越来越多的信号分子参与了保卫细胞气孔响应环境刺激的信号调节过程(刘新等,2003;吕东等,2005;Yan et al., 2007; Li et al.,2014).H2S、Ca2+、NO和ROS 在模式植物拟南芥和一些农作物如蚕豆、甘薯等对SO2的响应过程中起着很重要的作用(赵均等,2014;仪慧兰等,2012;景秀清, 2012,Hu et al., 2014).然而关于SO2胁迫下景观植物气孔对 SO2响应的信号机制还很少有报道.
园林景观植物是城市生态环境的主体,在改善空气质量,维护生态平衡,改善生态环境中起着主导和不可替代的作用.萱草(Hemerocallis fulva),隶属百合科,多年生宿根草本花卉,是非常重要的园林固坡和城市绿化植物,因而很早就引起了学者的广泛的重视(陈丽飞,2007;Griesbach,1989;Zhang et al.,2014).SO2污染造成环境恶化,研究其对景观园林绿化植物的毒作用机制,对城市绿化建设和环境保护工作有着及其重要的理论和现实意义.本课题组前期研究了SO2胁迫对萱草保卫细胞的致死效应及其信号调节(Wei et al., 2013),然而萱草气孔对SO2胁迫是如何响应的,又有哪些信号分子起作用还尚未进行深入研究.因此,本文以萱草叶片下表皮为材料,进一步研究SO2诱导的萱草保卫细胞气孔运动及其信号调节.
2 材料与方法(Materials and methods) 2.1 实验材料将优质大花萱草金娃娃(Hemerocallis fulva ‘Stella deoro’)宿根种植于花盆中,温室培养,待6~8周后,植株约15~20片叶子,叶长约20 cm时进行实验.
2.2 药物处理取10盆长势良好的萱草植株,并取第2层平展叶片,用镊子撕取其下表皮,毛刷去除表皮上的叶肉组织.将长宽适中的表皮块浸于MES缓冲液(50 mmol · L-1 KCl,10 mmol · L-1 MES,0.1 mmol · L-1 Tris,pH为6.4)中,保证以下每个处理至少6个表皮条.
2.2.1 SO2衍生物处理将表皮条置于MES缓冲液中,在培养箱中照光(96 μmol · m-2 · s-1)处理3 h,让气孔张开,然后将处理过的表皮条用50~400 μmol · L-1 的SO2衍生物(Na2SO3 ∶ NaHSO3=3 ∶ 1)照光3 h,观察气孔开度.取部分经照光和SO2衍生物处理过的表皮条置于缓冲液中,在光下洗脱恢复处理3 h,观察气孔关闭程度. 2.2.2 缓解处理 将表皮块置于缓冲液中,在培养箱中光照培养3 h,分别转移到含250 μmol · L-1SO2衍生物和相应浓度的干扰剂中光照培养3 h.一部分表皮用于测量气孔开度,另一部分表皮进行荧光标记,测量信号分子含量.干扰剂包括抗氧化剂抗坏血酸(AsA:0.05、0.1、0.5 mmol · L-1)、过氧化氢酶(CAT:100、200、300 U · mL-1)、Ca2+螯合剂 EGTA(0.05、0.1、0.5 mmol · L-1)、Ca2+通道抑制剂 LaCl3(0.05、0.1、0.5 mmol · L-1)、硝酸还原酶抑制剂NaN3(0.05、0.1、0.2 mmol · L-1)、NO清除剂 C-PTIO(0.05、0.2、0.5 mmol · L-1)和NO 合成酶抑制剂 L-NAME(0.01、0.02、0.03 mmol · L-1).
2.2.3 荧光标记表皮块经缓解处理之后用蒸馏水清洗几次,将其取出,经AsA和CAT处理的表皮块用活性氧荧光探针DCFH-DA(20 μmol · L-1)荧光标记,并在培养箱中暗孵育1 h(25 ℃),测量保卫细胞中ROS含量;经Ca2+螯合剂EGTA和Ca2+通道抑制剂LaCl3处理的表皮块用钙离子荧光探针Fluo-3AM(10 μmol · L-1)进行荧光标记,在培养箱中暗孵育2 h(25 ℃),测定细胞内钙离子含量;经硝酸还原酶抑制剂NaN3、NO 清除剂 C-PTIO和NO 合成酶抑制剂 L-NAME 处理过的表皮块用 NO 荧光探针DAF-FMDA(10 μmol · L-1)荧光标记,在培养箱中暗孵育1.5 h(25 ℃),测定细胞内 NO 含量. 2.2.4 保卫细胞内ROS、Ca2+、NO在气孔运动中的相互关系 表皮块经缓解处理之后用蒸馏水清洗几次,将其取出.经EGTA、AsA和L-NAME处理过的表皮条各自分别分成3部分,分别测定经不同干扰剂处理之后保卫细胞内ROS、Ca2+和NO的含量.
2.3 指标测定 2.3.1 气孔开度测量将药物处理后的表皮条用缓冲液漂洗后置于载坡片上,装片在光学显微镜下进行观察,采用MOTIC Advanced 3.2 数码成像采集系统采集图片(10×40),并使用该软件进行气孔开度测量.每组处理随机选取至少100个气孔进行测量,实验重复测3次,最后统计平均值.
2.3.2 保卫细胞内钙离子、一氧化氮和活性氧含量检测将用Ca2+、NO和ROS荧光探针标记后的表皮块经暗孵育后置于载坡片上,制成装片,置于OLYMPUS DP70荧光显微镜蓝色激发光下观察并拍照(40×),采用图像分析软件Image-Pro Plus 6.0测量保卫细胞荧光值,每组测量100个细胞,计算各组荧光信号的平均值;将对照组的荧光值设为1,相对荧光值即为各处理组与对照组荧光值之比,用不同信号分子的相对荧光值分别代表其含量(魏爱丽等,2014).
2.4 数据统计分析计算每组经3次重复实验数值的平均值和标准差.F检验后,采用Duncan方法进行多重比较,分析不同处理组与对照组间的差异显著性.各表中*表示p<0.05,为差异显著,**表示p<0.01,为差异极显著,均与对照相比;各表中各数据后面的字母的排序从小到大为a,b,c…,不同字母代表差异显著(p<0.05).
3 结果与分析(Results and analysis) 3.1 SO2处理对萱草保卫细胞气孔开度的影响由表 1可以看出,将萱草叶表皮置于缓冲液中光照处理3 h后,用不同浓度的SO2衍生物处理3 h,萱草保卫细胞的气孔开度随SO2衍生物浓度的增加呈递减趋势.统计分析表明,250~400 μmol · L-1 SO2衍生物处理组气孔开度极显著(p<0.01)小于对照组.250 μmol · L-1SO2衍生物处理组气孔开度减少了44%,400 μmol · L-1 SO2衍生物处理组气孔开度减小了83%.说明SO2可促进萱草开放的气孔关闭,较高浓度组的效果尤为显著.
| 表1 不同浓度 SO2衍生物处理后的萱草保卫细胞气孔开度 Table 1 Stomatal aperture of guard cells of H. fulva leaves treated with SO2 derivatives |
光照后经不同浓度SO2衍生物处理3 h的萱草表皮浸于缓冲液中洗脱处理3 h,测量气孔开度,发现SO2衍生物处理所导致的气孔关闭程度均有所缓解.0~250 μmol · L-1的SO2衍生物处理组气孔开度恢复程度较大,250 μmol · L-1 SO2衍生物处理组气孔恢复增幅为93%,而 300~400 μmol · L-1的 SO2衍生物处理组气孔开度极显著低于对照组.结果表明,250 μmol · L-1的 SO2衍生物能引起萱草气孔开度极显著降低,但恢复处理后萱草保卫细胞气孔开度又能极显著恢复,证明此浓度下萱草保卫细胞能够灵敏调节气孔运动,故以此浓度进行后续试验.
3.2 ROS干扰剂对SO2胁迫下萱草气孔运动的影响由表 2和图 1可以看出,250 μmol · L-1 SO2显著降低了萱草保卫细胞气孔开度,ROS相对荧光值即ROS水平极显著增高,添加不同浓度的AsA和CAT处理后,各处理组气孔开度均增大;添加0.05、0.1、0.5 mmol · L-1 AsA处理后气孔开度比单独SO2处理组分别增加39.8%、54.9%、44.2%,ROS含量下降17.6%、34.2%和29.2%;添加浓度为100、200、300 U · mL-1 CAT处理后气孔开度比单独SO2处理组分别提高42.5%、49.6%和38.9%,ROS含量分别下降18.8%、35.3%和16.6%,且以0.1 mmol · L-1 AsA和200 U · mL-1 CAT处理组气孔开度增幅较大,ROS水平比SO2处理组降低显著,说明ROS参与了萱草保卫细胞的气孔运动.
| 表2 AsA、CAT和250 μmol · L-1 SO2衍生物处理后保卫细胞的气孔开度和ROS含量 Table 2 Stomatal aperture and ROS content treated with 250 μmol · L-1 SO2,AsA and CAT |
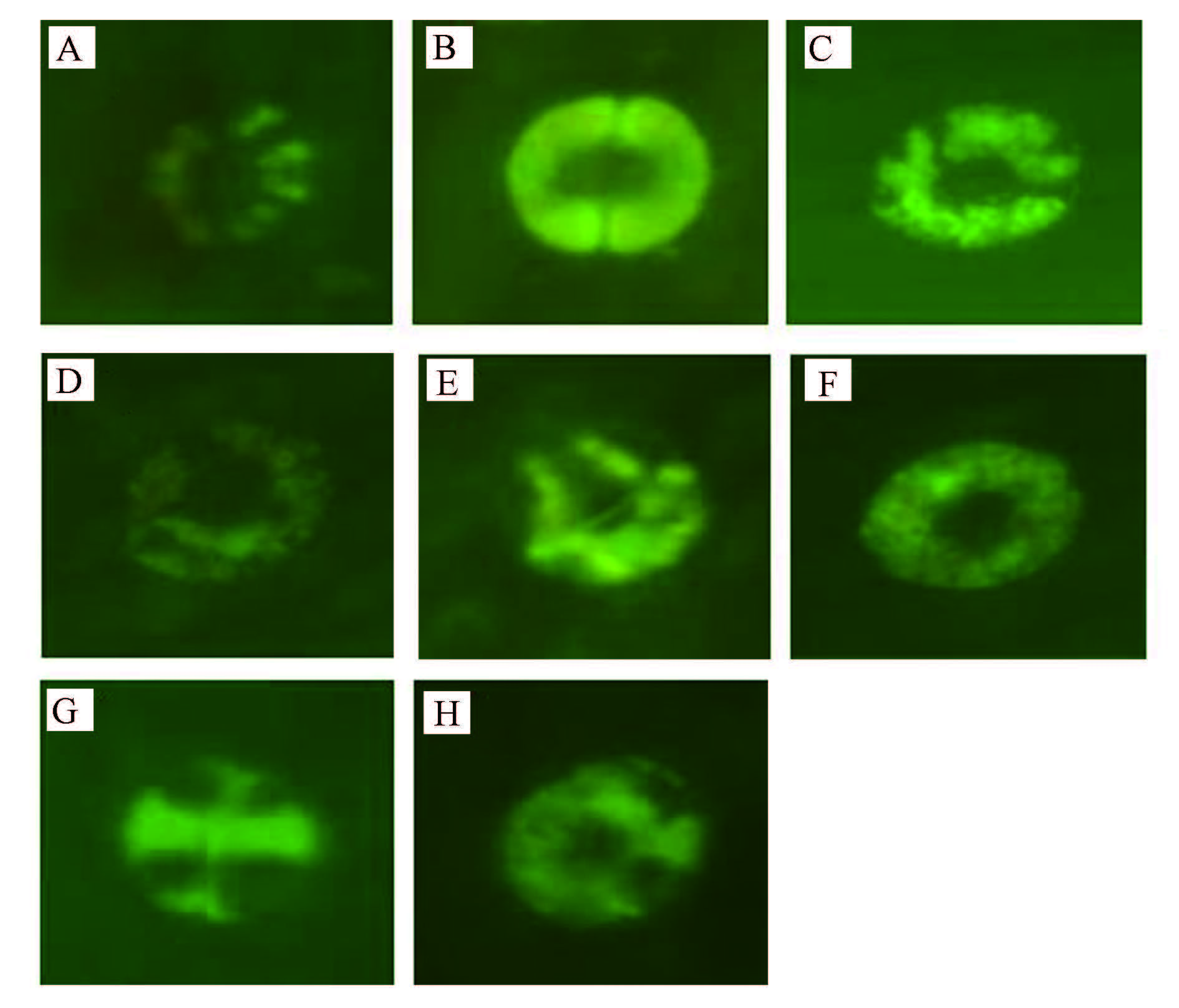 |
| 图1 AsA和CAT处理后保卫细胞中的ROS水平荧光标记图(A~H对应处理见表 1) Fig.1 Fluorescence labeling graphs of ROS levels of guard cells treated with AsA and CAT in H. fulva leaves |
从表 3和图 2可以看出,250 μmol · L-1SO2显著降低了萱草保卫细胞气孔开度,NO相对荧光值即NO水平极显著增高.用不同浓度的硝酸还原酶抑制剂NaN3、NO合成酶抑制剂L-NAME和NO清除剂C-PTIO处理后,各处理组气孔开度均增大;0.05、0.2、0.5 mmol · L-1 NaN3处理后,气孔开度比单独SO2处理组分别增加38.1%、48.7%、39.0%;0.05、0.02、0.03 mmol · L-1 L-NAME处理后气孔开度的增幅分别为37.1%、53.1%、45.1%;0.05、0.2、0.5 mmol · L-1 C-PTIO处理后气孔开度的增幅分别为38.1%、51.3%、40.1%.相对荧光值即NO水平比单独SO2处理组显著降低,0.05、0.2、0.5 mmol · L-1 NaN3处理后NO水平比SO2处理组降低了19%、33%、27%;0.05、0.02、0.03 mmol · L-1 L-NAME处理后NO水平降低了9.8%、29%、24%;0.05、0.2、0.5 mmol · L-1 C-PTIO处理后NO水平降低了15%、23%、19%.且以0.2 mmol · L-1 NaN3和0.2 mmol · L-1 C-PTIO,以及0.02 mmol · L-1 L-NAME处理组气孔开度增幅较大,NO水平比SO2处理组降低显著.说明NO参与了萱草保卫细胞的气孔运动.
| 表3 NaN3、L-NAME、C-PTIO和250 μmol · L-1 SO2衍生物共同处理后保卫细胞的气孔开度和NO含量 Table 3 Stomatal aperture and ROS content treated with NaN3,L-NAME,C-PTIO and 250 μmol · L-1 SO2 in H.fulva leaves |
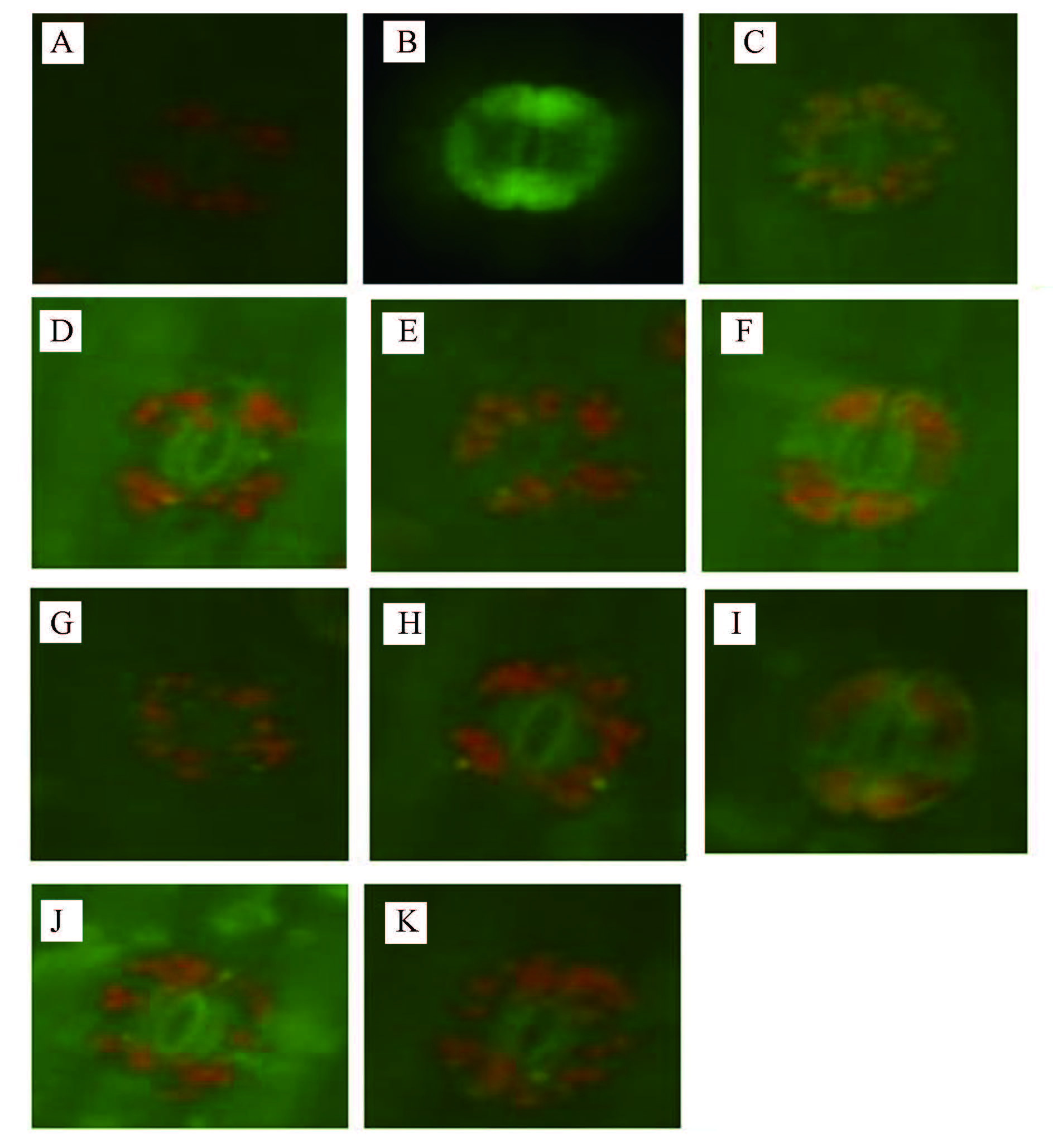 |
| 图2 NaN3,L-NAME和C-PITO处理后保卫细胞中NO水平的荧光标记图(A~K对应处理见表 3) Fig.2 Fluorescence labeling graphs of NO levels of guard cells treated with NaN3,L-NAME and C-PITO in H. fulva leaves |
由表 4和图 3可以看出,250 μmol · L-1 SO2显著降低了萱草保卫细胞气孔开度,Ca2+相对荧光值即Ca2+水平极显著增高.用不同浓度的Ca2+螯合剂EGTA(0.05、0.1、0.5 mmol · L-1)和Ca2+通道抑制剂LaCl3(0.05、0.1、0.2 mmol · L-1)处理后,各处理组气孔开度均增大;浓度为0.05、0.1、0.5 mmol · L-1 EGTA处理后气孔开度的增幅分别为39.8%、52.2%和42.5%;浓度为0.05、0.1、0.2 mmol · L-1 LaCl3处理后气孔开度的增幅分别为39.8%、49.6%和43.4%.相对荧光值即Ca2+水平比SO2处理组显著降低;0.05、0.1、0.5 mmol · L-1 EGTA处理后Ca2+水平降低了24%、43%、31%;0.05、0.1、0.2 mmol · L-1 LaCl3处理 后Ca2+水平降低了18%、36%、31%,且以0.1 mmol · L-1 EGTA和0.1 mmol · L-1 LaCl3处理的气孔开度增幅较大,Ca2+水平比SO2处理组降低显著.说明Ca2+参与了萱草保卫细胞的气孔运动.
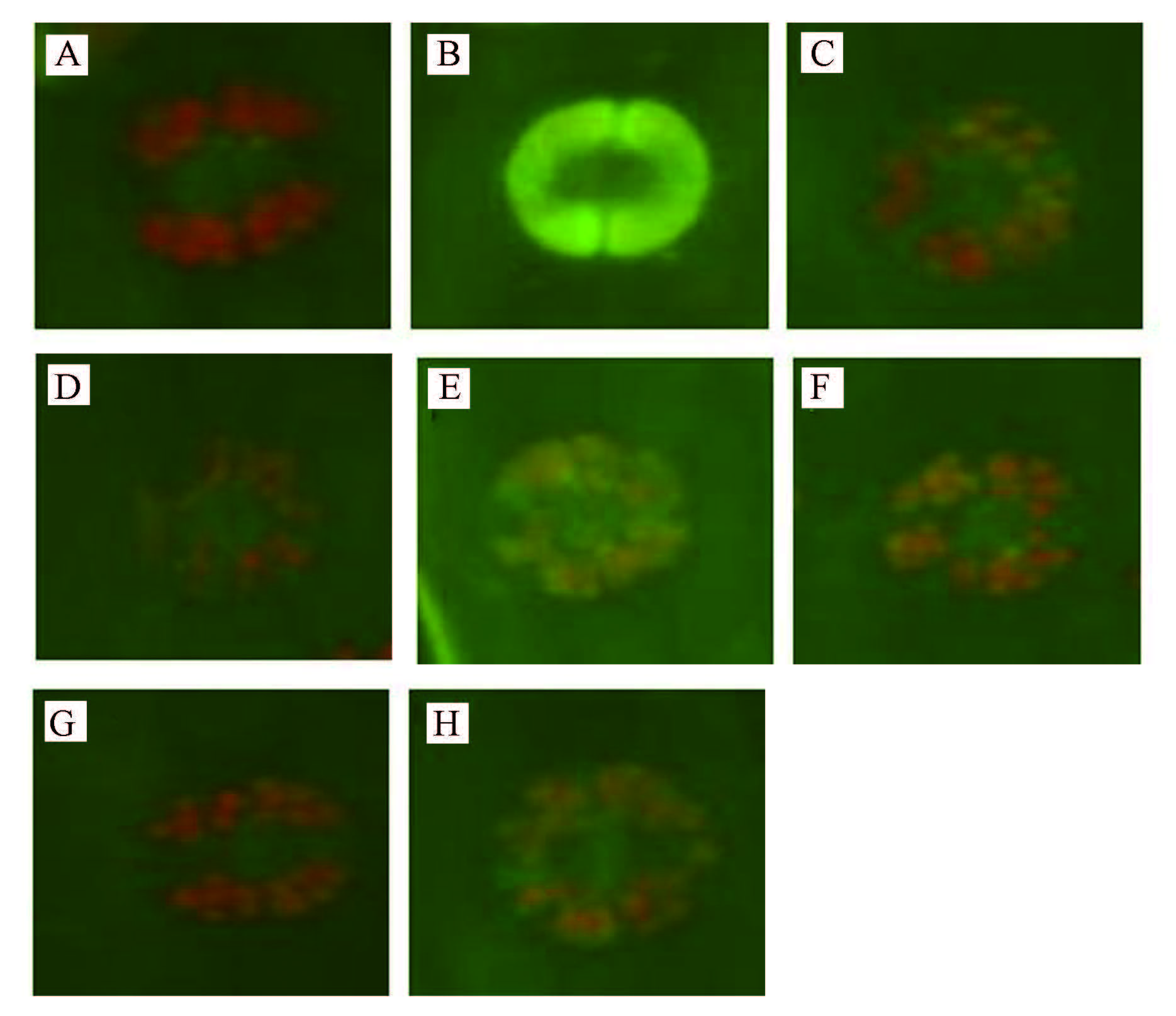 |
| 图3 EGTA和LaCl3处理后保卫细胞中Ca2+水平的荧光标记图(A~H对应处理见表 4) Fig.3 Fluorescence labeling graphs of Ca2+ levels of guard cells treated with EGTA and LaCl3 in H. fulva leaves |
| 表4 EGTA、LaCl3和250 μmol · L-1 SO2衍生物处理后保卫细胞的气孔开度和Ca2+含量 Table 4 Stomatal aperture and ROS content treated with EGTA,LaCl3 and 250 μmol · L-1 SO2 in H.fulva leaves |
由表 5可以看出,抗氧化剂AsA与SO2衍生物共同作用后,保卫细胞内的ROS、Ca2+和NO含量均较SO2单独处理组减少,但NO的减少幅度相对小;NO合成酶抑制剂L-NAME与SO2衍生物共同作用 后,细胞内NO、Ca2+和ROS含量也均减少;而Ca2+螯合剂EGTA与SO2衍生物共同作用后,保卫细胞内Ca2+含量减少,NO和ROS含量则无显著变化,表明Ca2+信号在NO和ROS信号下游.
| 表5 ROS、NO、Ca2+干扰剂和SO2衍生物共同作用后的相对水平 Table 5 ROS,NO,Ca2+ levels treated by their antagonists and SO2 derivatives |
SO2作为一种大气污染物,对植物的伤害是多方面的.研究表明,它影响植物的新陈代谢,加快呼吸作用,改变酶的活性,导致气孔保卫细胞死亡(王磊等,2007;仪慧兰等,2009;Wei et al., 2013).SO2胁迫下保卫细胞气孔的关闭效应已在拟南芥(赵均等,2014)、蚕豆(仪慧兰等,2012)等多种植物中被研究证实.
ROS作为第二信使,在植物遭遇逆境胁迫时能传递信号,使植物组织产生一系列的防御反应(Neill et al., 2002).AsA和CAT是两种重要的抗氧化剂,可以通过不同的途径来清除细胞内多余的活性氧(程艳丽,2005;Huang et al., 2005).本试验中,经AsA和CAT与SO2一同处理后,SO2诱导的保卫细胞气孔关闭得到显著减缓,同时,保卫细胞中ROS含量显著降低,表明ROS参与调节了SO2诱导的保卫细胞气孔运动.
Ca2+是细胞内重要的第二信使,参与多种生理过程.研究表明,Ca2+参与了水杨酸诱导蚕豆气孔运动时的信号转导(刘新等,2003).本研究中,经Ca2+螯合剂EGTA或Ca2+通道抑制剂LaCl3处理后,SO2诱导的萱草保卫细胞气孔关闭程度减小,同时,保卫细胞内Ca2+水平降低,表明Ca2+参与了萱草气孔运动的调控,通过细胞膜上的Ca2+通道调节胞内外Ca2+含量而调节气孔运动.
NO是一种微小、可扩散、多功能的跨细胞信使,已被证实参与许多生理和病理过程(王鹏程等,2009).当细胞受到外界胁迫时,胞内NO含量迅速增加,引起ROS爆发,改变细胞的活性状态,也可能通过Ca2+或cGMP介导的环核苷酸门控离子通道的激活来发挥作用(Neill et al., 2002;肖强等,2005).NO还参与调节细胞程序性死亡、气孔关闭、根系重力感应等众多生理过程(熊杰等,2011).本研究中,经硝酸还原酶抑制剂NaN3、NO合成酶抑制剂L-NAME和NO清除剂C-PTIO进行干扰处理后,SO2胁迫所导致的气孔关闭效应有所减缓,气孔开度增大,细胞中NO含量增高,表明NO参与了萱草保卫气孔运动的调节.用不同干扰剂和SO2衍生物共同作用于萱草保卫细胞后,检测分析一种信号分子变化时胞内其余信号分子的变化规律(王毅,2013),发现不同浓度的NO干扰剂处理后,胞内NO、ROS、Ca2+水平同期降低,ROS清除剂处理后,ROS、NO、Ca2+水平也都降低,但NO下降幅度小些,而用Ca2+干扰剂处理后,胞内Ca2+水平降低,而NO、ROS水平变化不大.说明在SO2诱导的萱草保卫细胞气孔运动过程中,NO和ROS能够调节胞内Ca2+水平,NO和ROS具有相互作用,即NO和ROS在Ca2+上游调控保卫细胞气孔运动.这与仪慧兰等(2012)在SO2诱导的蚕豆保卫细胞运动中的结果相似.
5 结论(Conclusions)SO2诱导的萱草保卫细胞气孔运动,可能通过诱导NO增加,调节胞内Ca2+水平,或NO引起ROS爆发,激活细胞质膜钙通道,进而引起胞内Ca2+增加的信号途径调控保卫细胞的气孔关闭.
| [1] | 陈丽飞,董然.2007.萱草属植物研究进展[J].北方园艺,(6):66-69 |
| [2] | 程艳丽,宋纯鹏.2005.植物细胞H2O2的信号转导途径[J].中国科学C辑(生命科学),35(6):480-489 |
| [3] | Fan L M,Ghao G,Assmann S M.2004.Guard cells:a dynamic signaling model[J].Curr Opin Plant Biol,7:537-546 |
| [4] | Griesbach R J.1989.Selection of a dwarf hemerocallis through tissue culture[J].Hort Sci,24(6):1027-1028 |
| [5] | Hu K D,Tang J,Zhao D L,et al.2014.Stomatal closure in sweet potato leaves induced by sulfur dioxide involves H2S and NO signaling pathways[J].Biologia Plantarum.58(4):676-680 |
| [6] | Huang C H,He W L,Guo J K,et al.2005.Increased sensitivity to salt stress in an ascorbate deficient Arabidopsis mutant[J].J Exp Bot,56(422):3041-3049 |
| [7] | 景秀清.2012.H2S在SO2诱导蚕豆气孔运动与保卫细胞死亡中的作用[D].太原:山西大学 |
| [8] | 李利红,仪慧兰,王磊,等.2008.二氧化硫暴露对拟南芥叶片形态和生理生化指标的影响[J].农业环境科学学报,27 (2):525-529 |
| [9] | Li L,Yi H.2012.Effect of sulfur dioxide on ROS production,gene expression and antioxidant enzyme activity in Arabidopsis plants[J].Plant Physiol Bioch,58:46-53 |
| [10] | Li Y,Xu S S,Gao J,et al.2014.Chlorella induces stomatal closure via NADPH oxidase-dependent ROS production and its effects on instantaneous water use efficiency in Vicia faba[J].PLoS One,9:e93290 |
| [11] | 刘新,孟繁霞,张蜀秋,等.2003.Ca2+参与水杨酸诱导蚕豆气孔运动时的信号转导[J].植物生理与分子生物学,29(1):59-64 |
| [12] | 吕东,张骁,江静,等.2005.NO可能作为H2O2的下游信号介导ABA诱导的蚕豆气孔关闭[J].植物生理与分子生物学报,31:62-70 |
| [13] | Madamanchi N R,Alscher R G.1991.Metabolic bases for differences in sensitivity of two pea cultiva[J].Plant Physiol,97:88-93 |
| [14] | Neill S J,Desikan R,Hancock J T.2002.Hydrogen peroxide signaling[J].Current Opinion in Plant Biology,5(5):388-395 |
| [15] | Pan J W,Zhu M Y,Chen H.2001.Aluminum-induced cell death in barely root tips[J].Environ Bot,46(1):71-79 |
| [16] | Pei Z M,Murata Y,Benning G,et al.2000.Calcium channels activated by hydrogen peroxide mediate abscisic acid signaling in guard cells[J].Nature,106:731-734 |
| [17] | Sirichandra C,Wasilewska A,Vlad F,et al.2009.The guard cell as a single model towards understanding drought tolerance and abscisic acid action[J].J Exp Bot,60:1439-1463 |
| [18] | 王磊,仪慧兰.2007.SO2胁迫对拟南芥抗氧化酶活性的影响[J].生态环境,16(6):1612-1614 |
| [19] | 王鹏程,杜艳艳,宋纯鹏.2009.植物细胞一氧化氮信号转导研究进展[J].植物学报,44(5):517-525 |
| [20] | 王毅,仪慧兰.2013.NO参与铝诱导蚕豆保卫细胞死亡的调控[J].环境科学学学报,33(6):1803-1808 |
| [21] | 魏爱丽,辛晓静,王云山,等.2014.SO2诱导的萱草保卫细胞凋亡及其信号调节[J].环境科学学报,34(3):801-806 |
| [22] | Wei A,Xin X J,Wang Y S, et al.2013.Signal regulation involved in sulfur dioxide-induced guard cell apoptosis in Hemerocallis fulva[J].Ecotoxicology and Environmental Safety,98:41-45 |
| [23] | Xia Z,Sun K,Wang M,et al.2012.Over expression of a maize sulfite oxidase gene in tobacco enhances tolerance to sulfite stress via sulfite oxidation and CAT mediated H2O2 scavenging[J].PLoS ONE,5:e37383 |
| [24] | 肖强,郑海雷.2005.植物中的一氧化氮信号分子[J].生物学通报, 40(11):17-18 |
| [25] | 熊杰,符冠富,杨永杰,等.2011.一氧化氮在植物根系生长发育过程中的作用研究进展[J].华中农业大学学报,30(3):375-383 |
| [26] | Yan J,Tsuichihara N,Etoh T,et al.2007.Reactive oxygen species and nitric oxide are involved in ABA inhibition of stomatal opening[J].Plant,Cell Environ.,30:1320-1325 |
| [27] | Yi H,Yin J,Liu X,et al.2012.Sulfur dioxide induced programmed cell death in Vicia guard cells[J].Ecotox Environ Safe,78:281-286 |
| [28] | 仪慧兰,刘鑫,尹晶晶.2012.活性氧与NO在SO2诱导蚕豆气孔运动中的作用[J].河南大学学报,42(5):593-598 |
| [29] | 仪慧兰,仪民,吴婷.2009.SO2诱导拟南芥保卫细胞凋亡[J].山西大学学报(自然科学版),32(4):62-626 |
| [30] | Zhang C,Cao D,Kang L,et al.2014.Ploidy variation and karyotype analysis in Hemerocallis spp.(Xanthorrhoeaceae) and implications on daylily breeding[J].New Zeal J Crop Hort Sci,42(3):183-193 |
| [31] | 赵均,薛美昭,白鹤丽,等.2014.硝酸还原酶介导的NO合成参与SO2引发的拟南芥气孔运动的调节[J].环境科学学报,34(3):796-800 |
 2016, Vol. 36
2016, Vol. 36


