苯系物是常见的毒性有机污染物,其主要来源为机动车尾气、建筑涂装、工业排放、餐饮油烟等(Liu et al., 2008).甲苯是苯系物中含量较高的一种污染物,常用的控制方法主要有吸附法、燃烧法、等离子体法和光降解法等(王文婷等,2014;刘洋等,2006).其中,光降解技术因其高效、无二次污染等优点而备受关注.研究发现,一定波长范围的紫外光能够发射高能量光子,激发空气中的水蒸气和氧气产生具有强氧化作用的· OH(邓南圣等,2003;王灿等,2008)等物质,最终实现有机污染物的降解.很多学者利用光降解技术对甲苯等有机物的光化学降解展开了一系列研究.Korologos等(2012)利用P25/Pt、P25/Fe、P25/Ce催化剂降解苯系物,结果显示,随着甲苯浓度的增加,其降解效率会缓慢下降.光照强度对甲苯降解的影响则表现出了相反的效果,Vincent等(2009)发现在较低光强下,光降解速率(r)与光照强度(I0)呈线性关系:r∝I0;而中等光照强度下,r∝I0.50.Mo等(2009)研究了不同工况下TiO2催化剂对甲苯的光催化降解效果,发现降解产物中包含苯、苯甲酸、苯甲醛、甲酸、丁醛等物质.而Huang等(2011)利用复合型等离子体催化剂对甲苯进行催化降解,发现降解产物主要包含苯、苯甲醛、2-丁酮、乙酸等12种物质.同时,White等(2014)发现在不同相对湿度下,甲苯的光降解产物组成及种类也存在差异.然而,对甲苯的降解规律仍存在争议,且不同条件下甲苯降解的中间产物较为复杂(Shankar et al., 2015;Thevenet, et al., 2014),可能会产生部分毒性更强的物质,其定量分析也较为困难(White et al., 2014),相关分析报道并未得出明确的公认反应机理.基于此,本文选取UV 254 nm紫外灯为光源,在自制光化学反应器上开展甲苯的光氧化降解试验,研究甲苯初始浓度、相对湿度、光照强度对甲苯降解效果的影响,分析甲苯在降解过程中所产生的中间产物并探讨其降解机理,以期为甲苯光降解反应机理提供参考依据.
2 实验部分(Experiments)甲苯光降解反应实验装置如图 1所示,反应器主要为一内径130 mm、高度320 mm的圆柱形石英玻璃釜(容积约为4 L),内置小型石英套筒(内径40 mm,高度380 mm),其内放置UV254 nm紫外灯(广东雪莱特光电科技股份有限公司,zw9d12w-h145、zw18d17w-h217、zw24d17w-h317和zw36d17w-h411)提供实验所需的光源.实验时通过更换不同功率(9、18、24、36 W)的紫外灯以调节紫外光照强度,反应器温度在循环水浴中保持为30 ℃,其内部湿度通过蒸汽发生器及温湿度计进行调节控制.实验时量取一定体积的甲苯注入反应器内,并缓慢均匀加热使其完全挥发,静置待反应器重新达到设定温度.实验开始阶段,抽取气体样品以检测甲苯初始浓度C0,其后每隔1 h抽取气样品分析其甲苯浓度Ct.实验结束后,向反应器内缓缓通入空气,将反应后气体排入甲醇洗气瓶,收集甲醇清洗液,送入气相色谱质谱联用仪分析甲苯光降解中间产物.实验时的甲苯浓度由气相色谱仪(Agilent 7890A)检测,色谱柱为INNOWAX毛细管柱(30 m×0.25 mm×0.25 μm).GC的升温程序为在50 ℃时保持1 min,然后以10 ℃ · min-1的升温速率加热至180 ℃.采用外标法绘制标准曲线,标准曲线线性相关度(R2)大于0.99.
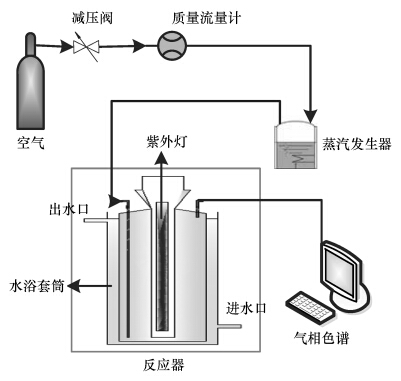 |
| 图 1 光降解反应系统图 Fig. 1 Apparatus of photooxidation reaction |
经过甲苯降解试验后的气体产物则通过Trace DSQ Ⅱ型气相色谱质谱联用仪(GC-MS,Thermo Fisher)进行检测,采用的色谱柱为DB-WAX色谱柱.柱温首先在40 ℃下保持1 min,然后以10 ℃ · min-1的升温速率加热到200 ℃,再以8 ℃ · min-1的升温速率加热到240 ℃并维持5 min.质谱离子源温度为200 ℃,扫描方式为全扫描,质量数范围为35~450,1 s扫描次数为5次.分析结果通过VOCs图谱与NIST05数据库进行比对确定最终产物.
本文中甲苯的转化效率由以下公式得出:
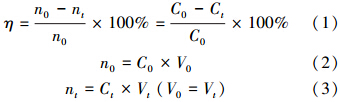
式中,C0、Ct分别为初始和光降解t时刻气相甲苯浓度(mg · m-3);n0、nt分别为初始和光降解t时刻气相甲苯的物质的量(mol);η为甲苯转化率;V0、Vt分别为初始和光降解t时刻气相甲苯的体积(m3).
3 结果与讨论(Results and discussion) 3.1 甲苯初始浓度的影响本文考察了不同甲苯初始浓度对转化率的影响,反应条件为:36 W紫外灯持续照射,相对湿度维持在55%,甲苯初始浓度分别为5.8、19.2、38.5、57.6 mg · m-3.将实验结果根据对数方程-ln(Ct/C0)-t进行处理,发现曲线线性度拟合良好,拟合系数达到0.99以上,同时发现系数随甲苯初始浓度的增加而降低,Wang等(2000)也发现了类似的规律,因此,提出伪一级反应动力学方程,具体如下式所示:
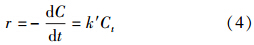
式中,r为反应速率(mg · h-1 · m-3); k′为表观速率常数(h-1).
结合图 2、表 1可以发现,UV254 nm紫外光对不同初始浓度的甲苯均有较高的脱除率,随着甲苯初始浓度的增加,单位时间内反应速率有所增加,但整体转化率会缓慢下降.反应时间为6 h,初始浓度为5.8 mg · m-3时,甲苯降解效率达到94.35%,表观速率常数为0.483 h-1;初始浓度为19.2 mg · m-3和38.5 mg · m-3时,甲苯降解效率略有下降,分别降至92.78%和88.15%;而当初始浓度为57.6 mg · m-3时,甲苯降解效率则下降为81.63%.这是因为紫外灯功率一定时,其单位时间内发出光子数量相同,即反应体系中所能产生自由基数量受到限制,而甲苯光直接氧化反应主要是依靠吸收光子和与· OH反应引发的,但随着甲苯浓度的增加,体系中所产生的自由基不足以引发更多反应(武江波等,2007;张忠良等,2006),从而造成甲苯转化率的缓慢降低.
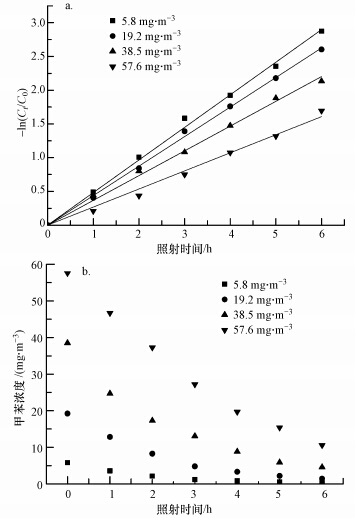 |
| 图 2 不同初始浓度下甲苯光降解反应的ln(Ct/C0)与t的关系(a)及甲苯的光降解效果(b) Fig. 2 Relationships between ln(Ct/C0) and irradiation time for photooxidation of toluene(a) and degradation rates in photooxidation of toluene under different initial concentrations(b) |
| 表 1 不同甲苯初始浓度下甲苯的反应动力学参数 Table 1 Kinetic parameters of toluene under different initial toluene concentrations |
在甲苯初始浓度为19.2 mg · m-3、相对湿度55%的实验条件下,考察了不同功率紫外灯下对应光强对甲苯脱除效果的影响,紫外灯功率分别为9、18、24、36 W.试验结果如图 3所示,其反应动力学参数列于表 2.结合图 3、表 2可以发现,随着光照强度的增加,甲苯的转化率不断增加.光照8 h后,紫外灯功率为9 W时,甲苯降解效率仅为33.42%;当紫外灯功率提高为18 W和24 W时,甲苯降解效率分别提高了37.77%和55.37%;而紫外灯功率为36 W时,甲苯降解效率可达96.99%.根据表 2动力学拟合结果可以看出,9、18、24、36 W所对应的表观速率常数与紫外灯光照强度成正比,与文献结论(Vincent et al., 2009)一致.这是因为紫外灯强度越高,单位时间内产生的光子数量越多,相应会增加激发甲苯脱除反应链的活性自由基,从而提高甲苯的光降解效率.
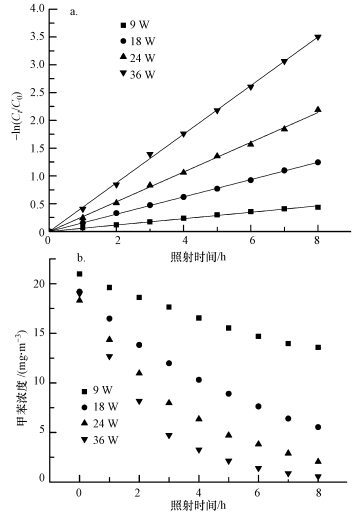 |
| 图 3 不同光照强度下甲苯光降解反应的ln(Ct/C0)与t的关系(a)及甲苯光降解效果(b) Fig. 3 Relationships between ln(Ct/C0) and irradiation time for photooxidation of toluene(a) and degradation rates in photooxidation of toluene(b)under different illumination intensities |
| 表 2 不同光照强度下甲苯的反应动力学参数 Table 2 Kinetic parameters of toluene under different illumination intensities |
图 4反映了在甲苯初始浓度为19.2 mg · m-3,光照时间为3 h时,不同紫外灯功率工况下,相对湿度对甲苯脱除效果的影响.实验过程中的所采用的相对湿度为25%~65%,从图中明显可以看出,在不同紫外光强度下,随着相对湿度的增加,甲苯转化均呈现先升高后降低的趋势.36 W紫外灯下,相对湿度为25%时,甲苯转化率为63.50%;当相对湿度为55%时,甲苯转化率提高了约12%,达到75.11%;而相对湿度为65%时,甲苯转化率却有所下降,降至68.75%.而在18 W和24 W紫外灯下,相对湿度为55%左右时,甲苯转化率也达到最高,分别为37.65%和56.45%.这是因为在254 nm紫外线照射下空气中的氧气会产生少量的单态氧O(1D)(王子东等,2009;张婷婷等,2014),与空气中的水蒸气反应生成· OH降解甲苯.相对湿度较低时,随着空气中水分子的增多,反应体系中· OH数目增多,使得体系中光化学反应增强,光降解效率得到提高;但随着湿度的进一步提高,体系中过量的水分子会与甲苯竞争吸收光子,甲苯的链式反应被减缓,从而导致甲苯转化率效率缓慢下降,这与张春洋等(2011)的研究结果一致.因此,需要寻求甲苯降解的最佳相对湿度,以确保实现较高的甲苯降解效率.本试验中发现,在不同光照强度下,甲苯降解效率最高时所对应的最佳相对湿度均在55%左右.这可能是因为甲苯的光降解反应主要由两条路径,包括甲苯直接吸收光子氧化降解及与体系中的水蒸汽生成的· OH反应,随着光照强度的增强,产生的光子数量虽然增多,但大部分光子直接参与了甲苯的氧化反应,提升了甲苯的转化率,在此条件下,单态氧O(1D)的生成有可能有所提高,但生成量较少(王子东等,2009),所以· OH变化量不大,从而最佳相对湿度并不会发生明显偏移.
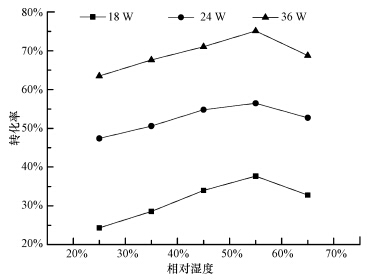 |
| 图 4 相对湿度对甲苯转化率的影响 Fig. 4 Effect of relative humidity on conversion efficiency of toluene |
为探讨甲苯的光化学反应机理,本文在不同紫外灯功率下,主要针对在甲苯初始浓度为19.2 mg · m-3、相对湿度为55%的实验条件下,甲苯光降解8 h后的产物进行分析.各物质的相对含量为GC-MS所测报告中该物质的峰面积与总面积的比值.如表 3所示,在UV 254 nm紫外光照射8 h后,甲苯降解的产物主要有乙醇、苯和苯甲酸等,其次为乙酸、苯甲醇和苯甲醛缩二甲醇,此外,还有少量的苯酚、2-戊酮等,其中,2-戊酮虽在文献中有所提及,却未给出相应的反应机理(Jenkin et al., 2008).当紫外灯功率由18 W提高到36 W时,发现产物中乙醇的相对含量由38.7%增加到43.19%,而含苯环产物的相对含量由58.05%降至42.01%,且在36 W紫外灯的照射下,并无甲酚(邻、间、对)的产生.这是因为紫外强度越高,反应体系得到的光子量越多,体系产生更多的· OH,从而增强了大分子物质向小分子物质的进一步转化.
| 表 3 甲苯降解副产物的相对含量 Table 3 Relative content of toluene degradation by-products |
前面的实验结果表明,甲苯通过光降解能生成苯、苯甲醇和苯甲酸产物,为此提出了甲苯降解生成主要的一些含苯环产物的机理,如图 5所示,反应途径可能有以下3种.一(如路径1所示)是甲苯分子直接吸收光子或与羟基自由基反应,生成苄基自由基(PhCH2 ·)及氢自由基(· H)(武江波等,2007),苄基自由基与反应系统中的O2进一步反应生成苄过氧自由基(PhCH2OO ·),苄过氧自由基会发生耦合,耦合产物不稳定,随后分解生成苯甲醛和苯甲醇(D′Hennezel et al., 1998),产物苯甲醛在紫外光与O2的协同作用下,很容易被氧化成苯甲酸,随后脱羧基生成苯(武江波等,2007).二(如路径2所示)是甲苯的甲基中C—H键能较低,被羟基自由基直接氧化生成苯甲醇(Chen et al., 2012),继而氧化成苯甲醛,再氧化生成苯甲酸,最后脱羧基生成苯.三(如路径3所示)是由于苯环与甲基之间的C—C键能为3.6 eV,比苯环上的C—C键和C—H键的键能都低,可能直接断裂脱甲基生成苯自由基和甲基自由基(殷永泉等,2009).部分研究者(D′Hennezel et al., 1998)认为后两者反应所占比例比较小,甲苯光氧化生成苯的反应主要通过路径1实现.而产物中的苯可再与羟基自由基反应得到苯酚.反应过程中生成的部分苯甲醛还会与体系中生成的甲醇在光照条件下反应生成苯甲醛缩二甲醇(Nobuta et al., 2012),据此可以推断出有甲醇的生成.而实验中甲酚的生成则是由于在紫外光与O2协同作用下,甲苯上的苯环与羟基自由基直接反应生成的(Mo et al., 2009).
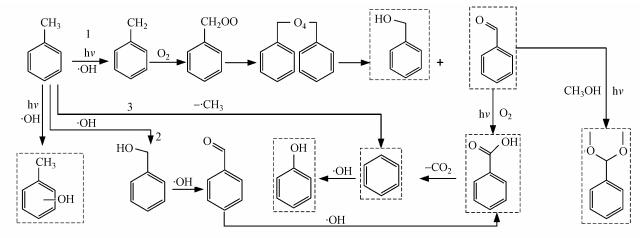 |
| 图 5 含苯环产物的生成路径 Fig. 5 Generation pathways of chemicals containing phenyl |
如图 6所示,甲苯反应得到大分子苯甲醇、苯甲醛、苯甲酸后,部分苯环产物会与羟基自由基反应生成羟基化同分异构体(Mo et al., 2009;Frankcombe et al., 2008),而生成的邻位羟基化同分异构体中,因羟基取代了苯环上的H原子,削弱了邻位间的的C—C键键能,其断裂能垒相对其他苯环上的C—C键要小(Frankcombe,2008),易继续受到· OH的攻击发生断裂,而光降解体系中的光子可提供足够的能量来跨越这一能垒,从而开环生成长碳链产物(Mo et al., 2009),继而脱除羧基并与体系中的甲基自由基发生加成反应,在受到羟基自由基进一步攻击后,发生β位的C—C断裂(邓南圣等,2003),形成碳链较短的小分子产物,其后再与体系中的甲基自由基及氢自由基反应,生成2-戊酮,最终氧化成乙醇、甲酸、二氧化碳和水等小分子产物.
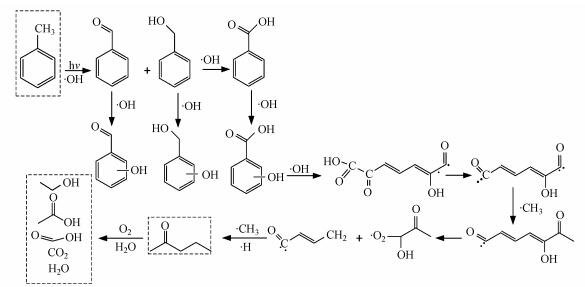 |
| 图 6 开环产物的生成路径 Fig. 6 Generation pathways of ring-opening chemicals |
综上所述,甲苯的光降解中间产物主要包括苯、苯甲酸、乙酸、乙醇等,且实验中小分子产物乙醇含量相对较高,可能是由于本实验中光照时间较长,甲苯的降解比较充分,而这些产物还可被进一步降解成水和二氧化碳等小分子.
4 结论(Conclusions)1)随着甲苯初始浓度的增加,单位时间内反应速率加快,但转化率会缓慢下降;而光照强度的增强,则会使其转化率逐渐升高.随着相对湿度的增加,甲苯转化率呈现先升高后降低的趋势,最佳相对湿度在50%~60%之间.
2)在进行动力学分析时,发现甲苯光氧化降解反应符合伪一级反应动力学方程,且表观速率常数与紫外灯光照强度成正比.
3)甲苯光降解的副产物主要包括苯、苯甲酸、乙醇、乙酸等,且随着光照强度的增加,产物中乙醇的相对含量由38.7%增加到43.19%,而含苯环产物的相对含量由58.05%降至42.01%.
| [1] | Chen H,Nanayakkara C E,Grassian V H.2012.Titanium dioxide photocatalysis in atmospheric chemistry[J].Chemical Reviews, 112(11): 5919-5948 |
| [2] | D'Hennezel O, Pichat P, Ollis.1998.Benzene and toluene gas-phase photocatalytic degradation over H2O and HCL pretreated TiO2: by-products and mechanisms[J].Journal of Photochemistry and Photobiology (A: Chemistry), 118(3): 197-204 |
| [3] | 邓南圣,吴峰.2003.环境光化学[M].北京: 化学工业出版社.52-56 |
| [4] | Frankcombe T J,Smith S C.2007.OH-initiated oxidation of toluene.1.Quantum chemistry investigation of the reaction path[J].The Journal of Physical Chemistry A,111(19): 3686-3690 |
| [5] | Frankcombe T J.2008.OH-initiated oxidation of toluene.3.Low-energy routes to cresol and oxoheptadienal[J].The Journal of Physical Chemistry A,112(7): 1572-1575 |
| [6] | Huang H B,Ye D Q,Leung D Y C,et al.2011.Byproducts and pathways of toluene destruction via plasma-catalysis[J].Journal of Molecular Catalysis (A: Chemical),336(1/2): 87-93 |
| [7] | Jenkin M E,Watson L A,Utembe S R,et al.2008.A Common Representative Intermediates (CRI) mechanism for VOC degradation.Part 1: Gas phase mechanism development[J].Atmospheric Environment,42(31): 7185-7195 |
| [8] | Korologos C A,Nikolaki M D,Zerva C N,et al.2012.Photocatalytic oxidation of benzene,toluene,ethylbenzene and m-xylene in the gas-phase over TiO2-based catalysts[J].Journal of Photochemistry and Photobiology (A: Chemistry),244: 24-31 |
| [9] | 刘洋,李岩,尚静,等.2006.TiO2纳米粒子光催化氧化室内挥发性有机污染物甲苯的研究[J].环境科学学报,26(12): 1964-1970 |
| [10] | Liu Y,Shao M,Fu L L,et al.2008.Source profiles of volatile organic compounds (VOCs) measured in China: Part I[J].Atmospheric Environment,42(25): 6247-6260 |
| [11] | Mo J H,Zhang Y P,Xu Q J,et al.2009.Determination and risk assessment of by-products resulting from photocatalytic oxidation of toluene[J].Applied Catalysis (B: Environmental),89(3/4): 570-576 |
| [12] | Nobuta T,Fujiya A,Hirashima S,et al.2012.Aerobic oxidative esterification of benzyl alcohols with catalytic tetrabromomethane under visible light irradiation[J].Tetrahedron Letters,53(39): 5306-5308 |
| [13] | Shankar R,Shim W J,An J G,et al.2015.A practical review on photooxidation of crude oil: Laboratory lamp setup and factors affecting it[J].Water Research,68: 304-315 |
| [14] | Thevenet F,Sivachandiran L,Guaitella O,et al.2014.Plasma-catalyst coupling for volatile organic compound removal and indoor air treatment: a review[J].Journal of Physics (D: Applied Physics),47(22): 224011 |
| [15] | Vincent G,Marquaire P M,Zahraa O.2009.Photocatalytic degradation of gaseous 1-propanol using an annular reactor: Kinetic modelling and pathways[J].Journal of Hazardous Materials,161(2/3): 1173-1181 |
| [16] | 王灿,席劲瑛,胡洪营,等.2008.紫外光降解高浓度氯苯气体的研究[J].环境科学研究,21(2): 125-129 |
| [17] | Wang J H,Ray M B.2000.Application of ultraviolet photooxidation to remove organic pollutants in the gas phase[J].Separation and Purification Technology,19(1/2): 11-20 |
| [18] | 王文婷,黄立维.2014.脉冲电晕放电降解水溶液中甲苯实验研究[J].环境科学学报,34(12): 3006-3010 |
| [19] | 王子东,马永亮.2009.利用UVC去除低浓度苯的实验研究[J].环境工程学报,3(7): 1284-1288 |
| [20] | White S J,Jamie I M,Angove D E.2014.Chemical characterisation of semi-volatile and aerosol compounds from the photooxidation of toluene and NOx[J].Atmospheric Environment,83: 237-244 |
| [21] | 武江波,曾祥英,李桂英,等.2007.紫外光照射下甲苯光化学降解的初步研究[J].地球化学,36(3): 328-334 |
| [22] | 殷永泉,郑艳,苏元成,等.2009.气相甲苯光催化降解反应动力学及机理[J].过程工程学报,9(3): 536-540 |
| [23] | 张春洋,马永亮.2011.UV254nm+185nm光照降解气态甲苯的实验研究[J].中国环境科学,31(6): 898-903 |
| [24] | 张忠良,罗吉敏,张彭义,等.2006.真空紫外光解—活性炭吸附去除甲苯及副产物臭氧[J].中国环境科学,26(S1): 56-60 |
| [25] | 张婷婷,祁蕾,于洋,等.2014.微波无极光降解甲硫醚[J].化工学报,65(11): 4579-4585 |
 2015, Vol. 35
2015, Vol. 35


