人工湿地作为一种生态化、低成本的水处理技术,具有较好的脱氮能力,目前在国内外已广泛用于废水的脱氮处理(Vymaza,2009;杨敦和周琪,2003).人工湿地中去除硝态氮的方式有植物吸收、填料吸附过滤和微生物反硝化(卢少勇等,2006),其中微生物反硝化作用是湿地去除硝态氮的主要方式(张玲和崔理华,2012).反硝化过程中,微生物以湿地中的有机物作为电子供体,将NO3-和NO2-还原为N2或N2O从湿地中去除.因此,是否存在足够的电子供体影响着反硝化过程能否顺利完成.
铁有0、+2、+3 3种价态,在有氧的环境中铁(Ⅱ)很容易被氧化为铁(Ⅲ),而在还原环境中铁(Ⅲ)又很容易被还原为铁(Ⅱ),铁的价态可变性使其在生物地球化学循环中具有重要意义.其中湿地是研究铁循环的热点区域(Liesack et al., 2000; Roden and Wetzel, 2002),有研究表明湿地水中的可溶性铁与总氮显著正相关(邹元春等,2009).已有报道在淡水或者海洋表面沉积物中存在铁-氮耦合氧化还原过程(Straub et al., 2001),研究者也已在多种环境中如湿地、沉积物等中发现了能够氧化亚铁并还原硝态氮的微生物(Neubauer et al., 2002;Hauck et al., 2001),该类型微生物分别以亚铁和硝态氮作为电子供体和受体,将亚铁氧化为三价铁的同时还原硝态氮,可见铁-氮反应过程在自然系统中大量存在.铁-氮过程发生时以Fe2+提供电子硝酸盐接受电子,这对于尤其是低碳氮比的废水中硝酸盐氮的去除具有一定的积极意义,以亚铁作为电子供体参与反硝化作用可以减少有机碳源的添加.另外,亚铁在有效去除硝酸盐的同时可以减少亚硝酸盐积累、有机物过剩等现象(Huang et al., 2011).亚铁在参与反硝化作用时转化为三价铁,当反应体系中的硝态氮消耗殆尽时,微生物可利用有机物将三价铁还原为亚铁(Coby et al., 2011).亚铁的存在可以提高反硝化能力,目前已有将铁-氮过程应用在UASB(Zhang et al., 2015)、SBR反应器(王梦月和马鲁铭,2014)等废水处理工艺中,然而在人工系统中的应用鲜有报道.因此研究人工湿地中铁-氮过程其对氮素去除的影响具有一定的意义.
本研究的主要目的是考察不同初始Fe2+浓度时人工湿地硝态氮去除效果的差异以及C/N对Fe2+参与人工湿地反硝化作用的影响,为亚铁强化脱氮的人工湿地设计和运行提供理论参考.
2 材料与方法(Materials and methods) 2.1 实验装置本实验采用水平潜流小试人工湿地.装置为5个50 cm×39 cm×35 cm的PVC材质实验箱,在实验箱距离底部5 cm处设置出水口,以粒径4~6 mm的石英砂作为填充介质,其表面种植株高15 cm左右的幼苗期美人蕉,种植密度为20株· m-2.
2.2 湿地进水利用葡萄糖、硝酸钠、硫酸亚铁、磷酸二氢钾、氯化钙、氯化钾、碳酸氢钠以及微量元素等配置人工污水.Fe2+浓度和C/N以FeSO4 · 7H2O和C6H12O6 · H2O调节,以NaHCO3调节进水pH.具体实验进水水质指标如表 1.不同C/N主要由以下几个方面确定:①确定在无碳源存在的条件下Fe2+是否参与反硝化作用;②人工湿地经常需要处理低碳氮比的污水,研究低碳氮比时Fe2+对反硝化作用的影响;③无氧条件下,反硝化作用所需理论C/N为4.6 ∶ 1(李军等,2002),有文献认为人工湿地最适反硝化C/N为5.25(Matsumoto et al., 2007),本研究中添加了不同浓度Fe2+,C/N需根据亚铁加入量进行确定;④高COD条件下反硝化作用通常可以很好的完成,无需外加Fe2+提高反硝化能力.
| 表1 实验进水的水质指标 Table 1 Water quality of influent |
人工湿地运行方式为间歇进水,水力负荷为28 L · d-1.实验装置于2014年9月底构建完成,10月初在每个湿地中加入2.8 L活性污泥进行驯化.驯化期间以NO3--N=30 mg · L-1,COD=60 mg · L-1及微量元素配水,每天换水1次.35 d后,其中4个湿地的配水中添加5 mg · L-1 Fe2+,另一个湿地作为对照不添加Fe2+,每3 d换水1次,每5 d测定1次出水,20 d后出水达到稳定,12月初进入实验测定阶段.整个实验分为两个阶段:第一阶段设置5个Fe2+浓度梯度,分别是0、5、15、30和45 mg · L-1,C/N为2,共5个周期,每个周期运行3 d,每天取样测定;第二阶段测定不同C/N时Fe2+浓度为5、15、30和45 mg · L-1的出水水质,设置4组C/N,分别为0、2、4和6,水力停留时间(HRT)为2 d,每组C/N条件下进行5个周期.整个实验在自然条件下进行,温度为2~10 ℃.
2.4 分析方法分析项目包括pH、DO、NO3--N、NO2--N、NH3-N、TN、COD、Fe2+和总铁.DO和pH采用Hach HQ 40 d测定,NO3--N和TN采用紫外分光光度计测定,NO2--N采用GMA3202气相分子吸收光谱仪测定,NH3-N采用HI9 3733氨氮离子浓度比色测定,COD、Fe2+和总铁采用DR 900多参数水质分析仪测定.采用Microsoft Excel 2013软件对数据进行处理和绘图,SPSS 17.0统计分析软件对数据进行差异显著性检验与方差分析.
3 结果与分析(Results and analyses) 3.1 亚铁离子浓度对反硝化作用的影响 3.1.1 初始Fe2+浓度对NO3-去除影响图 1为3种HRT时不同初始Fe2+浓度的人工湿地硝态氮去除效果.可见,不添加Fe2+时,NO3--N在HRT为1 d、2 d、3 d的去除率分别仅为6.89%、10.18%和14.21%左右.添加Fe2+的湿地NO3--N去除率显著增加(p<0.05)且随初始Fe2+浓度的增大而逐渐增大.添加45 mg · L-1Fe2+的NO3--N去除率分别提高到30.8%,35.36%和40.43%左右.不同HRT时NO3--N的去除率与初始Fe2+浓度间的关系呈现一致性,NO3--N去除率与初始Fe2+浓度正相关,HRT为2 d、3 d的NO3--N去除率均随初始Fe2+浓度增加而显著增加(p<0.05).这表明添加Fe2+可以促进人工湿地的反硝化作用,原因可能是Fe2+参与了人工湿地的反硝化过程,与NO3-发生反应从而去除硝态氮.
 |
| 图1 不同初始进水Fe2+浓度硝氮去除率(注:图中表示在相同HRT下,不同初始Fe2+浓度硝氮去除率的显著性比较(n=3),其中同系列柱形图上具有相同字母的表示差异不显著(p<0.05)) Fig.1 The removal rate of nitrate in different initial Fe2+ concentrations |
一定条件下,人工湿地的反硝化过程会导致NO2-的积累,NO2-对人体有一定的健康危害,地下水质量标准(GB/T 14848-93)中,Ⅳ类水的NO2-N浓度不能大于0.1 mg · L-1. 因此,分析反硝化人工湿地出水NO2-浓度是十分必要的.
人工湿地进水的NO2--N浓度小于0.01 mg · L-1,由图 2可以看出不加Fe2+的人工湿地中出水NO2--N较进水有一定的积累.HRT为1 d时NO2--N浓度为0.18 mg · L-1左右,2 d后浓度显著提高到0.72 mg · L-1左右,第3天下降到0.59 mg · L-1左右;而添加了5 mg · L-1Fe2+的人工湿地,3种HRT时出水NO2--N浓度为0.07 mg · L-1、0.12 mg · L-1、0.15 mg · L-1.随着初始Fe2+浓度增加,人工湿地出水NO2--N浓度逐渐减少,当添加30和45 mg · L-1 Fe2+时NO2--N出水浓度和进水浓度基本一致,小于0.01 mg · L-1.这说明Fe2+的加入可以减少NO2-的积累,这可能是Fe2+提供了电子,促进反硝化过程彻底进行.
 |
| 图2 不同初始进水Fe2+浓度出水亚硝氮浓度 Fig.2 The effluent nitrite concentration under different initial Fe2+ concentration |
图 3与图 4分别为人工湿地出水Fe2+与总铁浓度.可见,出水Fe2+浓度基本小于0.1 mg · L-1,总铁浓度小于0.3 mg · L-1,随着添加的Fe2+增加,出水Fe2+与总铁浓度逐渐增加,但出水Fe2+与总铁浓度基本不影响人工湿地出水水质.在接近中性条件下Fe(Ⅲ)通常以氢氧化物存在,本研究中出水Fe2+与总铁浓度较低可能是Fe2+与NO3-反应生成的Fe(Ⅲ)以氢氧化物形式存留在人工湿地中.
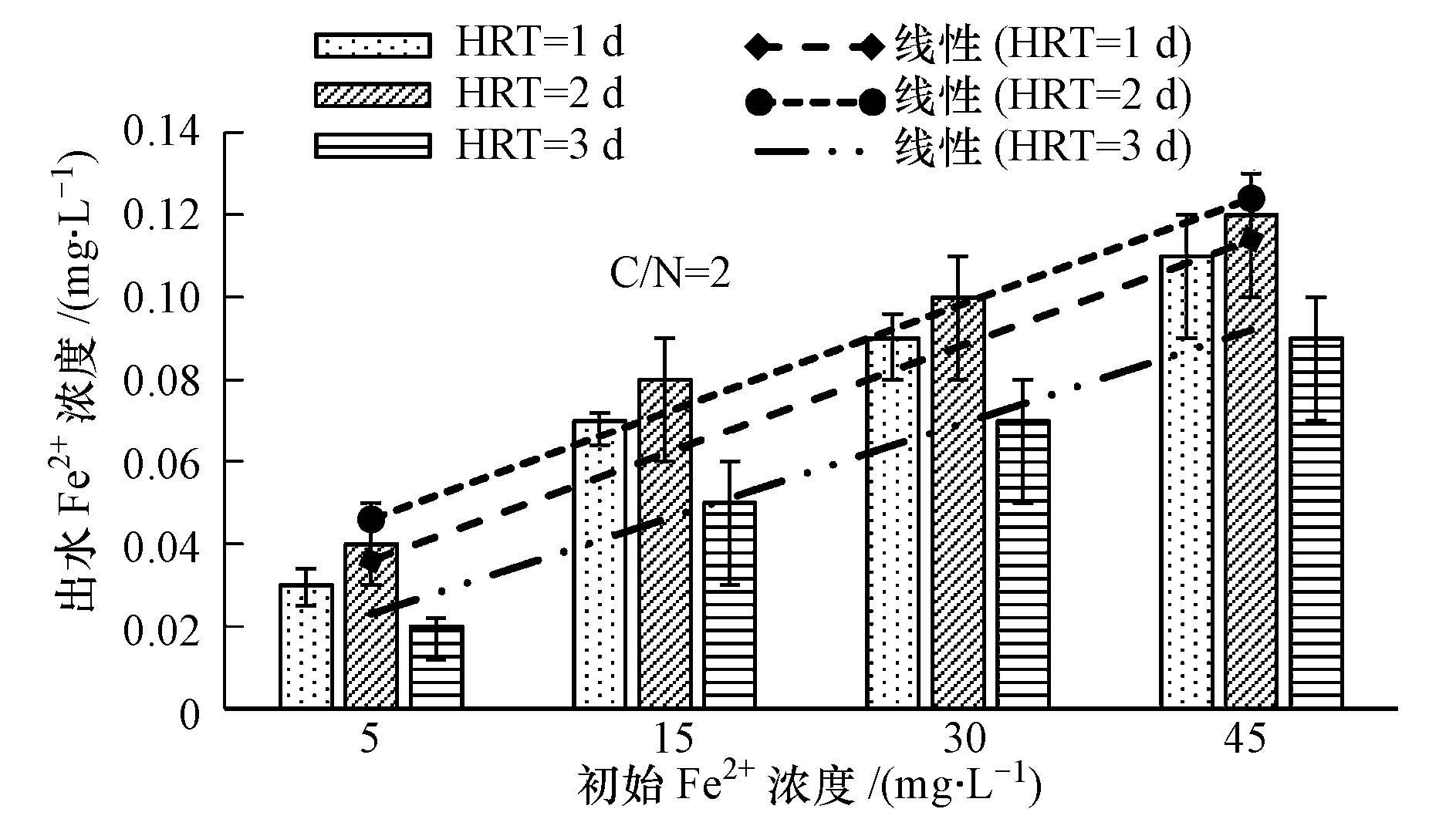 |
| 图3 不同初始进水Fe2+浓度的出水Fe2+浓度 Fig.3 The effluent Fe2+ concentration under different influent Fe2+ concentrations |
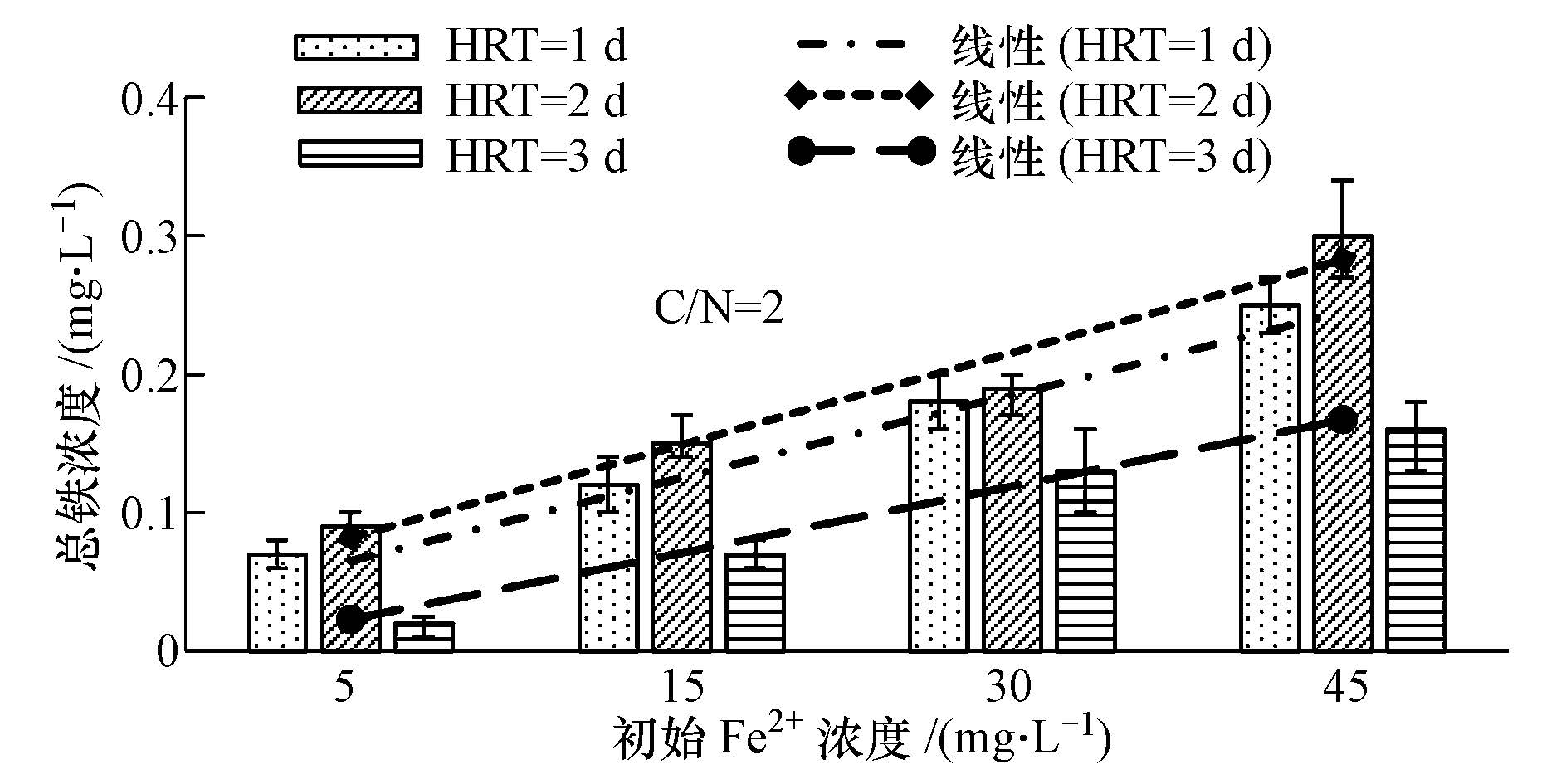 |
| 图4 不同初始进水Fe2+浓度出水总铁浓度 Fig.4 The effluent total iron concentration under different influent Fe2+ concentrations |
由图 3与图 4也可以看出Fe2+与总铁的出水浓度具有周期性,出水浓度随时间先增大后减少,HRT为2 d时出水浓度最大,这说明铁在人工湿地中存在一定的循环作用.可能是Fe2+还原NO3-后变为Fe(Ⅲ),水中的有机物又将Fe(Ⅲ)还原为Fe2+.另外,出水Fe2+、总铁浓度与进水Fe2+浓度分别具有很好的线性关系,这为进水Fe2+浓度的确定提供了一定的参考意义.
3.2 碳氮比对亚铁反硝化作用的影响由以上可知,不同HRT时Fe2+对人工湿地反硝化作用的影响规律基本一致,故本节选取HRT为2 d研究不同C/N对Fe2+参与的反硝化作用影响.
3.2.1 C/N对硝态氮去除率的影响图 5为不同C/N对外加Fe2+的人工湿地的硝态氮去除效果的影响.可见,不加碳源时,不同初始Fe2+浓度的人工湿地硝态氮去除率较低,分别为5.6%、7.1%、9.8%和12.1%左右;当C/N为4时,不同初始Fe2+浓度的硝态氮去除率显著提高到25.61%、32.07%、44.10%和53.00%左右.硝态氮的去除率随C/N的增加显著增加(p<0.05).一方面,因为碳源的增加有利于促进人工湿地的反硝化作用(肖蕾等,2012);另一方面,可能是有机碳源的存在可以促进亚铁参与的反硝化作用(Picardal,2012;王娅静等,2014).对初始Fe2+浓度与C/N作两因素方差分析,由表 2可知两者具有交互作用且三者对硝态氮去除率贡献大小为:C/N > 初始Fe2+浓度> C/N *初始Fe2+浓度,初始Fe2+浓度与C/N对硝态氮去除率都有显著影响(p<0.05).
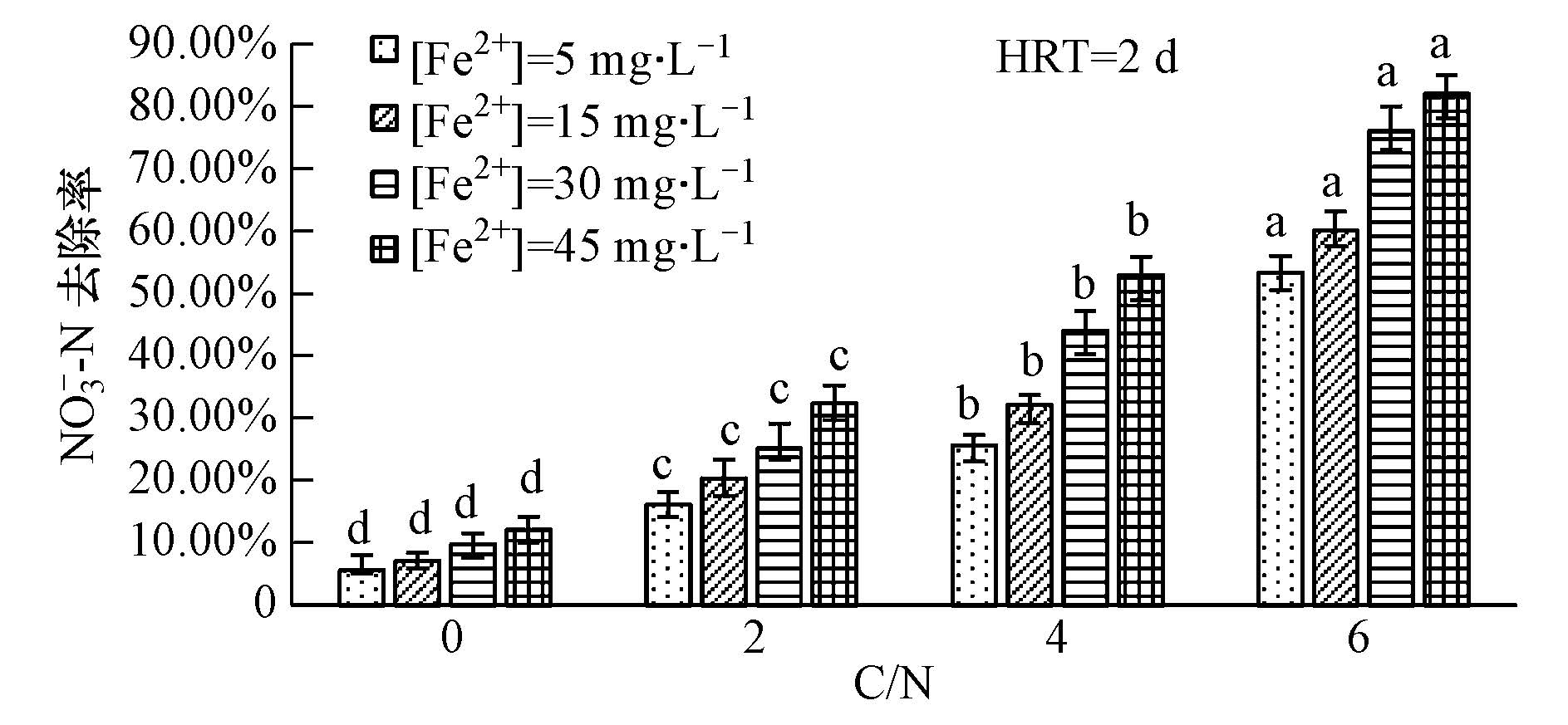 |
| 图5 不同C/N条件下的不同Fe2+浓度的硝氮去除率(注:图中表示在相同条件下,初始进水Fe2+浓度不同C/N时硝氮去除率的显著性比较(n=3),其中同系列柱形图上具有相同字母的表示差异不显著(p<0.05) Fig.5 The removal rate of nitrate under different C/N ratios |
| 表2 亚铁离子与碳氮比的主体间效应的检验 Table 2 The test of main-body effects between Fe2+ and C/N ratio |
由图 6可见随C/N的增加,NO2--N的浓度先增加后减少,在碳氮比为4时出现了最大值,达到1.2 mg · L-1.陆松柳的研究中也发现不加碳源的人工湿地出水亚硝氮浓度为0.1 mg · L-1,而添加碳源后约为3 mg · L-1,表 明碳源的添加会导致亚硝氮的积累(陆松柳等,2011).本研究加入了Fe2+,结果表明出水NO2--N浓度有所减少,且随初始Fe2+浓度增加,NO2--N的浓度逐渐减少.这说明亚铁可以促进人工湿地反硝化作用的进行,减少亚硝态氮的积累,原因可能是亚铁可以作为电子供体参与人工湿地的反硝化作用.
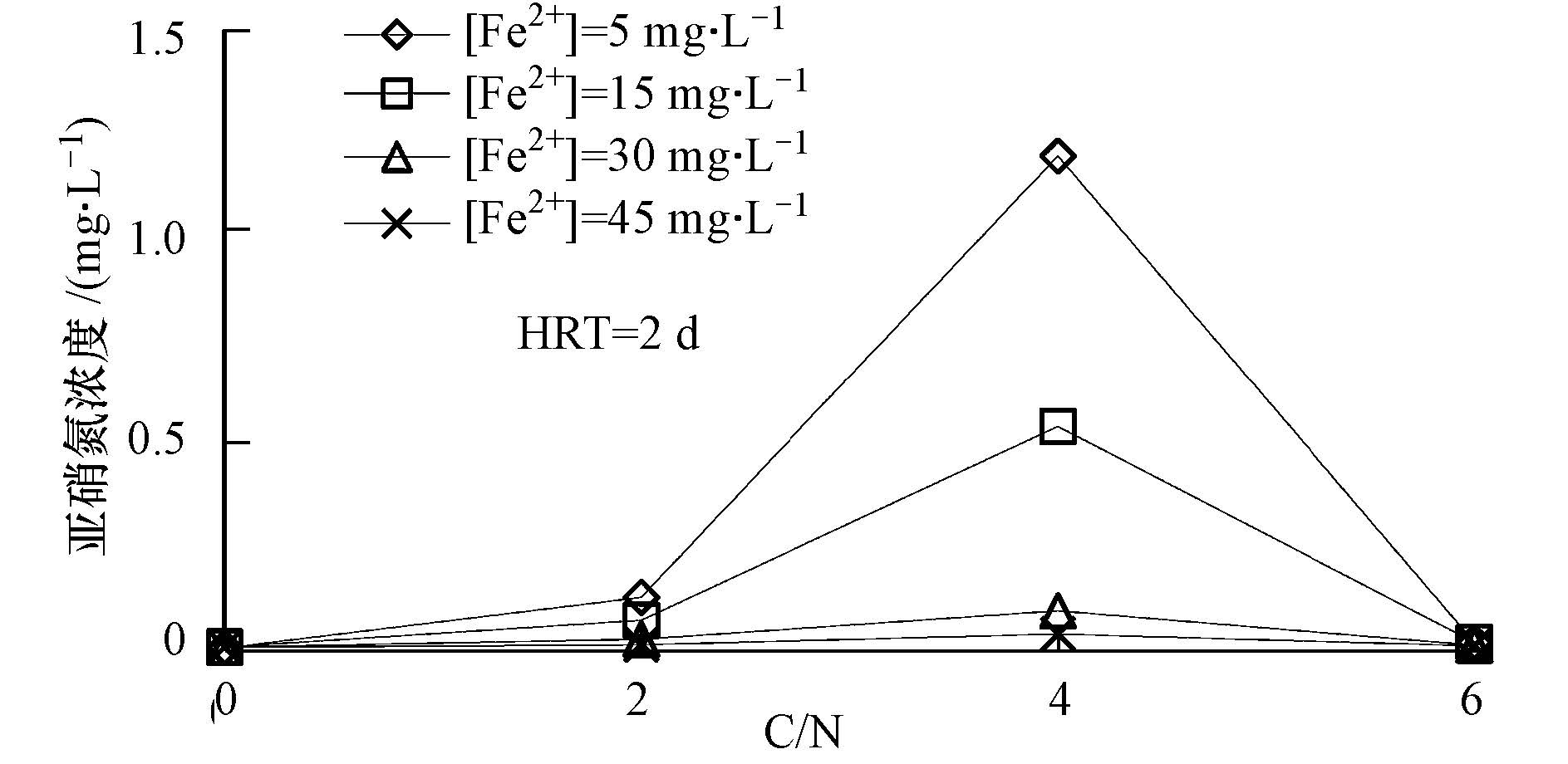 |
| 图6 不同C/N的出水亚硝氮浓度 Fig.6 The effluent nitrite concentrations under different C/N ratios |
图 7、图 8分别为不同C/N人工湿地出水Fe2+、总铁浓度.可见,不加碳源的人工湿地出水Fe2+浓度小于0.1 mg · L-1、总铁浓度小于0.25 mg · L-1.随C/N增加,不同初始Fe2+浓度的人工湿地出水Fe2+和总铁的浓度均逐渐增加,C/N为6,初始Fe2+浓度为45 mg · L-1的人工湿地出水Fe2+与总铁浓度显著增加(p<0.05).原因可能是人工湿地中以葡萄糖和Fe2+两种物质同时作为电子供体进行反硝化作用,且由表 2知C/N对反硝化作用的贡献作用大于Fe2+,因此有机物增加会减少Fe2+作为反硝化作用的电子供体,从而出水的Fe2+和总铁的浓度会增加.另外,出水Fe2+和总铁浓度分别与C/N具有很好的指数关系,这也为确定人工湿地进水C/N和Fe2+浓度提供了一定的依据.
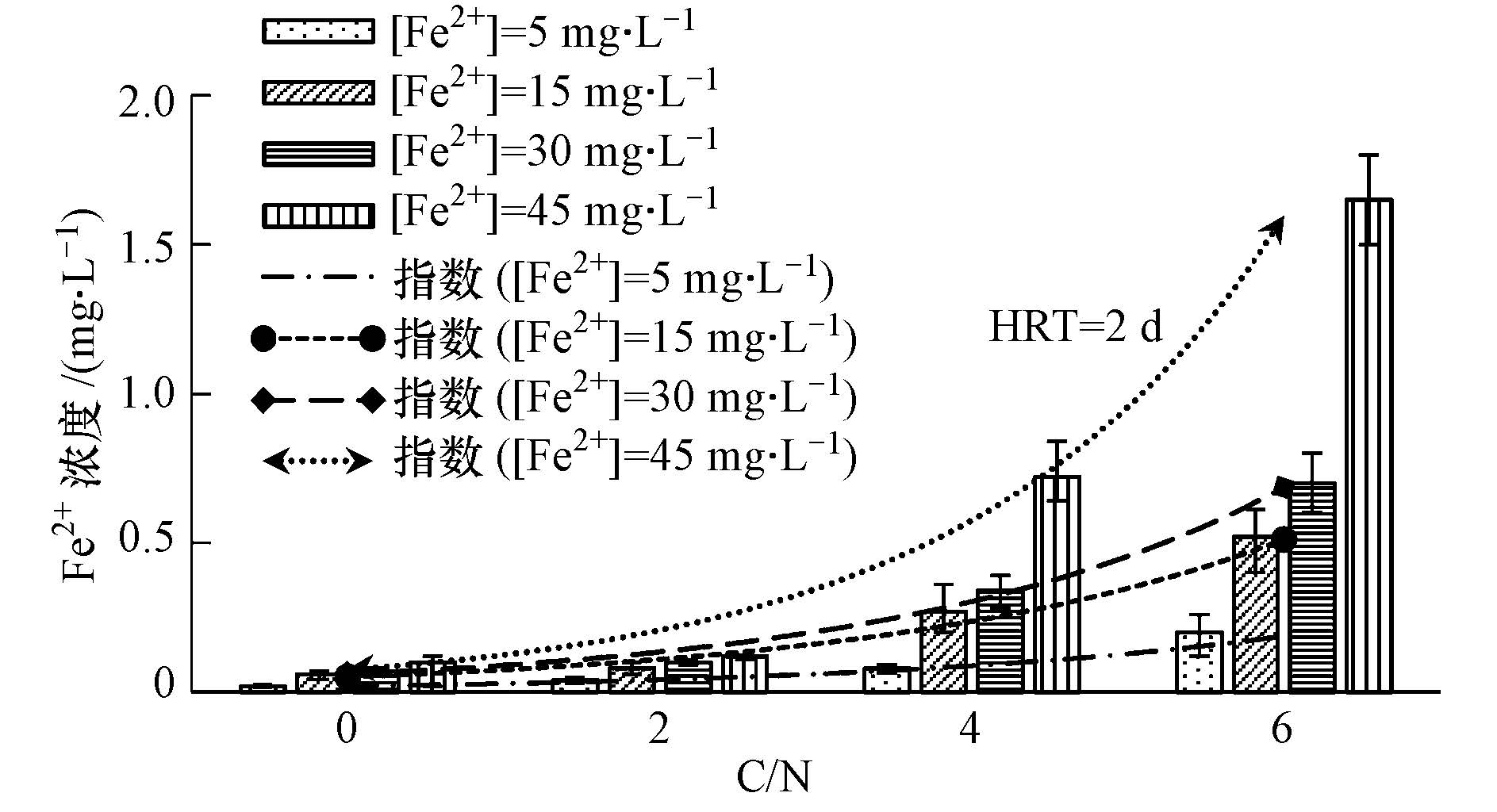 |
| 图7 不同C/N出水Fe2+浓度 Fig.7 The effluent Fe2+ concentrations under different C/N ratios |
 |
| 图8 不同C/N出水总铁浓度 Fig.8 Eight total iron concentrations under different C/N ratios |
本研究结果表明,添加Fe2+后可以显著提高人工湿地硝态氮的去除率(p<0.05)且去除率随初始Fe2+浓度增加而逐渐增加.表明Fe2+可以促进反硝化过程的进行,Fe2+可能参与反硝化作用从而去除硝态氮.Nielsen研究添加亚铁对污水处理厂活性污泥硝态氮去除率的影响,结果发现很多污水处理厂的活性污泥在添加亚铁后的硝态氮去除率都明显提高(Nielsen and Nielsen, 1998),与本研究结论一致.亚铁参与人工湿地反硝化作用的机制有两种.一方面Fe2+与硝酸盐可以发生化学反应,反应方程如下:

然而一般液相条件下,化学反硝化作用不容易发生或反应很缓慢(Buresh and Moraghan, 1976;Picardal,2012),在固相界面或者存在某些金属离子、金属氧化物等固相物质时可以促进化学反硝化的进行(Buresh and Moraghan, 1976;Tai and Dempsey, 2009).另一方面,Fe2+与硝酸盐可以发生生物反硝化作用.在铁存在下硝态氮依赖某些微生物进行还原代谢(Weber et al., 2006),这种微生物可以在氧化Fe2+的同时还原NO3-.人工湿地是一种含有基质、微生物丰富的综合生态处理系统,这为硝态氮的化学和生物反硝化作用的发生提供了良好的条件.
4.2 有机物与亚铁反硝化的相互影响作用本研究显示,有机物的存在对亚铁参与反硝化产生很大的影响,有机物与Fe2+对人工湿地的反硝化作用具有交互作用.有机物对Fe2+参与的反硝化作用既有直接影响也有间接影响.首先,Fe2+反硝化反应后生成的Fe(Ⅲ)可以通过有机物再次还原成Fe2+,有机物可以促进铁的循环(冯欢等,2014),从而促进反硝化的进行.Coby等通过不断改变反应体系中乙酸和NO3-的负荷,使体系中持续进行铁的氧化还原循环和氮素同步转化(Coby et al., 2011).其次,对于生物反硝化作用而言,有机物是微生物生长、生存的必要条件,其通过影响微生物的生长来影响反硝化作用.大多数亚铁氧化微生物仅能在有机碳源存在的条件下氧化亚铁并同时还原硝态氮(Muehe et al., 2009).
对于有机物较少但富含铁的废水而言,亚铁可以参与人工湿地反硝化作用具有较大的意义,这解决了人工湿地脱氮过程中碳源不足的问题.对于有机物含量过高的体系,一方面有机物作为反硝化作用的电子供体参与反应;另一方面,有机物过高时可能被厌氧降解为甲烷(王维奇等,2009),排放到空气中会造成温室效应.如果人工湿地中存在三价铁或二价铁,则可以减少CH4的产生.因为有机物可以被用来还原二价铁,这样减少了有机物通过发酵作用变成CH4.也有研究表明,三价铁的存在使得铁异化还原菌与产甲烷菌发生竞争,从而可以抑制甲烷的产生(姜明等,2006).综上所述,不管对于有机物含量高还是有机物含量低的污废水,亚铁的存在都有一定的积极意义.
5 结论(Conclusions)1)人工湿地进水中添加Fe2+可以显著提高硝态氮的去除率,NO3--N的去除率随初始Fe2+浓度增加而增加,Fe2+的存在也可以减少NO2--N的生成.表明Fe2+可以参与反硝化作用,其作为人工湿地反硝化的电子供体具有一定的可行性.
2)在人工湿地的反硝化过程中,C/N与初始Fe2+浓度对反硝化作用都具有显著影响且两者具有交互作用,有机碳源的存在可以促进亚铁参与的反硝化作用.
3)出水Fe2+与总铁的浓度与初始Fe2+浓度和C/N有关.出水Fe2+、总铁浓度分别与初始Fe2+浓度线性相关,与C/N指数相关.出水Fe2+与总铁浓度不高,表明Fe2+反应后可能生成难溶性物质存留在人工湿地中.
| [1] | Buresh R J, Moraghan J T. 1976. Chemical reduction of nitrate by ferrous iron[J]. Journal of Environmental Quality, 5(3):320-325 |
| [2] | Coby A J, Picardal F, Shelobolina E, et al. 2011. Repeated anaerobic microbial redox cycling of iron[J]. Applied and Environmental Microbiology, 77(17):6036-6042 |
| [3] | 冯欢, 梁禹翔, 杜耀, 等. 2014. 填埋场中铁的生物化学循环对反硝化的影响[J]. 环境科学学报, 34(2):409-416 |
| [4] | Hauck S, Benz M, Brune A, et al. 2001. Ferrous iron oxidation by denitrifying bacteria in profundal sediments of a deep lake (Lake Constance)[J]. FEMS Microbiology Ecology, 37:127-134 |
| [5] | Huang B, Chi G Y, Chen Y, et al. 2011. Removal of highly elevated nitrate from drinking water by pH-heterogenized heterotrophic denitrification facilitated with ferrous sulfide-based autotrophic denitrification[J]. Bioresource Technology, 102(21):10154-10157 |
| [6] | 姜明, 吕宪国, 杨青, 等. 2006. 湿地铁的生物地球化学循环及其环境效应[J]. 土壤学报, 43(3):493-499 |
| [7] | 李军, 杨秀山, 彭永臻, 等. 2002. 微生物与水处理工程[M]. 北京:化学工业出版社 |
| [8] | Liesack W, Schnell S, Revsbech N P. 2000. Microbiology of flooded rice paddies[J]. FEMS Microbiology Reviews, 24(5):625-645 |
| [9] | 陆松柳, 张辰, 王国华. 2011. 碳源强化对人工湿地反硝化过程的影响研究[J]. 环境科学学报, 31(9):1949-1954 |
| [10] | 卢少勇, 金相灿, 余刚. 2006. 人工湿地的氮去除机理[J]. 生态学报, 26(8):2670-2677 |
| [11] | Matsumoto S, Terada A, Tsuneda S. 2007. Modeling of membrane-aerated biofilm:Effects of C/N ratio, biofilm thickness and surface loading of oxygen on feasibility of simultaneous nitrification and denitrification[J]. Biochemical Engineering Journal, 37(1):98-107 |
| [12] | Muehe E M, Gerhardt S, Schink B, et al. 2009. Ecophysiology and the energetic benefit of mixotrophic Fe(Ⅱ) oxidation by various strains of nitrate-reducing bacteria[J]. FEMS Microbiology Ecology, 70(3):335-343 |
| [13] | Neubauer S C, Emerson D, Megonigal J P. 2002. Life at the energetic edge:Kinetics of circumneutral iron oxidation by lithotrophic iron-oxidizing bacteria isolated from the wetland-plant rhizosphere[J]. Applied and Environmental Microbiology, 68(8):3988-3995 |
| [14] | Nielsen J L, Nielsen P H. 1998. Microbial nitrate-dependent oxidation of ferrous iron in activated sludge[J]. Environmental Science & Technology, 32(22):3556-3561 |
| [15] | Picardal F. 2012. Abiotic and microbial interactions during anaerobic transformations of Fe(Ⅱ) and NOx. Frontiers in Microbiology, 3:112 |
| [16] | Roden E E, Wetzel R G. 2002. Kinetics of microbial Fe(Ⅲ) oxide reduction in freshwater wetland sediments[J]. Limnology & Oceanography, 47(1):198-211 |
| [17] | Straub K L, Benz M, Schink B. 2001. Iron metabolism in anoxic environments at near neutral pH[J]. FEMS Microbiology Ecology, 34(3):181-186 |
| [18] | Tai Y L, Dempsey B A. 2009. Nitrite reduction with hydrous ferric oxide and Fe(Ⅱ):Stoichiometry, rate, and mechanism[J]. Water Research, 43(2):546-552 |
| [19] | Vymaza J. 2009. The use constructed wetlands with horizontal sub-surface flow for various types of wastewater[J]. Ecological Engineering, 35(1):1-17 |
| [20] | 王维奇,曾从盛,仝川.2009.控制湿地甲烷产生的主要电子受子研究进展[J].地理科学,2(29):300-305 |
| [21] | 王梦月, 马鲁铭. 2014. 催化铁强化低碳废水生物反硝化过程的探讨[J]. 环境科学, 35(7):2633-2638 |
| [22] | 王娅静, 刘晶, 郭景恒. 2014. 铁作用下土壤氮素化学转化过程的研究进展[J]. 中国农业大学学报, 19(2):95-99 |
| [23] | Weber K A, Urrutia M M, Churchill P F, et al. 2006. Anaerobic redox cycling of iron by freshwater sediment microorganisms[J]. Environmental Microbiology, 8(1):100-113 |
| [24] | 肖蕾, 贺锋, 黄丹萍, 等. 2012. 人工湿地反硝化外加碳源研究进展[J]. 水生态学杂志, 33(1):139-143 |
| [25] | 杨敦, 周琪. 2003. 人工湿地脱氮技术的机理及应用[J]. 中国给水排水, 19(1):23-24 |
| [26] | 张玲, 崔理华. 2012. 人工湿地脱氮现状与研究进展[J]. 中国农学通报, 28(5):268-272 |
| [27] | Zhang M, Zheng P, Li W, et al. 2015. Performance of nitrate-dependent anaerobic ferrous oxidizing (NAFO) process:A novel prospective technology for autotrophic denitrification[J]. Bioresource Technology, 179:543-548 |
| [28] | 邹元春, 吕宪国, 姜明. 2009. 不同水文情势下环形湿地土壤铁的时空分布特征[J]. 环境科学, 30(7):2059-2064 |
 2016, Vol. 36
2016, Vol. 36


