消毒是水处理工艺流程中的一个重要处理单元,常见的消毒方法有氯消毒、臭氧消毒、紫外线消毒等.但氯消毒过程中会产生三氯甲烷、卤乙酸等消毒副产物,而臭氧消毒、紫外线消毒则因成本高、维护费用和能量损耗大而使应用受到限制(Liu et al., 2013).20世纪50年代,电化学法开始被研究用于水的消毒,该方法具有环境友好、安全、效率高、处理费用低等优点(陈喆等,2008),因此,受到越来越多的关注.
电化学消毒体系中,微生物的灭活机理包括电场的直接作用(Cotillas et al., 2015)、电化学过程产生自由氯组分的作用(Kraft et al., 1999)和活性基团的作用(Kerwick et al., 2005).目前对电化学消毒影响因素的研究较多,除了电极材料(周键等,2014)和电化学反应器形式(Chen,2004; Diao et al., 2004)外,反应的操作条件,如电流密度、pH值、电解质组成等也是不容忽视的因素(Palmas et al., 2007).电化学消毒能够有效杀灭水中的大肠杆菌(Li et al., 2004)、MS2噬菌体(Fang et al., 2006)、隐性孢子虫(Venczel et al., 1997)等,但其对水中某些高风险微生物,如抗生素抗性菌的灭活研究则较少.
因此,本研究通过对模式大肠杆菌的灭活试验,优化电化学消毒系统的参数和操作条件,在此基础上进一步考察电化学消毒法对四环素抗性大肠杆菌的灭活效果及其抗性变化,从而为电化学消毒方法的评价提供支持.
2 材料与方法(Material and methods) 2.1 水样与抗生素储备液配制试验所用模式菌株分别为大肠杆菌(E.coli CGMCC 1.3373)和四环素抗性菌(E.coli CGMCC 1.1595),购于中国科学院菌种保藏中心.用营养肉汤液体培养基(蛋白胨10 g · L-1,牛肉浸出粉3 g · L-1,氯化钠5 g · L-1)在37 ℃、160 r · min-1下培养16~24 h,10000 r · min-1离心10 min后,将菌体再悬浮于含0.05% NaCl的去离子水中,使水样中模式菌浓度约为106 CFU · mL-1.
配制浓度为800 mg · L-1的青霉素、氯霉素和四环素储备液,并进行过膜除菌,具体配制方法见表 1. 将抗生素储备液避光保存于-20 ℃冰箱内,保存时间不超过1周.
| 表1 抗生素储备液的配制浓度及方法 Table 1 Preparation of antibiotics stock solution |
本研究构建了4套电化学消毒小试装置,每套装置均由消毒槽、直流稳压电源、电极板组成.消毒槽为长方体,有机玻璃材质,消毒槽内部左右两侧分别固定有阴极和阳极电极板.4套装置电极板面积均为50 mm×50 mm,极板间距分别为30、50、70、90 mm.阴极采用不锈钢板,阳极分别采用钌铱涂层、铅涂层和铱钽涂层的钛电极板.系统采用直流稳压电源(深圳兆信电子仪器设备厂,RXN-605D),电压范围0~55 V,电流0~3 A.
2.3 消毒试验条件为探究装置参数对消毒效果的影响,在连续流条件下,分别改变阳极极板材料和极板间距,在相同消毒条件下考察电化学装置对大肠杆菌CGMCC 1.3373的灭活效果.一般采用对数去除率,即消毒后微生物存活率倒数的对数值(以10为底)表示灭活效果,如对数去除率2对应的灭活率为99%.在确定最佳装置参数后,进一步考察pH、水温和NaCl浓度等水质条件对大肠杆菌CGMCC 1.3373电化学消毒特性的影响.最后,考察电化学装置对四环素抗性菌CGMCC 1.1595的灭活效果及对其抗性的影响.具体试验条件如表 2所示.
| 表2 电化学消毒试验条件 Table 2 Conditions of electrochemical disinfection experiments |
水样中的大肠杆菌和四环素抗性菌浓度采用平板培养法测定.用磷酸缓冲盐溶液(Phosphate Buffered Saline,PBS)以10倍梯度稀释水样,取1 mL不同倍数的稀释液加入培养皿(Φ90 mm)中,加入10 mL营养琼脂培养基(蛋白胨10 g · L-1,牛肉膏粉3 g · L-1,氯化钠5 g · L-1,琼脂15 g · L-1),摇匀凝固后,倒置放于37 ℃培养箱内培养24 h,计所有菌落数,用单位体积水样的菌落形成单位(CFU · mL-1)表示细菌浓度.每次测定设2个平行样.
为了表征四环素抗性菌的抗性变化,用含一定浓度抗生素(青霉素、氯霉素和四环素的浓度分别为16、32、16 mg · L-1)的营养琼脂培养基测定四环素抗性菌浓度,用所得结果与普通培养基测定结果之比(N抗性培养基/N普通培养基)表示四环素抗性菌抗性.该比值越高,表示抗性越强.
3 结果与讨论(Results and discussion) 3.1 不同装置参数对消毒效果的影响3种不同阳极电极板对普通大肠杆菌的电化学灭活效果如图 1所示,在实验过程中调整电极板之间的电压和电流,保证在相同的电功率下进行消毒.由图 1可以看出,钌铱涂层钛电极板的效果明显好于铅涂层和铱钽涂层钛电极板,因此,在后续的试验中采用钌铱涂层钛电极板作为反应器的极板.电化学消毒机理包括电场直接作用灭菌、电解产生自由氯灭菌和电解产生羟基自由基等强氧化性物质灭菌等.研究发现,电解产氯对消毒效果的贡献较大(陈喆等,2008).为了探究不同阳极板消毒效果的差异,进一步测定不同电极板在消毒20 s时产生的余氯量,结果如图 2所示.由图 2可知,钌铱涂层钛电极板在消毒20 s后产生的余氯明显高于铅涂层和铱钽涂层钛电极板,该结果表明钌铱涂层钛电极板产氯效率高是其消毒效果好的重要原因.
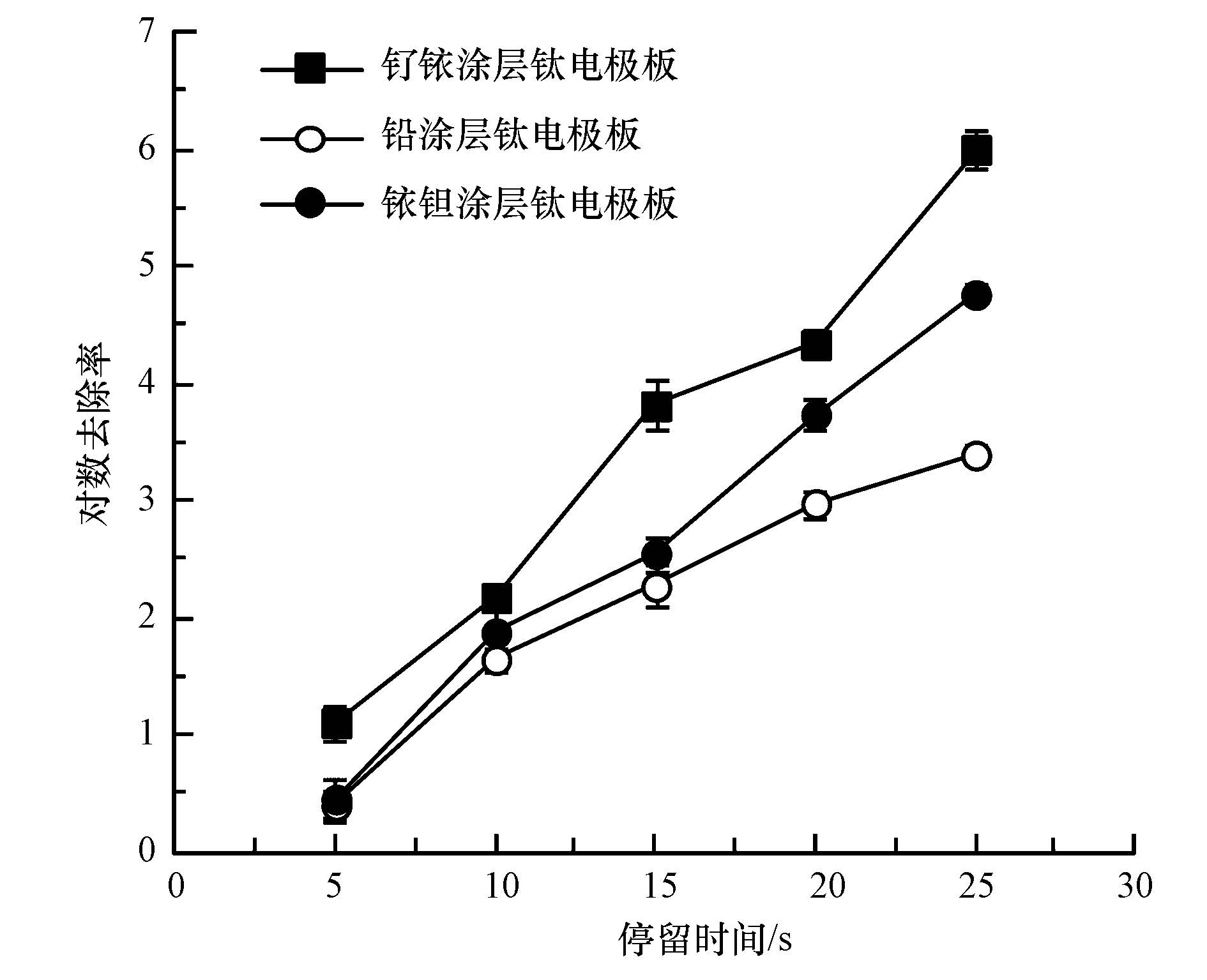 |
| 图1 阳极电极板材料对大肠杆菌灭活效果的影响 Fig.1 Effect of anode plate coating on inactivation ratio of E. coli |
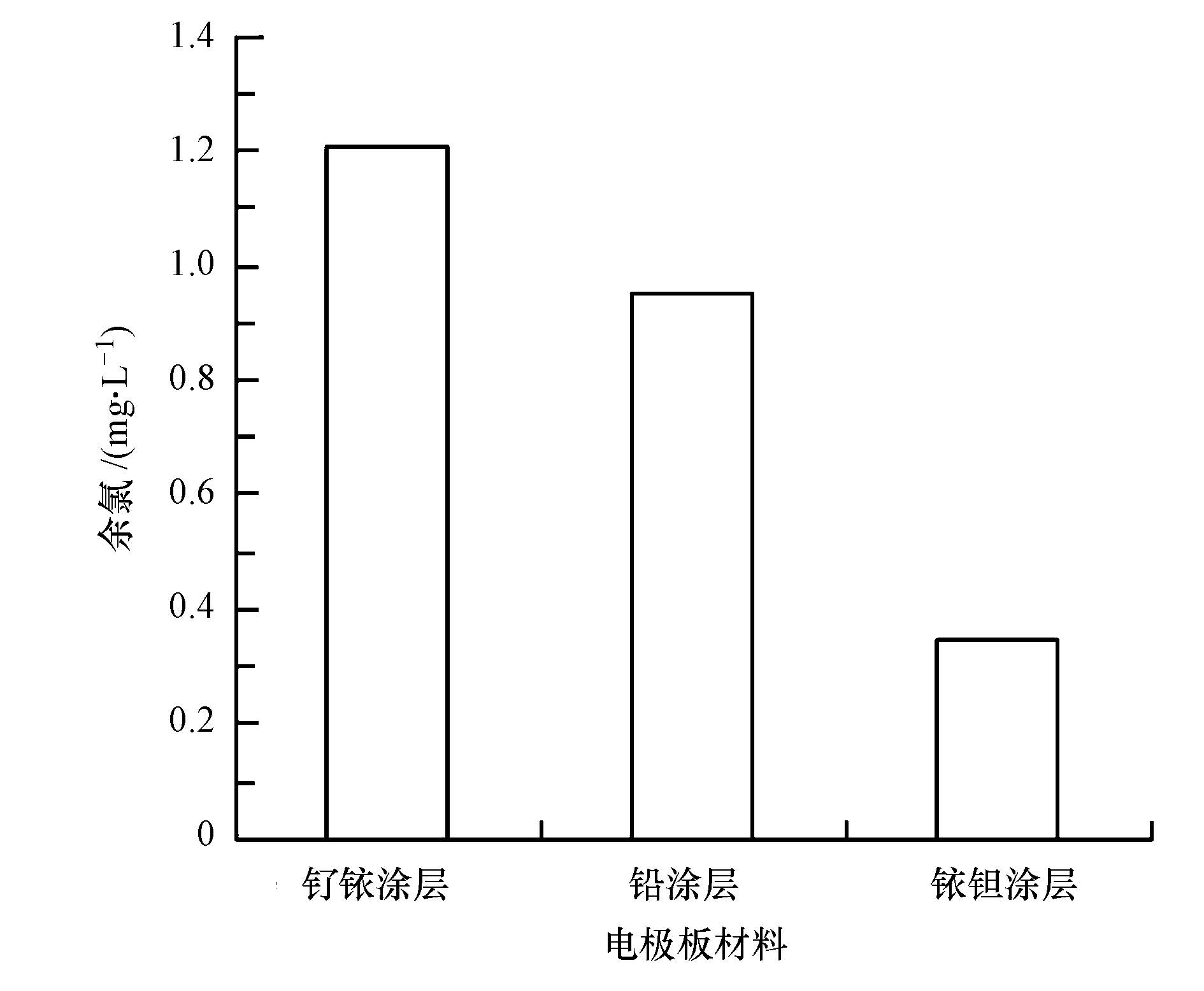 |
| 图2 不同阳极电极板材料产生余氯对比 Fig.2 Concentrations of residual chlorine produced by anode plates with different coatings |
进一步考察不同电极板间距对电化学消毒效果的影响,结果如图 3所示.由图 3a可知,在流量相同且电功率相同的条件下,极板间距为50 mm时,电化学消毒效果最好.由图 3b可知,在停留时间相同,即流速相同的条件下,极板间距30 mm与间距50 mm的装置消毒效果类似,而极板间距为50 mm装置在相同时间内处理水量是间距为30 mm装置的1.7倍.综上可知,极板间距为50 mm的装置消毒效果最好.
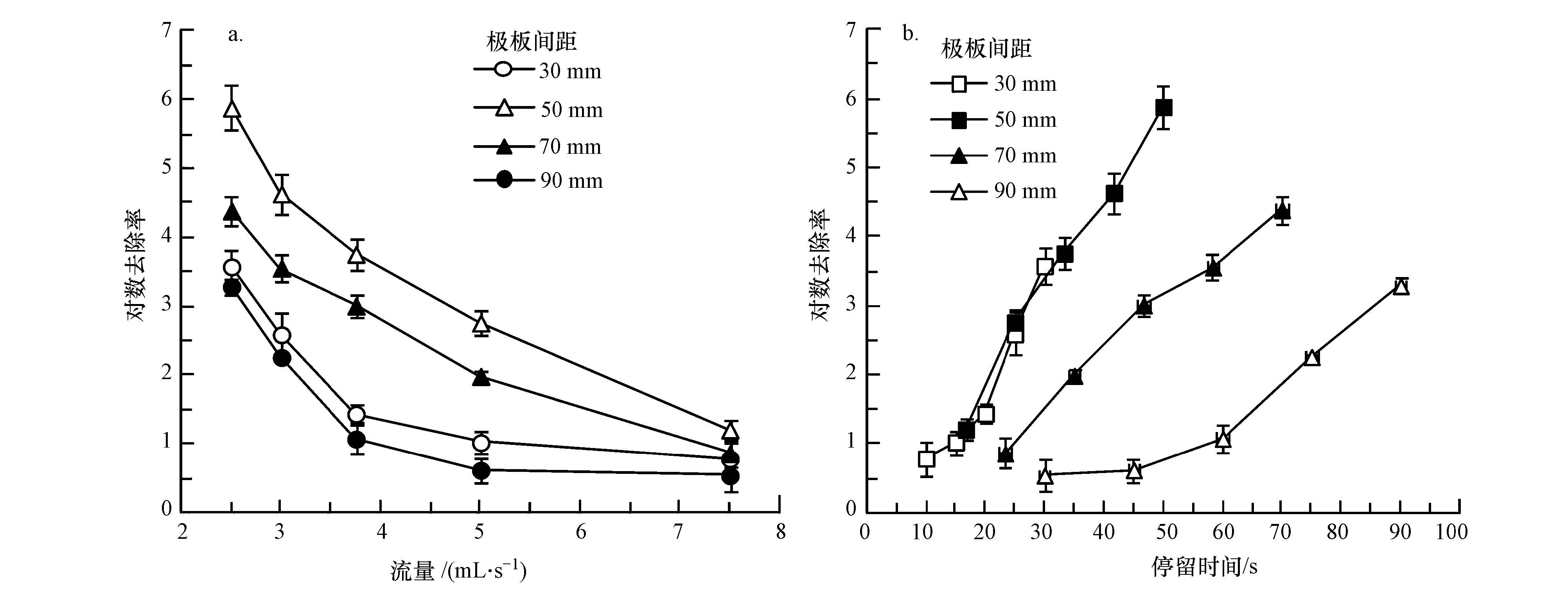 |
| 图3 电极板间距对普通大肠杆菌对数去除率的影响(a.不同流量下的电化学灭活效果;b.不同停留时间下的电化学灭活效果) Fig.3 Effect of plates distance on inactivation ratio of E. coli. (a. Inactivation ratio under different flows; b. Inactivation ratio under different retention time) |
在其他影响因素相同的条件下,分别改变pH、温度、NaCl浓度等水质条件,考察以上因素对电化学消毒效果的影响,结果如图 4所示.
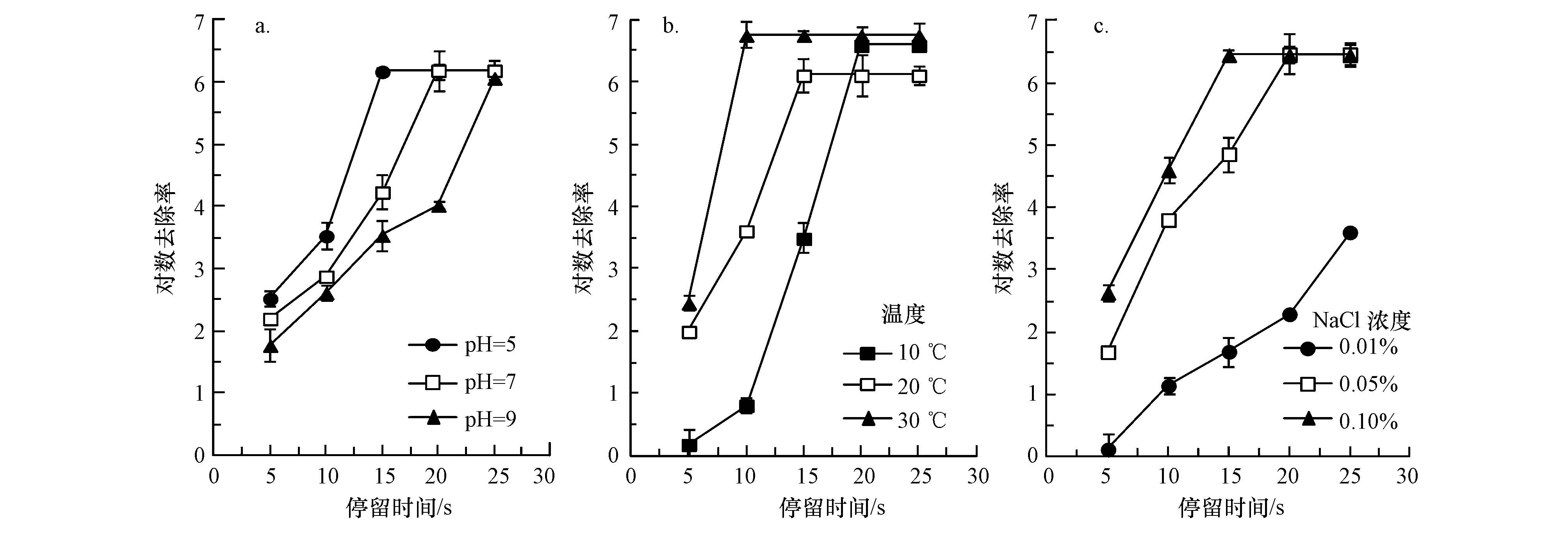 |
| 图4 pH(a)、温度(b)和NaCl浓度(c)对大肠杆菌灭活效果的影响 Fig.4 Effects of pH(a),temperature(b) and NaCl concentration(c)on inactivation ratio of E. coli. |
从图 4a可以看出,随着pH值的增加(5.0~7.0),电化学法对大肠杆菌的灭活效果随之降低,灭活率下降,表明在酸性条件下电化学消毒的效果较好.这可能是因为在酸性条件下,电化学法产生的氯气能有效溶解在水中,形成杀菌效果较好的HClO.而在碱性条件下,会形成较多的ClO-,杀菌效果较差.
从图 4b可以看出,随着温度的升高(10~30 ℃),电化学法对大肠杆菌的消毒效果显著增强.这可能是由于温度升高,电化学反应速度加快,相同时间内氯气等活性消毒成分产量增加的缘故.
从图 4c可以看出,电化学消毒系统对大肠杆菌的对数去除率随NaCl浓度升高而增加.当NaCl浓度为0.01%时,消毒15 s时对数去除率仅有1.7,而当NaCl浓度上升至0.05%和0.10%时,消毒15 s时大肠杆菌的对数去除率分别增大到5.2和6.5.这是因为水中NaCl浓度越高,单位时间内电化学作用产生的氯气越多,对微生物的杀灭作用也越强.
与氯消毒相比,电化学消毒体系产生的电场直接作用能导致细菌细胞膜分解或发生电穿孔现象,从而使自由氯进入细胞内部的能力大大提升,可能使得在相同氯剂量下的电化学消毒效果要好于氯消毒.
3.3 电化学法对四环素抗性菌的灭活及对其抗性的影响在相同电化学消毒条件下,比较了电化学法对普通大肠杆菌CGMCC 1.3373和四环素抗性菌CGMCC 1.1595的灭活效果,结果如图 5所示.从图 5可以看出,在相同的试验条件下,电化学法对四环素抗性菌的去除率明显低于普通大肠杆菌.在本试验体系中,电化学法产生的氯气对细菌起重要的消毒作用.Allard等(1992)的研究显示,pBR322上tet(A)表达的细胞膜上的横跨膜蛋白具有疏水性.因此,可以推测四环素抗性菌其细胞膜上的横跨膜蛋白数量多,从而使得整个细胞膜的疏水性增加,这保护了细胞不受氯的氧化和氯化,从而降低了氯消毒对四环素抗性菌的灭活率.从另一角度来讲,也就是四环素抗性菌可能具有更高的电化学消毒耐受能力.
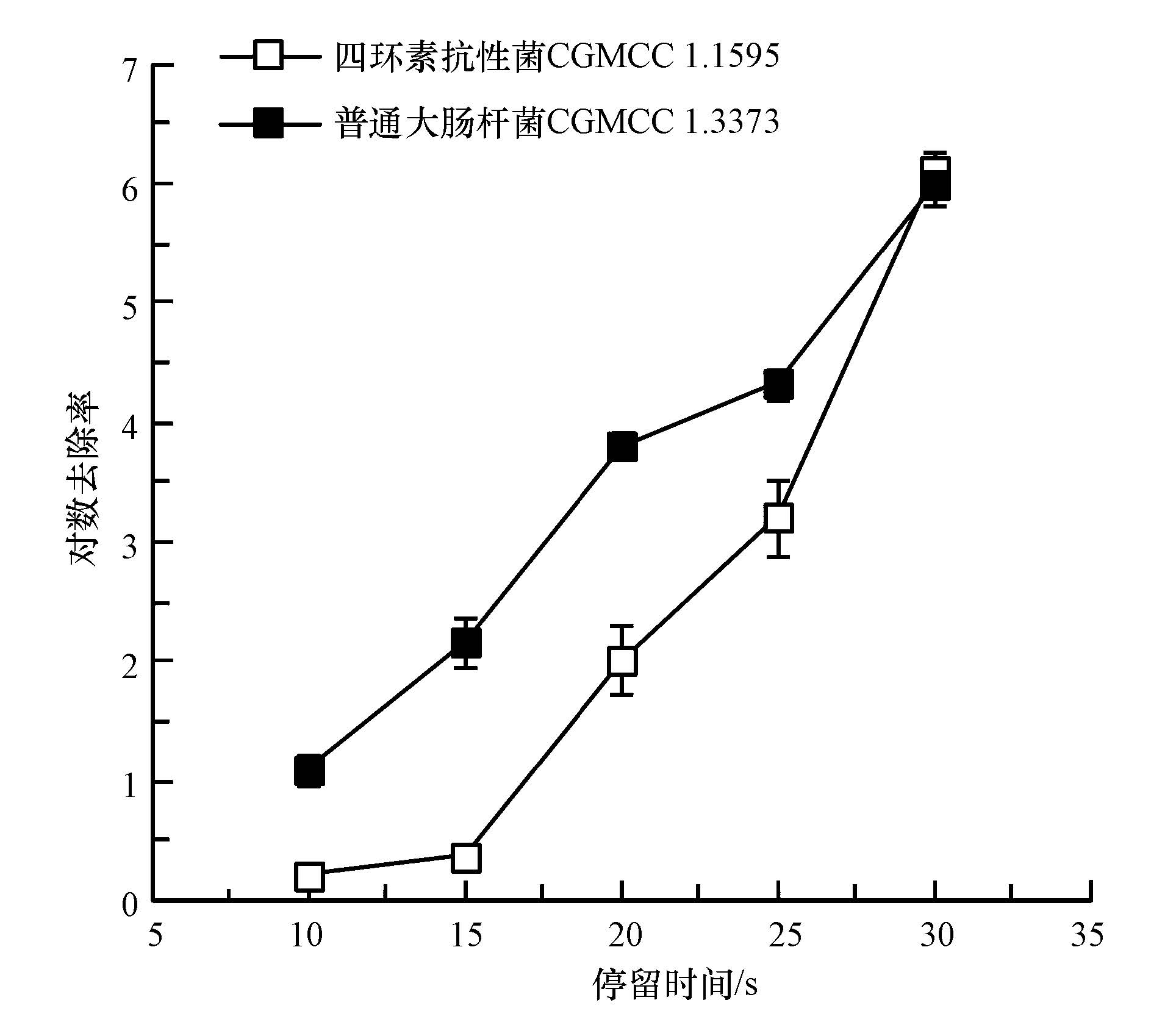 |
| 图5 电化学法对普通大肠杆菌和四环素抗性大肠杆菌的灭活效果对比 Fig.5 Inactivation of E. coli and tetracycline resistant E. coli by electrochemical disinfection |
四环素抗性菌经过不同时间电化学消毒后,消毒耐受菌株在3种抗生素培养基中的存活率如图 6所示.随着消毒停留时间的增加,消毒耐受的抗性大肠杆菌在四环素、青霉素、氯霉素培养基中的存活率呈先下降后上升的趋势.四环素抗性菌的抗性与消毒后细胞膜受损伤程度和细胞个体抗性水平的差异等因素有关,由于缺乏进一步的实验数据,在不同消毒时间下其抗性变化的原因有待进一步深入研究.
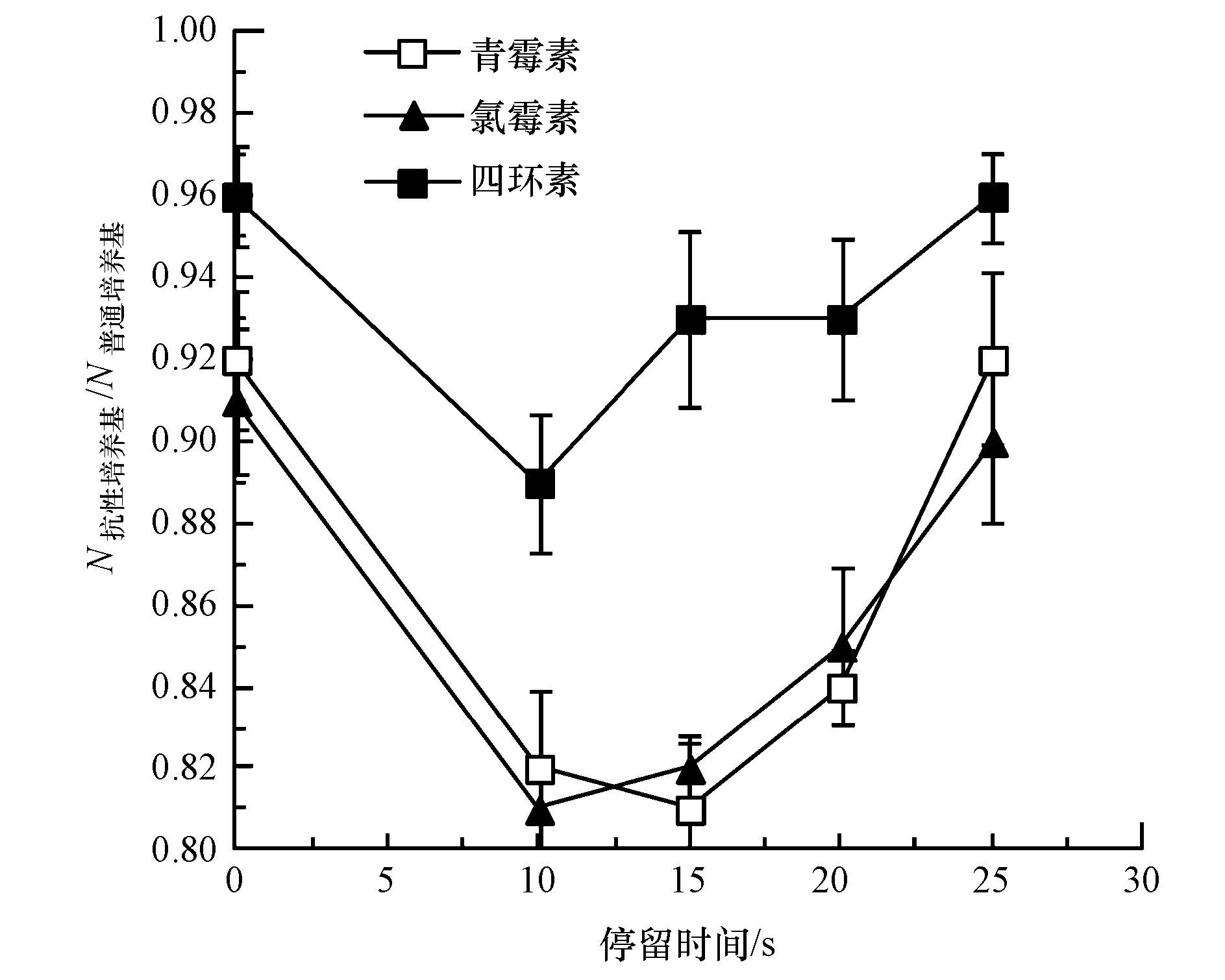 |
| 图6 电化学消毒对四环素抗性菌抗性的影响 Fig.6 Effect of electrochemical disinfection on survival of tetracycline resistant E. coli on different antibiotic plates |
1)电化学装置阳极采用钌铱涂层钛电极板,且极板间距为50 mm时,相同能耗下对大肠杆菌的灭活效果最好.
2)在pH值为5~9、水温10~30 ℃、NaCl浓度为0.01%~0.10%的条件下,电化学消毒法对大肠杆菌的灭活率随水的pH升高而降低,随水温和NaCl浓度升高而升高.
3)在相同消毒条件下,电化学法对抗生素抗性大肠杆菌的灭活率显著低于普通大肠杆菌.消毒后存活抗性菌对四环素、青霉素、氯霉素的抗性随消毒时间延长呈现先下降后上升的规律.
| [1] | Allard J D,Bertrand K P.1992.Membrane topology of the pbr322 tetracycline resistance protein:TetA-PhoA gene fusions and implications for the mechanism of TetA membrane insertion[J].The Journal of Biological Chemistry,267(25):17809-17819 |
| [2] | Chen G H.2004.Electrochemical technologies in wastewater treatment[J].Separation and Purification Technology,38(1):11-41 |
| [3] | 陈喆,王红武,马鲁铭.2008.电化学杀菌水处理技术研究进展[J].工业用水与废水,39(6):1-5 |
| [4] | Cotillas S,Llanos J,Rodrigo M A,et al.2015.Use of carbon felt cathodes for the electrochemical reclamation of urban treated wastewaters[J].Applied Catalysis B:Environmental,162:252-259 |
| [5] | Diao H F,Li X Y,Gu J D,et al.2004.Electron microscopic investigation of the bactericidal action of electrochemical disinfection in comparison with chlorination,ozonation and Fenton reaction[J].Process Biochemistry,39(11):1421-1426 |
| [6] | Fang Q,Shang C,Chen G H.2006.MS2 inactivation by chloride-assisted electrochemical disinfection[J].Journal of Environmental Engineering,132(1):13-22 |
| [7] | Kerwick M I,Reddy S M,Chamberlain A H L,et al.2005.Electrochemical disinfection,an environmentally acceptable method of drinking water disinfection?[J].Electrochimica Acta,50(25/26):5270-5277 |
| [8] | Kraft A,Stadelmann M,Blaschke M,et al.1999.Electrochemical water disinfection Part I:Hypochlorite production from very dilute chloride solutions[J].Journal of Applied Electrochemistry,29(7):859-866 |
| [9] | Li X Y,Diao H F,Fan F X J,et al.2004.Electrochemical wastewater disinfection:Identification of its principal germicidal actions[J].Journal of Environmental Engineering,130(10):1217-1221 |
| [10] | Liu C,Xie X,Zhao W T,et al.2013.Conducting nanosponge electroporation for affordable and high-efficiency disinfection of bacteria and viruses in water[J].Nano Letters,13(9):4288-4293 |
| [11] | Palmas S,Polcaro A M,Vacca A,et al.2007.Influence of the operating conditions on the electrochemical disinfection process of natural waters at BDD electrodes[J].Journal of Applied Electrochemistry,37(11):1357-1365 |
| [12] | Venczel L V,Arrowood M,Hurd M,et al.1997.Inactivation of Cryptosporidium parvum oocysts and Clostridium perfringens spores by a mixed-oxidant disinfectant and by free chlorine[J].Applied and Environmental Microbiology,63(11):4625 |
| [13] | 周键,王三反,薛志强,等.2014.Ti/SnO2-Sb2O3/β-PbO2阳极消毒处理医院污水[J].环境工程学报,8(10):4110-4114 |
 2016, Vol. 36
2016, Vol. 36


