2. 辽宁省沈阳市浑南新区环境保护局, 沈阳 110015
2. Hunnan New District Environmental Protection Bureau of Shenyang City, Liaoning Province, Shenyang 110015
水溶性有机物(Dissolved Organic Matter,DOM)广泛存在于自然水体和人工水体中,主要是由含氧、氮和硫的氨基酸、脂肪族、芳香族等功能团组成的异质碳氢混合物(Chen et al., 2003;杨楠等,2014).DOM主要来源于土壤、动植物残体、藻类排泄物及人类活动排放物等(Borisover et al., 2009; Vazquez et al., 2011),是细菌繁殖、紫外光降解与生物地球化学反应的有机组成部分(岳兰秀等,2005;Yu et al., 2012).在水生生态系统中,DOM不仅影响营养物保持与释放、生物可利用性、重金属离子和有机化合物络合,而且还被用来表征水质特征.此外,DOM能与污染物形成易于流动的聚合物,不仅影响化合物在水生态系统中的生物可利用性,而且还会与水消毒剂反应生成致癌物质(Borisove et al., 2009; Lu et al., 2009; Yu et al., 2013).
三维荧光是一种简单、快速、灵敏度高、成本低的检测方法,广泛用于定量分析水体中的DOM组成结构,揭示DOM在河流、湖泊、地下水、海洋及污水等水环境中的动力学特征(Zhang et al., 2011; Goldman et al., 2012; Yu et al., 2013).早期人们通过识别5个荧光特征峰表征不同水体中DOM组成结构,例如,类酪氨酸峰(Peak B)、类色氨酸峰(Peak T)、类富里酸峰(Peak A和Peak C)与微生物代谢产物峰(Peak M)(Hudson et al., 2008; Osburn et al., 2012).近年来,人们应用区域积分、平行因子、自组织神经网络等方法表征DOM组成结构、来源及归宿,辨识DOM荧光组分,阐述不同水生态系统中DOM迁移与转化机制.
因此,本文应用三维荧光区域积分方法,分析城镇化河流——白塔堡河DOM组成结构特征,揭示DOM空间分布规律,阐述DOM与水质相关性,为白塔堡河水质改善与生态修复提供理论支持.
2 材料与方法(Materials and methods) 2.1 区域概况白塔堡河位于沈阳市浑南新区内(123°39′E,41°38′N),是浑河水系的Ⅰ级支流,为沈阳市主要河流之一(图 1).白塔堡河发源于前老溏峪村(海拔187.6 m),蜿蜒向北,流至后老溏峪村转而向西,流经前李相村向北横穿李相镇和永安村,向西流经营城子镇,绕经沈阳理工大学向西南横穿浑南新城,流至白塔堡镇转向西北,在曹仲屯汇入浑河.河流总长48.5 km,流域面积为178 km2(杨楠等,2013).随着城市化进程加速,城市人口持续增加,生活污水总量高速增长,且由于污水处理能力低,致使大量的污染物进入河流,引起了一系列水量、水质、水生态、水安全等问题.
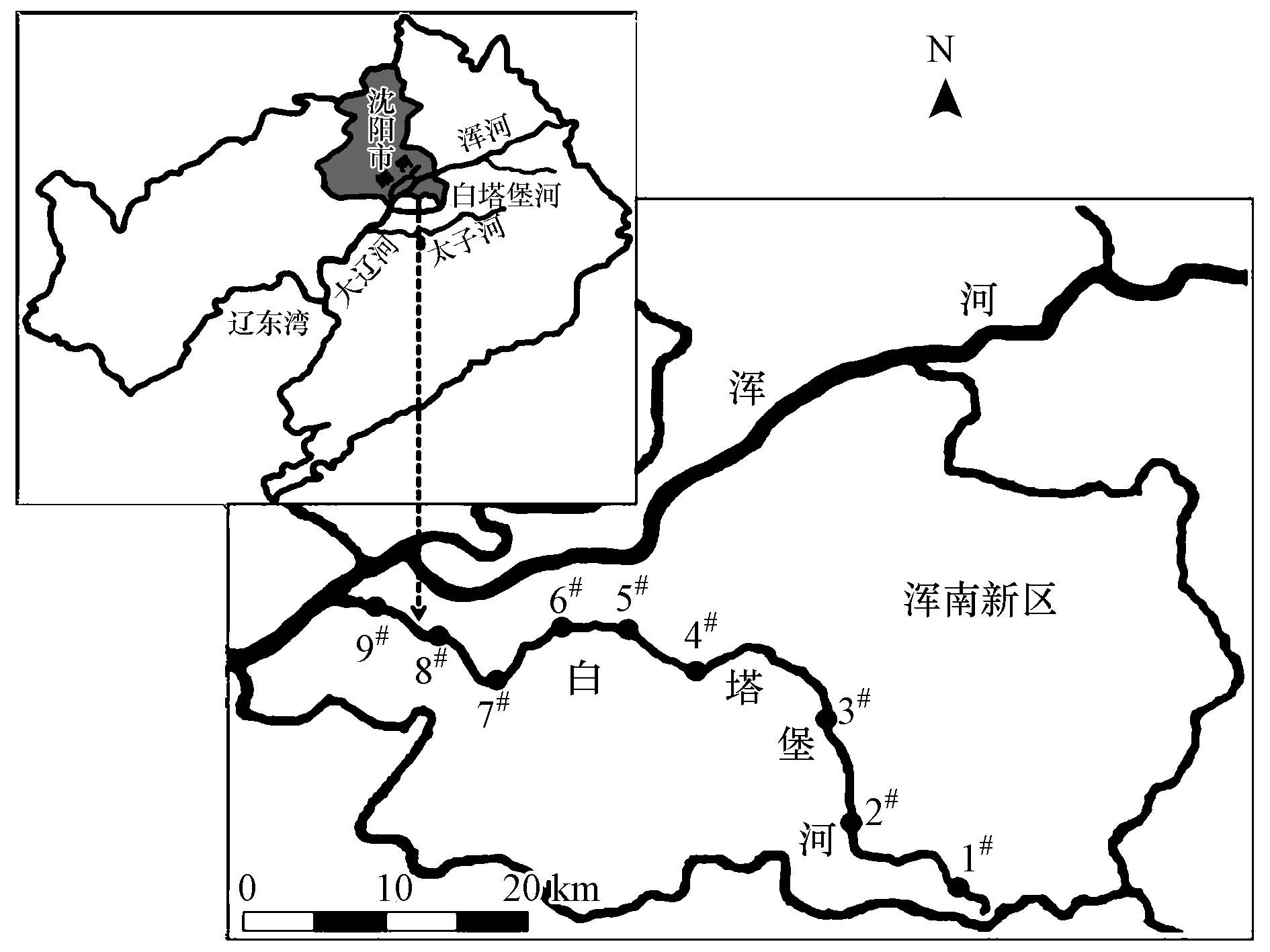 |
| 图1 白塔堡河位置与采样点布设 Fig.1 Location of the study area and sampling sites |
为了研究水质空间分布与DOM组成结构特征,在河流流经的农村地区设置3个采样点,即老溏峪(1#)、李相镇(2#)和永安村(3#).1#采样点位于河源头附近,流量约为0.02 m3 · s-1,以自然补给水和农村生活污水为主;2#和3#采样点流量分别约为0.18 m3 · s-1和0.45 m3 · s-1,除了上游来水,农村生活污水和养殖废水汇入河流.在城镇河段设置3个采样点,即营城子(4#)、理工大学(5#)和21世纪湖(6#).4#、5#和6#采样点流量分别为0.62、1.37和1.23 m3 · s-1,除了上游来水,生活污水和工业园排水汇入河流.在城市河段设置3个采样点,即白塔镇(7#)、沈苏公路桥(8#)和曹仲屯(9#).7#、8#和9#采样点流量分别为1.58、3.37和1.79 m3 · s-1,除了上游来水,生活污水和污水厂出水汇入河流.在每个采样点位的河流断面,依据水流向的左、中、右采集水样.使用不锈钢采水器采集水样,每个采样点采集3次,将3次样品混合作为该采样点样品(杨楠等,2013).混合水样装入500 mL聚乙烯水样瓶里,置于冷藏箱(<4 ℃),运回实验室后立即分析.
2.3 理化指标检测利用水质检测仪(YSI 600)现场测量河水的温度(Temperature,TEMP)、pH、溶解氧(Dissolved Oxygen,DO)与电导率(Electrical Conductivity,EC).在实验室里,过滤(=0.45 μm)的水样用于测量氨氮(NH3-N)、硝酸盐(NO3--N)、水溶性有机碳(DOC),未过滤的水样用于测量总氮(TN)、总磷(TP)、化学需氧量(COD)、五日生化需氧量(BOD5)和叶绿素(Chla),参照《地表水环境质量标准》(GB3838—2002)中的检测方法进行.
2.4 荧光光谱检测利用荧光分光光度计(Hitachi F-4600)进行三维荧光检测,配以1 cm石英比色皿.以Mill-Q水为空白,对过滤后的水样进行荧光扫描.仪器光源为150 W氙灯,光电倍增电压为400 V,激发和发射狭缝宽度均为5 nm,响应时间0.5 s,扫描速度2400 nm · min-1,扫描光谱进行仪器自动校正.激发波长(λEx)范围为200~450 nm,发射波长(λEm)范围为280~550 nm.所有水样的三维荧光分别减去空白光谱,以去除拉曼散射的影响(Murphy et al., 2011);在位于发射波长等于激发波长或2倍激发波长的光谱区域内,将瑞利散射及上方的光谱数据均赋值为0,以消除瑞利散射的影响(Stedmon et al., 2008; Yu et al., 2013).
2.5 多元统计分析采用区域体积积分方法,分析DOM组成结构,计算各组分的丰度;利用主成分(PCA)方法,识别影响水质的潜在因子,辨析污染源,揭示DOM组分与水质相关性.
3 结果与讨论(Results and discussion) 3.1 理化特征分析河水温度平均值为(12.46±0.46)℃,2#点的温度最低(12.07 ℃),5#点的温度最高(13.31 ℃),各采样点的温度变化不大(图 2a).各采样点的pH变化范围在7.28~8.18之间(图 2b),河水呈弱碱性.1#和2#采样点的EC在100 μS · m-1以下,3#~9#点的EC在400 μS · m-1以上(图 2c),表明白塔堡河源头区域的水土流失程度远小于其它区域.河水DO浓度从上游到下游逐渐减小,入浑河口附近(8#~9#)的DO浓度小于1.00 mg · L-1,表明河水好氧水平从上游到下游逐渐降低,而厌氧水平逐渐升高.城市河段COD平均值为(38.64±10.31)mg · L-1,是城镇河段COD平均值的1.75倍,农村河段的2.13倍.城市河段BOD5的平均值最大((14.46±5.25)mg · L-1),农村河段的BOD5最小((4.59±1.35)mg · L-1),城镇介于两者之间((8.26±2.26)mg · L-1).河水的NH3-N、NO3--N、TN、TP、DOC和Chla变化趋势与COD、 BOD5的变化趋势类似,表明农村河段水质最好,而城市河段水质最差,城镇河段介于两者之间.在农村河段,河水以农村生活污水及养殖废水补给为主,补给水量较小,污染物浓度较低;在城镇河段,除了农村河段来水外,河水以生活污水与工业园排水补给为主,补给水量较大,污染物浓度较高;在城市河段,除了城镇河段来水外,河水以处理和未处理的生活污水及工业废水为主,补给水量大,污染物浓度高.河水的DOM分别与NH3-N(r=0.76,p<0.05)和TP(r=0.86,p<0.01)呈现显著正相关.因为NH3-N和TP是生活污水的典型成分(Herzsprung et al., 2012),所以河水中的DOM主要来源于排入河流的生活污水(Goldman et al., 2012).
 |
| 图2 白塔堡河各采样点水质指标的柱状与偏差示意图 Fig.2 The distributions of water quality parameters in Baitapuhe River |
在河水DOM三维荧光光谱上,很明显地呈现5个荧光峰(图 3).根据相关文献描述(Coble,1996; Chen et al., 2003; Li et al., 2013),Peak B(λEx/λEm= 215~235 nm/290~320 nm)定义为类酪氨酸物质,Peak T1(λEx/λEm=215~235 nm/330~370 nm)定义为类色氨酸物质,Peak T2(λEx/λEm=260~280 nm/320~360 nm)是由微生物代谢产物引起的,可以用来表征河水中微生物活动强度;Peak A(λEx/λEm=215~235 nm/390~440 nm)是紫外光区类富里酸物质,Peak C(λEx/λEm=310~350 nm/390~440 nm)为可见光区类富里酸物质.在农村河段,微生物代谢产物产生的荧光呈现肩峰(图 3a~c);在城镇河段,微生物代谢产物产生的荧光由肩峰向尖峰过渡;在城市河段,微生物代谢产物的荧光都呈现为尖峰.这表明城市河段的微生物的活性最强,农村河段的最弱,城镇河段的介于两者之间.类酪氨酸荧光从上游到下游呈现出明显的红移现象,表明类酪氨酸中的羟基、羰基、羧基等含量递减的顺序为城市河段>镇区河段>农村河段.
 |
| 图3 白塔堡河DOM的三维荧光光谱 Fig.3 EEM fluorescence spectra of DOM in Baitapuhe River |
为了更深入地了解DOM荧光特征,采用区域体积积分法定量分析DOM荧光组分特征(Chen et al., 2003;Wang et al., 2009;Bilal et al., 2010).利用连续的激发和发射波长将三维荧光光谱划分为7个区域(图 3b),较短的激发(<250 nm)与较短的发射波长(<380 nm)围成的区域为类芳香蛋白物质,即类酪氨酸(区域I)和类色氨酸(区域II),而与较长的发射光谱围成的区域为紫外光区类富里酸物质.激发波长250~300 nm与较短的发射波长(<380 nm)围成的区域代表微生物代谢产物(区域IV),而与较长的激发光谱围成的区域代表类糖化蛋白物质(区域V).在激发波长300~380 nm与发射波长大于340 nm区域,荧光峰代表可见光区富里酸物质.较长的激发波长(>380 nm)和较长的发射波长(>420 nm)围成的区域为类胡敏酸物质.此外,区域VI和区域VII的比值定义为荧光指数(FI),可用来表征有机质的腐殖化程度,腐殖化程度随着FI的减小而增大.
三维荧光区域体积积分(Φi,i=1~7)能够正确地表征不同荧光组分的相对浓度(Chen et al., 2003).三维荧光总的体积积分(ΦT)分别与NH3-N(r=0.89,p<0.01)、TP(r=0.88,p<0.01)呈现出显著的正相关性.由于NH3-N和TP是生活污水中的主要成分,进而证明河水中的DOM主要来源于排入河流的生活污水.河水DOM的ΦT沿河呈现连续递增趋势(图 4),即农村河段<城镇河段<城市河段,表明城市河段DOM中芳香碳含量最大,农村河段的最小,城镇河段介于两者之间.在城市河段Φ1的平均值为247.85±61.65,约为城镇河段和农村河段的2倍,并且城市河段各采样点Φ1的变化幅度远大于城镇和农村河段.Φ2的变化趋势与Φ1的相似.Φ3的值从河源到入浑河口呈现连续上升趋势,Φ5的值与Φ3的变化趋势类似.Φ4沿河递增的次序为农村河段(220.65±41.61)<城镇河段(360.49±48.11)<城市河段(483.36±107.82).相对于Φ1~Φ5,Φ6的值很小(<10.00),而Φ7的值更小(<0.12).此外,FI的平均值沿河递增次序为农村河段(292.07±5.25)>城镇河段(94.40±2.44)>城市河段(82.22±4.48),表明DOM腐殖化程度递增次序为城市河段>城镇河段>农村河段.
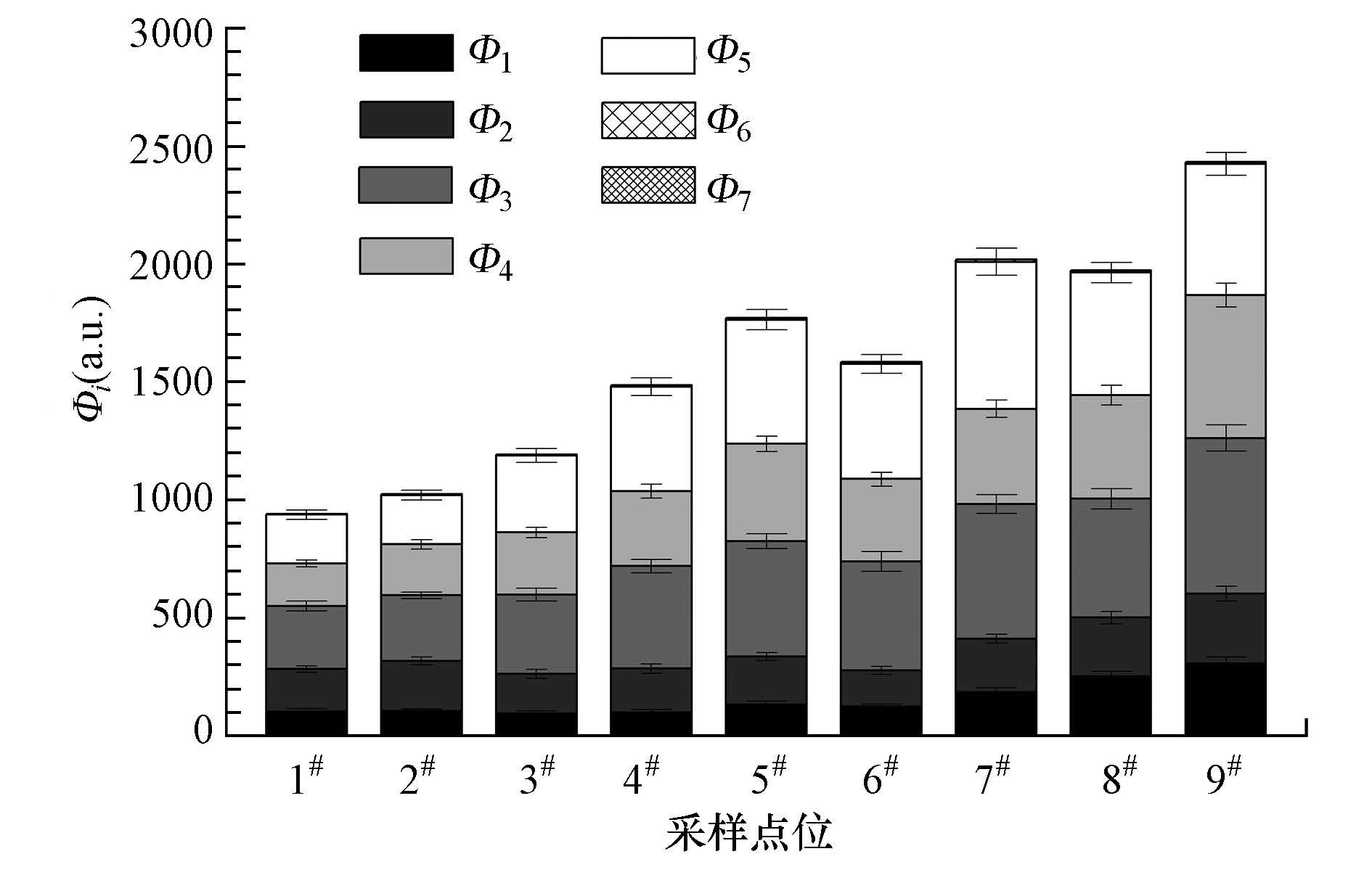 |
| 图4 白塔堡河DOM各组分相对丰度分布 Fig.4 Distributions of relative abundance of DOM components in Baitapuhe River |
将Φi占ΦT的百分比定义为Pi,表征DOM各组分所占的比重.由图 5可知,各采样点P1(8.01%~12.77%)、P4(19.24%~24.91%)与P5(20.33%~29.71%)的变动较小,而P2(19.24%~24.91%)的变动较大.显然,类蛋白物质是DOM的主要成分.P3的变动较小(27.54%~29.22%),表明紫外光区的类富里酸物质在DOM含量相对稳定.P6值很小(0.36%~0.52%),而且变动不大;相对于P6、P7的值更小.
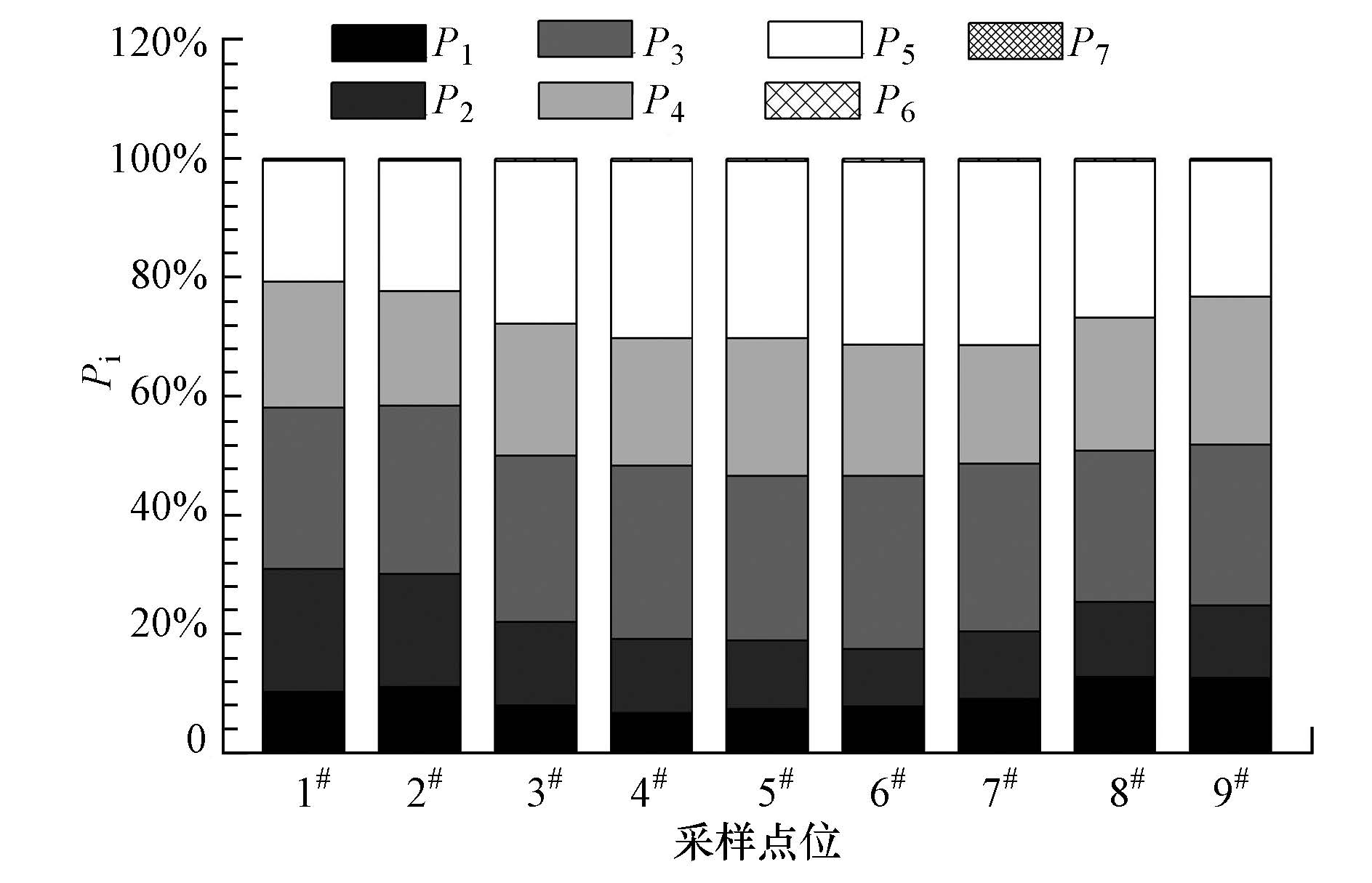 |
| 图5 白塔堡河DOM各组分的百分含量分布 Fig.5 Distributions of percentages of DOM components in Baitapuhe River |
应用PCA对Φi和水质指标进行分析,辨析河流营养水平特征.基于变量的载荷值与采样点的得分值聚类分析,可以识别影响河水营养状态的潜在因子,进而辨识污染源.通过对DOM组分和水质的相关性分析,揭示DOM对河流营养状态的响应机理(Santos et al., 2010).当变量的载荷值大于0.8时,该变量对河流系统具有较强的影响作用;采样点得分较高时,表明该采样点河水呈现出较强的水质、营养水平及污染强度特征(Kowalkowski et al., 2006).
PCA产生两个主成分(PCs),占总方差的79.41%.在PC1(52.84%)中,Φ1、COD、Φ2、NH3-N和BOD5具有较大的正载荷值(图 6),间接地证明河水中的污染物主要来源于养殖废水、生活污水与污水厂排水等.DO具有较强的负载荷,表明DO是决定河水好氧/厌氧状态的重要因子,影响污染物的降解.此外,DO与Chla具有显著负相关性(r=-0.93,p<0.01),DO可以表征河水的富营养化程度.8#与9#采样点具有较高的得分,表明这两个采样点河水的Φ1、COD、Φ2、NH3-N、BOD5比其他采样点的高,而DO比其他采样点低(图 2).在8#采样点,除了上游汇集的污染物与表层沉积物孔隙水释放营养物外,白塔污水处理厂出水(15000 m3 · d-1)在此排入河流.在PC2(37.72%)中,EC、Φ5与NO3--N具有较高的正载荷值,表明土壤侵蚀与工业废水影响水质.1#和2#采样点具有较低的得分,表明EC、Φ5与NO3--N的浓度比其他采样点的低.
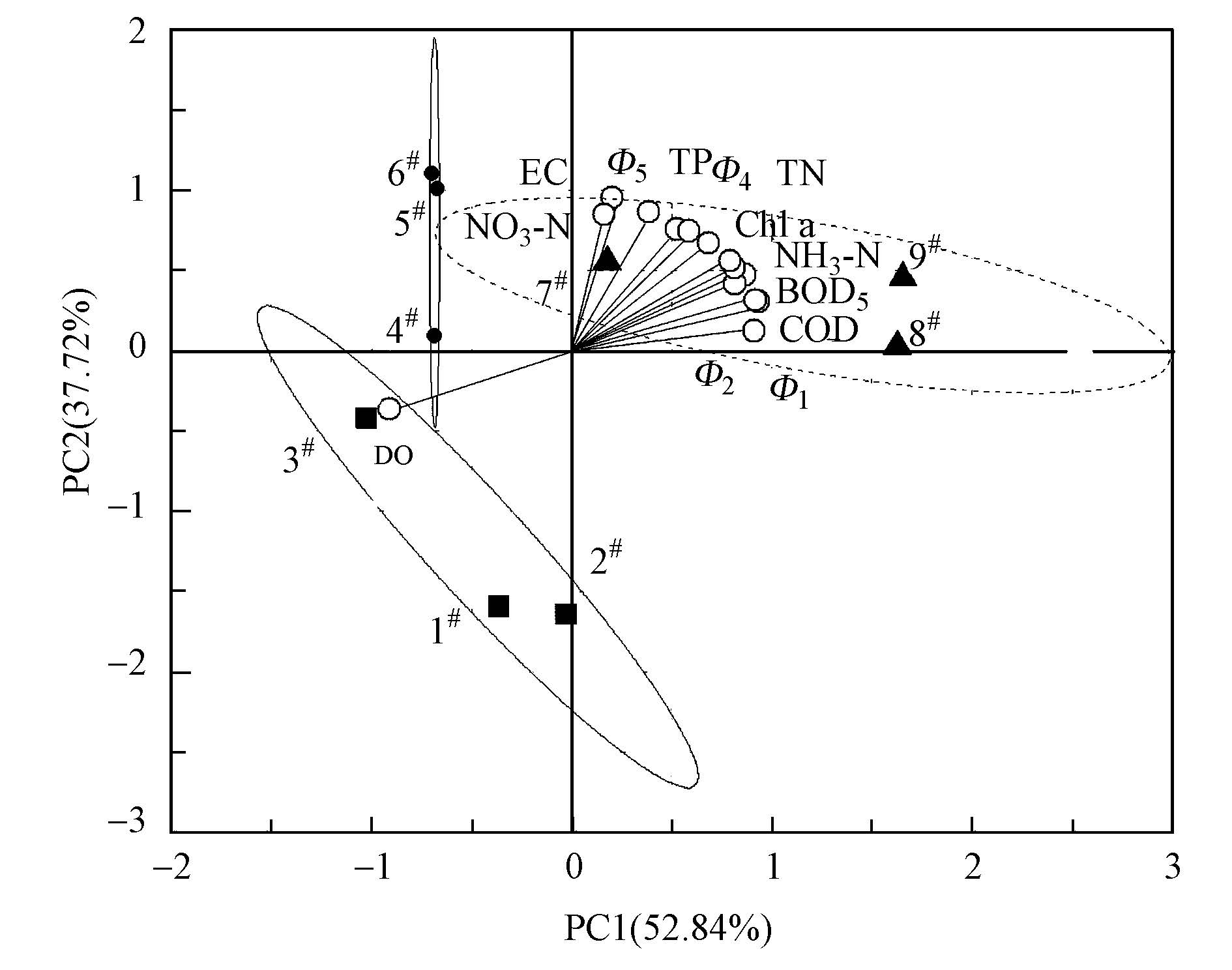 |
| 图6 白塔堡河DOM组分与水质指标的载荷与采样点的得分矩阵 Fig.6 Loadings plot and scores plot for PC1 and PC2 of DOM components and water quality parameters in Baitupuhe River |
1#~3#采样点位于第三象限,4#~6#采样点位于第二象限,7#~9#采样点位于第一象限,并且它们分别位于3个不同的置信椭圆内(置信度为40%),验证了白塔堡河营养水平深受人类活动的影响,沿着农村河段、城镇河段和城市河段分布.3#和4#采样点的距离近,表明这两个采样点位于农村河段和城镇河段的过渡带,河水营养水平相近.
4 结论(Conclusions)三维荧光光谱与多元统计可以分析白塔堡河DOM的组成结构,揭示DOM组分对水质响应机制.在城市河段,DOM的芳化度和腐殖化程度最高,农村河段最小,城镇河段介于两者之间.在DOM各组分中,类蛋白所占比重最大,而类胡敏酸最小,类富里酸在两者之间.影响河流水质的潜在因子包括类酪氨酸、COD、类色氨酸、NH3-N、BOD5与DO,污染物主要来源于畜禽养殖废水、生活污水和工业废水.在农村河段,应加强对养殖废水污染和生活污染控制;在城镇河段,除了加强治理养殖废水和生活污水外,还要集中处理工业园区的排水;在城市河段,要提高城市污水厂排放标准,实施河流底泥疏浚工程.
| [1] | Bilal M,Jaffrezic A,Dudal Y,et al. 2010.Discrimination of farm waste contamination by fluorescence spectroscopy coupled with multivariate analysis during a biodegradation study[J]. Journal of Agricultural and Food Chemistry,58(5):3093-3100 |
| [2] | Borisover M,Laor Y,Parparov A,et al. 2009. Spatial and seasonal patterns of fluorescent organic matter in Lake Kinneret (Sea of Galilee) and its catchment basin[J]. Water Research,43(12):3104-3116 |
| [3] | Chen W,Westerhoff P,Leenheer J A,et al. 2003. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science & Technology,37(24):5701-5710 |
| [4] | Coble P G. 1996. Characterization of marine and terrestrial DOM in seawater using excitation-emission matrix spectroscopy[J]. Marine Chemistry,51(4):325-346 |
| [5] | Goldman J H,Rounds S A,Needoba J A. 2012. Applications of fluorescence spectroscopy for predicting percent wastewater in an urban stream[J]. Environmental Science & Technology,46(8):4374-4381 |
| [6] | Herzsprung H,von Tümpling W,Hertkorn N,et al. 2012. Variations of DOM quality in inflows of a drinking water reservoir:linking of van Krevelen Diagrams with EEMF spectra by rank correlation[J]. Environmental Science & Technology,46(10):5511-5518 |
| [7] | Hudson N,Baker A,Ward D,et al. 2008. Can fluorescence spectrometry be used as a surrogate for the biochemical oxygen demand (BOD) test in water quality assessment? An example from South West England[J]. Science of the Total Environment,391(1):149-158 |
| [8] | Kowalkowski T,Zbytniewski R,Szpejna J,et al. 2006. Application of chemometrics in river water classification[J]. Water Research,40(4):744-752 |
| [9] | Li W T,Xu Z X,Li A M,et al. 2013. HPLC/HPSEC-FLD with multi-excitation/emission scan for EEM interpretation and dissolved organic matter analysis[J]. Water Research,47(3):1246-1256 |
| [10] | Lu J F,Zhang T,Ma J,et al. 2009. Evaluation of disinfection by-products formation during chlorination and chloramination of dissolved natural organic matter fractions isolated from a filtered river water[J]. Journal of Hazardous Materials,162(1):140-145 |
| [11] | Murphy K R,Hambly A,Singh S,et al. 2011. Organic matter fluorescence in municipal water recycling schemes:Toward a unified PARAFAC Model[J]. Environmental Science & Technology,45(7):2909-2916 |
| [12] | Osburn C L,Handsel L T,Mikan M P,et al. 2012. Fluorescence tracking of dissolved and particulate organic matter quality in a river-dominated estuary[J]. Environmental Science & Technology,42(16):8628-8636 |
| [13] | Santos L M D,Simões M L,de Melo W J,et al. 2010. Application of chemometric methods in the evaluation of chemical and spectroscopic data on organic matter from Oxisols in sewage sludge applications[J]. Geoderma,155(1/2):121-127 |
| [14] | Stedmon C A,Bro R. 2008. Characterizing dissolved organic matter fluorescence with parallel factor analysis:a tutorial[J]. Limnology and Oceanography:Methods,6(11):572-579 |
| [15] | Vazquez E,Amalfitano S,Fazi S,et al. 2011. Dissolved organic matter composition in a fragmented Mediterranean fluvial system under severe drought conditions[J]. Biogeochemistry,102(1/3):59-72 |
| [16] | Wang Z W,Wu Z C,Tang S J. 2009. Characterization of dissolved organic matter in a submerged membrane bioreactor by using three-dimensional excitation and emission matrix fluorescence spectroscopy[J]. Water Research,43(6):1533-1540 |
| [17] | 杨楠,于会彬,宋永会,等. 2013. 白塔堡河上覆水与沉积物间隙水N、P分布特征[J]. 环境科学研究,26(7):728-735 |
| [18] | 杨楠,于会彬,宋永会,等. 2014. 应用多元统计研究城市河流沉积物孔隙水中DOM紫外光谱特征[J]. 环境科学学报,34(7):1751-1757 |
| [19] | Yu H B,Song Y H,Xi B D,et al. 2012. Application of chemometrics to spectroscopic data for indicating humification degree and assessing salinization processes of soils[J]. Journal of Soils and Sediments,12(3):341-353 |
| [20] | Yu H B,Song Y H,Tu X,et al. 2013. Assessing removal efficiency of dissolved organic matter in wastewater treatment using fluorescence excitation emission matrices with parallel factor analysis and second derivative synchronous fluorescence[J]. Bioresource Technology,144:595-601 |
| [21] | 岳兰秀,吴丰昌,刘丛强,等. 2005. 红枫湖和百花湖天然溶解有机质的分子荧光特征与分子量分布的关系[J]. 科学通报,50(24):2774-2780 |
| [22] | Zhang Y L,Yin Y,Feng L Q,et al. 2011. Characterizing chromophoric dissolved organic matter in Lake Tianmuhu and its catchment basin using excitation-emission matrix fluorescence and parallel factor analysis[J]. Water Research,45(16):5110-5122 |
 2016, Vol. 36
2016, Vol. 36


